华卟啉钠介导的声动力疗法联合声诺维促脑胶质瘤凋亡的体内外实验研究
2023-01-13赵睿姜欢戴绍春
赵睿,姜欢,戴绍春
哈尔滨医科大学附属肿瘤医院超声科,黑龙江 哈尔滨 150081;*通信作者 戴绍春 daishaochun@yeah.net
胶质瘤的侵袭性高、生长速度快、容易复发,并且由于血-脑屏障的存在,大部分化疗药物对其的治疗效果受到限制[1]。声动力疗法(sonodynamic therapy,SDT)是基于光动力疗法发展而来的特异性疗法,在治疗实体肿瘤方面展现出极大的潜力,并且由于超声波具有良好的穿透性,尤其适用于较深部脑肿瘤的治疗[2]。超声联合微泡可引起血管内皮细胞的破坏,增加血-脑屏障的通透性,促进药物进入颅内,提高其对中枢神经系统疾病的治疗效果[3]。本研究拟在体内外探究新型光敏剂华卟啉钠(sinoporphyrin sodium,DVDMS)介导的SDT 联合微泡造影剂声诺维(SonoVue)对脑胶质瘤的凋亡作用。
1 材料与方法
1.1 仪器 多功能超声治疗仪UT-1041(上海张东科技有限公司);磁共振扫描仪(飞利浦,3.0T);立体定向仪(江湾,中国);透射电子显微镜(JEOL,日本)。
1.2 试剂 DVDMS由中国医学科学院(北京)方启程教授无偿提供;SonoVue(Bracco Suisse SA,意大利);免疫组化试剂盒(博士德公司,中国);Tunel试剂盒(Roche,瑞士)。
1.3 实验动物及细胞 120只雄性Wistar大鼠由哈尔滨医科大学实验动物中心提供[动物许可证编号:SYXK(黑)2017-008],于(23±2)℃空调室内饲养,保持昼夜交替照明,每天给予饲料及饮用水。C6胶质瘤细胞系来自中国科学院细胞库(中国上海),于37℃、5% CO2、100%湿度的孵育箱中孵育,用含10%胎牛血清的DMEM培养液(HyClone,美国)传代培养。
1.4 建立动物模型 调整C6胶质瘤细胞浓度为5×109/ml以备接种。Wistar大鼠用2.5%异氟烷进行麻醉,然后向腹腔注射氯胺酮(64.5 mg/kg)和甲苯噻嗪(5.4 mg/kg)混合物,固定于立体定向仪上。在前囟后1.0 mm、矢状缝右侧3.0 mm处钻孔(不伤及硬脑膜)。调节微量注射器,使针尖距硬脑膜5 mm,将细胞悬液注入颅内,注射时间为10 min,留针5 min后缓慢退针。用骨蜡封闭骨窗,缝合头皮,切口消毒后分笼饲养。每天观察大鼠的生存状态并记录。
1.5 荷瘤大鼠的筛选及实验分组 体外实验:将细胞分为6组:对照组、DVDMS组、超声组、超声联合微泡(US-MB)组、SDT组、SDT联合微泡(SDT-MB)组。体内实验:接种15 d后,向大鼠腹腔注射核磁增强剂(钆特酸葡甲胺注射液,5 mg/kg),分别行横断面、冠状面和矢状面扫描及增强扫描,根据结果随机分成6组,每组20只,组别与体外实验相同。
1.6 SDT 超声参数:频率1.0 MHz、强度1.0 W/cm2、占空比10%、辐照时间60 s。体外实验:超声辐照前在US-MB和SDT-MB组加入SonoVue(0.1 ml/孔),然后使用多功能超声治疗仪对超声、US-MB、SDT、SDTMB组在室温海绵水浴中进行照射。体内实验:在接种部位钻1个2 mm的小孔后,对超声、US-MB、SDT、SDT-MB组的大鼠进行辐照。SDT、SDT-MB组在辐照前6 h经大鼠尾静脉注射DVDMS(2 mg/kg),US-MB、SDT-MB组采用同样的方式在辐照前注射SonoVue(0.3 ml/kg),超声组仅进行超声辐照。DVDMS、超声、US-MB、SDT及SDT-MB组大鼠照射后均避光饲养24 h;对照组常规饲养不进行任何治疗。治疗后将各组荷瘤鼠麻醉(每组10只),用4%多聚甲醛左心室冲洗,取出完整脑组织用4%戊二醛固定2 h以上,然后进行检测。
1.7 观察与检测指标 ①接种15 d后采用增强MRI筛选荷瘤鼠,观察荷瘤鼠颅内胶质瘤的成像情况并测量大小;②超声照射后立即采用电子自旋共振法检测6组细胞中单线态氧的产生;③治疗24 h后,采用Tunel试剂盒和透射电镜检测和观察各组荷瘤鼠胶质瘤细胞的凋亡率及结构变化;④免疫组化检测Caspase-9、Caspase-3、CD31、Claudin-5、Caveolin-1的表达和Cyt-c的释放;⑤记录荷瘤鼠的生存时间:6组大鼠治疗后每组10只继续饲养直至自然死亡,每天观察其生命体征,并记录生存时间及死亡日期。
1.8 统计学方法 采用SPSS 23.0软件,计量资料以表示,组间比较采用单因素方差分析,组间两两比较采用SNK检验,P<0.05表示差异有统计学意义。
2 结果
2.1 MRI扫描结果 接种15 d后采用增强MRI进行扫描筛选荷瘤鼠,可见肿瘤内明显不均匀强化,灶周有不规则水肿带(图1)。肿瘤直径约为(8.0±0.3)mm,符合SDT的要求。

图1 Wistar大鼠的矢状面(A)、冠状面(B)与横断面(C)增强MRI图像。箭示瘤体不均匀强化、灶周有水肿带
2.2 细胞内活性氧的产生 仅在SDT和SDT-MB组检测到单线态氧的特征谱(1∶1∶1),见图2。
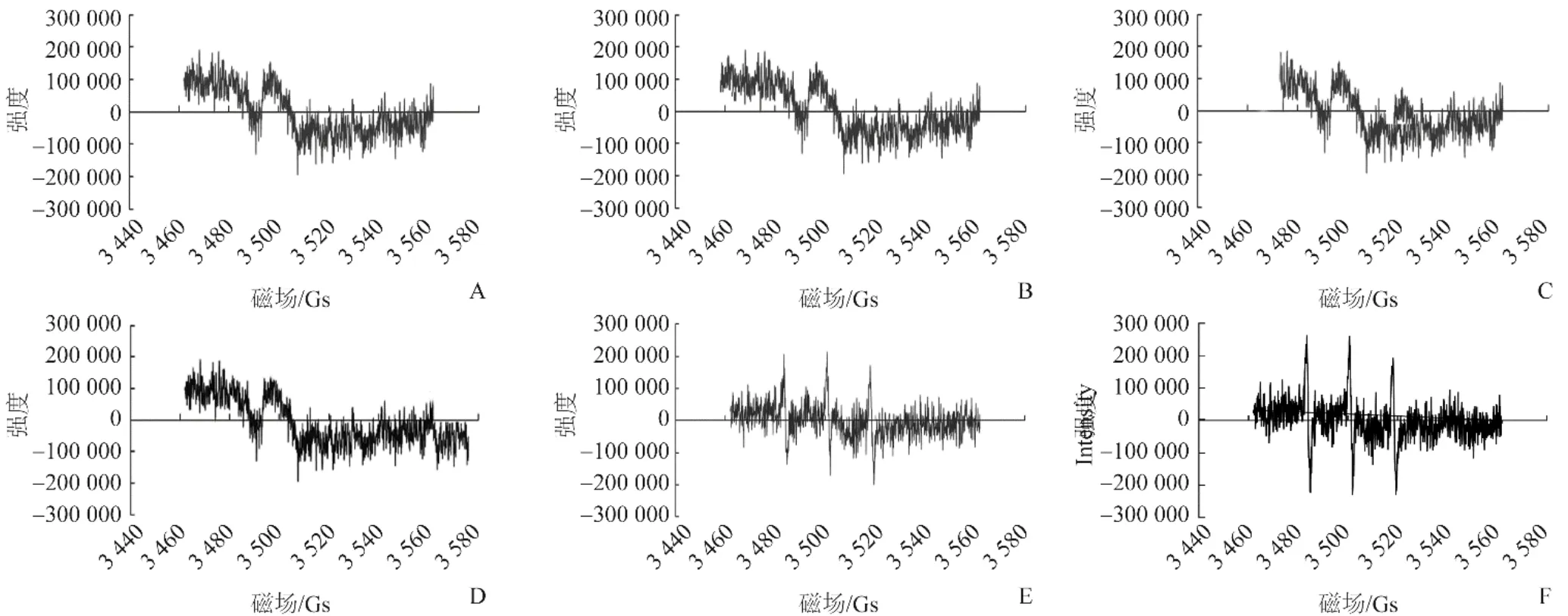
图2 采用电子自旋共振法检测6组细胞中单线态氧的产生。A.对照组;B.DVDMS组;C.超声组;D.US-MB组;E.SDT组;F.SDTMB组;仅在SDT(E)和SDT-MB组(F)检测到单线态氧,显示为1∶1∶1的等强度线
2.3 凋亡率 超声、US-MB、SDT、SDT-MB组的凋亡率均高于对照组和DVDMS组,差异有统计学意义(均P<0.05),其中SDT-MB组的凋亡率显著高于其他5组,差异有统计学意义(P<0.05),见表1、图3。

图3 Tunel染色检测各组荷瘤鼠胶质瘤细胞凋亡情况(×400)。A.对照组;B.DVDMS组;C.超声组;D.US-MB组;E.SDT组;F.SDT-MB组;C~F均可见细胞凋亡和胞质内的棕色颗粒;DVDMS:华卟啉钠;US-MB:超声联合微泡;SDT:声动力疗法;SDT-MB:声动力联合微泡
表1 各组凋亡率和荷瘤大鼠的生存时间(,n=20)
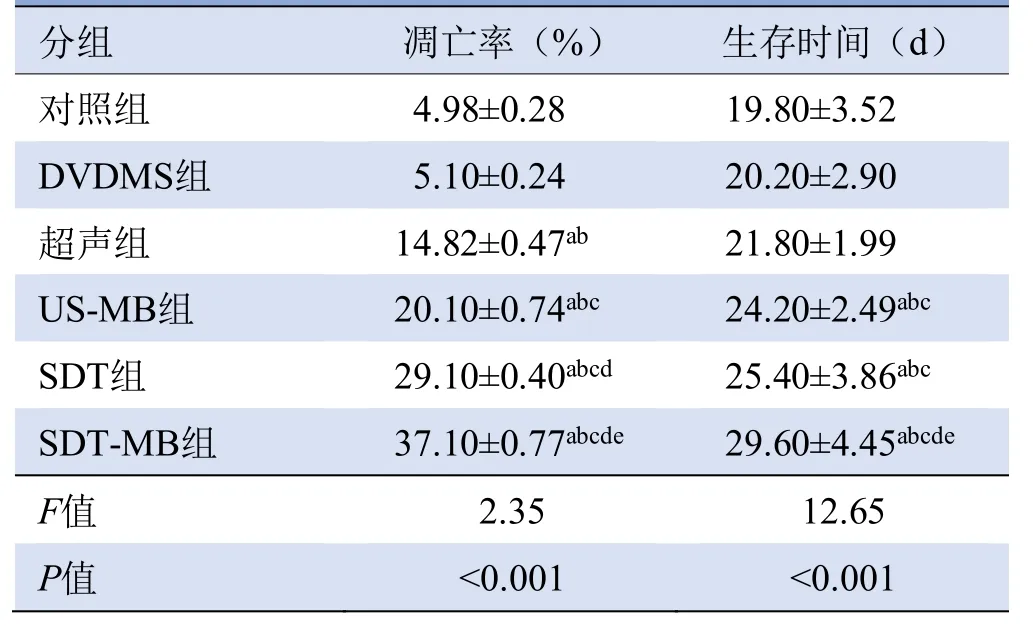
表1 各组凋亡率和荷瘤大鼠的生存时间(,n=20)
注:a与对照组比较,P<0.05;b与DVDMS组比较,P<0.05;c与超声组比较,P<0.05;d与US-MB组比较,P<0.05;e与SDT组比较,P<0.05;DVDMS:华卟啉钠;US-MB:超声联合微泡;SDT:声动力疗法;SDT-MB:声动力联合微泡
2.4 凋亡形态学变化 透射电镜观察到超声、USMB、SDT和SDT-MB组均出现不同程度的凋亡形态学改变,其中SDT-MB组改变最明显。观察发现,SDTMB组细胞微绒毛消失,包膜表面形成球状突起,可见更明显的细胞核变形和固缩、线粒体肿胀和空泡化;此外,SDT-MB组还显示部分血管内皮细胞破坏,血管壁结构模糊或破裂,见图4。
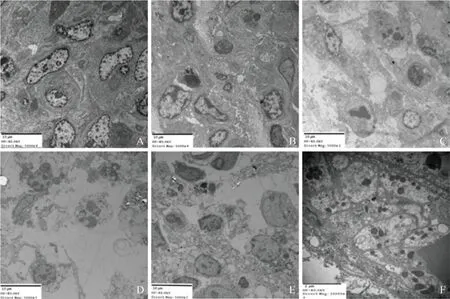
图4 透射电镜观察各组荷瘤鼠胶质瘤细胞形态学变化(×400)。A.对照组;B.DVDMS组;C.超声组;D.US-MB组;E.SDT组;F.SDTMB组;C~F可见细胞核固缩、变形,线粒体肿胀和空泡化;F可见血管内皮细胞破坏;DVDMS:华卟啉钠;US-MB:超声联合微泡;SDT:声动力疗法;SDT-MB:声动力联合微泡
2.5 相关蛋白表达 与对照组、DVDMS组相比,超声、US-MB、SDT、SDT-MB组Caspase-9、Caspase-3、Cyt-c、Claudin-5均表达上调,Caveolin-1和CD31表达下调。SDT-MB组相比其他组,蛋白表达变化更为明显(表2)。
表2 免疫组化定量分析(积分光密度IOD×10 000,)
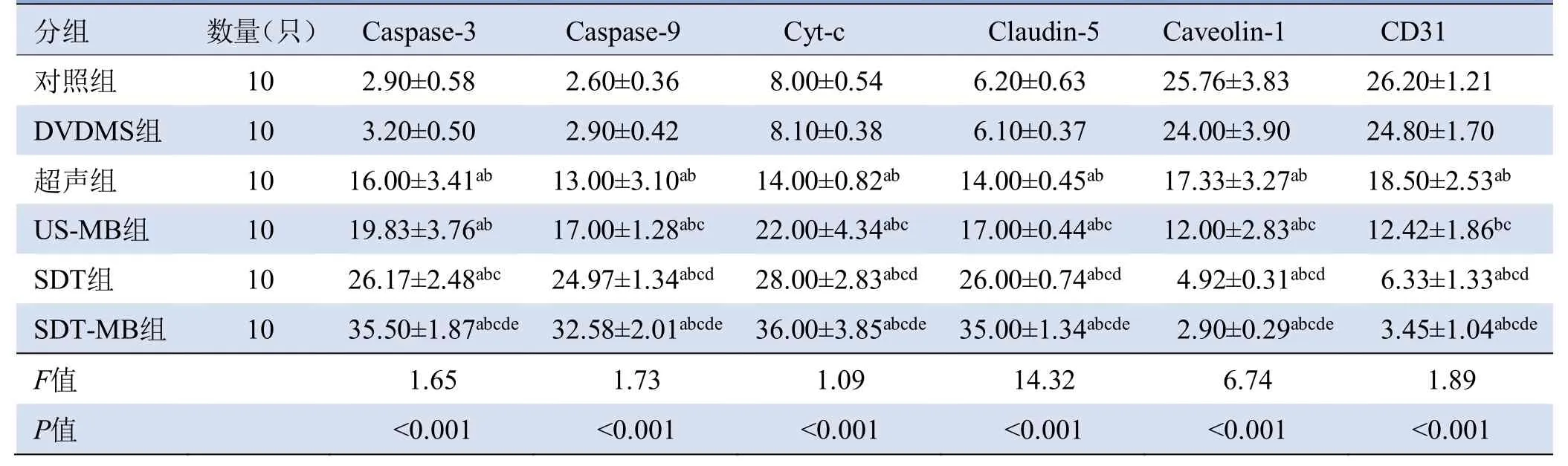
表2 免疫组化定量分析(积分光密度IOD×10 000,)
注:a与对照组比较,P<0.05;b与DVDMS组比较,P<0.05;c与超声组比较,P<0.05;d与US-MB组比较,P<0.05;e与SDT组比较,P<0.05;DVDMS:华卟啉钠;US-MB:超声联合微泡;SDT:声动力疗法;SDT-MB:声动力联合微泡
2.6 荷瘤鼠的生存时间 SDT-MB组荷瘤鼠的生存时间较其他组显著延长,差异有统计学意义(均P<0.05);US-MB和SDT组生存时间与对照、DVDMS和超声组相比显著延长,差异有统计学意义(P<0.05),但两者之间差异无统计学意义(P>0.05),见表1。
3 讨论
近年来,SDT在肿瘤治疗方面得到了广泛的研究,其利用低频低强度超声激活积聚在肿瘤内部的声敏剂,产生活性氧参与引起细胞凋亡的线粒体途径从而产生抗肿瘤作用[4-5]。超声波独特的组织穿透性为临床无创治疗脑胶质瘤提供了可能[2],其中声敏剂是SDT的关键因素,但目前所用的声敏剂治疗效果并不理想,可能与有效成分含量少、肿瘤内滞留时间短有关。方启程团队自主研发了一种新型光敏剂DVDMS,与Photofrin II相比,DVDMS的成分单一、水溶性好、靶向性强、皮肤光毒性低[6],而且能够选择性积聚在肿瘤内部,并被一定参数的超声波激活,诱导肿瘤细胞产生凋亡效应[7]。相关研究表明,在肿瘤SDT时加入微泡可通过降低空化效应的阈值增强空化效应,提高肿瘤的治疗效果[8];此外,低频聚焦超声联合微泡可引起血-脑屏障的开放或破坏,增强其通透性,促进药物进入颅内[9-10]。本实验在此基础上探讨DVDMSSDT和SonoVue对脑胶质瘤凋亡的协同作用对临床治疗的意义。
本研究体外实验结果表明,DVDMS-SDT联合SonoVue对胶质瘤细胞进行处理可在体外导致单线态氧的产生。笔者将此处理方式应用于胶质瘤荷瘤大鼠模型的SDT 中,发现SDT-MB 组凋亡率可达(37.10±0.77)%,明显高于SDT组,说明微泡的加入增强了SDT对荷瘤大鼠的凋亡作用,且透射电镜下细胞凋亡形态学的改变进一步证明了两者的协同作用。相关研究表明微泡在超声波的作用下会产生空化效应[11],因此,SDT-MB组治疗后增加的凋亡效应可能与空化核增多、空化阈值降低引起的空化效应增强有关。另外,SDT-MB组Caspase-9、Caspase-3和Cyt-c呈显著高表达,表明线粒体内源性凋亡途径参与了DVDMS-SDT-MB引起的细胞凋亡过程[12]。
Claudin-5和Caveolin-1在形成血-脑屏障紧密连接和调节其通透性方面发挥重要作用,当Claudin-5表达降低、Caveolin-1表达增加时可影响血-脑屏障的完整性导致其通透性增加[13-15]。CD31又称血小板内皮细胞黏附分子,主要表达在血小板、白细胞和紧密连接内皮细胞上,参与肿瘤细胞微血管的形成[16]。本研究中透射电镜观察发现SDT-MB组血管内皮细胞发生破坏,并且与SDT组相比,SDT-MB组荷瘤大鼠的胶质瘤组织中Caveolin-1呈显著高表达、Claudin-5呈显著低表达,以上均说明荷瘤大鼠经SDT-MB处理后血-脑屏障发生破坏,导致其通透性增加;CD31表达明显降低,说明SDT-MB治疗后抑制了胶质瘤的血管生成;本研究还发现SDT-MB组荷瘤大鼠的生存时间显著延长,进一步证实了这一结论。
尽管SDT-MB在治疗脑胶质瘤方面表现出了较好的治疗效果,但其开放血-脑屏障的具体作用机制目前尚不明确,有待进一步研究。
总之,DVDMS-SDT联合SonoVue能在体外导致单线态氧的产生,这种处理方式同时能引起荷瘤大鼠的血-脑屏障发生破坏和胶质瘤细胞凋亡,并显著延长荷瘤大鼠的生存时间,而且这一凋亡过程与线粒体内源性凋亡途径有关。
