超声在浸润性导管乳腺癌鉴别诊断中的应用价值及特异性征象研究
2023-01-13刘时香
刘 时 香
(福建省光泽县医院超声科 南平 354100)
浸润性导管乳腺癌(IDC)为乳腺恶性肿瘤中最常见的亚型,具有恶性程度高、病情进展快、预后差异性大等显著特点。临床上,早期准确诊断是促进临床开展一切治疗干预及靶向控制的基础。在长期的临床实践中,超声凭借其无创、经济、实时、可重复性好、诊断率高等优点成为目前临床上诊断乳腺肿瘤疾病最常用的方法;且近年来随着影像学技术与肿瘤病理学机制之间关系研究进程的不断推进,通过定性、定量分析方法总结特定肿瘤在超声影像学下的特异性征象,成为肿瘤疾病诊断及鉴别诊断的可靠依据[1]。与此同时,病理特征是判断肿瘤病情程度及预后评估的重要信息,而超声影像下的特异性征象及参数与肿瘤病理特征之间关系的研究,对促进临床开展无创性病理诊断及评估具有重要的作用[2]。本文主要探讨超声在IDC与鉴别诊断中的应用价值,及其在IDC病理特征判断中的应用优势。
1 资料与方法
1.1 临床资料
病例纳入方法采用回顾性纳入法,即从本院既往病例中纳入60例IDC患者设为D组,另纳入60例浸润性小叶乳腺癌(ILC)患者设为L组,病例纳入时间2019年6月—2022年6月。纳入标准:(1)遵循知情告知原则,取得患者知情同意;(2)病历资料中提供的病例信息符合本研究需求;(3)随访期内获得手术或穿刺病理学诊断结果;排除标准:(1)有彩超检查禁忌症者;(2)有乳腺恶性肿瘤手术史者。IDC组:患者年龄28~69岁,平均(54.57±4.35)岁;ILC组:患者年龄31~68岁,平均(53.25±4.21)岁。
1.2 方法
所有患者均开展彩色多普勒超声检查,检查仪器采用德国philips公司生产的EpIQ5型超声诊断仪及相应的成像软件。检查步骤:协助患者取仰卧位,双侧乳房及腋窝充分暴露,设置探头频率5~12MHz。探头经患者乳腺组织上方缓慢纵向扫至下方,再经乳腺组织内侧缓慢横向扫至外侧,再经乳头向乳房边缘做放射状扫查。探测到肿瘤病灶后对探头频率进行合理调整并聚焦,准确记录病灶位置、大小、形态、内部回声、边界特征、内部钙化、内部及周边血流等超声征象。待乳腺组织扫描完成后,对双侧腋窝进行依次扫描,观察有无淋巴结肿大及结构异常情况。然后,切换三维扫描模式,获得三维彩色多普勒图像,通过辅助软件获得肿瘤血管参数指标:血流阻力指数(RI)、血流搏动指数(PI)、收缩期流速峰值(PSV)。最后,由诊断医师根据影像学图像分析做出诊断结果。
1.3 观察指标
1.3.1 超声征象
于超声影像学检查结果下,分别从肿瘤位置、肿瘤分布、肿瘤形态、边缘毛刺、微钙化灶、后方回声衰减、血流特征七个方面对比D组与L组患者的超声征象。
1.3.2 血流参数
根据三维彩色多普勒成像下获取的肿瘤血管参数指标,对比D组与L组患者的超声血流参数。
1.3.3 D组患者超声血流参数与肿瘤病理特征的关系
肿瘤病理特征:临床分期、肿瘤分化程度、淋巴转移,对比不同病理特征组患者的血流参数:RI、PI、PSV。
1.4 统计学方法
采用SPSS20.0软件,计数、计量数据记为百分比(n/%)、标准差(±s),χ2、t检验, P<0.05提示差异比较有统计学意义。
2 结果
2.1 D组与L组患者超声征象的比较
在肿瘤分布、后方回声衰减、血流特征征象上,D组与L组患者比较,差异均无统计学意义(P>0.05);但D组患者肿瘤位置非中央区者比例高于L组(P<0.05),肿瘤形态不规则者比例高于L组(P<0.05),边缘毛刺者比例低于L组(P<0.05),微钙化灶者比例高于L组(P<0.05)。见表1。
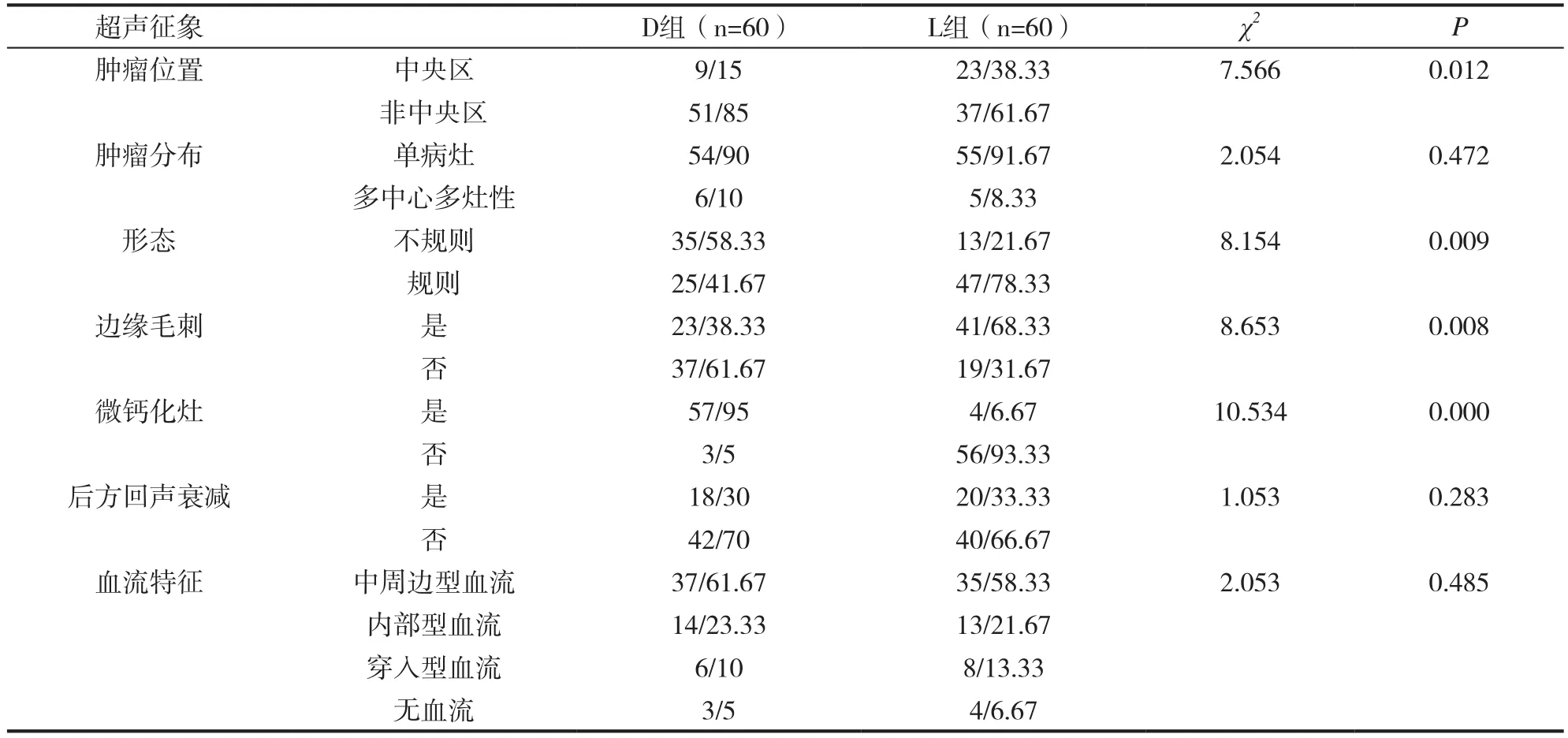
表1 D组与L组患者超声征象的比较(n/%)
2.2 D组与L组患者超声血流参数的比较
在RI、PI、PSV指标值上,D组与L组差异比较,均无统计学意义(t=0.785,P=1.223;t=1.424,P=0.783;t=1.056,P=0.824)。见图1。

图1 D组与L组患者超声血流参数比较
2.3 D组患者超声血流参数与肿瘤病理特征的关系
在RI、PI、PSV指标值上,相较于Ⅰ~Ⅱ期者,Ⅲ~Ⅳ期者更高(P<0.05);相较于高分化者,中低分化者更高(P<0.05) ;相较于未发生淋巴转移者,发生转移者更高(P<0.05)。见表2。
表2 D组患者超声血流参数与肿瘤病理特征的关系(±s )
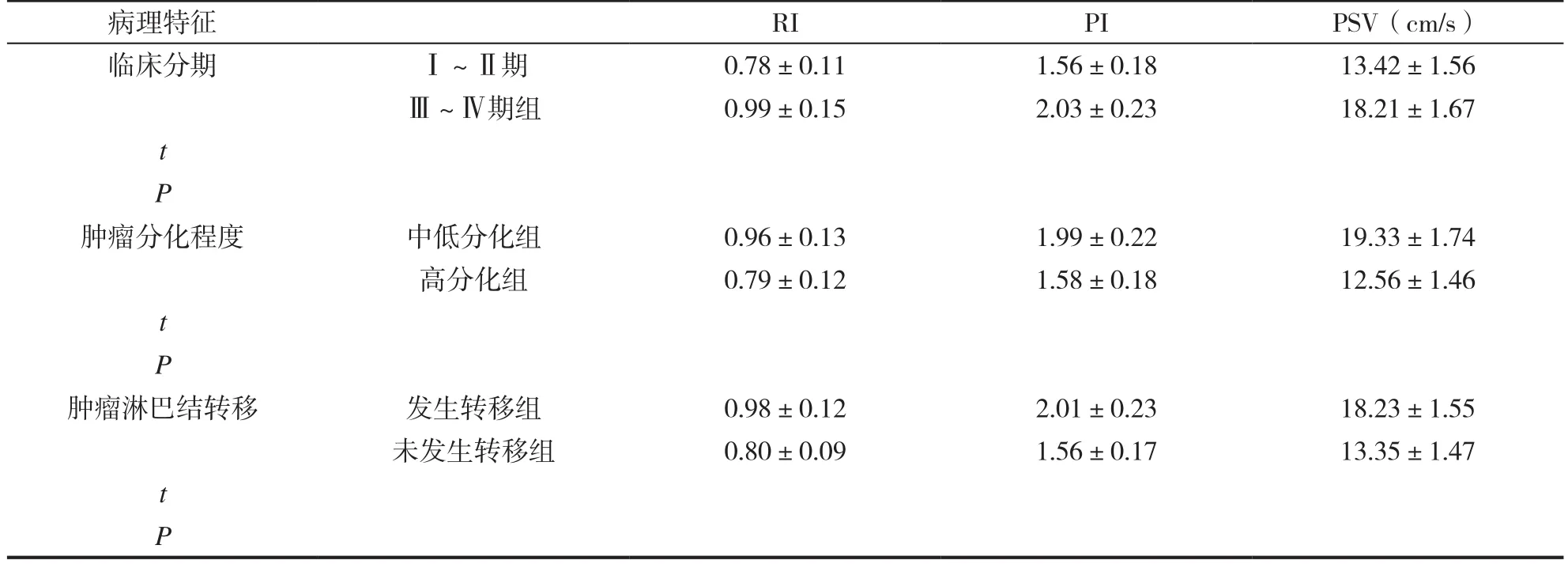
表2 D组患者超声血流参数与肿瘤病理特征的关系(±s )
病理特征 RI PI PSV(cm/s)临床分期 Ⅰ~Ⅱ期 0.78±0.11 1.56±0.18 13.42±1.56Ⅲ~Ⅳ期组 0.99±0.15 2.03±0.23 18.21±1.67 t P肿瘤分化程度 中低分化组 0.96±0.13 1.99±0.22 19.33±1.74高分化组 0.79±0.12 1.58±0.18 12.56±1.46 t P肿瘤淋巴结转移 发生转移组 0.98±0.12 2.01±0.23 18.23±1.55未发生转移组 0.80±0.09 1.56±0.17 13.35±1.47 t P
3 讨论
近年来,在人们生活节奏、环境、习惯等不断变化的大背景下,乳腺癌的发病率、危害程度及远期生存质量危害性高居女性恶性肿瘤疾病之首。早发现、早诊断是目前临床上预防乳腺癌疾病的重要手段。目前,影像学技术作为乳腺癌筛查及诊断的有效工具,主要包括X线、超声、MRI和核医学技术等,而在普及应用范围上超声普及面最为广泛[3]。且通过超声与其他影像学技术的多维度应用价值比较,其具有安全性好(电离辐射危险小)、可耐受性好(无创操作)、可重复性好、成本低等显著的优势。针对乳腺肿瘤患者,精准医学模式下在肿瘤疾病得以确诊的基础上予以临床分型的鉴别诊断是促进临床制定针对性治疗方案及改善患者预后的关键[4]。影像学征象作为特定类型病变在影像学图像下所表现的具有特定性质的影像学特征,临床上通过对疾病特定影像学征象的总结和归纳,发现其分布特点,可为疾病的诊断和鉴别诊断提供辅助性信息[5]。
IDC和ILC均为乳腺恶性肿瘤的临床常见分型,而在肿瘤病情进展、治疗及预后方面二者存在较大的差异。临床上加强其鉴别诊断有利于临床在明确肿瘤病理分型的基础上开展靶向干预措施,以实现精准化治疗。临床上肿瘤组织病理学和免疫组化检测是病理诊断的金标准,必要时还需开展基因检测[6]。而随着影像学技术与肿瘤病理表现之间相关关系研究的不断深入,已有多项报道强调,影像学下超声征象提取的特征与乳腺癌分子亚型之间具有一定的相关性,且通过对特异征象的总结,可为乳腺癌病理分型的诊断及鉴别诊断开辟新的路径[7-8]。本研究中,在超声特异性征象上,D组患者肿瘤位置非中央区者比例高于L组(P<0.05),肿瘤形态不规则者比例高于L组(P<0.05),边缘毛刺者比例低于L组(P<0.05),微钙化灶者比例高于L组(P<0.05)。即在超声检查下,肿瘤位置分布、肿瘤形态、边缘毛刺征、微钙化灶均是其特异性征象,与ILC的差异较大,可作为二者鉴别诊断的可靠依据[9]。
影像学下,肿瘤血流参数主要反映肿瘤组织血液供应情况,与肿瘤生长速度、恶性程度密切相关[10]。本研究中,同时,在RI、PI、PSV指标值上,D组患者临床分期Ⅲ~Ⅳ期组高于Ⅰ~Ⅱ期(P<0.05),肿瘤中低分化组高于高分化组(P<0.05),肿瘤淋巴结转移组高于未转移组(P<0.05)。即超声检查下IDC患者的肿瘤分期、分化程度及淋巴转移情况与RI、PI、PSV指标具有明显的相关性。临床上通过对IDC患者超声下肿瘤血流参数的分析,为其病理特征的评估提供参考。
综上,在超声影像下,IDC特异性征象主要表现为肿瘤位置主要位于非中央区,肿瘤形态多不规则,边缘毛刺、微钙化灶出现较多。且通过对患者超声血流参数的分析可为IDC病理特征的判断提供参考信息。
