正常及脾虚湿阻型单纯性肥胖大鼠脾组织蛋白组学差异分析*
2023-01-12刘芳芳李琳荣师新宇陶功定郭晓峰李俊莲
刘芳芳 李琳荣 王 平 张 耀 师新宇 李 娟 张 赞 陶功定 郭晓峰 李俊莲※
随着人们生活方式的改变,肥胖成为了全球日益严重的问题。根据WHO统计2015 年全球成人已有23亿达到超重,7亿人口达到了肥胖标准[1]。中医学认为肥胖形成的原因主要与过食肥甘厚味,内伤脾胃,湿从内生有关。《素问·奇病论》说:“必数食甘美而肥也”。《素问·通评虚实论》指出:“肥贵人,则膏粱之疾也”。饮食过量是导致肥胖的重要因素。这与现代医学认识一致,能量摄入过多,大于消耗,必然造成脂肪在体内堆积过多,导致肥胖的发生。单纯性肥胖病(Simple obesity)是指临床上仅表现为肥胖,无明显神经、内分泌系统疾病,是由于机体摄入的热量超过了消耗的热量,造成内脏和皮下脂肪蓄积而体质量超常,可伴有脂肪、糖代谢调节过程障碍。本研究通过比较正常及脾虚湿阻型大鼠脾组织蛋白质谱,筛选和鉴定与单纯性肥胖脾虚湿阻证有关的疾病特异性蛋白,探寻单纯性肥胖病的生物标志物,为其防治奠定生物学基础。
1 实验动物
1.1 种类 来源种类:雄性Spargue-Dawley(SD),成年健康大鼠40只,SPF级,体质量(200±20)g。来源:中国维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006。
1.2 试剂 耗材 仪器试剂:尿素 Urea (ACROSS)、蛋白酶抑制剂(Roche)、碳酸氢铵(SIGMA)、二硫苏糖 醇 Dithiothreito(l PlusOne)、碘乙酰胺 Iodoacetamide(Sigma)、胰酶 Trypsin (Promega V5280)、 FA 甲酸(Sigma)、SDS-PAGE 相关试剂、胰蛋白酶(trypsin,测序级)为Promega 公司(美国) 产品,HLB脱盐柱为Waters公司产品。其他试剂如乙腈(Acetonitrile,ACN)、二硫苏糖醇(Dithiothreitol,DTT)、碘代乙酰胺(Iodoacetamide,IAA)、碳酸氢铵(NH4HCO3 )等均购于Sigma公司(美国)等。
耗材:30KD FASP 管(Amicon UItra)、96 孔板(COSTAR)、Milli-Q water、Non-powder gloves、Face mask、Hat、10 μl and 200 μl tips(Eppendorf)、0.2 ml and 1.5 ml EP tube(Eppendorf)、 50 ml EP 、15 ml EP(Corning)、手术刀片、眼科手术剪。
仪器:超声破碎仪(SCIENTZ)、酶标仪 MULTISKAN MK3(Thermo)、真空干燥仪、水浴锅、2 μl、10 μl、100 μl、200 μl及1 ml移液器、废液缸、制冰和装冰设备、低温高速离心机、掌上离心机、涡旋仪、高速离心机、掌上离心机、扫胶仪。
2 实验方法
2.1 造模本实验根据单纯性肥胖模型制作文献,造成脾虚湿阻型单纯性肥胖模型大鼠[2]。适应性饲养1周后,随机分为正常对照组10只(普通饲料喂养)与单纯性肥胖模型组30只(高脂饲料喂养)。对照组:本组为同期饲养,自由进食饮水。脾虚湿阻组:高脂饲料喂养8周后,大鼠体质量超过普通饲料喂养大鼠体质量20%作为实验性营养肥胖大鼠,设为脾虚湿阻组大鼠组。
2.2 取材将各组大鼠第64天备毛,用75%酒精消毒皮肤,10%水合氯醛麻醉后,处死,暴露胸腔,摘除脾脏。
2.3 样本蛋白提取①蛋白提取:提取体系:600 μl; 提取试剂:8M UA+蛋白酶抑制剂; 提取方法:手术刀片切割绿豆粒大小组织块,天平快速称量后,加入提取试剂,采用手术剪剪碎组织块后,采用冰上超声再次破碎后,低温离心后,取上清转移;②浓度测定:将样本上清,稀释10倍后,取样本于96孔板中,再加入Bradford染色液, 放置10 min后,采用酶标仪测定蛋白浓度。
2.4 样本跑胶质控①配制 12%SDS-PAGE。②取 10 μg 样本加入 SDS、β-巯基乙醇,混匀,放于 95 ℃反应 10 min。③反应结束后,放于离心机中,14 000 g离心5 min,上样。④电泳设置为:S1:80 V,20 min;S2:120 V,120 min。
2.5 样品FASP酶切处理:① 各个样本各取300 μg添加至FASP管中,其加入200 μl 8M Urea,离心替换溶液;②加入终浓度 20 mM DTT,涡旋后,封口膜封口,37 ℃放置 1 h;③加入终浓度 50 mM IAA,涡旋后,避光放置 30 min;④加入 200 μl 8M Urea,离心 10 min 去除;⑤加入 200 μl 50 mM NH4HCO3 水溶液,替换2次;⑥更换新的收集管,加入 200 μl 50 mM NH4HCO3,8 μg胰蛋白酶。封口后,37 ℃过夜;⑦采用 50 mM NH4HCO3 回收肽段,热干。
2.6 酶解处理①水洗胶块2次,吸走液体。②胶块脱色。加脱色液(溶于50 mM NH4HCO3/50%CAN),100 μl左右(溶液的量视胶块具体大小而定)室温脱色至胶块颜色完全褪去。③胶块脱水。加100%CAN,让胶块变白完全脱水;再用离心浓缩仪挥干10 min。④还原烷基化(SDS一维电泳条带):加入50 μl 10 mM DTT溶液(溶于25 mM NH4HCO3),56 ℃水浴60 min;离心,吸走液体; 加入50 μl 55 mM IAA溶液(溶于25 mM NH4HCO3),避光反应40 min;吸走液体;加入100 μl水洗胶块,将反应剩余液体吸走。⑤胶块脱水,重复步骤3。⑥加入胰酶5~20 μl(具体视胶块大小而定),让胶块充分吸胀,变透明,冰上放置约20 min,再加3 μl覆盖液。⑦37 ℃水浴过夜16 h;分析则需要萃取胶内的多肽,萃取2次,冷冻干燥后脱盐再冻干待做LCMS。
2.7 液相色谱串联质谱①纳升液相为Thermo Scientific Easy-nLC 1000,流动相A为0.1%甲酸水溶液;溶液B为0.1%甲酸乙腈溶液。液相梯度设置为:4 min,8% B相;45 min,30%B相;55 min,90% B相;60 min,90% B相。②质谱仪为Orbitrap Fusion Lumos,碰撞能量为27% HCD,分辨率设置为一级70 000 m/z 200,二级17 500 m/z 200,母离子扫描范围为300~1800 m/z,子离子扫描范围起始为m/z 100,数据依赖模式MS/MS,隔离窗口为1.6 Da,动态排除为20 s;喷雾电压为2.0 kV,毛细管温度为275 ℃,S-lens:55%。
2.8 统计学方法质谱结果使用Proteome Discoverer 2.0 数据分析软件对进行搜库,酶解位点为精氨酸(R),赖氨酸(K),允许有2个漏切位点,允许一侧非特异性酶解,固定修饰:半胱氨酸的Carbamidomethylation。可变修饰:Oxidation / +15.995 Da (M)。
3 结果
3.1 样本电泳胶图双向凝胶电泳分析,样本跑胶质控良好。见图1。
图1 样本胶图结果
3.2 质谱分析差异蛋白质经过对差异蛋白质进行质谱分析,得到比较满意的质谱数据,并对这些蛋白质斑点进行数据库检索,最终鉴定得到3个蛋白质(见表1)。其中表达上调的有2个,经数据库检索,它们是蛋白质二硫化物异构酶A3前体(PDIA3)、60-kDa热休克蛋白(HSP60,也称为HSPD1)表达下调的有1个,经鉴定是巨噬细胞中穹窿主体蛋白(Major Vault Protein,MVP)。

表1 脾虚湿阻组与对照组对比差异蛋白的表达情况 (个)
4 讨论
蛋白质组学技术现已广泛应用到生命科学的各个领域[3]。因生物的蛋白质在不同环境下变化极为敏感,细胞内、外环境的改变及细胞内细胞器的活动都会影响氨基酸的序列、基因的表达以及蛋白质的翻译后加工[4],所以差异蛋白组学被用于疾病的早期诊断、疾病过程的监测、药物疗效的评价以及环境因素等对疾病的影响等方面[5]。本研究中,得到与脾虚湿阻证密切相关的生物因子3个。
4.1 巨噬细胞中穹窿主体蛋白巨噬细胞中穹窿主体蛋白(Major Vault Protein,MVP)具有拮抗大鼠高脂饮食引起的肥胖、全身性代谢紊乱和动脉粥样硬化的作用。其机制系通过MVP结合TRAF6,减少其泛素化,从而抑制IKK-NFkB信号通路介导的炎症反应而实现[6]。其作用机制如图2所示。
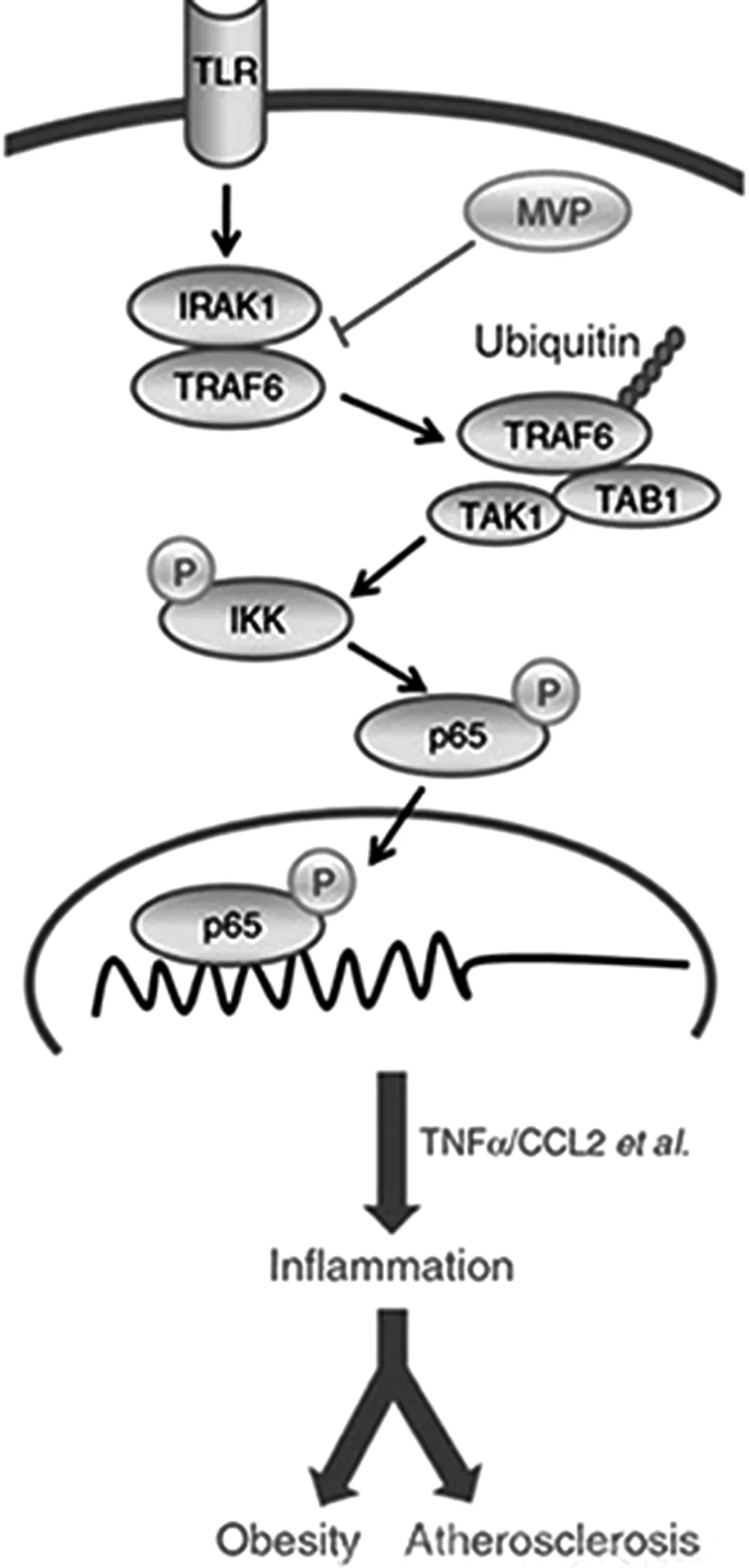
图2 主要穹窿蛋白通过抑制IKK-NF-κB信号介导的炎症反应抑制肥胖
由此可知,通过MVP结合TRAF6,从而抑制IKK-NFkB信号通路介导的炎症反应,MVP是巨噬细胞炎症反应的负性内控调节器,可选择性抑制由TRAF6介导的代谢性炎症反应,这为防治单纯性肥胖及冠心病等提供了新的靶点和理论依据。
4.2 蛋白质二硫化物异构酶A3前体(PDIA3)蛋 白 质 二 硫 化 物 异 构 酶A3 (Protein Disulfide Isomerase A3,PDIA3)[7]又名ERP57、 ER60、 GRP58和 1,25D3-MARRS,广泛存在于真核生物中,与钙网蛋白(Calreticulin,CRT)、钙连接蛋白共同构成内质网分子伴侣复合物,介导蛋白质的折叠与修饰[8]PDIA3与多种自身免疫性疾病密切相关[9]。
PDIA3水平上调出现于多种疾病中,在胎膜早破、肠易激综合征、肝细胞性肝癌中均有报道。既往研究表明 PDIA3Ab在多种自身免疫性疾病中呈高表达[10-12]。但目前尚无PDIA3与单纯性肥胖的相关文献报道,本研究首次证实PDIA3Ab在单纯性肥胖中呈现高表达。
4.3 60-kDa热休克蛋白(HSP60,也称为HSPD1)热休克蛋白60(HSP60)是一种重要的伴侣蛋白,它调节线粒体蛋白质的稳态,维持线粒体功能。线粒体糖酵解和hsp60kd抑制线粒体活性。HSP60沉默通过磷酸戊糖途径影响核糖核苷酸和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的合成,抑制细胞增殖。HSP60 KD抑制5'腺苷一磷酸活化蛋白激酶(AMPK),后者抑制关键酶6-磷酸果糖激酶/果糖2,6-二磷酸酶3(PFKFB3),通过抑制丙二酰辅酶A影响脂肪酸的代谢。研究数据表明,减少HSP60表达改变了单纯性肥胖的代谢重编程,抑制肿瘤进展并减少线粒体依赖性生物合成,这表明HSP60是单纯性肥胖治疗的潜在治疗靶点[13]。
本研究采用酶切、双向凝胶电泳结合质谱分析对脾虚湿阻型单纯性肥胖大鼠和正常对照组进行了差异蛋白组学研究。实验结果显示:2组中的蛋白质表达有差异。经鉴定3个与脾虚湿阻型单纯性肥胖大鼠密切相关的蛋白质,可为探索单纯性肥胖脾虚湿阻证的发病机制提供分子生物学依据,其中巨噬细胞中穹窿主体蛋白(Major Vault Protein,MVP)已在不同物种被多次证实为肥胖症的防治靶点,亦有可能成为脾虚湿阻型单纯性肥胖的分子诊断标志物。
