珊瑚脂质是其共生虫黄藻密度降低时的重要能量来源
2023-01-12门征陈汉吉许慎栋余克服莫洪燕
门征,陈汉吉,许慎栋, ,余克服, ,莫洪燕
( 1. 广西大学 海洋学院 广西南海珊瑚礁研究重点实验室,广西 南宁 530004;2. 中国科学院烟台海岸带研究所 中国科学院海岸带环境过程与生态修复重点实验室,山东 烟台 264003;3. 南方海洋科学与工程广东省实验室(珠海),广东 珠海519082)
1 引言
在人类活动和气候变暖的影响下,全球珊瑚礁生态系统正在经历严重的退化[1-3]。珊瑚的环境适应性和抗白化能力仍有许多未知之处。以往的研究主要集中于珊瑚共生虫黄藻密度和种类[4-5]、珊瑚形态[6-7]、组织厚度[8]等对珊瑚白化敏感性的影响。从能量供给的角度来看,白化时共生虫黄藻密度的降低会导致其光合作用强度的减弱,进而导致光合营养向珊瑚宿主提供的能量减少[9-10]。此时,珊瑚需要其他类型的能量来满足其日常代谢需求。许多研究证明,珊瑚宿主可以通过提高其自身异养摄食的强度来弥补虫黄藻自养营养输入的减少,并维持正常的能量供给[10-13]。但是目前关于珊瑚体内的脂质在维持能量供给稳定中的作用关注较少。
在健康的珊瑚中,共生虫黄藻通过光合作用固定大量的碳,主要以葡萄糖和甘油等有机化合物形式转移到宿主,满足珊瑚正常的能量需要[14]。与此同时,一部分碳被合成脂质并储存在珊瑚宿主组织中[15-16]。珊瑚宿主组织中的脂质含量占据珊瑚共生体(共生虫黄藻和珊瑚宿主)中脂质含量的绝大部分,高达90%以上[17]。脂质是珊瑚重要的能量成分和结构成分,参与珊瑚大部分生化和生理过程[18-19]。其中,甘油三酯和蜡酯是储存能量的主要脂质,占总脂质含量的40%~73%[20];甾醇和磷脂是主要的结构脂质,占总脂质含量的9%~60%,结构脂质是珊瑚细胞膜及虫黄藻的结构基础[18-19]。在自然环境中,环境胁迫会使珊瑚失去体内的虫黄藻/光合色素,导致珊瑚产生白化现象[21]。即使在未发生严重白化事件的年份,珊瑚的共生虫黄藻密度在不同季节也会出现明显的变化。通常由于海水温度升高/太阳辐射增强,珊瑚在夏季会失去大量的虫黄藻[8,22-23]。虫黄藻密度与珊瑚光合作用强度密切相关,虫黄藻密度的降低伴随着光合作用强度的下降[4,24]。在这种情况下,珊瑚无法通过虫黄藻光合作用获得足够的新陈代谢所需求的能量。研究珊瑚的脂质含量在不同季节,尤其是尚未白化的健康珊瑚在夏季虫黄藻密度降低时其脂质含量的变化情况,有助于我们进一步理解珊瑚在环境压力下维持能量平衡的机制。然而以往关于脂质的研究主要集中在脂质的来源[1]、合成途径[25]、成分分析[18]等。目前关于珊瑚脂质含量对野外自然因素所导致的夏季虫黄藻密度及其光合作用强度降低有何响应鲜有报道。
研究珊瑚脂质对虫黄藻密度及其光合作用强度变化的响应难点在于野外大规模测定虫黄藻的光合作用强度较为困难。这一问题可以通过在室内测定采集回来的珊瑚共生虫黄藻的稳定氮同位素(δ15Nz)值来解决。虫黄藻的δ15Nz值与珊瑚光合作用强度密切相关[26-27]。虫黄藻在光合作用时倾向于优先吸收含轻14N的无机营养物质(14NH+4、14NO-3等),这被称为同位素分馏效应[28]。当珊瑚光合作用强度增强时,虫黄藻对氮的需求增加[29]。为了满足光合作用的需要,虫黄藻有效同化可用的氮,吸收更多更重的15N,导致分馏效应降低[30]。综上,虫黄藻δ15Nz值受光合作用强度影响,虫黄藻光合作用强度增强,δ15Nz值随之升高,当光合作用强度减弱时,δ15Nz值降低[27-28]。因此,我们可以借助珊瑚共生虫黄藻δ15Nz值的大小获取光合作用相对强度的信息。
西沙群岛珊瑚礁区位于南海中部,远离大陆,受人类活动影响较小,但其更容易受到自然环境胁迫(异常水温、光照条件等)的影响[31]。例如在2020年,西沙群岛夏季(6月)最高海表面温度(Sea Surface Temperature, SST)高达30.6°C。夏季较高的SST通常会导致珊瑚虫黄藻密度降低[31]。因此,西沙群岛为研究自然条件下珊瑚脂质含量对夏季虫黄藻密度降低的响应提供了理想的研究区域。本文以2020年春季(3月)和夏季(6月)从西沙群岛采集的帛琉蜂巢珊瑚(Favia palauensis)和澄黄滨珊瑚(Porites lutea)样品为研究对象,测定了虫黄藻密度、脂质含量等生理参数以及虫黄藻稳定氮同位素δ15Nz值地球化学指标。通过生理参数与同位素指标相结合:(1)分析了珊瑚共生虫黄藻密度在夏季的降低及其原因;(2)通过δ15Nz值讨论了夏季虫黄藻密度的降低导致其光合作用强度的下降;(3)分析脂质对夏季虫黄藻光合作用强度降低的响应,并探讨了脂质储备对维持珊瑚能量供给稳定的意义。研究结果有助于从能量供给的角度进一步深入理解珊瑚的环境适应能力。
2 材料与方法
2.1 研究区域和珊瑚样品采集
西沙群岛(15°46′~17°08′N,111°11′~112°54′E)位于南海中部,是热带海区典型的珊瑚礁岛群,距海南省三亚市约330 km,远离人口稠密的大陆。西沙群岛的珊瑚礁受人类活动影响较小,呈现出较高的活珊瑚覆盖率[32]。但是,近年来全球变暖、海水温度升高、厄尔尼诺事件频发等对珊瑚礁生态系统产生了不利影响[3]。卫星遥感数据(https://giovanni.gsfc.nasa.gov)显示,研究区域采样年份(2020年)3月光合有效辐射(Photosynthetically Active Radiation, PAR)为47.06 E/(m2·d),6月 为56.65 E/(m2·d);3月 平 均SST为26.6°C,6月为30.3°C(高于珊瑚最适宜生长温度25~30℃的上限[31])。
2020年3月和6月从西沙群岛礁区2~4 m水深处,共采集到45个健康珊瑚,包括F. palauensis和P.lutea两个种,具体采样点见图1。其中F. palauensis在3月(n=10)和6月(n=17)共 采 集 到27个,P.lutea在3月(n=5)和6月(n=13)共采集到18个。所有的样品均在健康的珊瑚群落中随机采样,采集后的样品在实验分析前处于-20℃冷冻保存。
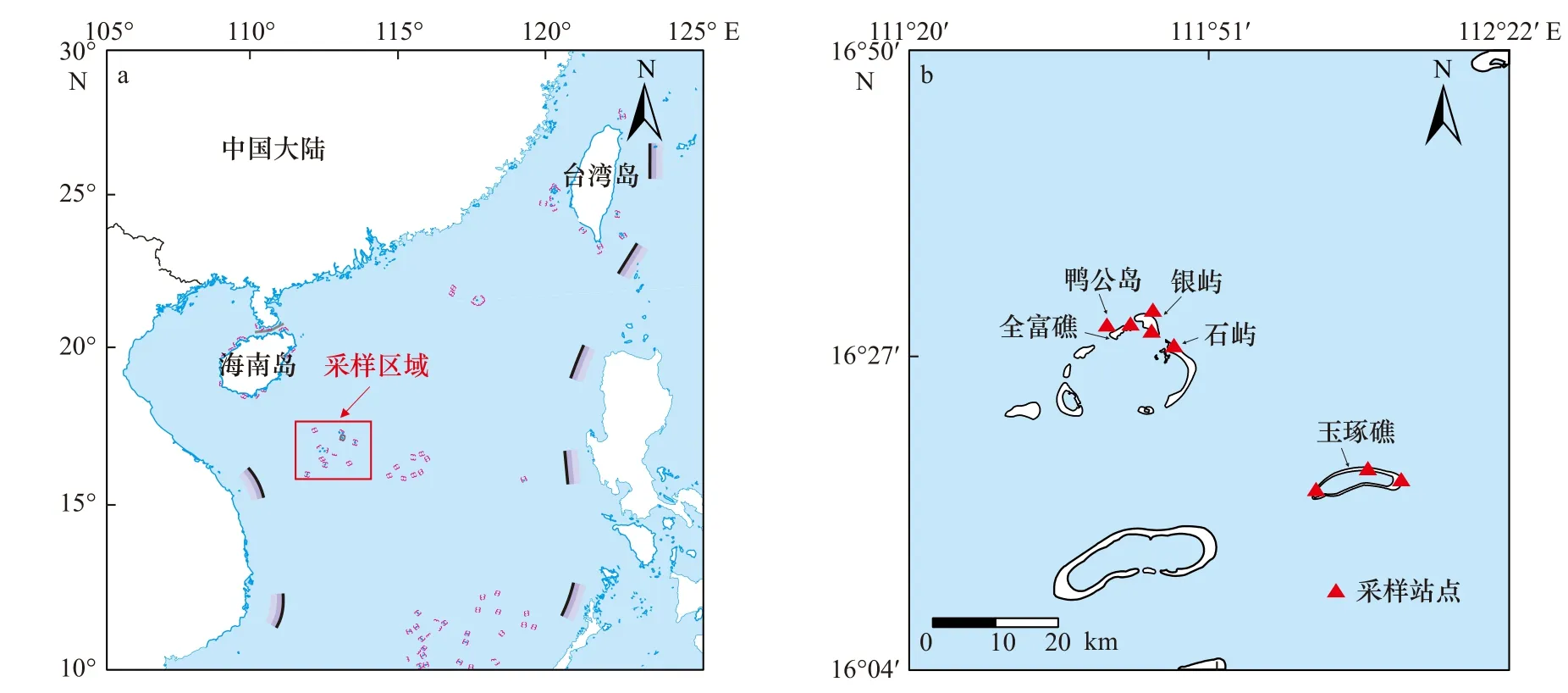
图1 本文研究区域① 审图号为GS(2020)4618号。(a)和具体采样点(b)Fig. 1 The study area (a) and specific locations of sampling (b) in this paper
2.2 实验方法
2.2.1 共生虫黄藻密度
珊瑚样品采集完成之后,从每个样品中分出一部分,将这部分分别修剪成合适的大小(长2~3 cm)用于测量共生虫黄藻密度。剩余部分的样品保存在-20°C的冰箱中用于后续测定脂质含量。使用waterpik冲洗器(经过0.4 μm滤膜过滤的海水)高压冲洗珊瑚表层,使珊瑚共生组织和骨骼分离,收集所有的冲洗浆液。将珊瑚骨骼放入35°C的烘箱中烘干后保存在PE塑料密封袋中用于测定其表面积。用量筒测量所有冲洗浆液的总体积,混合均匀后取4份,每份3 mL在离心管中离心(4 000 r/min,3 min)。去除上层清液,剩余藻体加入1 mL 5%甲醛固定2~4 h后置于0℃保存用于显微镜观察。使用血球计数板统计虫黄藻的数量(n=8),并换算成总体积溶液内所含虫黄藻的数量。用铝箔纸包裹珊瑚表面,裁剪下包裹珊瑚的铝箔纸并称重。裁剪长和宽均为10 cm的铝箔纸称重后计算出每平方厘米的铝箔纸重量,通过包裹珊瑚骨骼表面铝箔纸的重量除以每平方厘米铝箔纸的重量计算出珊瑚样品的表面积。最后依据总体积溶液内所含虫黄藻数量除以珊瑚骨骼表面积计算出珊瑚共生虫黄藻密度[23,33]。
2.2.2 虫黄藻和宿主组织的分离与收集
将2.2.1节中剩余的冲洗浆液离心处理(1 500 r/min,10 min)分离虫黄藻和宿主组织[20]。下层沉淀(虫黄藻颗粒)加入0.5 mL HCl(1 mol/L)去除附着的碳酸盐后用去离子水冲洗两次。随后放入35℃的烘箱中烘干收集用于测定氮同位素[34]。
2.2.3 脂质
取2.2.1节中用于测定脂质含量的珊瑚样品,将每个样品分别放入含有10%甲醛的海水浸泡24 h。用蒸馏水冲洗珊瑚样品并在35℃下干燥。将干燥的样品分别单独放入装有约20 mL氯仿-甲醇(2∶1)的软木塞小瓶中提取脂质。萃取24 h后,将溶剂萃取液通过粗滤纸过滤器倒入预先称重的铝盘中。为了将残余溶剂冲洗干净,用2~5 mL氯仿-甲醇溶液(2∶1)冲洗珊瑚样品和过滤器。然后将含有溶剂的铝盘在55℃下烘干,得到的脂质重量精确到0.001 g。脂质提取完成后,将瓶中剩余的珊瑚样品取出并烘干。用铝箔纸包裹珊瑚表面,根据铝箔纸重量和面积的关系计算珊瑚骨骼表面积。最后由脂质重量除以珊瑚骨骼表面积得到珊瑚脂质含量[35]。
2.2.4 稳定同位素分析
使用Sercon Integra 2型元素分析-稳定同位素比值质谱联用仪(EA-IRMS)进行珊瑚δ15Nz测试分析。为了监视仪器的稳定性和保证测试的精度,在整个测试过程中每12个样品插入两个乙酰苯胺标样(δ15N值为-4.21‰)。δ15Nz值以空气中N2标准给出。每个样品至少分析两次,最终结果取平均值,其分析误差≤0.2‰。
2.3 数据分析
本研究数据的统计分析工作在软件SPSS 25.0中进行。使用独立样本T检验分别检验珊瑚虫黄藻密度、脂质含量、δ15Nz值在季节、属种间的差异性。Shapiro-Wilk检验和Levene检验分别用于评估数据是否满足正态性和方差齐性。利用Pearson相关性分析分析了珊瑚虫黄藻密度与δ15Nz值及珊瑚脂质含量与虫黄藻密度、δ15Nz值之间的相关性。所有数据以平均值±标准偏差(mean±SD)表示。
3 结果
3.1 珊瑚生理参数和稳定氮同位素的属种差异
为了提高研究结果的可靠性,本文采用野外覆盖度高且具有代表性的F. palauensis和P. lutea两种块状珊瑚进行重复验证。我们利用独立样本T检验分析了F. palauensis和P. lutea虫黄藻密度、脂质含量、δ15Nz值之间的差异。如表1所示,两种珊瑚各参数之间均无显著差异。
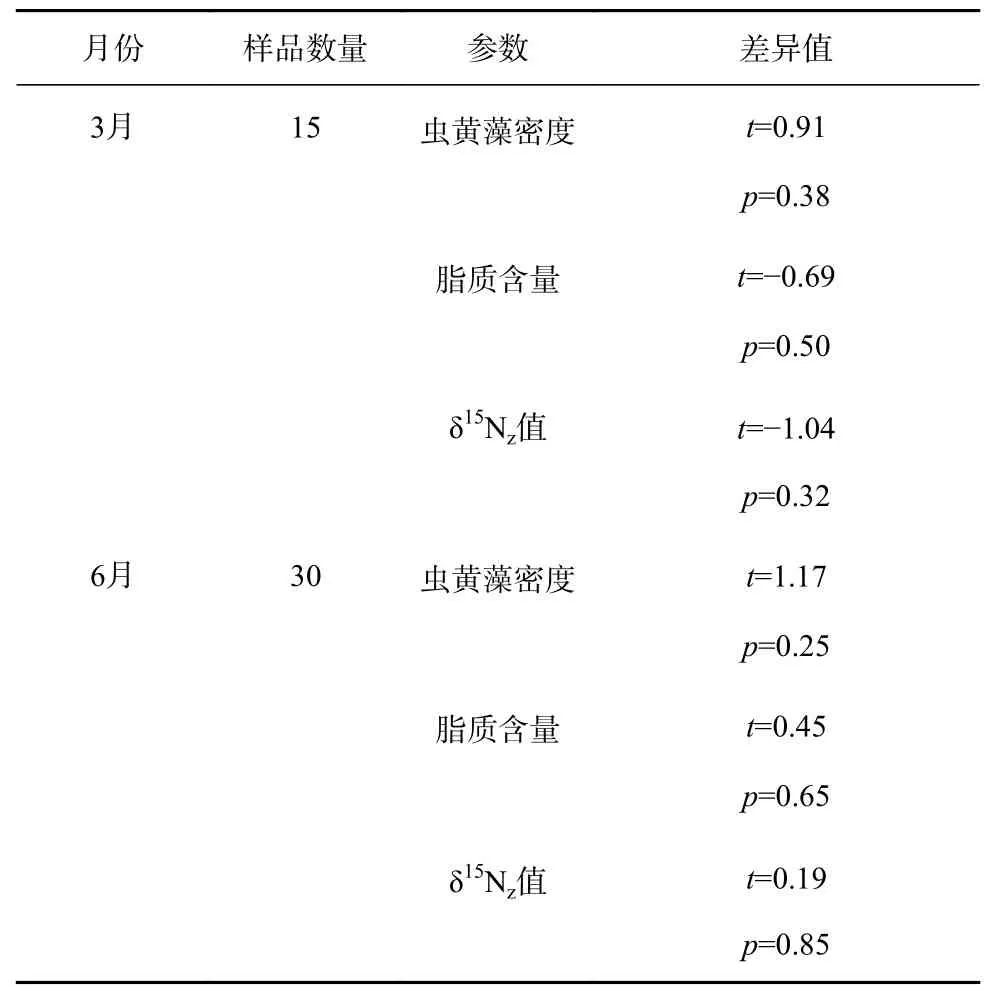
表1 两种珊瑚在3月和6月虫黄藻密度、脂质含量、δ15Nz值的属种差异Table 1 Interspecific differences in zooxanthellae density, lipid content and δ15Nz value of two genera of corals in March and June
3.2 珊瑚生理参数和稳定氮同位素的季节差异
本研究中两种珊瑚的虫黄藻密度均呈现明显的季节差异(表2)。具体来看,F. palauensis和P. lutea3月的虫黄藻密度平均值分别为(2.96±0.59)×106cells/cm2、(2.67±0.43)×106cells/cm2,6月的虫黄藻密度平均值分别为(2.32±0.61)×106cells/cm2、(2.07±0.53)×106cells/cm2,如图2a所示,两种珊瑚在夏季(6月)的虫黄藻密度明显低于春季(3月)。两种珊瑚的脂质含量也呈现明显的季节差异(表2)。F. palauensis和P. lutea3月的脂质含量平均值分别为(5.70±0.50)mg/cm2、(5.89±0.61)mg/cm2,6月的脂质含量平均值分别为(4.48±0.53)mg/cm2、(4.35±0.82)mg/cm2,如图2b所示,两种珊瑚在夏季的脂质含量明显低于春季。两种珊瑚的δ15Nz值也呈现明显的季节差异(表2)。F. palauensis和P. lutea3月的δ15Nz平均值分别为(5.47±0.33)‰、(5.64±0.25)‰、6月的δ15Nz平均值分别为(5.08±0.38)‰、(5.05±0.32)‰,如图2c所示,两种珊瑚δ15Nz值在夏季明显低于春季。
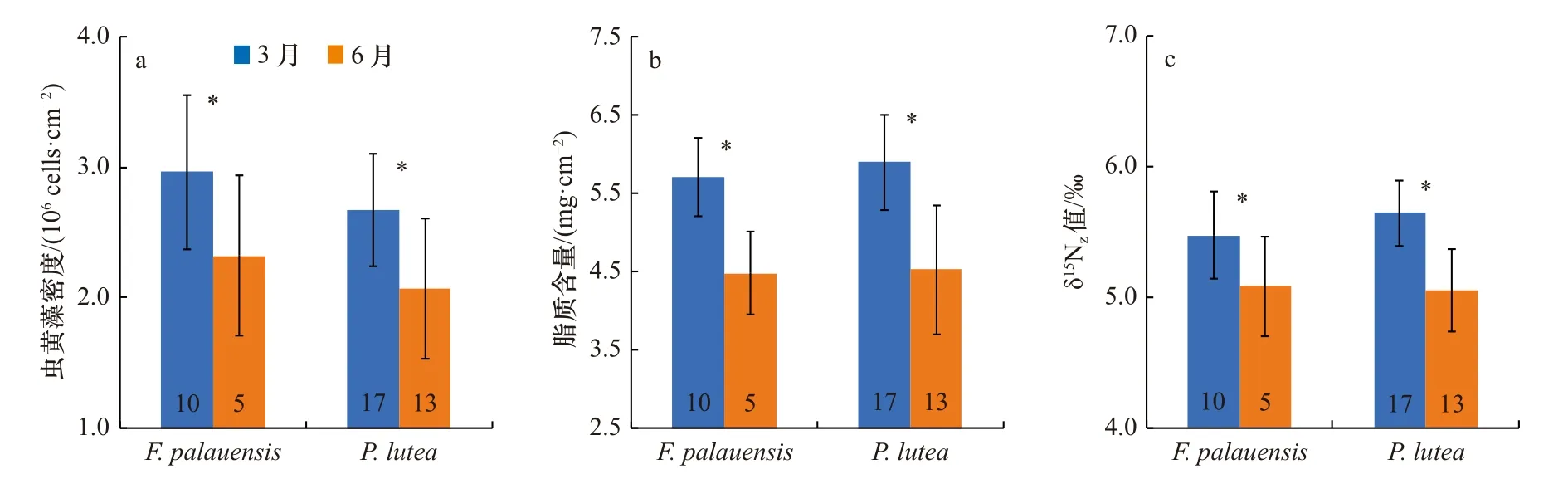
图2 两种珊瑚虫黄藻密度(a)、脂质含量(b)、δ15Nz值(c)的季节差异Fig. 2 Seasonal differences in zooxanthellae density (a), lipid content (b) and δ15Nz value (c) of two genera of corals
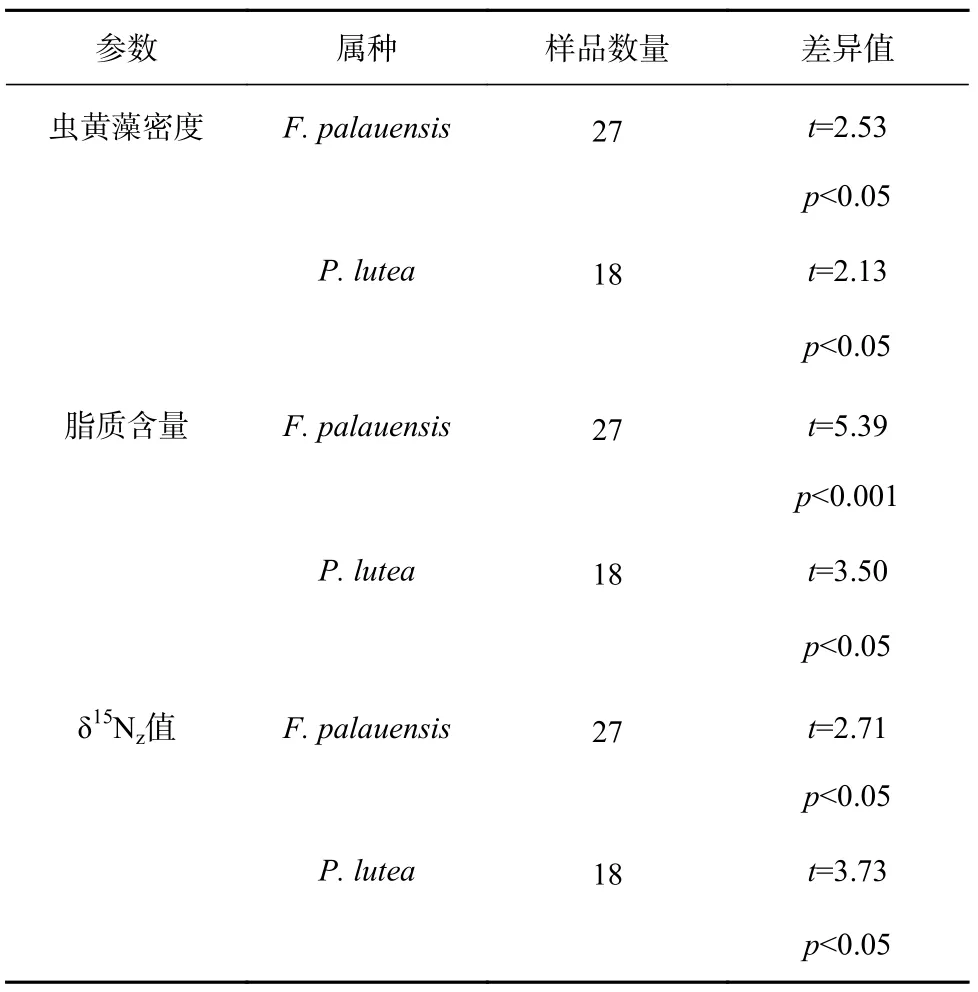
表2 两种珊瑚虫黄藻密度、脂质含量、δ15Nz的季节差异Table 2 Seasonal differences in zooxanthellae density, lipid content and δ15Nz of two genera of corals
3.3 虫黄藻密度与δ15Nz值的相关性
δ15Nz值与珊瑚共生虫黄藻的光合作用强度密切相关[27-28,30]。以往的研究发现,虫黄藻密度会影响珊瑚共生虫黄藻光合作用强度[26,36]。我们分析了两种珊瑚虫黄藻密度与δ15Nz值之间的相关性,结果显示虫黄藻密度与δ15Nz值呈正相关关系,如图3所示。
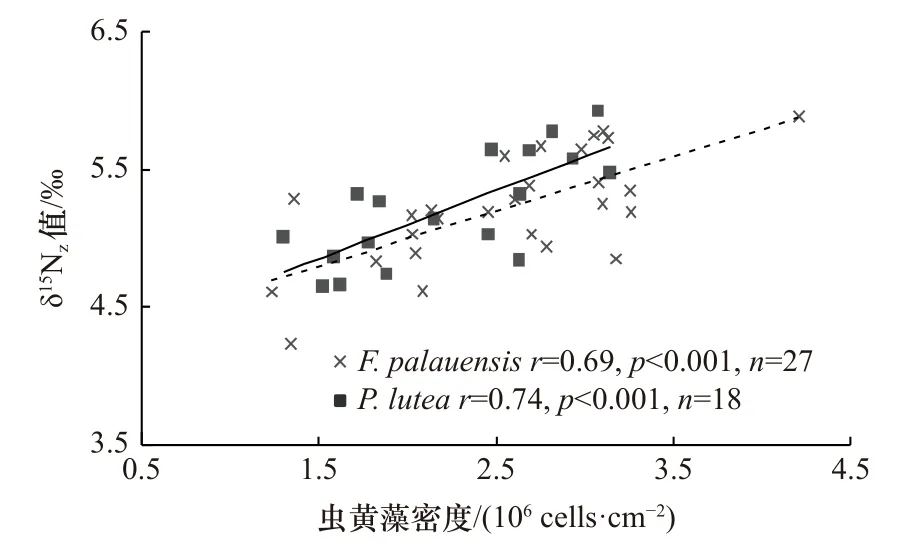
图3 两种珊瑚虫黄藻密度与δ15Nz值的关系Fig. 3 Relationship between zooxanthellae density and δ15Nz value of two genera of corals
3.4 脂质含量与虫黄藻密度和δ15Nz值的相关性
为了研究珊瑚脂质含量与虫黄藻密度、光合作用强度之间的关系。我们分析了珊瑚脂质含量与虫黄藻密度、δ15Nz值之间的相关性。如图4所示,珊瑚脂质含量与虫黄藻密度、δ15Nz值之间均呈正相关关系。

图4 珊瑚样本虫黄藻密度与脂质含量的关系(a)及珊瑚样本δ15Nz值与脂质含量的关系(b)Fig. 4 Relationship between zooxanthellae density and lipid content of coral samples (a) and relationship between δ15Nz value and lipid content of coral samples (b)
4 讨论
4.1 夏季共生虫黄藻密度显著降低
本研究中,两种珊瑚的共生虫黄藻密度在夏季(6月)均显著低于春季(3月)(图2a)。这与以往的研究结果一致,例如,Warner等[4]发现,在加勒比圆菊珊瑚属(Montastraea)的虫黄藻密度在春季高于夏季。Fitt等[8]发现,在巴哈马群岛5种珊瑚的虫黄藻密度在夏季末最低,在冬季最高。以往的研究表明,SST是影响珊瑚虫黄藻密度最重要的环境因素之一[8,22-23,31]。当SST接近甚至超过珊瑚耐受温度的上限会导致虫黄藻密度降低[37-38]。这是因为珊瑚在高温胁迫下,宿主细胞功能紊乱,虫黄藻和宿主之间的共生关系被破坏,含有虫黄藻的宿主细胞分解速度加快,虫黄藻被排出珊瑚体外[39]。例如,Glynn和D'Croz[37]通过室内温度胁迫实验发现,鹿角杯形珊瑚(Pocillopora damicornis)在30~32℃时虫黄藻密度迅速降低,但当珊瑚处于正常温度(26~28℃)时虫黄藻密度仍保持较高水平。在本研究中,研究区域采样年份平均SST为30.3°C,高于3月的26.6°C。并且30.3°C高于珊瑚最适宜生长温度的上限30°C[31,38]。因此,我们认为夏季的高温胁迫是导致虫黄藻密度在夏季降低的重要因素之一。
此外,过多的光照/紫外线辐射会阻碍光合系统电子转移、损伤光合系统II(PSII)上D1蛋白和增加破坏性活性氧的数量,最终导致珊瑚选择性地排出体内部分虫黄藻[40]。例如,Kuguru等[41]发现,在高辐射条件下,每个香菇珊瑚(Rhodactis rhodostoma)的共生虫黄藻密度都会明显降低。本研究中采样年份6月的平均PAR为56.65 E/(m2·d),高于3月的47.06 E/(m2·d)。因此较高的光照强度也可能是导致虫黄藻密度在夏季降低的原因之一。
虫黄藻密度是反映珊瑚健康状况的重要生理指标[8]。珊瑚具有较高的虫黄藻密度可以保护其免受温度和紫外线辐射的伤害,增加其对热白化的耐受性[42-43]。不仅如此,虫黄藻密度与珊瑚的光合作用强度密切相关[26,44]。珊瑚所需的营养物质主要通过共生虫黄藻转移光合作用产物获得[12,17,20]。研究珊瑚光合作用强度对夏季虫黄藻密度降低的响应有助于更好地理解珊瑚的能量供应机制。
4.2 夏季共生虫黄藻密度的降低导致其光合作用强度降低
δ15Nz值可以指示珊瑚共生虫黄藻光合作用强度的变化[28-29]。虫黄藻光合作用强度增强,δ15Nz值随之升高,反之亦然[30]。例如,Muscatine和Kaplan[27]的研究发现,当珊瑚共生虫黄藻光合作用强度增强时,虫黄藻会吸收大部分可用的氮,虫黄藻同位素分馏效应降低,δ15Nz值升高。以往的研究发现,虫黄藻密度会影响珊瑚共生虫黄藻光合作用强度,进而影响虫黄藻的δ15Nz值[26,36]。理论上,虫黄藻密度越高,珊瑚光合作用强度越强,进而导致δ15Nz值升高,反之亦然[36]。例如,Heikoop等[26]研究发现虫黄藻密度较高的礁区珊瑚δ15Nz值也较高,原因是高虫黄藻密度导致珊瑚光合作用强度增强,虫黄藻的同位素分馏效应降低。本研究中,两种珊瑚的虫黄藻密度与δ15Nz值均呈显著的正相关关系(F. palauensis:r=0.69,p<0.001;P. lutea:r=0.74,p<0.001,图3)。这说明两种珊瑚的δ15Nz值会受到虫黄藻密度的影响,且虫黄藻密度越高的珊瑚其自养光合作用越强,并导致δ15Nz值越高。此外,虫黄藻δ15Nz呈 现 明 显 的 季 节 差 异(F. palauensis:t=2.71,p<0.05;P. lutea:t=3.73,p<0.05,表2),春季珊瑚的δ15Nz值高于夏季(图2c),这与虫黄藻密度的季节性变化模式一致(图2a)。δ15Nz值与虫黄藻密度相同的变化模式意味着不同季节珊瑚虫黄藻密度的差异导致了虫黄藻光合作用强度的不同,进而造成δ15Nz值的差异。因此,我们认为虫黄藻密度的减少导致珊瑚共生虫黄藻光合作用强度和δ15Nz值在夏季降低。
需要指出的是,光照也是影响虫黄藻光合作用强度的重要因素之一。有研究发现,在共生虫黄藻能承受的范围内,光照越强,虫黄藻光合作用强度及其δ15Nz值越高,反之亦然[27,29]。例如,Heikoop等[29]的研究发现,在浅水(强光环境)中,强光照导致珊瑚光合作用增强,虫黄藻对15N的吸收增多,δ15Nz升高。本研究中采样年份3月平均PAR为47.06 E/(m2·d),6月为56.65 E/(m2·d),6月平均PAR比3月高20%。理论上,如果光照是影响虫黄藻光合作用强度的主要因素时,6月珊瑚的光合作用强度及其δ15Nz值应略高于3月。然而,相反的是,6月珊瑚的δ15Nz值低于3月(图2c)。这可能是因为6月光照增强导致的光合作用强度增加的幅度被虫黄藻密度降低导致的光合作用强度降低的幅度所掩盖。因此,在本研究中,光照不是导致夏季珊瑚虫黄藻光合作用强度和δ15Nz值降低的原因。
4.3 脂质储备是对虫黄藻自养光合作用降低的有效补充
造礁石珊瑚主要依赖共生虫黄藻的光合作用获取能量,光合营养可以为珊瑚宿主提供大部分甚至100%的日常代谢能量需求[44-45]。共生虫黄藻密度降低导致珊瑚光合作用强度降低,进而导致光合营养贡献给珊瑚宿主的能量减少[13]。此时珊瑚需要依靠其他能量来源来满足其正常的代谢能量需求。珊瑚可利用的储存能量主要存在于细胞内的大分子(如脂质、蛋白质和碳水化合物)中[46],这些大分子是由虫黄藻光合作用固定的碳如甘油、葡萄糖、丙氨酸、谷氨酸等转化而成[44,47]。但是蛋白质供能不具有普遍性,碳水化合物只占珊瑚能量储备的小部分,这两种物质提供的能量只能作为珊瑚短时间的补给[9,48]。而脂质作为长期的能量补充,每克脂质(能量:39.5 kJ)比每克蛋白质(能量:23.9 kJ)和每克碳水化合物(能量:17.5 kJ)多产生65%和126%的能量[49]。珊瑚组织内含有大量的脂质,可以形成高达40%的珊瑚组织生物量[20,35]。因此蕴含丰富能量的脂质是珊瑚潜在的能量储备。研究光合作用强度降低导致光合营养供给减少时脂质含量的变化,有助于我们进一步理解珊瑚在环境压力下维持能量平衡的机制。
从图2b可以看出,本研究中两种珊瑚的脂质含量在夏季均显著低于春季,这与其共生虫黄藻密度及其光合作用强度的季节变化一致(图2a,图2c)。不仅如此,珊瑚脂质含量与虫黄藻密度、δ15Nz值之间均呈正相关关系(与虫黄藻密度:r=0.33,p<0.05,n=45;与δ15Nz值:r=0.30,p<0.05,n=45,图4)。这说明珊瑚脂质含量受虫黄藻密度及其光合作用强度的影响,并且虫黄藻密度和光合作用强度越低的珊瑚其脂质含量越低。这意味着当夏季光合作用强度降低时,珊瑚可以通过消耗作为能量储备的脂质来维持正常的能量需求。这在以往关于珊瑚的白化研究和室内养殖实验结果中得到了验证。例如Grottoli等[21]研究发现,与健康珊瑚相比,白化后的扁缩滨珊瑚(Porites compressa)总脂质含量显著降低了56%,这是因为白化后珊瑚光合作用强度降低导致来自虫黄藻的营养减少,珊瑚在恢复过程中通过消耗自身的脂质储备来满足能量的需求。Davies[45]通过控制光照水平发现,当光照强度较高时,鹿角杯形珊瑚、疣表孔珊瑚(Montipora verrucosa)和团块滨珊瑚(Porites lobata)通过光合作用产生的能量足够满足其呼吸和生长的需求,此时珊瑚将脂质以黏液的形式排出以释放多余的能量;当光照减弱时,3种珊瑚自养光合作用获得的能量显著降低,此时珊瑚通过消耗脂质来弥补光合能量供应的不足。
需要指出的是珊瑚共生虫黄藻光合作用会影响脂质的合成[17,20,47]。虫黄藻利用珊瑚光合作用产生的能量将光合固定碳合成为脂质后以脂滴的形式迅速转移到宿主体内[15,17]。当珊瑚光合作用强度降低时,用于合成脂质的物质和能量减少,珊瑚脂质含量降低。例如,Porter等[9]的研究发现,受夏季高温的影响,圆菊珊瑚和拉马克氏菌珊瑚(Agarwia lamarck)共生虫黄藻密度分别降低了86%和57%,这导致两种珊瑚的脂质含量分别显著下降了39%和73%。因此,夏季较低的光合作用强度限制了脂质的合成,也可能在一定程度上导致了脂质含量的降低。
本研究中的两种块状珊瑚F. palauensis和P.lutea均是在健康状态下,即没有直观可见的白化情况下采集的。两种珊瑚的虫黄藻密度、脂质含量和δ15Nz值均无明显的属种间差异(表1)。本文选取两种块状珊瑚进行研究,二者的结果可以相互印证,使研究结果更可靠。结果显示,两种珊瑚的脂质含量在夏季显著降低,这与其共生虫黄藻密度及其光合作用强度的变化特征一致。前人关于珊瑚脂质含量与白化关系的研究发现:珊瑚的脂质含量越高,在白化事件中存活的概率越大、存活的时间也越长[50]。因此我们认为,脂质能量储备是对珊瑚自养作用降低的有效补充,这对于维持珊瑚能量供给的稳定具有重要意义,进而可以提高它们的环境适应能力。具有丰富脂质储备的珊瑚对环境胁迫的适应能力以及对白化的耐受性更强。
5 结论
本文通过同位素地球化学指标和生理参数相结合的方法,研究了帛琉蜂巢珊瑚和澄黄滨珊瑚脂质对夏季虫黄藻密度及其光合作用强度变化的响应,进而探讨了脂质对维持珊瑚能量供给稳定的意义。结果显示:两种珊瑚的δ15Nz值与虫黄藻密度之间均呈显著的正相关关系,并且夏季珊瑚的共生虫黄藻密度和δ15Nz值都显著低于春季。这意味着夏季共生虫黄藻密度的降低导致了其光合作用强度的降低,自养光合作用提供给珊瑚宿主的能量减少。与此同时,两种珊瑚中蕴含丰富能量的脂质的含量也显著下降,这说明当夏季虫黄藻密度及其光合作用降低时,珊瑚可以通过消耗其自身储存的脂质更好地维持能量供给的稳定。脂质能量储备是对虫黄藻自养光合作用降低的有效补充,这对于提高它们对环境胁迫的适应能力以及抗白化能力具有重要意义。
