硫化物胁迫对缢蛏血液 SO24-浓度及SULT1B1-12基因表达的影响
2023-01-12孙慧妙沈伟良陈彩芳林志华韩庆喜
孙慧妙 ,沈伟良,陈彩芳,林志华 ,韩庆喜
( 1. 浙江万里学院 生物与环境学院 浙江省水产种质资源高效利用技术研究重点实验室,浙江 宁波 315100;2. 宁波大学海洋学院,浙江 宁波 315823;3. 宁波市海洋与渔业研究院,浙江 宁波 315012;4. 浙江万里学院 宁海海洋生物种业研究院,浙江 宁海 315604)
1 引言
水生穴居动物由于生存空间有限,其摄食、排泄均在洞穴中进行,导致残饵、排泄物等有机物在洞穴中积累。尤其是退潮时,洞穴内氧气含量迅速下降,在缺氧条件下,底部沉积物中的硫酸盐、亚硫酸盐和含硫有机物会被还原为硫化物H2S[1],使得穴居动物长时间暴露于高浓度的硫化物环境中,对硫化物产生了一定的耐受性。目前对耐硫生物的研究主要集中在单环刺螠(Urechis unicinctus)[2]、美洲刺螠(Urechis caupo)[3]、罗 氏 沼虾(Macrobrachium rosenbergii)[4]和日本沼虾(Macrobrachium nipponense)[5]等水生无脊椎动物中。
硫化物(H2S、HS-和S2-)是底栖环境常见的不良环境因子,具有呼吸毒性和免疫毒性[6-7],会抑制需氧生物的有氧呼吸,使新陈代谢减慢,甚至导致生物体的死亡。为了抵御硫化物的毒性,耐硫生物会对其进行氧化代谢解毒[2]。此硫化物氧化代谢途径在硫醌氧化还原酶(Sulfide Quinine Oxidoreductase,SQR)、硫双加氧酶(Sulfur Dioxygenase,SDO)、硫转移酶(Sulfur Transferases,ST)等一系列酶的作用下,将有毒硫化物转化为无毒硫酸盐[8]。硫酸盐在机体内会被进一步活化为3′-磷酸腺苷5′-磷酸硫酸(3′-phosphoadenosine-5′-phosphosulfate,PAPS);而胞质磺基转移酶(Cytosolic Sulfotransferase,SULT)以PAPS作为其磺化反应的通用供体,促进甲状腺激素、类固醇和儿茶酚胺类等有效内源性物质的失活和消除[9]。胞质磺基转移酶1B1(Cytosolic Sulfotransferase 1B1, SULT1B1)通过磺化反应调节甲状腺激素(Thyroid Hormones,THs)水平[10],以调控机体生理代谢水平。
缢蛏(Sinonovacula constricta)是我国重要的经济养殖贝类之一,常栖居于潮间带的泥砂质滩涂中。作为典型的穴居双壳贝类,其埋栖深度可达体长的5~8倍,远远深于泥蚶(Tegillarca granosa)、文蛤(Meretrix meretrix)等其他滩涂贝类[11-12]。由于潮汐作用和洞穴内有限的海水交换,缢蛏常暴露于高浓度的硫化物环境中,且其耐受硫化物的能力要强于单环刺螠、中华绒螯蟹(Eriocheir sinensis)、罗氏沼虾等水生动物[12-13]。本课题组已有研究表明,缢蛏线粒体硫化物氧化途径是其对硫化物解毒的重要策略[11-12];在对其基因组的进一步分析中发现,缢蛏SULT1B1(ScSULT1B1)基因家族存在基因扩张现象,且在对已有的硫化物胁迫后缢蛏鳃转录组数据的比较分析中亦筛选到了该家族成员SULT1B1-12基因的全长cDNA序列。因此,本研究拟以硫代谢途径中间产物—硫酸盐水平为连接点,对ScSULT1B1-12基因的序列特征、组织表达和硫化物胁迫后的表达特征进行分析,探讨其在缢蛏耐硫性状中的作用机制,旨在为缢蛏耐硫化物分子机制研究及后续开展分子标记辅助育种提供理论依据。
2 材料和方法
2.1 实验材料
实验用缢蛏采集自宁波市海洋与渔业研究院科技创新基地。选取健康、活力好、壳体完整、规格均匀的成年缢蛏,体质量为(10.72±1.64)g,壳长为(5.8±0.5)cm。实验开始前暂养7 d,海水盐度为21.2±0.5,温度为(18.1±1.5)℃,连续充气,每日换水1次,并定时投喂适量的小球藻。随机选取4颗缢蛏,设为4个生物学平行,分别解剖取其鳃、闭壳肌、肝胰腺、斧足、外套膜、水管等组织,组织经液氮速冻后保存于-80℃,用于ScSULT1B1-12基因的组织表达研究。
2.2 硫化物胁迫实验
选取384颗健康缢蛏成贝进行硫化物攻毒实验。在实验开始前2 d停止投喂和充氧。鉴于硫化物对缢蛏的96 h安全浓度为158 μmol/L[11],故本研究设置3个浓度组,分别为50 μmol/L、150 μmol/L和300 μmol/L,每组均设4个平行。实验用九水硫化钠(Na2S·9H2O)配置100 mmol/L硫化物母液,成倍稀释母液使水体浓度分别达到相应实验设定浓度。每3 h补充1次母液,以维持暴毒水体硫化物浓度的稳定。于硫化物攻毒后0 h、3 h、6 h、12 h、24 h、48 h、72 h,从各平行组随机选取4颗缢蛏,抽取血液后解剖取其鳃和肝胰腺。各样品均于液氮速冻后储存于-80℃,用于Sc-SULT1B1-12基因的时间表达研究。
2.3 缢蛏血液 S O24-离子浓度检测
用珠磨法破碎缢蛏血细胞,3 000 r/min离心5 min;取上清液1 mL,加入1 mL乙腈沉淀蛋白质后加入8 mL去离子水,振荡混匀后静置5 min;随后10 000 r/min离心10 min,取上清液,经过孔径为0.22 μm滤膜过
滤。经离子色谱法检测滤液中 S O24
-浓度。
2.4 ScSULT1B1-12基因的生物信息学分析
从硫化物胁迫后缢蛏鳃转录组数据库中筛选得到ScSULT1B1-12基因全长序列。利用ORF Finder查找 其 开 放 阅 读 框(Open Reading Box,ORF)。使 用NCBI(National Center for Biotechnology Information)的BLAST(Basic Local Alignment Search Tool)(http://www.ncbi.nlm.nih.gov/blast)分析序列的完整性并进行同源性比较分析。使用ProtParam预测其等电点(Isoelectric point,pI)和分子量(Molecular weight,Mw)(https://web.expasy.org/protparam/)。利 用PROSITE(https://prosite.expasy.org/)进行功能域的分析。通过SWISSMODEL(https://npsa-prabi.ibcp.fr/)进行其蛋白质高级结构预测。用Clustal W软件进行多序列比对分析。利用MEGA-7软件构建系统发育树,并利用iTOL(https://itol.embl.de/)进行在线美化。
2.5 ScSULT1B1-12基因在缢蛏不同组织及硫化物胁迫下的表达
Trizol法提取缢蛏组织总RNA,使用 PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,日本)反转录成cDNA模板。根据ScSULT1B1-12基因全长序列设计RT-qPCR引物(表1)。利用LightCycler®480II实时PCR系统进行荧光定量PCR反应,每组样品设4个生物学平行,4个技术重复。以RS9基因为内参基因[14],采 用2-ΔΔCT法[15]计算ScSULT1B1-12的 相 对 表达量。

表1 实验所用引物及其序列Table 1 Primers and their sequences used in the experiment
2.6 数据处理
所有数据以平均值±标准差来表示,均使用SPSS 18.0软件进行单因素方差分析(One-way ANOVA),p<0.05表示差异显著。
3 结果
3.1 硫化物胁迫下缢蛏血液 S O24-浓度的变化
随着胁迫时间的延长,除50 μmol/L浓度组外,其余 较 高 浓 度 组(150 μmol/L、300 μmol/L)缢 蛏 血 液SO24-浓度波动较大,总体均呈下降趋势;且浓度越高,波动越剧烈(图1)。50 μmol/L硫化物胁迫下,其SO24-浓度波动不大,在3 h时小幅上升,6 h时略微下降,随后12 h、24 h、48 h时保持上升趋势,但差异不显著(p>0.05),72 h时小幅下降。150 μmol/L硫化物胁迫下,其 SO24-浓度3 h时显著下降(p<0.05),6 h、12 h时持续小幅上升,之后24 h时有所下降,到48 h、72 h时保持在同一水平内波动。300 μmol/L硫化物胁迫下,其 SO24-浓度3 h时显著上升(p<0.05),6 h时大幅下降(p<0.05),12 h时再次显著升高(p<0.05),24 h时小幅波动,48 h、72 h持续大幅下降(p<0.05)。
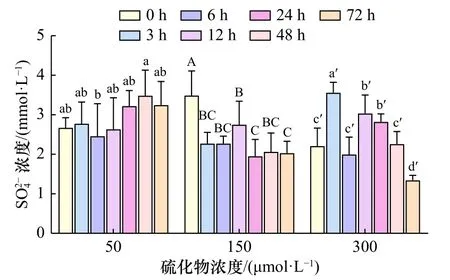
图1 硫化物胁迫下缢蛏血液 SO24-浓度的变化Fig. 1 Changes in S O24- concentration of Sinonovacula constricta under sulfide stress
3.2 ScSULT1B1-12基因序列的生物信息学分析
ScSULT1B1-12基因的cDNA序列全长为1 100 bp,包含 897 bp的ORF,编码298个氨基酸(图2)。其预测的蛋白分子量为35.03 kDa,理论等电点为6.37,其中极性氨基酸所占比例较高,为亲水性蛋白,无信号肽。功能域预测发现其有1个功能域(Pfam:Sulfotransfer_1,46~291 aa)。该蛋白的二级结构由117个H键、137个螺旋数和44个转角组成。三级结构预测显示其为同源二聚体。
氨基酸序列同源性分析显示,ScSULT1B1-12与其他软体动物ScSULT1B1的同源性最高,其中与长牡蛎(Crassostrea gigas)和美洲牡蛎(Crassostrea virginica)的同源性分别为52.36%和48.48%。与其他动物SULT1B1进行多重序列比对表明,该基因保守性较高,含有4个催化活性位点(56K、104N、106H和134A)、N端的PAPS结合域(YPKSGTXW)、C端的PAPS结合和二聚化域(RKGXXGDWKNXFTVXXE)(图3)。

图3 11种动物SULT1B1氨基酸序列的多重比较Fig. 3 Multiple alignments of the amino acid sequences of SULT1B1 in eleven animals
用MEGA7.0软件以邻接法构建了各物种SULT1B1的系统进化树,在线美化后如图4所示。该进化树由3个分支组成,ScSULT1B1-12首先与贝类聚为一支,随后与节肢动物聚为一支,最后再与脊椎动物聚为一支。
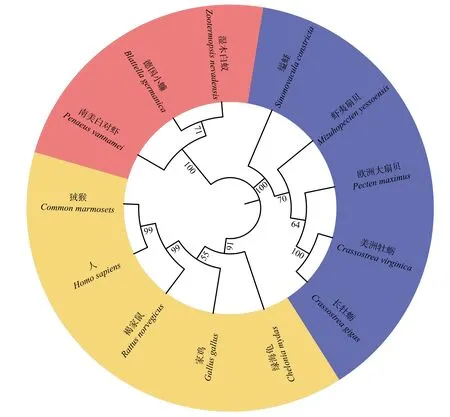
图4 邻接法构建的ScSULT1B1-12系统进化树Fig. 4 The ScSULT1B1-12 phylogenetic tree constructed by neighbor-joining method
3.3 ScSULT1B1-12基因组织表达分析
利用RT-qPCR技术检测了ScSULT1B1-12在缢蛏鳃、闭壳肌、肝胰腺、斧足、外套膜、水管中的表达情况(图5)。结果表明ScSULT1B1-12基因在6种组织中均有表达,且其在鳃中表达量最高,其次为闭壳肌和肝胰腺。
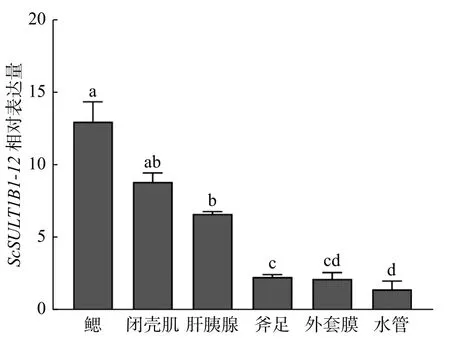
图5 ScSULT1B1-12基因在缢蛏不同组织中的表达Fig. 5 The expression of ScSULT1B1-12 gene in different tissues of Sinonovacula constricta
3.4 ScSULT1B1-12基因在硫化物胁迫下的表达特征分析
硫化物胁迫下,缢蛏鳃中ScSULT1B1-12基因表达水平随着时间的延长总体呈下降-升高-下降的波动模式(图6M)。50 μmol/L硫化物胁迫下,鳃ScSULT1B1-12基因的表达量在3 h 时略微下降,6 h、12 h时小幅波动上升后于 24 h 时显著升高(p<0.05),随后48 h 时显著下降(p<0.05),并在 72 h 时略有上升。150 μmol/L 硫化物胁迫下,鳃ScSULT1B1-12基因的表达量在 3 h 时显著下降(p<0.05),6 h、12 h 时小幅波动后于 24 h 时显著升高(p<0.05),随后 48 h 时显著下降(p<0.05),并在 72 h 时保持在同一表达水平。300 μmol/L硫化物胁迫下,鳃ScSULT1B1-12基因的表达水平较前两组波动剧烈,在3 h时略微下降后于6 h时显著上升至峰值(p<0.05),12 h时显著下降(p<0.05),随后24 h小幅升高,在48 h时又剧烈下降(p<0.05),最后于72 h时保持在同一表达水平。
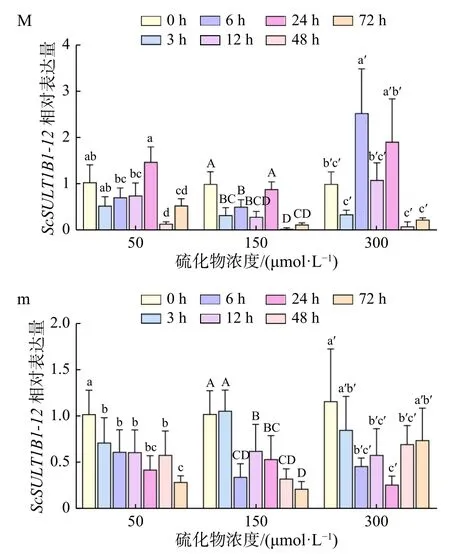
图6 硫化物胁迫下ScSULT1B1-12基因在缢蛏鳃(M)和肝胰腺(m)中的表达特征Fig. 6 The expression characteristics of the ScSULT1B1-12 gene in gill (M) and hepatopancreas (m) of Sinonovacula constricta under sulfide stress
硫化物胁迫下,缢蛏肝胰腺中ScSULT1B1-12基因表达水平亦呈波动模式(图6m)。50 μmol/L、150 μmol/L硫化物胁迫下,肝胰腺ScSULT1B1-12基因的表达模式类似,总体呈下降趋势。50 μmol/L浓度组,其基因表达量在3 h时显著下降(p<0.05),随后在6 h、12 h、24 h、48 h时在同一范围内小幅波动,最后于72 h时显著下降(p<0.05)。150 μmol/L浓度组,肝胰腺ScSULT1B1-12基因表达量在前3 h维持同一水平,6 h时显著下降(p<0.05),之后在12 h时显著上升(p<0.05),随后24 h、48 h、72 h时保持下降趋势。300 μmol/L浓度组,肝胰腺ScSULT1B1-12基因的表达量在3 h时略微下降,6 h继续下降后于12 h、24 h、48 h时在同一范围内波动,最后于72 h小幅上升。
4 讨论
硫是生命的基本元素,硫代谢对细胞的生长和存活至关重要[8]。在该代谢通路中,首先硫化物相继在SQR、SDO、ST等酶的催化下氧化生成代谢中间产物硫酸盐[8]。本研究发现,硫化物胁迫后缢蛏血液SO24-浓度与胁迫时间呈负相关关系。而硫酸盐必须经活化后才能参与SULT介导的磺化反应,并在调节内源性化学物质的生物活性,促进其消除中发挥关键作用[9,16]。故推测硫化物胁迫后缢蛏体内硫酸盐产物被活化为PAPS,为磺化反应提供通用供体[9],在激素、儿茶酚胺神经递质等的稳态中起着重要作用[17]。
SULT1B1属于SULT超家族成员之一[18]。该超家族基因包含4个保守的催化活性位点、PAPS结合域、PAPS结合和二聚化域[19]。本研究中ScSULT1B1-12基因也具有上述的催化活性位点及保守功能域。其中位于其C端的KTVE基序(KXXXTVXXE)是SULTs中同源和异源二聚体的常见蛋白质相互作用基序[20]。大多数SULTs是以同源二聚体形式存在[21]。这亦与本研究结果一致,ScSULT1B1-12蛋白的三级结构预测显示其为同源二聚体。除了SULTs的催化残基和二聚化区域外,SULTs最保守的区域是PAPS结合域[22]。每个亚型都必须结合PAPS才能发挥其功能[23]。这些活性位点与结构域为ScSULT1B1-12发挥其磺化功能提供了结构支撑。
从ScSULT1B1-12基因的组织表达结果发现其主要在鳃和肝胰腺中高表达,其中鳃表达量最高。这可能是由于鳃是水生生物的呼吸器官,直接暴露于硫化物中[11],其对胁迫的敏感性较高[24];而肝胰腺作为经典的解毒代谢器官,也是硫化物氧化的主要部位[25-26]。ScSULT1B1-12基因在缢蛏肝胰腺中高表达,与在啮齿动物和人类中的研究结果相一致[27],推测可能与该器官的强代谢能力有关[28-29]。
SULT1B1催化以THs为底物的磺化反应[10,30],该反应是THs代谢的重要途径[10],以调节机体内THs的稳态。而THs是机体最重要的激素之一[31],可调节所有组织的新陈代谢[10,31-33],且能参与免疫调节[34-37]。本研究结果表明,硫化物胁迫下ScSULT1B1-12基因的转录水平呈波动模式,总体呈下降趋势。这可能是由于磺化反应是导致THs失活的重要一步[10],在胁迫初期ScSULT1B1-12基因的表达量显著升高,使THs大量失活以抑制机体的生理代谢水平,降低其能量消耗;但随着胁迫时间的延长,其表达量受抑制,可使THs活性保持在一定水平,以加强机体代谢机能来维持基本生命活动所需,同时提高机体的免疫功能,以应对高硫化物浓度的不良环境。此外,缢蛏体内S O24-浓度的变化,从一定程度上也反应了被活化的硫酸盐通用供体,还可能参与除SULT1B1外的其他SULT超家族成员介导的磺化反应。
5 结论
本研究对ScSULT1B1-12基因的序列结构进行生物信息学分析,表明其在结构上具备催化磺化反应的能力。组织分布表明,其在鳃和肝胰腺中表达量较高。硫化物胁迫后缢蛏血液 SO24-浓度呈下降趋势,同时ScSULT1B1-12基因的转录水平呈抑制趋势,表明硫酸盐可被活化生成磺化反应的供体,而ScSULT1B1-12催化的磺化反应受抑制后可使缢蛏体内THs保持活性,以加强其代谢机能来维持机体的基本生命活动,同时提高机体的免疫功能,以适应高硫化物浓度的不良环境。
补充材料
表S1 物种拉丁文学名及其NCBI登录号对照表
补充材料可通过https://hyxbocean.cn/获取。补充材料未进行排版和编辑,内容的准确性和科学性由作者承担。
