夏、秋季南黄海小型底栖动物空间分布格局及其环境影响因素
2023-01-12宋远柳刘晓收
宋远柳 ,刘晓收 *
( 1. 中国海洋大学 海洋生命学院,山东 青岛 266003;2. 中国海洋大学 海洋生物多样性与进化研究所,山东 青岛 266003)
1 引言
黄海是位于中国大陆和朝鲜半岛之间的半封闭陆架浅海。黄海西北部与渤海相连,南部与东海相连,地形从海岸向外倾斜[1]。由于其自然地理环境,它通常被分为两部分,沿山东半岛成山角到朝鲜长山串的连线将其分为南黄海和北黄海。南黄海总面积超过30×104km2,位于31°45′~38°00′N,119°~127°E之间,与东海大陆架相连,是世界上最大的大陆架地区之一[2]。南黄海的地形分布具有明显的梯度。同时,在每年的夏半年(4-10月),南黄海海域出现南北跨度5个纬度,东 西 跨 度4个 经 度(33°43′~38°45′N,121°15′~125°05′E)的低温水体,这种独特的水文现象被称为“黄海冷水团”[3-6]。
小型底栖动物是指在分选时能通过0.5 mm孔径的网筛但被0.042 mm或0.031 mm孔径的网筛所截留的后生动物[7-9]。在本研究中使用的为0.031 mm孔径的网筛,因为许多成熟的小型底栖动物在0.031 mm的网筛上仍有保留[10]。小型底栖动物通过消耗溶解的有机碳、摄食初级生产者和细菌,在碳转移、物质循环中发挥着关键作用[11-14]。研究小型底栖动物对了解生态系统的功能、可持续性和复原力具有至关重要的意义[15-16]。此外,小型底栖动物在环境监测中也起着重要作用,近年来小型底栖动物的污染生物学受到了广泛关注,国内外许多专家提出了利用小型底栖动物类群种类变化和线虫桡足丰度比的变化作为环境监测的方法[17-19]。
国际上对于陆架水域小型底栖动物的研究较多[20-23]。我国对于北黄海[24-25]和南黄海[2,26-33]海域小型底栖动物的研究已有一定的成果。上述研究表明,南黄海小型底栖动物丰度呈现“近岸低、中部高、外海低”的分布特征[2,26,28],小型底栖动物主要分布于沉积物表层,水深、温度、盐度、沉积物粒度、叶绿素a含量、脱镁叶绿酸含量、有机质含量、含水量等环境变量对南黄海小型底栖动物分布均可产生影响[2,26-32],且小型底栖动物在浅海生态系统的能量流动中占有十分重要的地位[26-28]。
本研究在上述对南黄海小型底栖动物调查研究的基础上,旨在探讨小型底栖动物在时空分布上是否存在差异。利用统计学方法,结合各种环境因子对南黄海小型底栖动物的类群组成、丰度及生物量进行了研究,探讨小型底栖动物的时空变化及其影响因素,为海洋生态系统结构和功能研究提供参考资料。
2 材料与方法
2.1 研究海域与站位
本次研究分别于2020年8月和11月对南黄海海域(35.00°~36.26°N,120.89°~122.90°E)进行了采样调查,其中夏季共设置10个采样站位(站位编号为15、17、19、22、24、27、28、31、33、43);秋季共设置13个采样站位(站位编号为15、17、18、19、20、22、24、26、27、28、30、33、39),每个站位分别取3个重复样,以-1、-2、-3区分(夏季19、27号站位包括两个重复样)。研究站位见图1。
图1 南黄海夏、秋季小型底栖动物调查站位Fig. 1 The sampling sites of meiofauna in the southern Yellow Sea in summer and autumn
2.2 取样方法
现场调查依据《海洋调查规范》进行,使用内径为2.9 cm的取样管(由塑料注射器改装而成),从未受扰动的表面积为0.05 m2的箱式采泥器中随机取3个重复样,芯样长8 cm,取出后立即按0~2 cm、2~5 cm和5~8 cm分层分别装入250 mL塑料瓶中,加入4%中性甲醛溶液固定保存,用于分析小型底栖动物的类群组成和数量。刮取表层沉积物装入封口袋中,立即冷冻避光保存(-20℃),用于沉积物叶绿素a含量、有机质含量及粒度分析。其他环境因子由温盐深仪(CTD)现场测定,包括水深、底层水温和底层水盐度等。
2.3 室内分析
加入3~5 mL质量分数为1‰虎红溶液于小型底栖动物样品中,混合均匀,染色24 h后将样品转移到0.5 mm和0.031 mm孔径组成的双层套筛中,用自来水清洗至水流变清。将0.031 mm孔径网筛上的样品用Ludox-TM溶液(比重为1.15 g/cm3)冲洗至100 mL离心管中,1 800 r/min离心10 min,收集上清液,重复离心3次。将3次离心后获得的上清液倒入0.031 mm孔径的网筛上,用自来水冲洗掉Ludox-TM溶液,并将样品转移至划线培养皿中。在解剖镜下将后生小型底栖动物挑出,按照类群分开装瓶并计数,并使用4%的中性甲醛溶液将其保存在5 mL玻璃样品瓶中。
沉积物有机质含量采用重铬酸钾-硫酸(K2Cr2O7-H2SO4)氧化法测定。叶绿素a(Chla)和脱镁叶绿酸(Pha)含量用荧光仪(Triology, Turner,美国)测定。沉积物中值粒径使用激光粒度分析仪(Mastersizer 3000,Malvern, 英国)测定。
2.4 数据处理与分析
小型底栖动物丰度单位为ind./(10 cm2),表示每10 cm2中所含的小型底栖动物个数。小型底栖动物生物量为干质量生物量,其估算采用各类群丰度值乘以相应类群的平均个体干质量经验值的方法[28],单位为 μg/(10 cm2),其中不同类群的小型底栖动物平均干质量参照前人研究成果[33-36]。表1为小型底栖动物各类群的个体平均干质量。

表1 小型底栖动物各类群的个体平均干质量Table 1 Individual average dry weight of different meiofauna groups
应用 ArcGIS 10.2绘制采样站点图。应用SPSS 25.0软件对所得的生物数据和环境因子数据进行差异性检验,并对生物数据及各环境因子进行Pearson相关性分析。应用PRIMER 7.0软件进行多元统计分析。对环境因子进行主成分分析(PCA),分析环境相似度;对小型底栖动物群落进行非度量多维度分析(nMDS),并利用PERMANOVA检验组间差异显著性;用BIOENV分析连接环境和生物矩阵,分析环境因子对小型底栖动物类群组成的影响。
3 结果
3.1 环境因子
南黄海研究区域环境因子如表2所示。夏季采样站位的平均水深为47.1 m,水深分布状况呈现梯度加深的趋势,可划分为3个梯度,30 m以浅(33号、43号站位)、30~60 m(15号、17号、27号、28号、31号站位)、60 m以深(19号、22号、24号站位)。平均底层水温度为12.91℃;平均底层水盐度为32.37;中值粒径平均值为0.022 mm;叶绿素a含量平均值为0.37 μg/g;脱镁叶绿酸含量平均值为1.54 μg/g;有机质含量平均值为1.63%。
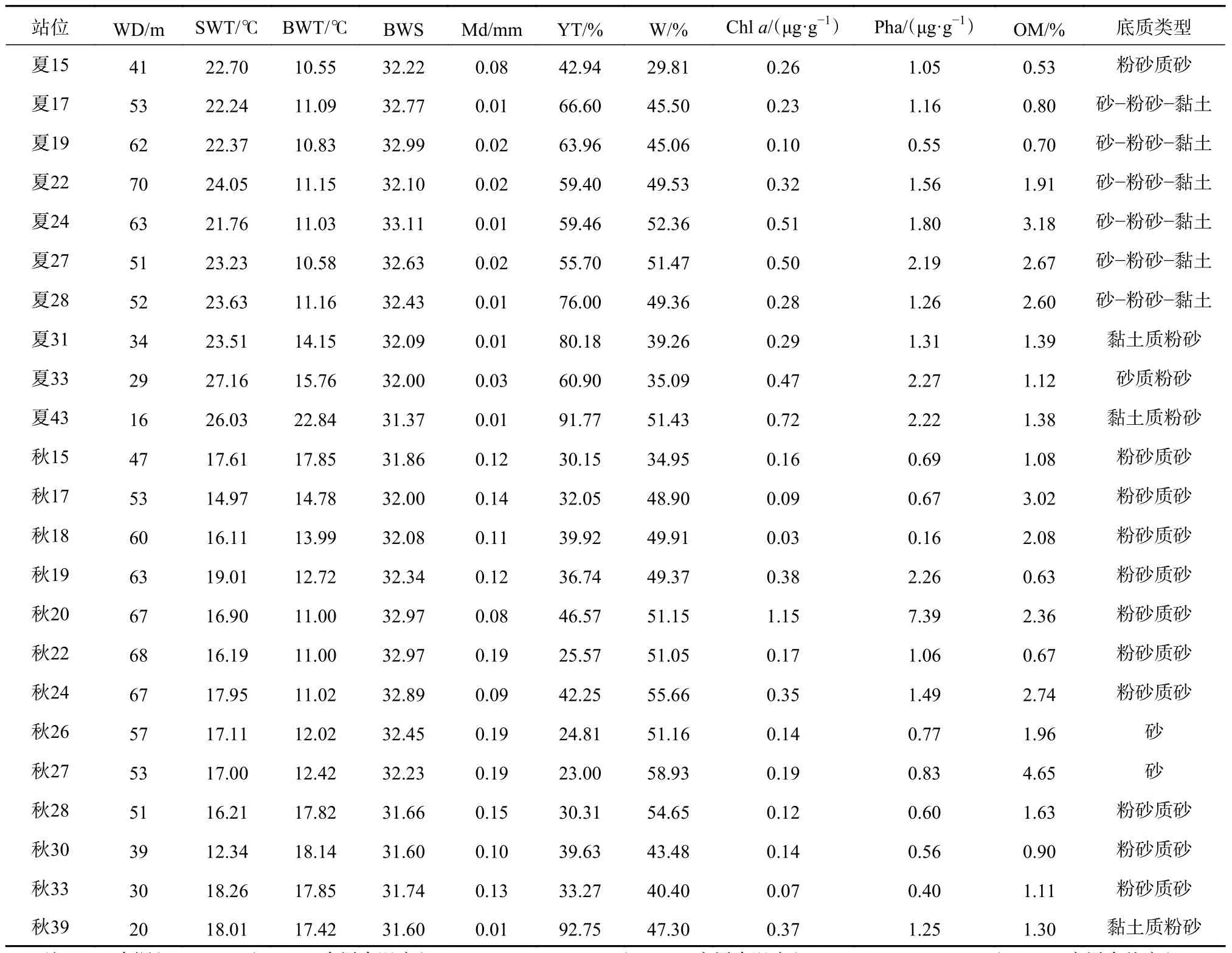
表2 南黄海海域夏、秋季调查站位环境因子Table 2 Environmental factors at the sampling sites in the southern Yellow Sea in summer and autumn
秋季采样站位的平均水深为52 m,水深分布状况同样呈现梯度加深的趋势,可分为3个梯度,30 m以浅(33号、39号站位)、30~60 m(15号、17号、18号、26号、27号、28号、30号站位)、60 m以深(19号、20号、22号、24号站位)。平均底层水温度为14.46℃;平均底层水盐度为32.18;中值粒径平均值为0.125 mm;叶绿素a含量平均值为0.26 μg/g;脱镁叶绿酸含量平均值为1.39 μg/g;有机质含量平均值为1.86%。
夏、秋季南黄海研究区域沉积物类型共有5种,夏季各站位沉积物类型为4种,分别为粉砂质砂、砂-粉砂-黏土、黏土质粉砂和砂质粉砂,其中砂-粉砂-黏土为沉积物优势类型,有6个站位沉积物属于这一类型。秋季各站位沉积物类型为3种,分别为粉砂质砂、黏土质粉砂和砂,其中粉砂质砂为沉积物优势类型,有10个站位沉积物属于这一类型。
南黄海夏、秋季采样站位环境因子的主成分分析(PCA)如图2所示。PC1和PC2轴累计可解释环境变异度的66%,沿PC1轴从左至右,代表粉砂-黏土含量和底温的增加,中值粒径、含水量、有机质含量、叶绿素a含量、脱镁叶绿酸含量、水深和底盐的降低;沿PC2轴由上至下,代表中值粒径、水深和底温的增加,粉砂黏土含量、含水量、有机质、叶绿素a含量、脱镁叶绿酸含量和底盐的降低。PCA反映了环境变量的时空差异,在PC1轴上,空间差异主要体现在水深、底温和底盐。在PC2轴上,夏、秋季站位呈季节分离,中值粒径、脱镁叶绿酸含量、叶绿素a含量和粉砂黏土含量与PC2轴高度相关,是引起环境因子季节差异的主要因素。对夏、秋季各站位环境因子进行独立样本t检验,结果显示南黄海沉积物的中值粒径和粉砂黏土含量季节差异极显著(p<0.01),其表现为夏季中值粒径值较小而粉砂黏土含量较高。

图2 南黄海调查站位夏、秋季环境因子主成分分析Fig. 2 Principal component analysis of environmental factors at the sampling sites in the southern Yellow Sea in summer and autumn
3.2 小型底栖动物
3.2.1 小型底栖动物的类群组成、丰度和生物量
共鉴定出小型底栖动物类群15个(表3),包括自由生活海洋线虫(Nematoda)、底栖桡足类(Copepoda)、端足类(Amphipoda)、枝角类(Cladocera)、原足类(Tanaidacea)、轮虫类(Rotifera)、等足类(Isopoda)、双壳类(Bivalvia)、海螨类(Halacaroidea)、动吻类(Kinorhyncha)、涡虫类(Turbellaria)、多毛类(Polychaeta)、介形类(Ostracoda)、涟虫(Cumacea)和其他类。海洋线虫为最优势类群,在两个航次中分别占小型底栖动物总丰度的75.6%和84.6%。其次为底栖桡足类,丰度占比分别为13.1%和5.8%。
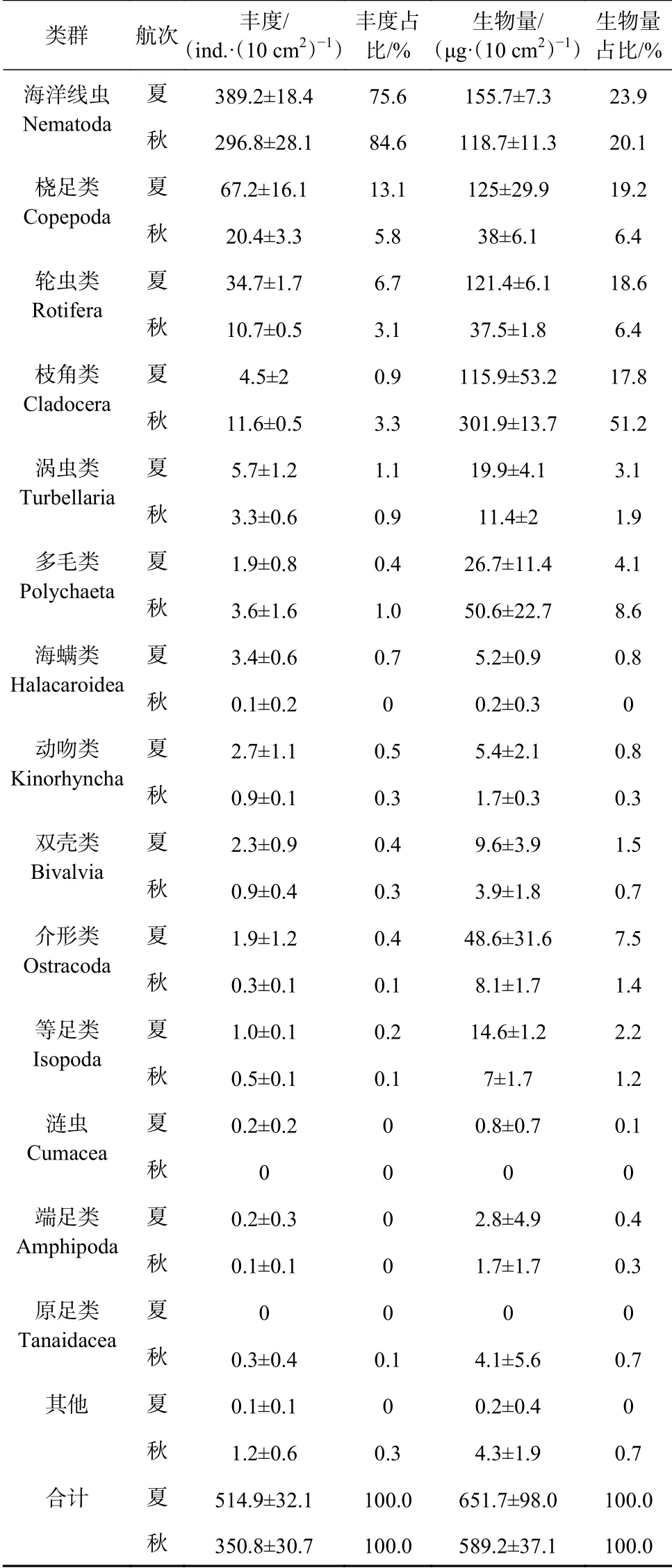
表3 南黄海海域夏、秋季小型底栖动物各类群丰度和生物量Table 3 Abundance and biomass of each meiofaunal group in the southern Yellow Sea in summer and autumn
夏季小型底栖动物的平均丰度为(514.9±32.1)ind./(10 cm2)。如图3a所示,22号站位丰度最低,为275.2 ind./ (10 cm2);33号站位丰度最高,为923.5 ind./ (10 cm2)。小型底栖动物丰度呈现出从近岸至外海随水深增加先增加后减小的趋势。对夏季不同水深的小型底栖动物丰度进行单因素方差分析,结果显示,夏季小型底栖动物丰度在不同水深间差异显著(p<0.05),水深大于60 m的水域线虫丰度显著降低(p<0.05)。
秋季小型底栖动物的平均丰度为(350.8±30.7)ind./ (10 cm2)。如图3b所示,27号站位丰度最低,为91.4 ind./ (10 cm2);30号站位丰度最高,为1 171.9 ind./ (10 cm2)。秋季30号站位小型底栖动物丰度远高于该季节平均丰度,若将秋季30号站位去除,则丰度呈现随着水深增加逐渐减小的趋势。对秋季不同水深的小型底栖动物丰度进行单因素方差分析,结果显示,秋季小型底栖动物丰度在不同水深间差异不显著(p>0.05)。
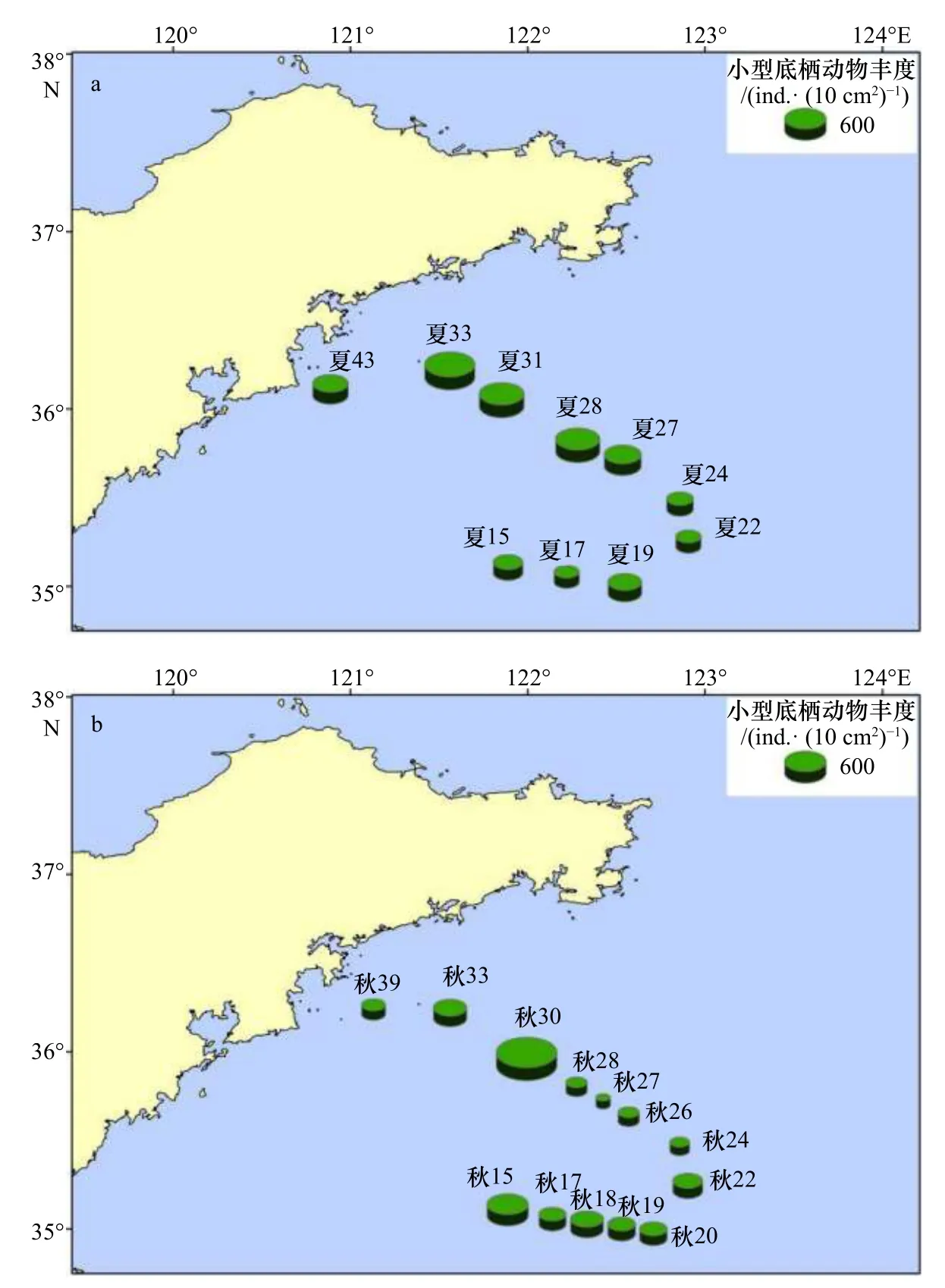
图3 南黄海夏季(a)、秋季(b)小型底栖动物丰度分布Fig. 3 Distribution of meiofaunal abundance in the southern Yellow Sea in summer (a) and autumn (b)
对夏、秋季小型底栖动物丰度进行独立样本t检验,结果显示小型底栖动物丰度无显著季节差异(p>0.05)。将秋季30号站位去除后再次进行独立样本t检验,结果显示小型底栖动物丰度存在极显著季节差异(p<0.01)。
夏季小型底栖动物的平均生物量为(651.7±98.0)μg/(10 cm2),最 高 值 出 现 在28号 站 位,为1 050.8 μg/(10 cm2)。秋季小型底栖动物的平均生物量为(589.2±37.1)μg/(10 cm2),最高值出现在30号站位,为1 261.9 μg/(10 cm2)。对夏秋季小型底栖动物生物量进行独立样本t检验,结果显示小型底栖动物生物量无显著季节差异(p>0.05)。
3.2.2 小型底栖动物群落结构
对南黄海夏、秋两季小型底栖动物群落结构进行非度量多维标度(nMDS)分析,结果如图4所示。夏、秋季站位各自聚集,具有季节区分性。PERMANOVA检验结果显示,小型底栖动物群落结构在季节间存在极显著差异(p<0.01)。引起差异的主要类群为海洋线虫(p<0.05)和桡足类(p<0.01),枝角类、轮虫类、海螨类和其他类群也存在显著的季节差异,但同质性检验显示,该差异可能是由组内分布不均匀引起。
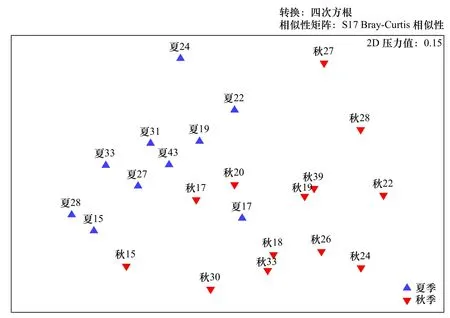
图4 南黄海海域夏、秋季小型底栖动物群落结构非度量多维标度Fig. 4 Non-metric multidimensional scaling plot for meiofauna community structure in the southern Yellow Sea in summer and autumn
对夏、秋两季不同水深的小型底栖动物群落结构分别进行非度量多维标度(nMDS)分析,结果如图5、图6所示。在夏季站位中,水深不大于30 m和水深为30~60 m的站位较为聚集,水深大于60 m的站位则较为分散。秋季站位不同水深则没有显著聚集。PERMANOVA检验结果显示,夏季小型底栖动物群落结构在各水深梯度之间存在极显著差异(p<0.01),差异表现在水深大于60 m与其他水深梯度之间(p<0.01),秋季小型底栖动物群落结构在各水深梯度之间无显著差异(p>0.05)。

图5 南黄海海域夏季不同水深的小型底栖动物群落结构的非度量多维标度Fig. 5 Non-metric multidimensional scaling plot for different depth meiofauna community structure in the southern Yellow Sea in summer
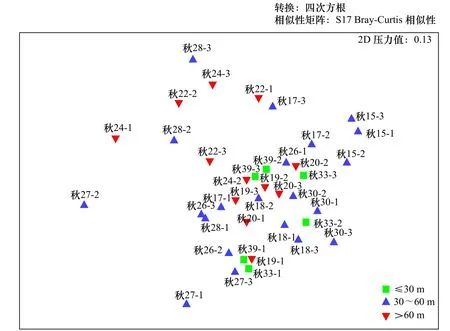
图6 南黄海海域秋季不同水深的小型底栖动物群落结构的非度量多维标度Fig. 6 Non-metric multidimensional scaling plot for different depth meiofauna community structure in the southern Yellow Sea in autumn
3.2.3 小型底栖动物的垂直分布
南黄海海域夏季和秋季调查站位小型底栖动物垂直分布如图7a、图7b所示。夏季小型底栖动物分布在沉积物0~2 cm、2~5 cm和5~8 cm的比例分别为53.3%、26.1%和20.6%。秋季小型底栖动物分布在沉积物0~2 cm、2~5 cm和5~8 cm的比例分别为49.8%、29.9%和20.3%。夏、秋季接近一半及以上的小型底栖动物分布于沉积物表层0~2 cm。对小型底栖动物垂直分布进行独立样本t检验,结果显示夏季和秋季小型底栖动物垂直分布无显著差异(p>0.05),表明小型底栖动物没有表现出显著的垂直迁移。
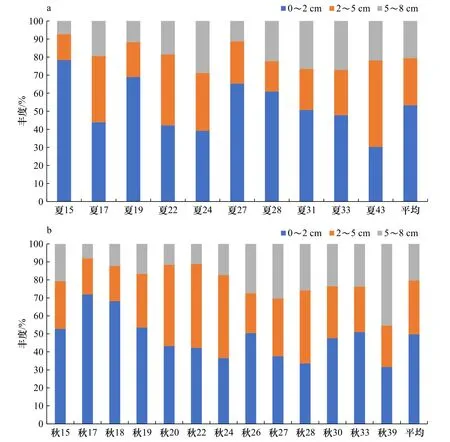
图7 南黄海夏(a)、秋季(b)调查站位小型底栖动物丰度在沉积物中的垂直分布Fig. 7 Vertical distribution of meiofaunal abundance in sediment in the southern Yellow Sea in summer (a) and autumn (b)
3.2.4 线虫和桡足类丰度比值(N/C比值)
南黄海夏、秋季海洋线虫和桡足类丰度之比(N/C比值)见表4。其中夏季N/C比值变化较小,平均为6.7,24号站位N/C比值最低,为1.3;43号站位N/C比值最高,为15.4。秋季N/C比值变化较大,平均为19.07,其中39号站位N/C比值最低,为6.2;22号站位N/C比值最高,为52.8。

表4 南黄海海域海洋线虫和桡足类丰度之比Table 4 Ratios of abundance of nematodes to copepods in the southern Yellow Sea
3.3 小型底栖动物与环境因子的关系
BIOENV分析结果显示(表5),沉积物中值粒径(Md)、含水量(W)这两个环境变量组合能够最好地解释小型底栖动物群落结构,其相关系数为0.424;其次为中值粒径(Md)、含水量(W)和有机质含量(OM)组合,其相关系数为0.419。对群落结构影响最大的单个环境因子为沉积物中值粒径,相关系数为0.286。Pearson相关性分析显示(表6),小型底栖动物丰度与水深呈显著负相关(p<0.05),与沉积物含水量呈极显著负相关(p<0.01);生物量与沉积物含水量呈显著负相关(p<0.05)。去除秋季30号站位进行Pearson相关性分析显示,小型底栖动物丰度与粉砂黏土含量呈显著正相关(p<0.05),与中值粒径呈显著负相关(p<0.05),与沉积物含水量呈极显著负相关(p<0.01);生物量与沉积物含水量呈极显著负相关(p<0.01)。
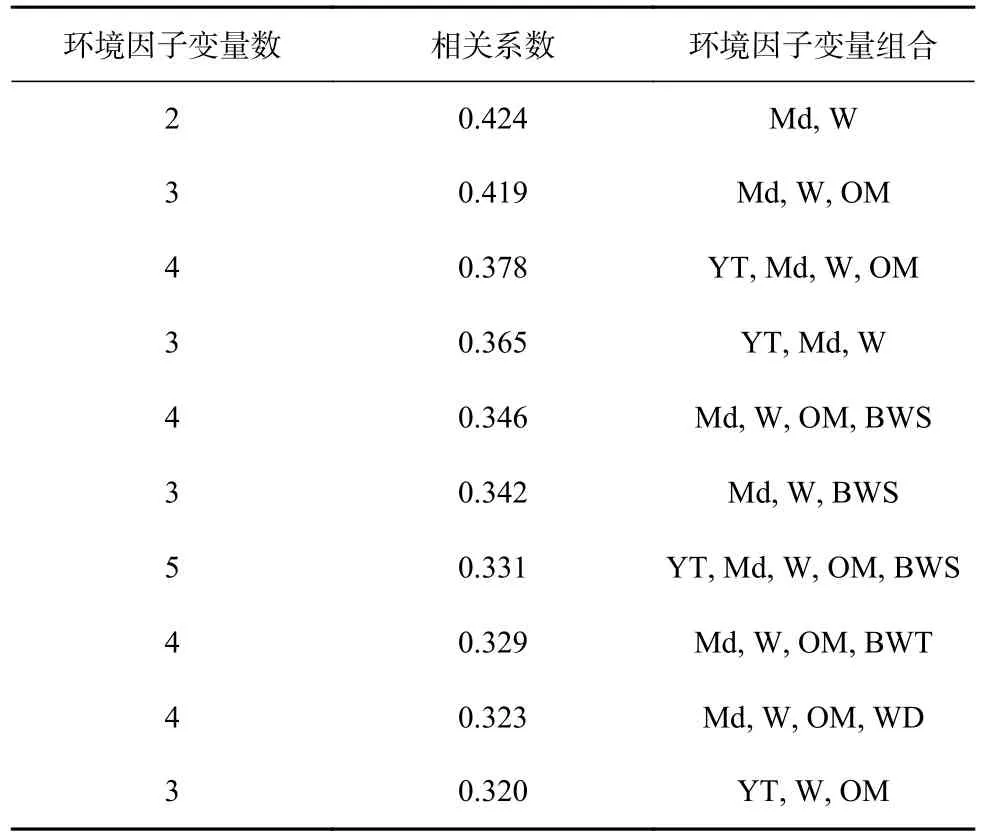
表 5 南黄海夏、秋季小型底栖动物与环境因子的BIOENV分析Table 5 Results of BIOENV analysis between meiofaunal assemblage and environmental factors in the southern Yellow Sea in summer and autumn
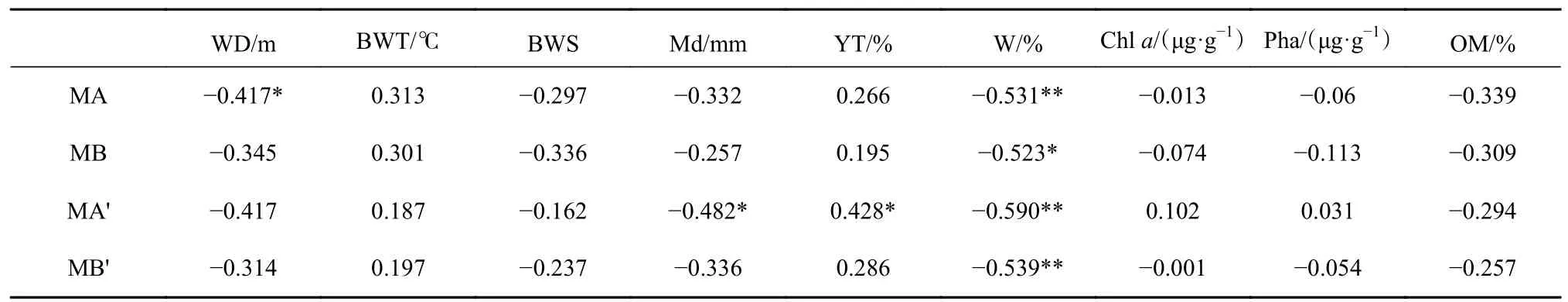
表6 南黄海夏、秋季小型底栖动物丰度、生物量与环境因子的相关分析结果Table 6 Results of correlation analysis between abundance and biomass of meiofauna and environmental factors in the southern Yellow Sea in summer and autumn
4 讨论
4.1 小型底栖动物丰度、群落结构的季节差异及其主要影响因子
已有研究报道表明,季节是造成小型底栖动物差异的主要原因[37-39]。本研究中南黄海夏季小型底栖动物的平均丰度高于秋季,但不构成显著的季节差异。由于秋季30号站位小型底栖动物丰度大于1 000 ind./(10 cm2),远高于该季节平均丰度和其他站位。若将秋季30号站位这一异常站位去除后,小型底栖动物丰度呈极显著季节差异(p<0.01),夏季的丰度高于秋季。Pearson相关性分析显示,去除秋季30号站位后小型底栖动物丰度与粉砂黏土含量呈显著正相关,与中值粒径呈显著负相关。对夏、秋季各站位环境因子进行独立样本t检验,结果显示南黄海的中值粒径和粉砂黏土含量呈极显著的季节差异(p<0.01)。与夏季相比,秋季站位的沉积物粒径相对于夏季的较高。研究表明,南黄海表层沉积物粒度分布的季节变化主要受环流系统的影响[40-42]。卢健和李安春[40]曾报道,南黄海沿岸水深较浅的海域(水深小于30 m),主要受近岸波浪和潮流的影响,秋季水动力增强,沉积物的粒度组成中粗粒成分增加。由春季至秋季,南黄海中西部区域由主要受黄海冷水团控制转变为主要受黄海沿岸流的影响[40-41],同时从北黄海输送到南黄海的黄河输沙量在秋季达到最大值[42]。由于水动力增强,表层沉积物中砂和粉砂含量有所增加,而黏土含量降低,中值粒径相对变粗[40-42]。
南黄海夏、秋两季小型底栖动物群落结构存在极显著季节差异。研究表明,小型底栖动物的分布受到多种因素的影响,如水深、沉积物粒度、叶绿素a含量、有机质含量等[43-44]。结合BIOENV分析,中值粒径、含水量和有机质含量是较好解释小型底栖动物群落结构的环境因子组合。沉积物中值粒径的大小决定了小型底栖动物生存空隙的大小以及可利用的有机碎屑量,细砂沉积物通常含有较高含量的营养物质,进而可能促进优势类群海洋线虫丰度及类群多样性增加[45-47]。本研究南黄海夏季沉积物砂质较细,可能更利于第一优势类群线虫的生存。同时,夏季叶绿素a含量较高,能够为小型底栖动物提供充足的食物来源,导致小型底栖动物群落结构在季节间产生差异。
夏季小型底栖动物丰度和群落结构在不同水深之间存在显著差异,差异主要表现在水深大于60 m与其他水深梯度之间,而秋季小型底栖动物丰度和群落结构在不同水深之间则无显著差异。夏季小型底栖动物在不同水深梯度间的差异可能是受到了黄海冷水团影响。黄海冷水团在夏初处于鼎盛期,随着远离近岸,底温逐渐降低,底盐逐渐增加,冷水团中央为低于10℃的冷水[5]。根据水深、温度、盐度及关于黄海冷水团的水文资料[4-5,48]可知,本研究中夏季60 m以深的站位靠近中央冷水团,受到中央冷水团的影响,小型底栖动物丰度和群落结构在不同水深之间存在显著差异。研究表明,黄海冷水团中心站位小型底栖动物数量明显较低,推测影响小型底栖动物分布的主要因素是冷水团沉积物有机质含量[30-31]。黄海冬季冷水沉降、黄海暖流的加入和黄海表面夏季环流形成的漩涡,形成了冷水团区域独特的沉积环境[5,48-49],而不同的生境类型决定了小型底栖动物类群的分布特点[31,50-51]。
4.2 南黄海小型底栖动物丰度的长周期变化特征及影响因素
本研究与历史资料的对比见表7。本研究中,海洋线虫和桡足类分别为第一和第二优势类群,这与历史研究结果相同[2,26-32],海洋线虫一直为南黄海海域小型底栖动物的最优势类群。
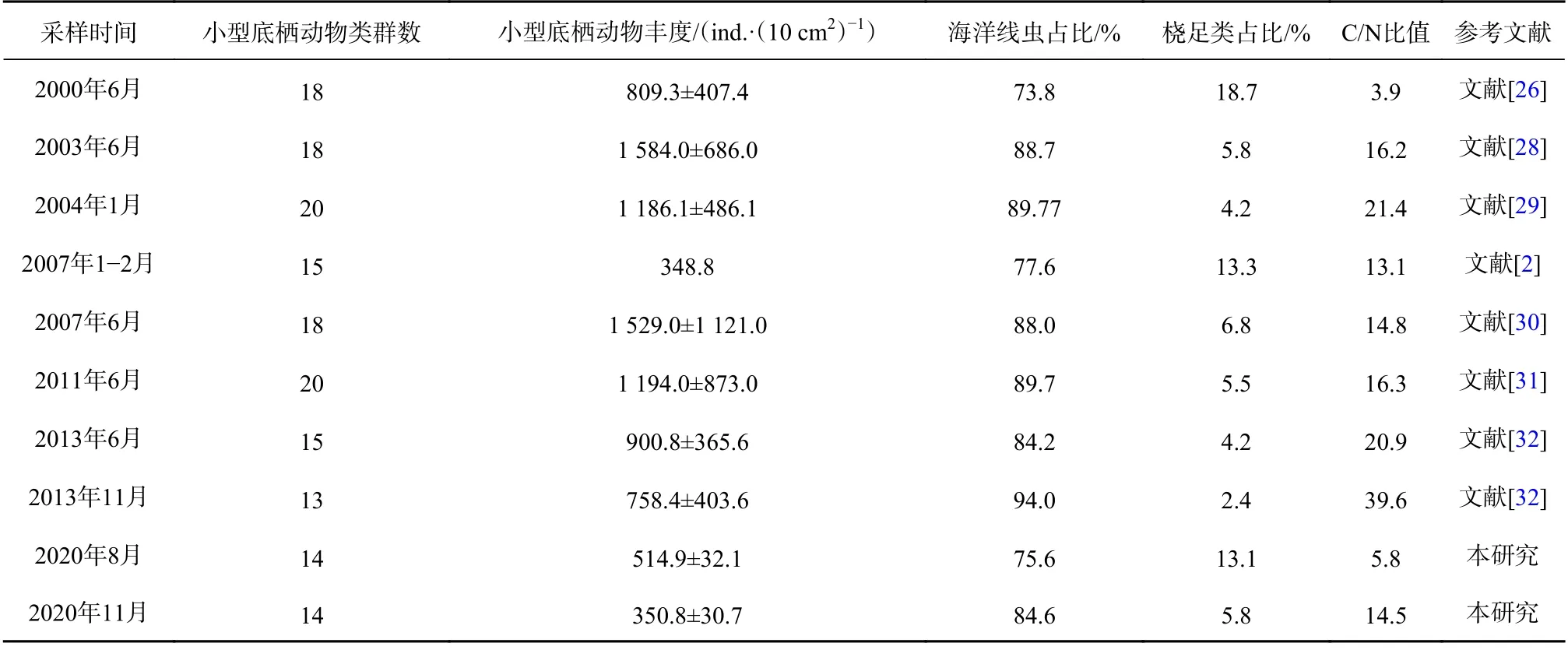
表7 南黄海小型底栖动物历史数据对比Table 7 Comparison of historical data of meiofauna in the southern Yellow Sea
本研究中,两个航次小型底栖动物的总平均丰度与2007年冬季小型底栖动物平均丰度相似[2],但低于其他年份的研究[26-32],丰度由2000年6月(809.3±407.4)ind./(10 cm2)下 降 为2020年8月(514.9±32.1)ind./(10 cm2)和11月(350.8±30.7)ind./(10 cm2),小型底栖动物的类群数量也低于之前的研究[2,26-32],这可能与各研究采样的时间、站位的分布不同等因素有关。本研究沉积物中值粒径相比于其他研究较高,夏季站位沉积物类型主要为砂-粉砂-黏土,秋季站位沉积物类型主要为粉砂质砂。与南黄海小型底栖动物历史研究相比较,南黄海海域沉积物中值粒径呈现波动并略有增大[2,26-32],说明沉积物颗粒大小呈现一定的增大趋势。沉积物底质的变化会影响沉积物中有机质的含量,相关研究表明,沉积物中有机质的含量一般随着沉积物颗粒的粗化而减小[52]。小型底栖动物食物来源减少,导致了小型底栖动物丰度下降,但南黄海海域沉积物底质变化对小型底栖动物造成的其他影响尚需进一步的数据支持及更深入的研究。
叶绿素a含量可代表研究海域的初级生产力。初级生产力是最基本的生物生产力,是海域生产有机物的基础[52]。沉积物中叶绿素a含量是小型底栖动物的重要食物来源并能反映底质环境状况的好坏,脱镁叶绿酸(Pha)含量的高低则反映了沉积物中已死亡及沉降的藻类多寡[30,38]。周红等[53]曾报道,食物的缺乏被看作是小型底栖动物丰度减小最重要的原因。与南黄海海域其他研究相比,本研究中,沉积物叶绿素a含量平均值低于其他研究,沉积物有机质含量平均值与张艳等[29]、王家栋等[30]的结果相近,但低于其他人的研究结果[26-28,31-32]。因此,沉积物叶绿素a含量及有机质含量的减小是引起南黄海小型底栖动物丰度变化的重要因素。
4.3 N/C比值在沉积环境有机污染监测上的应用
Raffaelli和Mason[54]根据底栖桡足类对有机质污染比较敏感,而海洋线虫对有机质污染耐受力较强的特点,提出利用海洋线虫和桡足类丰度比值(N/C比值)来评估某一海域的有机质污染程度这一方法[55]。
根据海洋线虫和底栖桡足类对适宜环境的要求和对有机质污染的耐受力不同,已有很多研究将海洋线虫(N)与桡足类(C)的丰度之比作为指示海洋环境有机质污染程度的指标[43-44,55]。这一比值因使用简单,无需复杂的分类鉴定,因此广泛应用于海洋环境监测中[55]。通常,N/C比值小于50,表示海域正常;50~100,表示海域富营养化;大于100,表示海域为有机质污染区。根据这一标准可知,2000-2020年南黄海海域未受到有机质污染(表7)。表4显示,本研究夏季所有站位和秋季站位(除22号站位)N/C比值均小于50,显示海域未受到污染。在自然环境中,小型底栖主要类群(线虫和桡足类)的丰度与沉积物的粒径、有机质含量、食物来源、季节、温度和自身繁殖等因素有关[17],采用N/C比值对环境状况进行评价过于片面[55]。Warwick[56]根据沉积物类型和小型底栖生物的营养动力学提出了更为细致的划分,即泥质沉积物中N/C比值大于40,砂质沉积物中N/C比值大于10,即表明环境受到有机质污染。本研究夏季站位底质类型大多为砂-粉砂-黏土,N/C比值平均为6.7;秋季站位底质类型大多为粉砂质砂,接近于砂质沉积物,N/C比值平均为19.07,根据Warwick[56]的标准判断,该海域夏季未受到有机污染,秋季受到一定程度的有机污染。
应用大型底栖动物对同一区域进行环境评价,结果显示南黄海夏季和秋季环境评价总体处于良好状态,秋季的环境质量较优于夏季[57],这与利用N/C比值进行评价结果不一致。由于本文只测定了沉积物有机质含量,没有对其他有机污染物进行测定,无法对南黄海海域环境质量进行准确的评价。在评价生态环境时,应从多个角度进行考量,对于应用N/C比值评价环境质量还需要进一步的研究。
5 结论
(1)2020年夏季和秋季对南黄海的调查研究共发现小型底栖动物类群15个,包括自由生活海洋线虫、底栖桡足类、端足类、枝角类、原足类、轮虫类、等足类、双壳类、海螨类、动吻类、涡虫类、多毛类、介形类、涟虫和其他类。自由生活海洋线虫为小型底栖动物的最优势类群。
(2)在季节分布上,南黄海夏、秋季小型底栖动物的丰度和群落结构存在显著差异,其中夏季小型底栖动物的平均丰度为(514.9±32.1)ind./(10 cm2),显著高于秋季。沉积物粒径是影响小型底栖动物丰度和群落结构季节差异的重要因素。其次,水动力通过选择性沉积不同粒径的沉积物,对小型底栖动物的季节分布也产生了一定的影响。
(3)在空间分布上,夏季小型底栖动物的丰度和群落结构在不同水深梯度间存在显著差异,其中丰度呈现出从近岸至外海先增加后减小的趋势。黄海冷水团可能是影响其分布的重要因素。秋季小型底栖动物的丰度和群落结构在不同水深梯度间则无显著差异。
(4)与南黄海以往研究相比,本研究小型底栖动物的丰度较低。调查时间、站位分布以及沉积物叶绿素含量、有机质含量的不同可能是主要原因。海洋线虫桡足类比值(N/C比值)结果显示,该海域夏季未受到有机污染,而秋季受到一定程度的有机污染。这与相同海域的大型底栖动物评价结果不一致,因此应用N/C比值来评价海洋环境质量还需进一步探讨。
