宁夏菜心不同部位发酵理化品质及挥发性风味物质的分析
2023-01-12陆胜勇肖更生罗文珊徐玉娟吴继军余元善李璐
陆胜勇,肖更生,罗文珊,徐玉娟,吴继军,余元善,李璐*
(1.仲恺农业工程学院轻工食品学院,广东广州 510225)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
菜心(Brassica parachinensisL.H.Bailey)又名菜薹,一年或二年生草本植物,是一种常见的蔬菜。菜心因其清甜味美、营养丰富而深受消费者喜爱。有研究表明菜心含有较高含量的硫代葡萄糖苷,因此其具有较强的抗癌特性[1,2]。菜心主要种植于南方地区,近年来,宁夏等地也有较大面积的种植。具有地理标志的宁夏菜心,生长于海拔1 000 m 以上的黄土高原。由于高原地区日照时间长、气候适宜赋予宁夏菜心色泽鲜艳、口感脆嫩、口味独特和营养丰富的特点,深受消费者青睐[3,4]。宁夏菜心组织柔嫩、含水量高,在储运过程中极易发生黄化和通心,而菜心多在南方地区销售,造成了大量宁夏菜心的浪费[5]。然而目前针对宁夏菜心的加工技术较少,亟待开发多元化的加工技术以丰富宁夏菜心加工产品的种类。
泡菜作为我国的传统发酵蔬菜制品,具有悠久的历史。蔬菜通过漂烫、调配等工序后经乳酸菌密封发酵而成,蔬菜经发酵不仅可保留其本身的营养成分,还可赋予其独特的风味[6]。制作泡菜的原料种类繁多,如萝卜、芥菜、白菜、姜、大蒜等茎菜类。菜心也被选为发酵蔬菜的原料,刘培芝等[7]在菜心中添加10%食盐进行干腌,研究其腌制后色泽、风味和质地的变化规律。但目前关于菜心的发酵方式主要为干腌,尚未有菜心湿态发酵的报道。
有研究表明,蔬菜不同部位的营养成分和物化性状具有显著差异,芹菜[8]叶片中营养成分的含量和抗氧化能力均高于基部茎和顶端茎。陈子琪等[9]利用植物乳杆菌对香菇不同部位发酵,香菇盖比香菇柄发酵液的等鲜浓度值(EUC)高,增加了香菇风味物质含量,明显改善了香菇的风味。通过分析以上文献可推断菜心不同部位发酵后其品质和挥发性风味物质也会产生显著的变化。目前,菜心的研究主要集中于其品质分析方面,原远等[10,11]运用主成分分析和聚类分析解析了23 种菜心的风味品质差异,研究结果表明酯、醇和酚类是构成菜心的主要挥发性风味物质,风味品质综合评分最佳的油绿702 菜心。然而,面对菜心供大于求的局面,目前针对菜心加工的手段非常缺乏,亟待开发出适用于菜心深加工的技术。因此,本研究选用宁夏菜心为原材料,对其不同部位进行接种发酵,解析宁夏菜心不同部分对其发酵品质和挥发性风味物质的影响规律,为宁夏菜心湿态发酵提供理论依据。
1 材料与方法
1.1 主要实验材料与试剂
宁夏菜心,市售;食盐,广东省广盐集团股份有限公司;白砂糖,云南颠鹏糖业有限公司;植物乳杆菌(Lactobacillus plantarum)GDMCC 1.2868,实验室保存。
生物胺(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺)分析标准品、有机酸(草酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸)分析标准品、癸酸乙酯分析标准品、1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl,DPPH)(分析纯),上海源叶生物科技有限公司;亚硝酸钠,分析纯,福晨(天津化学试剂有限公司);培养基(PCA、MRS、孟加拉红),广东环凯微生物科技有限公司;其他试剂均为国产AR。
1.2 主要仪器设备
LC-20AT 高效液相色谱仪、UV1800 紫外分光光度计,岛津仪器有限公司;7890-5977B 气相色谱-质谱联用仪,美国Agilent 科技公司;HWS24 恒温磁力搅拌器,上海一恒科学仪器有限公司;SPX-250B-Z 生化培养箱、YXQ-LS-50SⅡ立式压力蒸汽灭菌锅,上海博迅医疗生物科技股份有限公司;SW-CJ-2FD 洁净工作台,苏州安泰空气技术有限公司;D3024R 台式高速冷冻离心机,美国赛洛杰克公司。
1.3 实验方法
1.3.1 菜心发酵工艺
将菜心清洗,按照图1 基部茎、顶端茎、叶切分得到菜心的三个不同部位。基部茎切分成1.5 cm,顶端茎切分成2.0 cm。将基部茎、顶端茎、叶和整颗菜心(切分长度为2 cm)分别放入沸水中漂烫1 min 并沥干水分,将其放入含m=3%食盐、m=2%白砂糖的发酵液中,发酵罐中固液比为1:3,接入3%(V/V)植物乳杆菌菌液,30 ℃密封发酵15 d。本研究设置未发酵组(基部茎A1、顶端茎A2、叶子A3、整颗菜心A4)和发酵组(基部茎B1、顶端茎B2、叶子B3、整颗菜心B4)。

图1 菜心取样部位示意图Fig.1 Schematic diagram of the sampling site of Chinese cabbage
1.3.2 理化指标测定
微生物检测:参照GB 4789.2-2016《食品微生物学检验菌落总数测定》、GB 4789.35-2016《食品微生物学检验乳酸菌检验》、GB 4789.15-2016《食品微生物学检验霉菌和酵母计数》的平板计数法。
pH 测定:pH 计直接测定。
有机酸测定:参照GB 5009.157-2016《食品有机酸的测定》。
亚硝酸盐测定:参照GB 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》的分光光度法。
DPPH 自由基清除能力:参照SRIDHAR 等[12]的测定方法,样品用φ=80%甲醇溶液以1:2 稀释,超声提取30 min 后,12 000 r/min 离心10 min,取上清液0.5 mL,加入2.5 mL DPPH 乙醇溶液(0.01 mmol/L),用分光光度计测定,波长为517 nm。设定空白组、对照组。清除率(B,%)计算公式如公式(1):

式中:
A0——DPPH+样液试剂测定的吸光值;
A1——DPPH+样液测定的吸光值。
生物胺测定:参照GB 5009.208-2016《食品中生物胺的测定》的液相色谱法。
挥发性风味物质测定:采用气相色谱-质谱联用方法进行测定。(1)顶空固相微萃取条件:参考Nie 等[13]的方法,称取5.0 g 匀浆泡菜样品和20 μL 50 mg/L 的癸酸乙酯标准品于20 mL顶空瓶并放置在60 ℃恒温水浴锅内平衡10 min,萃取头在250 ℃活化30 min 后,插入顶空瓶内吸附40 min,随后将萃取头插至进样口,解离挥发性物质成分5 min 并同时采集数据。(2)气相色谱条件:色谱柱:HP-5 MS 毛细管色谱柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度为35 ℃,保持2 min,以4 ℃/min 速率升至220 ℃,保持2 min;载气为氦气,流速为1.0 mL/min,3:1 分流进样。(3)质谱条件:采用EI 离子源(70 eV),其温度230 ℃,接口温度280 ℃,全程扫描范围m/z10~450。
测定以上指标每个样品均为3 个平行。
1.4 数据处理
GM-MS 数据的定性定量:将GC-MS 分析获得的挥发性成分的质谱信息与标准信息谱库NIST14.0 进行相似度检索匹配,选取匹配度不低于90%的化合物进行分析,并结合已发表的文献确定挥发性风味组分。采用内标法对挥发性物质进行定量,计算出各挥发性物质的相对含量。其他实验数据运用Excel 2019 整理,利用IBM SPSS Statistics 22 进行统计分析;采用Origin 2018 作图。
2 结果与分析
2.1 菜心不同部位发酵对微生物和pH 的影响
泡菜发酵过程中,营养物质的组成会直接影响微生物的生长和发酵后泡菜的品质。本研究是接种发酵,乳酸菌作为优势菌,对泡菜的亚硝酸盐、有机酸种类和含量均有影响,也是影响挥发性风味物质直接因素[14]。菜心不同部位发酵后微生物结果如图2a 所示,发酵后未检出酵母和霉菌,菜心各部位的乳酸菌数与菌落总数未发现显著性差异,说明发酵样品中的优势微生物是乳酸菌,发酵过程中未被杂菌污染。B1、B2、B3、B4 组的乳酸菌数分别是1.7×106、3.4×106、4.6×106、1.9×104CFU/mL。发酵过程中,由于四个部位的营养物质组成不同,不同发酵样品中的乳酸菌数存在显著性差异。B3 组的菌落总数和乳酸菌数均高于B1、B2、B4,可能是因为B3 的营养物质组成更适合乳酸菌的生长。pH 是泡菜发酵的重要理化指标,可以衡量微生物生长状况。由图2b 可知,未发酵时菜心各部位的pH值在6~7 之间,经植物乳杆菌发酵后菜心各部位样品的pH 值在3~4,导致pH 下降的原因是因为乳酸菌的快速生长,产生了大量乳酸。
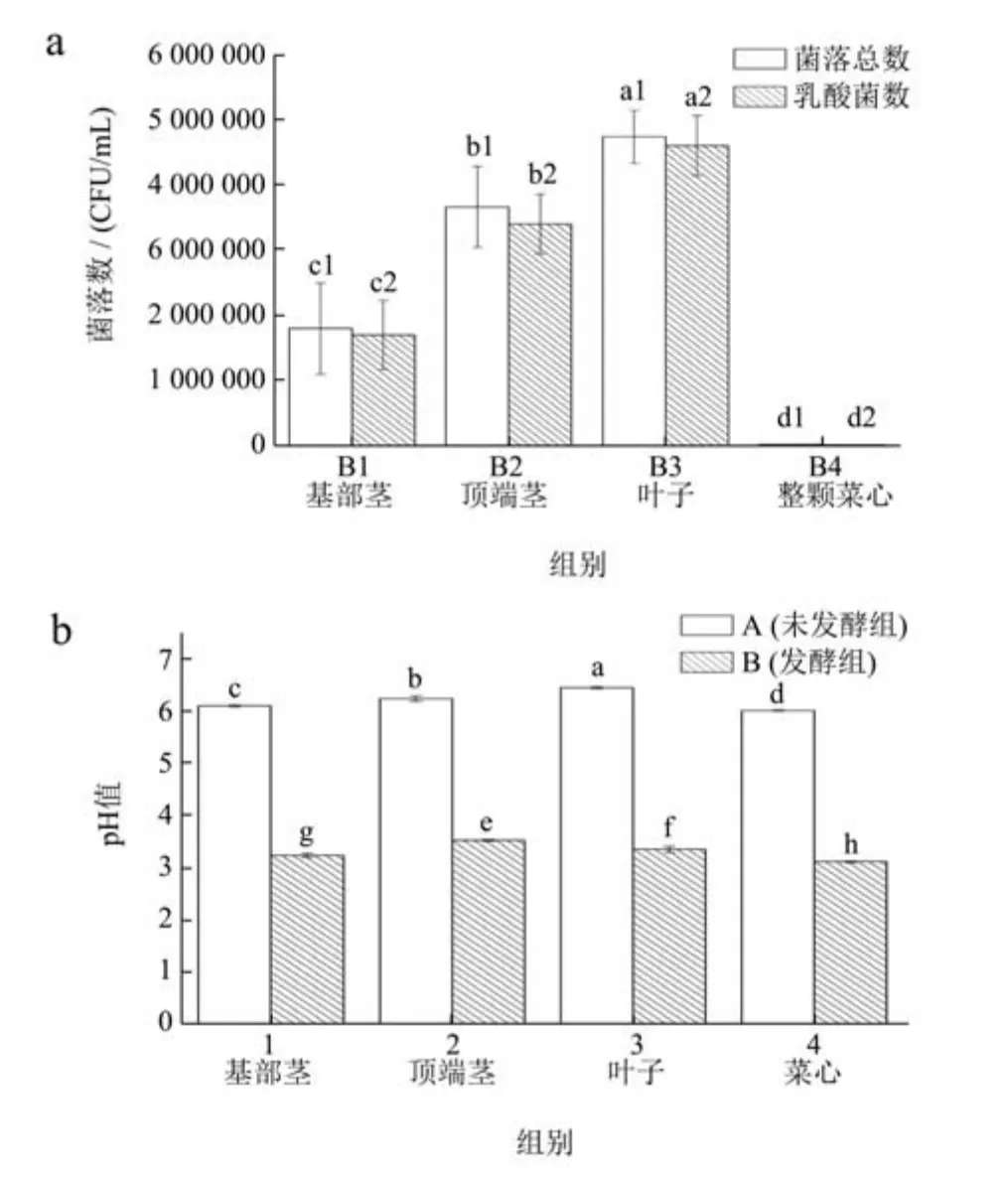
图2 菜心不同部位发酵后微生物和pH 测定值Fig.2 Microbial and pH measurement values of different parts of Chinese cabbage after fermentation
2.2 菜心不同部位发酵对有机酸的影响
泡菜中的有机酸是微生物发酵过程中的重要代谢产物,可赋予泡菜柔和的酸味和清香,代谢产物中有机酸种类主要有乳酸、酒石酸、柠檬酸、草酸等[15]。菜心不同部位发酵前后有机酸测定值如表1 所示,发酵后菜心各部位的总有机酸含量显著降低,其中草酸、酒石酸、苹果酸、乙酸、柠檬酸含量均出现下降,而乳酸含量升高。草酸含量降低的原因是因为发酵过程中草酸与醇类物质反应生成酯类物质,或被微生物利用生成其他物质[16,17];酒石酸含量显著降低原因可能是生成酒石酸盐析出和微生物降解或转化为其他的有机酸[18];苹果酸在乳酸菌的作用下,可转化为乳酸和挥发性风味物质,导致其含量的降低。乙酸和柠檬酸在泡菜发酵过程中为分别被转化成酯类和α-酮戊二酸等物质,从而造成两者含量的降低。而发酵样品中乳酸含量的升高是因为发酵过程中的乳酸菌会消耗菜心样品中的碳源而产生乳酸。
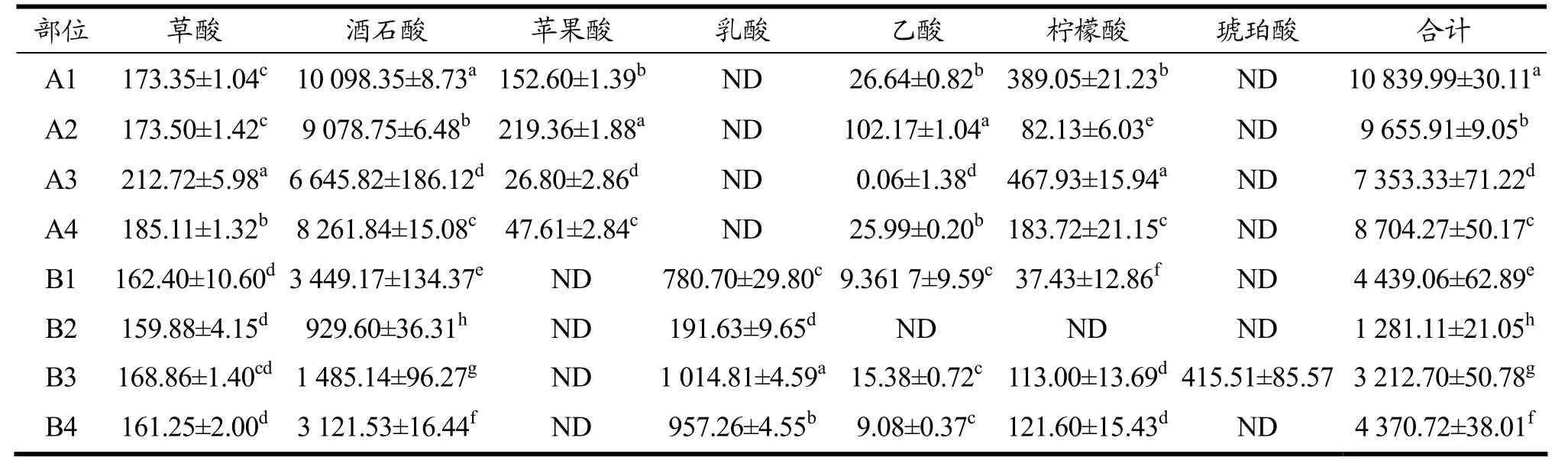
表1 菜心不同部位发酵前后有机酸测定值(mg/100 g)Table 1 Measured values of organic acids in different parts of Chinese cabbage before and after fermentation
经乳酸菌发酵,基部茎、顶端茎、叶子、整颗菜心的草酸含量分别减少10.95、13.62、43.86、23.86 mg/100 g,叶子的草酸含量变化最大。菜心各部位的酒石酸含量均较高,A1 中的酒石酸含量高达10 098.35 mg/100 g。发酵后酒石酸含量变化最大的是顶端茎,减少了8 149.15 mg/100 g。B3 的乳酸含量为1 014.81 mg/100 g,显著高于其他组,可能是B3 中的乳酸菌数显著高于其他组,发酵过程中合成了大量的乳酸。B2 的乳酸菌数目仅次于B3,但其总有机酸含量和乳酸含量均处于较低水平,且B2 中未检测到乙酸和柠檬酸,这可能是因为顶端茎中成分有利于乳酸菌生长,但并未促进乳酸菌产生乳酸,且B2 代谢旺盛,分解或转化了大量的有机酸和其他营养成分。
2.3 菜心不同部位发酵对DPPH 自由基清除能力的影响
抗氧化能力是多酚类化合物最重要的功能性质,可作为评价泡菜品质重要指标之一[19]。菜心不同部位发酵对DPPH 自由基清除能力影响如图3 所示,菜心各部位发酵前的DPPH 自由基清除能力均高于发酵后,经发酵,基部茎、顶部茎、叶子和整颗菜心的DPPH自由基清除率分别降低了19.39%、41.81%、21.12%、25.44%。发酵过程中,微生物的生长需要较多的营养物质,并造成多酚类物质的降解,从而导致发酵样品抗氧化能力的降低[20]。未发酵组中A3 对DPPH 自由基的清除能力最强,A1 组是最弱的;发酵组中B3 的DPPH 自由基清除能力最强,B2 最弱,以上结果说明A3 和B3 中的酚类等物质含量较高,优于其他组。
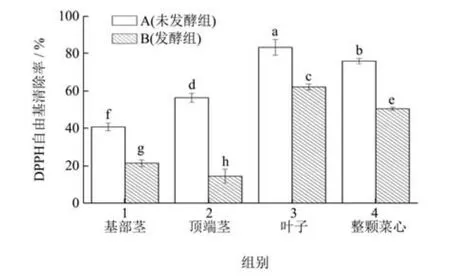
图3 菜心不同部位发酵前后DPPH 自由基清除能力Fig.3 DPPH free radical scavenging ability of different parts of Chinese cabbage before and after fermentation
2.4 菜心不同部位发酵对亚硝酸盐含量的影响
亚硝酸盐普遍存在于腌制品中,是评价腌制品是否安全的重要指标,亚硝酸盐与胺类或酰胺同时存在时,可能会合成强致癌物-亚硝酸胺。菜心不同部位发酵前后的亚硝酸盐变化如图4 所示,除基部茎以外,各部分经发酵均能显著降低其亚硝酸盐含量。B1、B2、B3、B4 组的亚硝酸盐含量分别为0.12、0.12、0.26、0.13 mg/kg,均显著低于国家限量卫生标准(20 mg/kg)。经乳酸菌发酵各样品中的亚硝酸盐含量降低,周光燕等[21]研究表明,植物乳杆菌能明显缩短泡菜发酵时间,提高泡菜的品质,并且显著的降低亚硝酸盐含量。泡菜中亚硝酸盐的降解,主要途径是酸降解和酶降解,现有的研究中表明[18,22],乳酸菌中的亚硝酸还原酶可将亚硝酸盐还原为NO 和N2O;在酸性条件下,有机酸作为还原剂,亚硝酸盐可发生自身的还原反应,生成HNO3和NO。
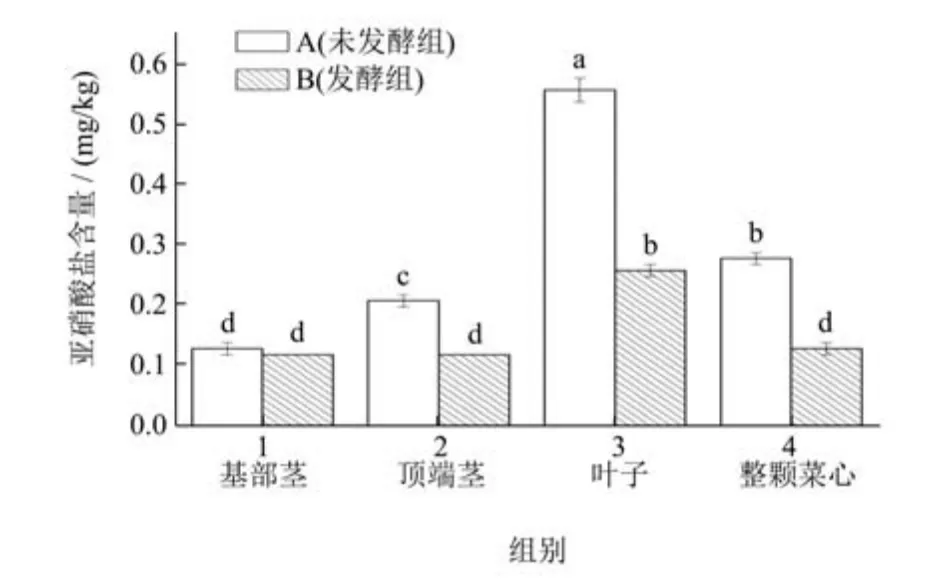
图4 菜心不同部位发酵前后亚硝酸盐测定值Fig.4 Determination of nitrite in different parts of Chinese cabbage before and after fermentation
2.5 菜心不同部位发酵对生物胺含量的影响
生物胺是一类低分子量含氮化合物,广泛存在于发酵食品中,主要通过微生物分泌的氨基酸脱羧酶作用于对应的氨基酸而产生[23]。新鲜蔬菜中也存在生物胺,人体摄入适量的生物胺会对其生理机能起到一定的调节作用,但过多摄入生物胺会造成中毒。腌制品在生产过程中因微生物的介入会导致其存在生物胺含量过高的风险。菜心不同部位发酵前后生物胺情况如表2 所示,发酵前的总生物胺含量显著高于发酵后。未发酵样品中检测到腐胺、尸胺、组胺和精胺,而经微生物发酵后样品中仅检测到组胺。微生物除了具有合成生物胺的功能外,部分微生物还具有降解生物胺的功能[24,25]。本研究结果表明接种的L.plantarum在菜心发酵过程中未产生生物胺,且对腐胺、尸胺和精胺具有降解作用。但发酵样品中仍存在一定量的组胺,使发酵菜心样品的安全性存在一定的隐患,在未来的研究中需要进一步控制。
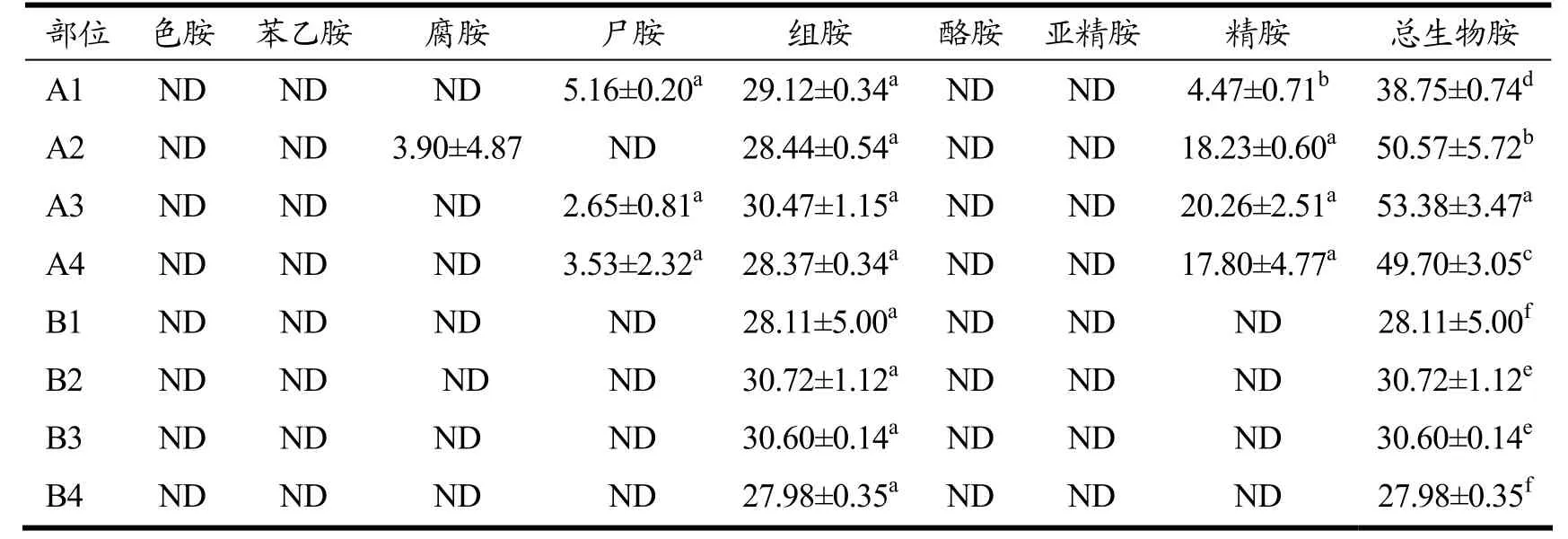
表2 菜心不同部位发酵前后生物胺测定值(mg/kg)Table 2 Determination of biogenic amines in different parts of Chinese cabbage before and after fermentation
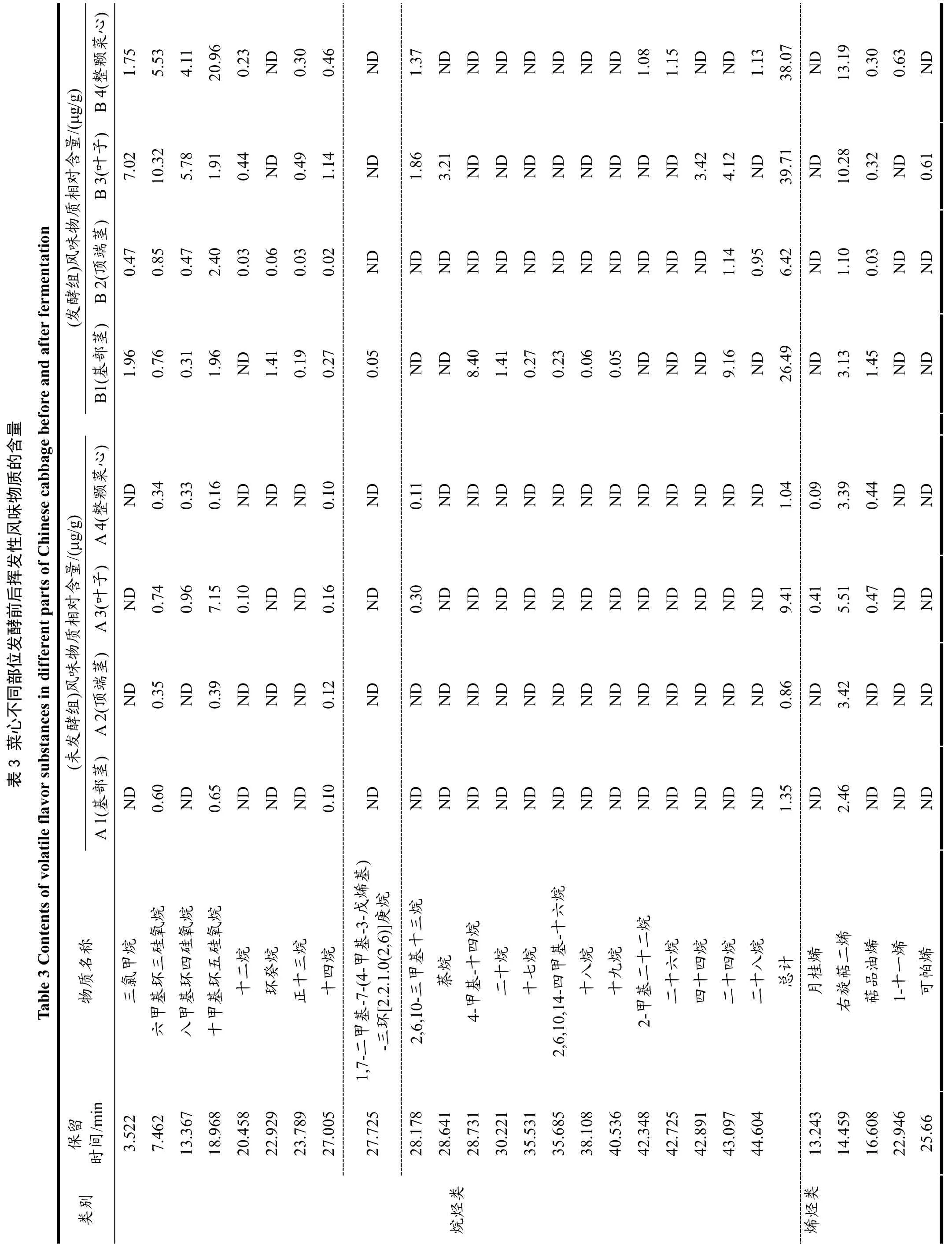
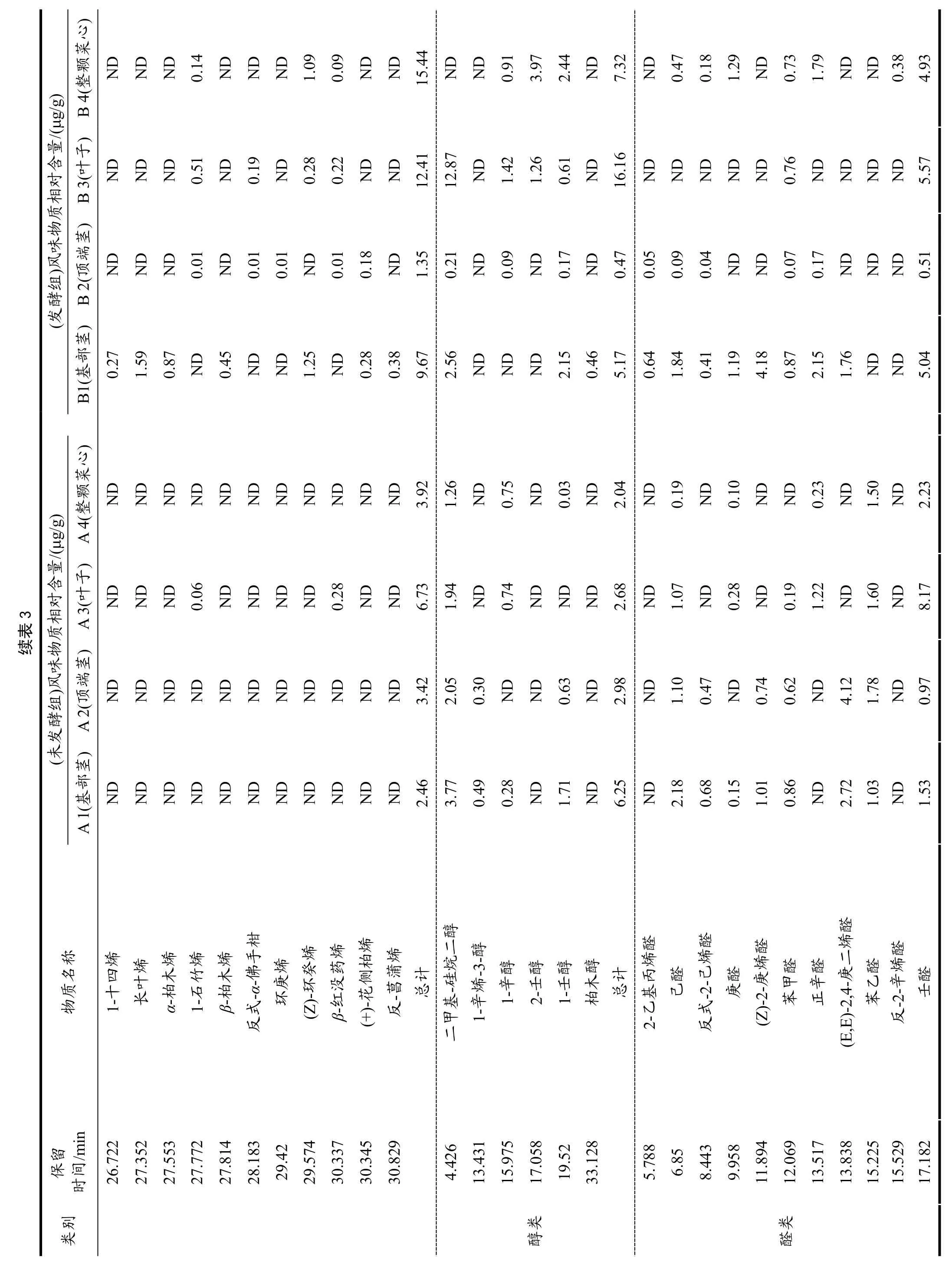
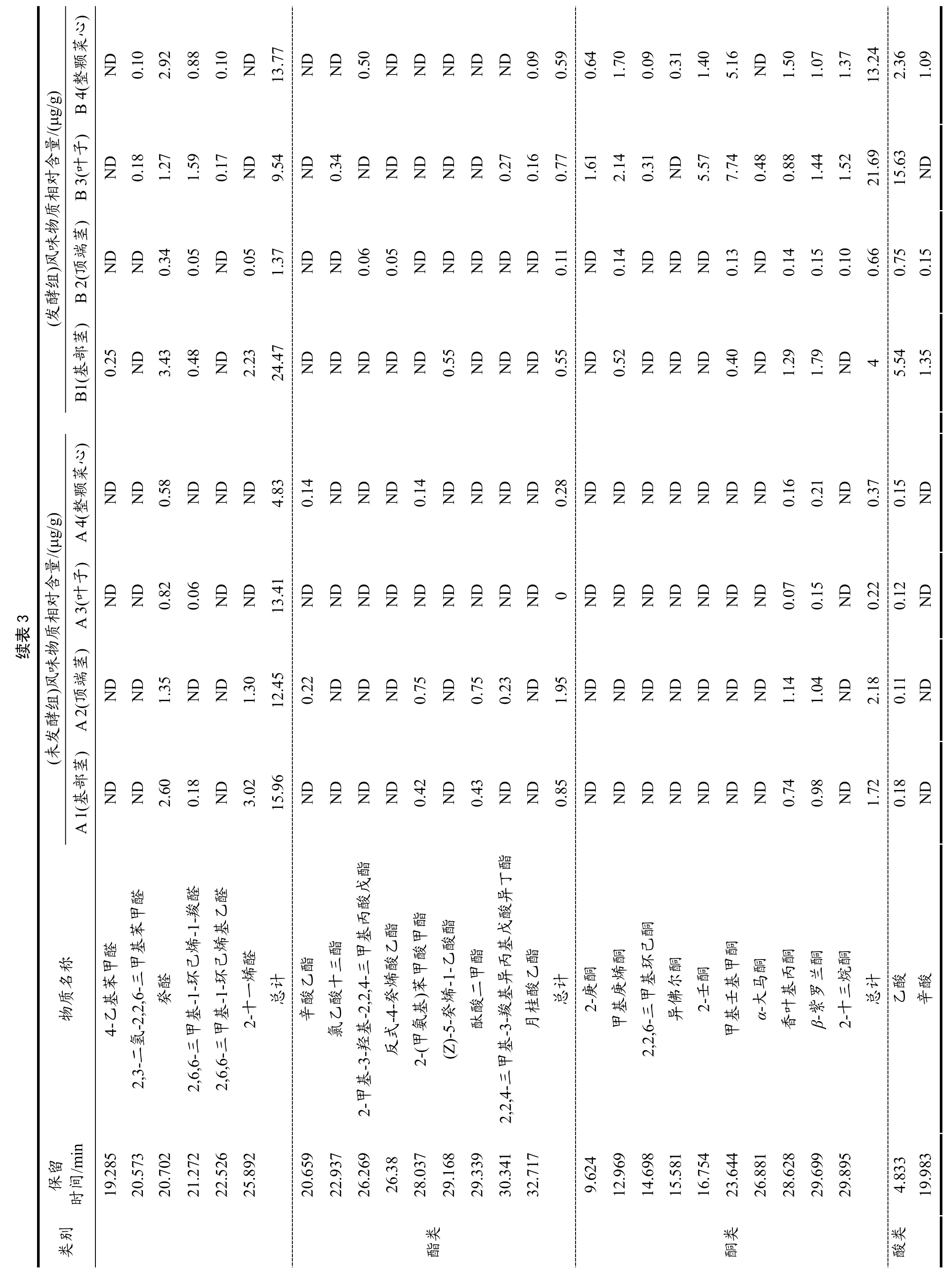
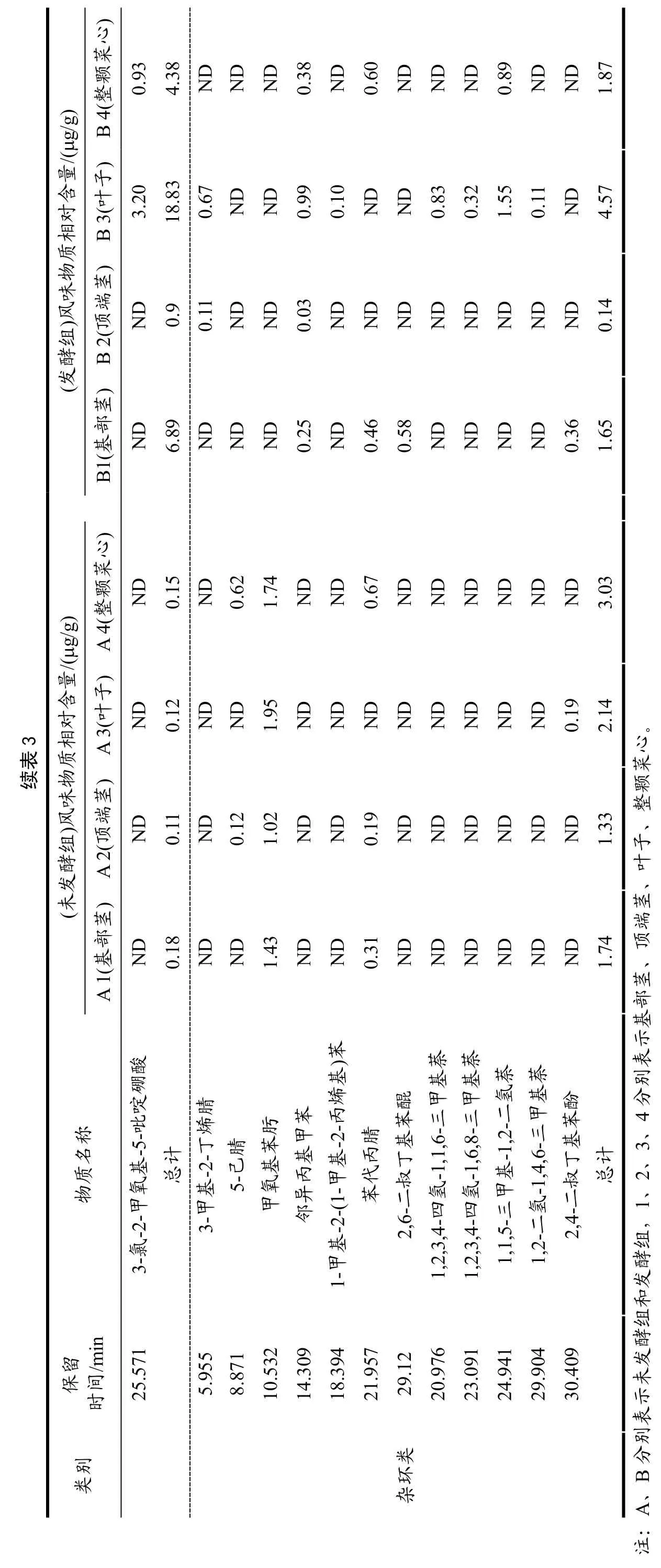

2.6 菜心不同部位发酵对挥发性风味物质的影响
由表3 和表4 可看出,菜心样品发酵前后共检测出95 种风味物质,主要包括烷烃类22 种、烯烃类16种、醇类6 种、醛类17 种、酯类9 种、酮类10 种、酸类3 种、杂环化合物12 种。A1、A2、A3 组中检测出26 种共有挥发性风味物质,A4 组检测出25 种挥发性风味物质,B1、B2、B3、B4 组分别检测出50、40、48、48 种挥发性风味物质。未发酵组检测出的共有挥发性风味物质有13 种,分别是六甲基环三硅氧烷、十甲基环五硅氧烷、十四烷、右旋萜二烯、二甲基硅烷二醇、己醛、苯乙醛、壬醛、癸醛、香叶基丙酮、β-紫罗兰酮、甲氧基苯肟;发酵组检测出的共有挥发性风味物质为19 种,分别是三氯甲烷、六甲基环三硅氧烷、八甲基环四硅氧烷、十甲基环五硅氧烷、正十三烷、十四烷、右旋萜二烯、萜品油烯、1-壬醇、苯甲醛、壬醛、癸醛、2,6,6-三甲基-1-环己烯-1-羧醛、甲基庚烯酮、甲基壬基甲酮、香叶基丙酮、β-紫罗兰酮、乙酸、邻异丙基甲苯;未发酵组和发酵组检测出的共有挥发性风味物质共有9 种,分别是六甲基环三硅氧烷、十甲基环五硅氧烷、十四烷、右旋萜二烯、壬醛、癸醛、香叶基丙酮、β-紫罗兰酮、乙酸;在检测出的95 种风味物质中,未发酵组主要的挥发性物质有十甲基环五硅氧烷、右旋萜二烯、二甲基-硅烷二醇、(E,E)-2,4-庚二烯醛、2-(甲氨基)苯甲酸甲酯、香叶基丙酮、乙酸、甲氧基苯肟;发酵组主要的挥发性物质有十甲基环五硅氧烷、右旋萜二烯、二甲基-硅烷二醇、壬醛、(Z)-5-癸烯-1-乙酸酯、甲基壬基甲酮、乙酸、1,1,5-三甲基-1,2-二氢萘,表明右旋萜二烯、二甲基-硅烷二醇、壬醛、甲基壬基甲酮、乙酸、邻异丙基甲苯等普遍存在菜心的各部位中且含量高。通过对挥发性物质分析,菜心的叶子发酵过后,其化合物种类和含量均显著提高。
多不饱和脂肪酸、氨基酸的氧化或降解过程中会产生多种酮类物质[26]。研究发现菜心经发酵后会产生具有柑橘类油脂和芸香油般香气的甲基壬基甲酮,并且还生成了具有梨香的2-庚酮、柠檬草和乙酸异丁酯般香气的甲基庚烯酮和水果、花、油脂和药草似香气的2-壬酮。醛类化合物是发酵菜心的主要风味物质之一,具有油脂香、坚果香、蜡香、柑橘香和花香的壬醛和癸醛是其主要的呈香物质。而发酵菜心样品中检测到的醇类物质阈值普遍较高,对其风味的贡献较小,且发酵后的菜心样品中醇类含量降低。菜心经发酵后会产生较多含量的烷烃类化合物,如具有鲜花清淡香气的右旋萜二烯,具有丁香似香味的1-石竹烯,具有木香、柑橘香、花香和果香的β-红没药烯,以上物质赋予了发酵菜心独特的风味。
3 结论
本研究对宁夏菜心不同部位进行接种发酵,解析其发酵前后理化指标和挥发性风味物质的变化规律,以探讨宁夏菜心作为泡菜原材料的可行性。研究结果表明,宁夏菜心不同部位发酵前后微生物、有机酸、抗氧化活性、亚硝酸盐、生物胺和挥发性风味物质均存在显著差异。经乳酸菌发酵后,宁夏菜心基部茎、顶端茎、叶子和整颗菜心的总有机酸含量分别降低了6 400.93、8 374.80、4 140.63 和4 333.55 mg/100 g,其抗氧化能力、亚硝酸盐含量和生物胺含量也均出现显著降低;在挥发性风味物质方面,基部茎、叶子和整颗菜心的挥发性风味物质含量较发酵前分别提高了48.38、88.97、79.02 μg/g,而顶端茎挥发性风味物质含量较发酵前降低了13.86 μg/g。与其他发酵组相比,叶子经乳酸菌发酵后,其有机酸组成、抗氧化能力和挥发性风味物质的组成与含量均处于较优水平,且亚硝酸盐和生物胺含量较低。综上所述,宁夏菜心可作为泡菜发酵的原材料,且较优发酵部位是叶子,本研究为宁夏菜心湿态发酵提供理论依据,为菜心的精深加工提供潜在技术手段。
