文冠果果壳总皂苷的提取工艺优化及抗氧化、抗肿瘤活性评价
2023-01-12王冠英李珂珂李中玉叶淑红孙浩弓晓杰
王冠英,李珂珂,李中玉,叶淑红,孙浩*,弓晓杰*
(1.大连工业大学食品学院,辽宁大连 116038)(2.大连民族大学生命科学学院,辽宁大连 116602)
文冠果(Xanthoceras sorbifoliumBunge)又名文冠木、木瓜、温旦革子等,为无患子科(Sapindaceae)文冠果属(Xanthoceras)植物,单属单种[1]。文冠果原产于我国北方黄土高原地区,天然分布于北纬32°~46°,东经100°~127°,是我国特有的珍稀木本油料作物[2]。可从文冠果仁中提取得到品质较高的食用油,文冠果果油含有丰富的人体不能自身合成的亚油酸、亚麻酸、二十碳烯酸等成分[3]。文冠果的果壳、叶片、茎枝、种皮、种仁均可入药,曾列入1977 年版《中国药典》,且作为蒙药列入1984 年版《中国民族药志》,主要用于治疗风湿病[4]。近年来,研究发现文冠果中含有丰富的玉蕊醇型三萜及皂苷类化学成分,其中,该成分在文冠果的果壳、果柄及种子中含量较高;另外,活性研究表明,此类皂苷具有显著的抗肿瘤及抗阿尔茨海默病作用[5-7]。因此,通过开发高效的文冠果果壳总皂苷提取工艺,可为文冠果果壳的深入开发利用提供参考依据,并为玉蕊醇型皂苷的药物筛选提供丰富的物质基础。
超声细胞破碎法利用超声分散破坏植物组织,能加速溶剂穿透组织的作用,提高样品中有效成分的提取;另外,在提取过程中,可以利用冷凝装置保持温度的恒定,避免温度升高对成分的破坏,具有高效节能、节约溶剂的优点,已广泛应用于龙葵多糖[8]、香蕉皮单宁[9]、甜菊多酚[10]等天然产物的提取。
本实验采用响应面法对超声细胞破碎法提取文冠果果壳总皂苷的工艺进行优化,旨在提供一种高效的文冠果果壳总皂苷的提取工艺。采用扫描电镜对不同方式提取后的样品粉末的形态进行观察,为不同提取工艺下总皂苷含量高低做出最直观的科学解释,并对优化后的超声细胞破碎法提取的总皂苷提取物的抗氧化、抗肿瘤作用进行研究,为文冠果果壳中皂苷类物质的生理活性研究提供理论支持,并为其废弃物的充分开发利用提供实际的指导意义。
1 材料与方法
1.1 材料与试剂
文冠果(X.sorbifoliumBunge)果壳(无霉变、无杂质),采自辽宁朝阳;肺癌细胞A549 和肝癌细胞HepG2 为实验室保藏;齐墩果酸(标准品),上海阿拉丁生物化学科技有限公司;Trolox(标准品)、EDTA-2Na(标准品)、二苯基苦基苯肼自由基、2,2-联氨-二-(3-乙基-苯并噻-6-磺酸)二胺盐、6-羟基-2,5,7,8-四甲基色烷-2-羧酸,上海源叶公司;胎牛血清,美国Hyclone 公司;高糖DMEM,美国Gibco 公司;链霉素,美国Beyotime 公司;细胞计数试剂盒-8,美国Dojindo 公司;胰蛋白酶EDTA,美国Gibco 公司;无水乙醇、甲醇、香草醛、冰醋酸、高氯酸等均为分析纯,天津科密欧化学试剂有限公司。
JY99-ⅡDN 超声波细胞粉碎仪,宁波新芝生物科技有限公司;Synergy HI 酶标仪,美国 BioTex Instruments 公司;SB-1300 旋转蒸发仪,上海爱郎仪器有限公司;H2050R 高速冷冻离心机,广州深华生物技术有限公司;S-4800 扫描电镜,日本Hitachi 公司;KQ-3000TDE 超声波清洗器,昆山市超声仪器有限公司;102739-103Steri-Cycle CO2细胞培养箱,Themo Electron 公司;HYC-950L-20 ℃冰箱,海尔集团。
1.2 文冠果果壳总皂苷提取方法
1.2.1 超声细胞破碎法
取1 g 文冠果果壳粉末,按液料比为35:1(mL/g)加入70%乙醇置于超声细胞破碎仪中进行提取。超声功率200 W、超声时间35 min、超声温度50 ℃。分别考察乙醇体积分数、液料比、超声时间、超声功率及超声温度对总皂苷提取得率的影响。
1.2.1.1 单因素试验
分别考察乙醇体积分数及溶剂(60%、70%、80%、90%、无水乙醇、甲醇),液料比(20:1、25:1、30:1、35:1、40:1、45:1 mL/g),超声时间(15、20、25、30、35、40 min),超声功率(90、144、198、252、306、360 W)及超声温度(40、45、50、55、60、65 ℃)对总皂苷提取得率的影响。研究其中单一因素改变时,其他各因素固定的条件为:乙醇体积分数70%、液料比35:1 mL/g、超声时间35 min、超声功率198 W、超声温度50 ℃。
1.2.1.2 Box-Behnken 试验设计
在单因素试验基础上,以文冠果果壳中总皂苷得率作为响应值,选取对果壳皂苷含量影响最大的液料比X1、乙醇体积分数X2和超声功率X3设计响应面试验。在3 个水平上(-1、0、1)系统地确定了提取变量,试验设计见表1。

表1 Box-Behnken 设计试验因素水平编码Table 1 Code and level of independent variables used for Box-Behnken design
1.2.2 加热回流法
取1 g 文冠果果壳粉末,按液料比为35:1(mL/g)加入φ=65%乙醇置于回流抽提器中,水浴加热温度90 ℃,回流提取3 次,每次35 min。将提取液离心(4 000 r/min,10 min),取上层溶液减压浓缩至浸膏。将浸膏加正丁醇:水(V/V=1:1)萃取3 次,合并正丁醇层萃取液,减压浓缩至膏状,即得到文冠果果壳总皂苷。
1.2.3 常规超声法
取1 g 文冠果果壳粉末,按液料比为35:1(mL/g)加入φ=65%乙醇置于超声清洗器,其余方法同1.2.1。
1.2.4 扫描电镜观察
取适量提取后并晒干的文冠果果壳粉末,用双面胶带将其固定于样品台,进行镀膜处理后放置在扫描电镜下观察样品形态。
1.3 文冠果果壳中总皂苷的含量测定
采用邱悦等[11]的香草醛-高氯酸比色法,并稍作修改。准确称取齐墩果酸标准品6 mg,配置成0.12 mg/mL的齐墩果酸标准品储备液。量取不同浓度标准品溶液50 μL 于试管中,水浴挥干甲醇;加入新鲜配置的5%香草醛-冰醋酸溶液0.50 mL,高氯酸1 mL,于60 ℃恒温水浴加热15 min取出,流水冷却,并在最佳波长530 nm处测定吸光度。以齐墩果酸含量(X,mg)为横坐标,吸光度值(A)为纵坐标绘制标准曲线,得回归方程:y=4.94x+0.12(R2=0.993 4)。取“1.2”项制备的文冠果果壳皂苷溶液50 μL 按标准曲线的方法测其吸光度值,计算出待测液的总皂苷含量,再通过公式(1)计算得到样品中的总皂苷含量。

式中:
Y——样品中总皂苷含量,mg/g;
c——待测液中总皂苷含量,mg/mL;
V——待测液总体积,mL;
m——文冠果果壳质量,g。
1.4 抗氧化活性测定
将超声细胞破碎法最佳工艺下提取的总皂苷提取物减压浓缩,用无水乙醇配置成不同浓度的溶液。阳性对照Trolox(水溶性维生素E)用无水乙醇配置,EDTA-2Na 用去离子水配置。DPPH·清除能力测定参照Tsai 等[12]的方法;ABTS+·清除能力测定参照Luo等[13]的方法;Fe2+螯合能力测定参照Huang 等[14]的方法。
1.5 抗肿瘤活性测定
1.5.1 细胞形态观察
细胞活性的测定参照孟雪等[15,16]的方法。取对数生长期的A549 细胞和HepG2 细胞从CO2培养箱取出,进行消化,替换新的培养基并于37 ℃,φ=5% CO2培养箱中培养过夜。按照空白对照组(牛血清)、药物组(优化后的文冠果果壳总皂苷提取物溶液20、40、60、80、100、120 μg/mL)加样品处理,每组3 个复孔,每孔为1 mL。按上述处理方式孵育24 h 后,使用普通光学显微镜下观察并拍摄细胞形态变化。
1.5.2 细胞活力测定
对空白对照组和实验组加样品处理24 h 后,每孔加CCK-8 试剂100 μL,置于含有φ=5% CO2、37 ℃的培养箱中24 h。然后采用酶标仪于450 nm 下测定OD值。以正常对照组OD 值为100%细胞活力,其余各组OD 值与正常对照组OD 值的比值为相对活力。以相对活力评价文冠果果壳总皂苷提取物对A549 细胞和HepG2 细胞增殖的抑制率。

式中:
C——细胞生长抑制率,%;
OD450药物——药物组450 nm 下的OD 值;
OD450对照——细胞对照组450 nm 下的OD 值
1.6 数据处理与分析
采用SPSS 23 软件对实验数据进行进行Duncan’s差异分析,以p<0.05 表示差异显著。
2 结果与讨论
2.1 总皂苷提取的单因素试验结果
2.1.1 乙醇体积分数对文冠果果壳总皂苷含量的影响
如图1 所示,乙醇体积分数在60%~100%时,总皂苷的含量先升高后降低,在乙醇体积分数为70%时达到最大值,此时总皂苷得率为14.50 mg/g。乙醇与水的混合液可以破坏皂苷类物质与蛋白质、糖类、果胶等物质的结合键,有利于皂苷的提取[17]。用甲醇作提取溶剂时,总皂苷得率为13.20 mg/g,这说明大极性的甲醇也能够提取获得较大量的皂苷,但是得率还是低于φ=70%乙醇。这可能是因为用甲醇提取时,没有水的参与,只有甲醇与果壳细胞间的相互作用[18]。这与Escribano-Bailon[19]报道的结果类似。皂苷做为水溶性成分,在含水有机溶剂中有利于其从细胞中溶出,提高得率。因此,最佳提取溶剂为70%乙醇。
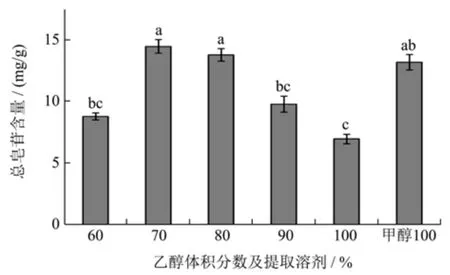
图1 乙醇体积分数及提取溶剂对文冠果果壳总皂苷含量的影响Fig.1 Effect of ethanol concentration and extraction solvent on the total saponin yield from husk of X.sorbifolia
2.1.2 液料比对文冠果果壳总皂苷含量的影响
如图2 所示,文冠果果壳总皂苷的得率先升高后降低。在液料比为20:1~35:1 时,随着液料比不断增加,总皂苷的含量不断升高。这可能是由于溶剂的不断增加,使其在超声波作用下的分散系数和溶解细胞壁能力增强。当液料比达到35:1 时,溶液的溶解度达到最大,总皂苷得率为13 mg/g。当液料比超过35:1 时,总皂苷得率不断下降。这可能是因为随着溶剂的增多,非皂苷类成分的溶出会影响皂苷的提取率。因此,最佳液料比为35:1。

图2 液料比对文冠果果壳总皂苷含量的影响Fig.2 Effect of liquid material ratio on the total saponin yield from husk of X.sorbifolia
2.1.3 超声时间对文冠果果壳总皂苷含量的影响
如图3 所示,随着超声时间的延长,总皂苷的含量不断升高。这可能是由于在一定的时间内,果壳与溶剂能够充分接触,从而使皂苷在超声波的作用下能最大程度地溶出至溶剂中。在超声时间达到35 min 时,总皂苷的含量最高,为11.40 mg/g。但是,超声时间超过35 min,总皂苷的含量会下降。这可能是由于长时间的超声波作用,使溶出的部分皂苷发生降解。因此,最佳超声时间为35 min。

图3 超声时间对文冠果果壳总皂苷含量的影响Fig.3 Effect of ultrasonic time on the total saponin yield from husk of X.sorbifolia
2.1.4 超声功率对文冠果果壳总皂苷含量的影响
如图4 所示,文冠果果壳总皂苷的含量先升高后降低。提取功率为90~198 W 时,总皂苷含量随超声功率的增大而增加,这可能是由于超声波传质能力的加强,不断增强对果壳细胞的粉碎程度,促进皂苷从细胞内溶出。当超声功率超过198 W 时,总皂苷含量又呈下降趋势,从14.45 mg/g 下降至6.36 mg/g。这可能是因为功率增大,导致部分皂苷降解。因此,最佳超声功率为198 W。
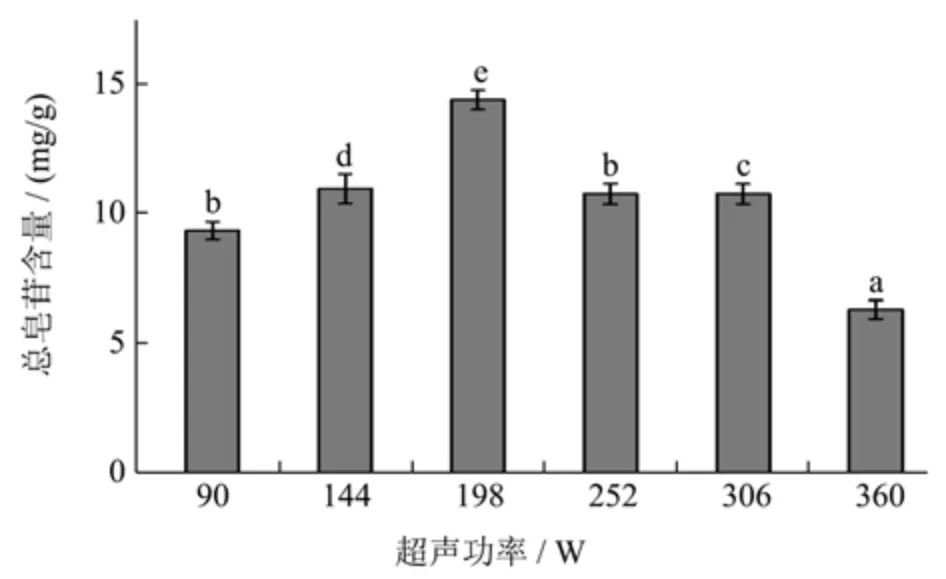
图4 超声功率对文冠果果壳总皂苷含量的影响Fig.4 Effect of ultrasonic power on the total saponin yield from husk of X.sorbifolia
2.1.5 超声温度对文冠果果壳总皂苷含量的影响
如图5 所示,在恒定的超声功率下,超声温度在40~50 ℃时,随着温度的升高总皂苷的得率不断增大,这与文献报道的结果一致,升高温度会提高溶质的溶解度和扩散系数,促使小极性及含量低的皂苷也能溶解于提取溶剂中[20]。在超声温度为50 ℃时,总皂苷得率达到最大值12.02 mg/g。当进一步升高超声温度时,总皂苷含量呈下降趋势。这可能是因为温度过高,改变了传质效率,导致皂苷结构破坏。因此,最佳超声温度为50 ℃。

图5 超声温度对文冠果果壳总皂苷得率的影响Fig.5 Effect of ultrasonic temperature on the total saponin yield from husk of X.sorbifolia
2.2 响应面优化法试验结果
以总皂苷得率为响应值,在单因素试验的基础上,选取液料比(X1)、乙醇体积分数(X2)及超声功率(X3)进行响应面设计,实验设计及结果如表2 所示。
根据Box-Behnken 的中心组合试验设计原理,结合单因素试验结果,采用响应面法对文冠果果壳总皂苷的提取工艺进行优化,以液料比X1、乙醇体积分数X2和超声功率X3为自变量,总皂苷含量(Y)为响应值,得到文冠果果壳总皂苷得率的三因素三水平的结果如表 2 所示。二次多项回归方程为:Y=1.48-0.11X1-0.20X2+0.03X3-0.03X1X2+0.08X1X3-0.09X2X3-0.31X12-0.27X22-0.14X32。
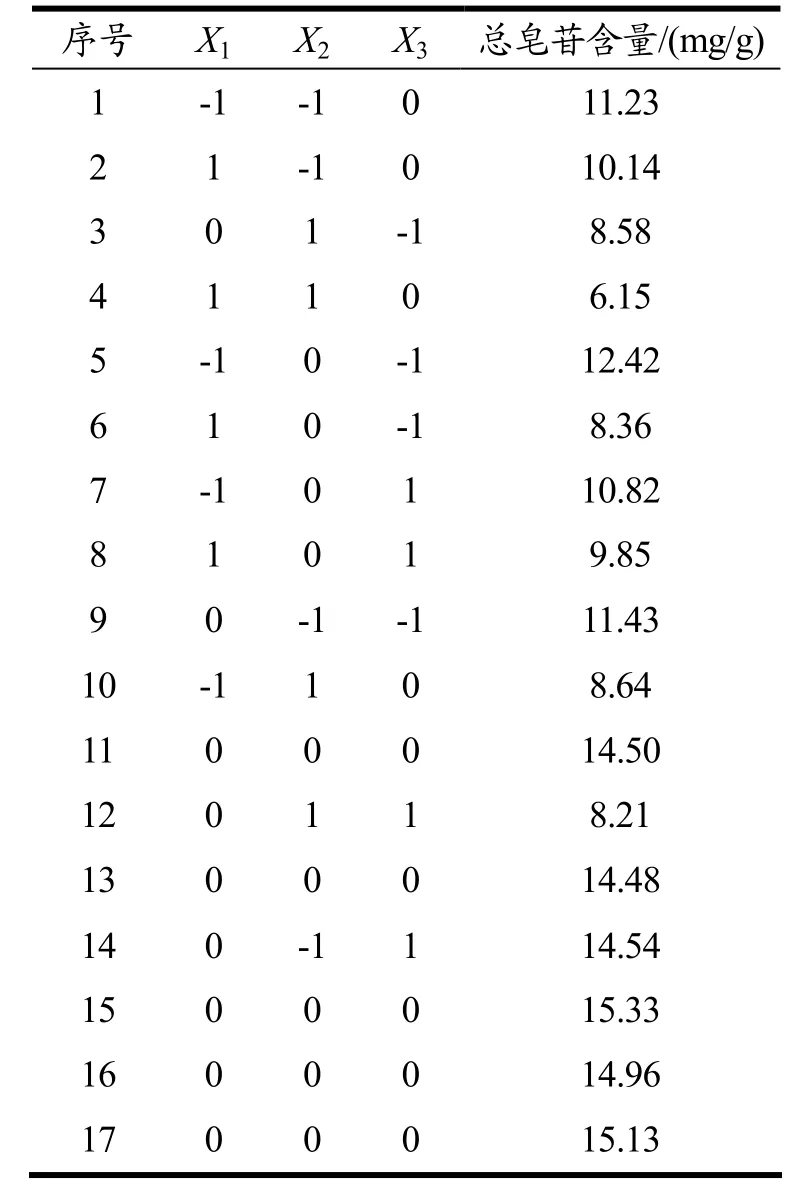
表2 Box-Behnken 试验设计及结果Table 2 Box-Behnken design with experimental results
试验所选用模型F值(40.24)较高,p值较低(<0.000 1),失拟项F值(p=0.662>0.05)不显著,决定系数R2值为0.981 0,校正系数Radj2为0.956 7。说明响应值的变化有98.10%来源于所选变量,该方程的拟合情况较好,可以用来分析和预测文冠果果壳总皂苷得率的工艺参数[21]。通过F值分析,各因素对总皂苷含量的影响依次为乙醇体积分数及提取溶剂(X2)>液料比(X1)>超声功率(X3)。
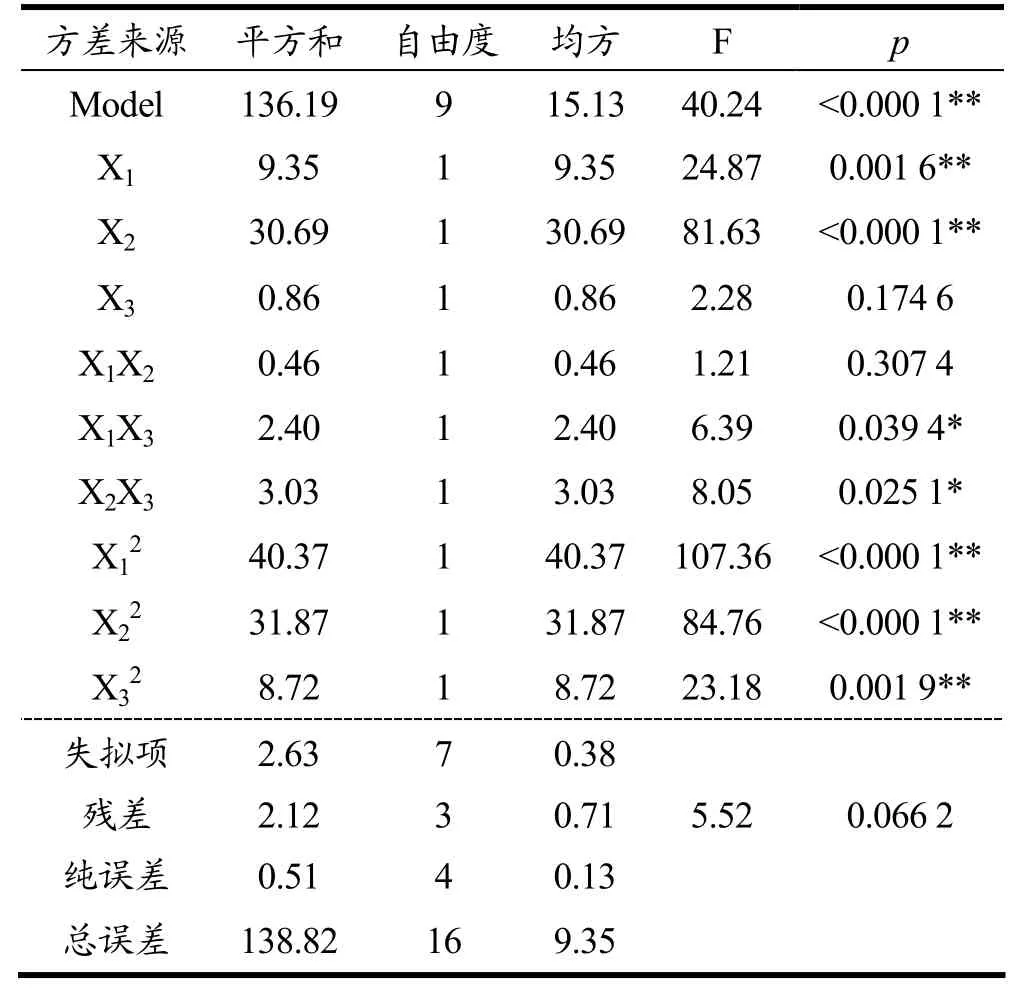
表3 回归方差分析结果Table 3 Analysis of variance for the fitted regression model
由图6a 可知,随液料比和乙醇体积分数的增加,总皂苷含量显示出先增大后减小的趋势。在液料比为35:1(mL/g)左右、乙醇体积分数为70%左右时,总皂苷含量达到最大值。液料比和乙醇体积分数交互作用中坡度较为平坦,等高线图近似圆形,影响不显著。而乙醇体积分数对应的曲线更陡峭,说明乙醇体积分数较液料比对文冠果果壳总皂苷含量影响更显著,这与方差分析结果相符合。由图6b 可知,随着液料比和超声功率的增加,总皂苷含量表现出先增大后减小的趋势。在液料比为35:1(mL/g)左右,超声功率为198 W 左右时,总皂苷含量达到最大值。液料比的曲面变化与超声功率曲面相比,较为陡峭,说明液料比较超声功率对文冠果果壳总皂苷含量影响更显著。从等高线图来看,其等高线图近似椭圆,说明液料比和超声功率对文冠果果壳总皂苷含量影响的交互作用较弱。由图6c 可知,总皂苷含量随乙醇体积分数和超声功率的增大先快速升高到最大值后缓慢下降,在乙醇体积分数为70%左右,超声功率为198 W 左右时,总皂苷含量达到最大限度。乙醇体积分数对应的曲线变化更陡峭,说明乙醇体积分数较超声功率对文冠果果壳总皂苷含量影响更显著。此外,从曲面图和等高线图来看,其等高线图呈明显的椭圆形,说明乙醇体积分数和超声功率之间交互作用较为显著[22]。

图6 两因素交互作用对总皂苷提取量的响应面图和等高线图Fig.6 Response surface and contour plots showing the interactive effects of ethanol concentration,solvent-to-solid ratio,and ultrasonic power on the extraction yield of total saponin from husk of X.sorbifolia
2.3 验证性实验结果
为检验模型预测的准确性,考虑到实际性操作,将最优工艺条件调整为乙醇体积分数65%、液料比35:1(V/m)、超声功率200 W、超声时间35 min,进行验证性实验,得到实际总皂苷的含量为14.95 mg/g,而模型预测的总皂苷含量为15.26 mg/g,证明该方程的准确性和实用性较好[23],具有一定的指导意义。
2.4 不同提取方法的总皂苷得率比较
本实验选取实验室常用的加热回流法及常规超声法,与优化后得到的超声细胞破碎法在同一工艺条件下进行比较。结果表明,加热回流法得到的总皂苷仅为5.95 mg/g,常规超声法得到的总皂苷为10.72 mg/g,超声细胞破碎法得到的总皂苷含量显著高于其他两种常规方法,分别是其2.51 倍和1.39 倍。图7 是电镜下不同提取方法所得文冠果果壳提取粉末的微观结构图。

图7 不同提取方法所得文冠果果壳提取粉末的扫描电镜图Fig.7 SEM of the extracted powder of husk of X.sorbifolia by different extraction methods
如图7a,超声细胞破碎法提取后的文冠果果壳粉末,细胞壁完全破裂,断层及褶皱明显;如图7b,常规超声法提取后的文冠果果壳粉末,其细胞壁虽有破裂,但链接密集度高;如图7c,加热回流法提取后的文冠果果壳粉末,细胞壁基本无破碎现象,细胞链接紧密。由此可见,超声细胞破碎法的提取可以达到对样品中所含物质较为完全的获取,是一种比较高效的活性物质提取方法[24]。
2.5 总皂苷提取物抗氧化活性测定结果
2.5.1 DPPH·清除能力测定结果
按照1.4 的方法进行试验,总皂苷提取物对DPPH·清除能力的影响如图8 所示。DPPH·是具有特征吸收的质子自由基的化合物之一,在接触自由基清除剂后,其吸收明显减少。在与DPPH·相互作用时,抗氧化剂会将一个电子或一个氢原子转移到DPPH·,从而中和它的自由基特性[25]。由图8 可知,总皂苷提取物浓度为0.01~0.05 mg/mL 范围内时,DPPH·清除能力和总皂苷提取物质量浓度呈显著差异(p<0.05)。对比阳性对照Trolox(96.22%),浓度为0.05 mg/mL 时,总皂苷提取物的DPPH·清除能力最强,清除率达到91.35%,其DPPH·清除率IC50值0.02 mg/mL。总皂苷提取物质量浓度为0.04 mg/mL 和0.05 mg/mL 时,两者之间并无显著性。齐国雨等[26]发现文冠果果壳提取物质量浓度为0.75 mg/mL时,对DPPH·清除率达97.25%,这可能是超声细胞破碎法对文冠果果壳粉碎程度高,导致皂苷、多酚及色素等物质的溶出量较大。

图8 文冠果果壳总皂苷提取物DPPH·清除能力的测定结果Fig.8 Determination results of DPPH radical scavenging activity in husk of X.sorbifolia total saponins extraction
2.5.2 ABTS+·清除能力测定结果
按照1.4 的方法进行试验,总皂苷提取物对ABTS+·清除能力的影响如图9 所示。ABTS+·清除能力分析也是一种评价天然产物抗氧化能力最常用的方法之一。由图9 可知,总皂苷提取物质量浓度为0.01~0.05 mg/mL 范围内时,ABTS+·清除能力与总皂苷提取物质量浓度为极显著差异(p<0.01)。ABTS+·清除能力随溶液浓度增加而增强,但都显著低于阳性对照Trolox(99.62%)的清除率。总皂苷提取物浓度为0.05 mg/mL,对ABTS+·最大清除能力为82.63%,其IC50值为0.01 mg/mL,说明超声细胞破碎法得到的提取物中皂苷等有效组分的含量高。托盘根总皂苷提取物浓度为1 mg/mL 时,对ABTS+·清除能率为84.38%,其IC50值为0.28 mg/mL[27]。由此可见,总皂苷提取物质量浓度对ABTS+·的形成具有明显的抑制作用。
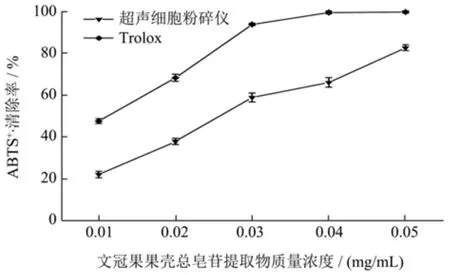
图9 文冠果果壳总皂苷提取物ABTS+·清除能力的测定结果Fig.9 Determination results of ABTS+· scavenging activity in husk of X.sorbifolia total saponins extraction
2.5.3 Fe2+螯合能力测定结果
按照1.4 的方法进行试验,总皂苷提取物对Fe2+螯合能力的影响如图10 所示。金属离子螯合剂可能通过稳定Fe2+来抑制脂质氧化[28]。由图10 可知,总皂苷提取物质量浓度为0.02~0.1 mg/mL 范围内时,Fe2+螯合能力与总皂苷提取物质量浓度为极显著差异(p<0.01)。浓度为0.1 mg/mL,总皂苷的Fe2+螯合能力达到最大值88.01%,其IC50值为0.02 mg/mL,但明显弱于EDTA-2Na(93.62%)的Fe2+螯合能力。韦兴英等[29]发现金属离子的螯合能力与藜麦总皂苷提取物浓度呈正相关。这些结果表明超声细胞破碎法得到的提取物中皂苷分子中含有羟基、羧基,能够起到较强的抗氧化效果[27]。

图10 文冠果果壳总皂苷提取物Fe2+螯合能力的测定结果Fig.10 Determination results of Fe2+ reduction capacity in husk of X.sorbifolia total saponins extraction
2.6 总皂苷提取物抗肿瘤活性测定结果
2.6.1 肝癌HepG2 细胞活力测定结果
肝癌HepG2 细胞活力测定主要对总皂苷提取物作用于HepG2 细胞的细胞形态及细胞存活率进行了分析,如图11 所示。如图11a 所示,从细胞存活率来看,CCK-8 试验结果显示随总皂苷提取物质量浓度的升高,HepG2 细胞存活率逐渐降低,说明总皂苷提取物质量浓度与细胞凋亡呈剂量依赖性。总皂苷提取物质量浓度为100 μg/mL 和120 μg/mL 对HepG2 细胞的存活率为15.63%和10.95%,其作用于24 h 的IC50值为79.30 μg/mL,两者无显著差异。张志宇等[30]发现文冠果种仁对HepG2 细胞处理24 h 后的IC50为9.70 mg/mL,张富禄[31]发现文冠果果壳总总皂苷提取物质量浓度为50 μg/mL 对HepG2 细胞的抑制率达到89.50%。从图11b 结果来看,与对照组相比,HepG2细胞经不同总皂苷提取物浓度处理后,其增殖受到明显的抑制作用。对照组中HepG2 细胞的细胞状态良好,呈规则的圆形,细胞表面整体较为平滑[32,33]。随着总皂苷提取物质量浓度的增加(从20~120 μg/mL),HepG2细胞胞体出现坍塌,体积明显收缩,细胞的数量明显变少。这些结果表明果壳总皂苷提取物能明显抑制HepG2细胞的生长。
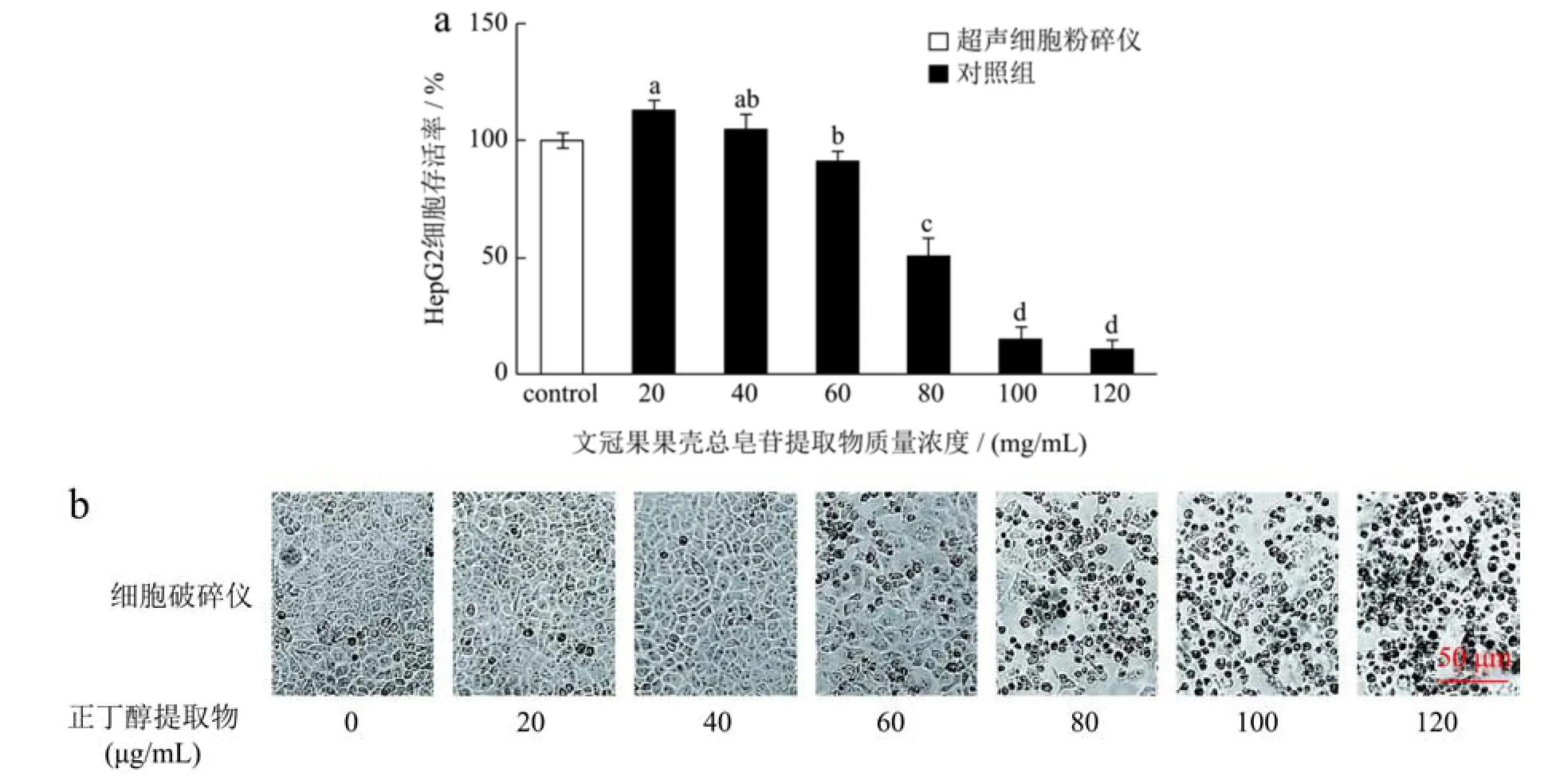
图11 文冠果果壳总皂苷提取物作用于HepG2 细胞的试验结果Fig.11 Test results of husk of X.sorbifolia total saponins extraction acting on HepG2 cells
2.6.2 肺癌A549 细胞活力测定结果
肺癌A549 细胞活力测定主要对总皂苷提取物作用于A549 细胞的细胞形态及细胞存活率进行了分析,如图12所示。如图12a所示,从细胞存活率来看,CCK-8试验结果显示随总皂苷提取物质量浓度升高,细胞存活率整体呈降低趋势,细胞存活率与总皂苷提取物质量浓度呈剂量依赖性。浓度为40 μg/mL~80 μg/mL 时,总皂苷提取物质量浓度对A549 细胞抑制率尤为明显,存活率显著下降。质量浓度为120 μg/mL,细胞存活率达到最低2.04%,其作用于24 h A549 细胞的IC50值为63 μg/mL。人参皂苷Rh2也可明显抑制A549细胞增殖,其作用于24 h A549 细胞的IC50值为46.56 μg/mL[34]。从图12b 显微镜观察结果来看,与对照组相比,A549细胞经不同总皂苷提取物质量浓度处理后,其增殖受到明显的抑制作用。对照组的A549 细胞的细胞形态为典型的上皮细胞样,细胞状态良好,呈立体的梭形,并且形成融合细胞集落[35]。随着总皂苷提取物质量浓度的增加(从20 μg/mL 至120 μg/mL),A549 细胞从细长梭形逐渐皱缩变圆,细胞的数量明显变少。当总皂苷提取物质量浓度达到最大的时候,细胞形态收缩变形,并伴有细胞数目的递减。这些结果表明,果壳总皂苷提取物能明显抑制A549 细胞的增殖[36]。
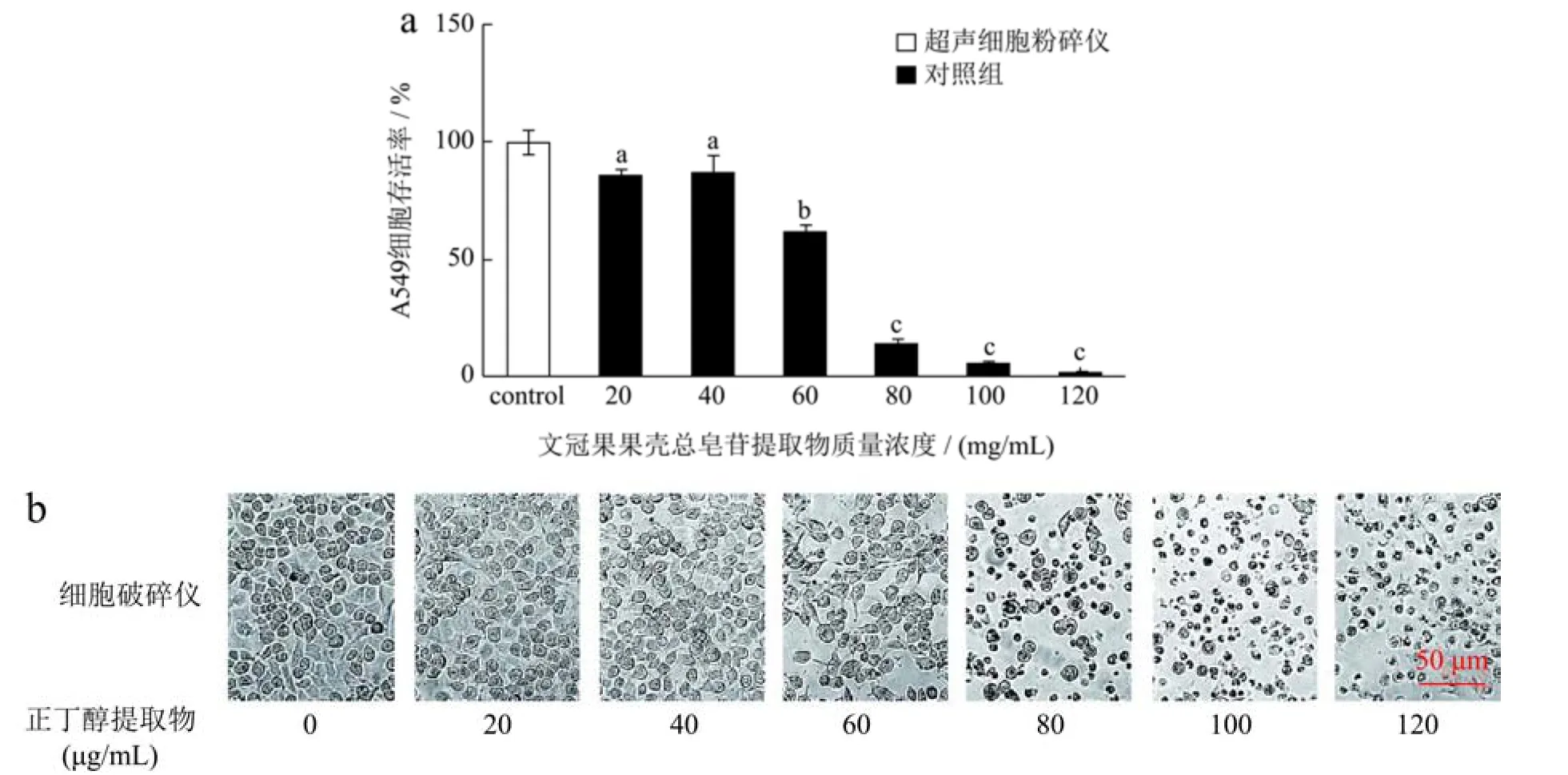
图12 文冠果果壳总皂苷提取物作用于A549 细胞的试验结果Fig.12 Test results of husk of X.sorbifolia total saponins extraction acting on A549 cells
3 结论
本研究采用超声细胞破碎法对文冠果果壳总皂苷进行提取,并在此基础上评价其抗氧化及抗肿瘤效果。结果表明:通过单因素试验及响应面法优化文冠果果壳总皂苷的提取工艺,同时辅以扫描电镜,得到最佳提取工艺:乙醇体积分数65%、液料比35:1(mL/g)、超声功率200 W、超声时间35 min、超声温度为50 °C,在此条件下,含量大小依次为超声细胞破碎法(14.95 mg/g)>常规超声法(10.72 mg/g)>加热回流法(5.95 mg/g);文冠果果壳总皂苷提取物具有良好的DPPH·、ABTS+·清除能力及Fe2+螯合能力,总皂苷提取物质量浓度与ABTS+·清除能力及Fe2+螯合能力均呈极显著差异(p<0.01),与DPPH·清除能力呈显著相关性(p<0.05)。(3)文冠果果壳总皂苷提取物对肝癌HepG2 细胞和肺癌A549 细胞具有一定的抑制效果,总皂苷提取物质量浓度与细胞生长率呈极显著差异(p<0.01)。实验结果表明,超声细胞破碎法是一种高效的从文冠果果壳中获得总皂苷的方法,成功开发了一种从废弃资源中获得具有丰富生物活性成分的提取方法;抗氧化、抗肿瘤实验结果表明文冠果果壳总皂苷提取物具有良好的抗氧化、抗肿瘤活性,具有开发成抗氧化剂和抗肿瘤药物制剂的潜力。本文旨在促进文冠果资源的充分利用及为其深入开发利用提供科学理论依据。
