绿豆蛋白基乳液的稳定性及胃肠消化行为
2023-01-12邓卓瑶韩凯宁杨晓泉
邓卓瑶,韩凯宁,杨晓泉
(华南理工大学食品科学与工程学院,广东广州 510640)
近年来,植物基膳食受到越来越多的关注,特别是针对植物蛋白的相关研究方兴未艾。除了环境可持续、低成本和低致敏性,植物蛋白呈现机体多种代谢的调节作用,如改善改善高胆固醇血症患者的血脂水平[1],适度改善糖尿病患者的血糖水平[2]。荟萃分析发现动物蛋白的摄入量的增加会导致较高的心血管疾病死亡率[3],而增加的植物蛋白摄入量则呈现较低的心血管病死亡率[4]。随着全球对植物蛋白的需求迅速扩大,植物蛋白在新产品中的使用也在增加,常见的如植物基食品和乳品饮料。
乳液被认为是保护和输送营养物质的优良体系,在食品工业中已经有着广泛的应用。由于乳液是一种热力学不稳定系统,需要通过乳化剂在油水界面形成吸附层,产生静电斥力等防止随着时间推移产生的液滴聚结和絮凝等变化[5]。然而一些常用的膳食乳化剂如卡拉胶等被证明可能对人体产生有害的影响,如改变微生物群的组成和促进炎症因子的表达[6]。蛋白质因自身具有两亲性,在两相界面能够自发形成稳定的界面膜提高乳状液的稳定性,又兼有较高的营养价值,是一种优质、安全的天然乳化剂。酪蛋白和乳清蛋白是目前最常使用的蛋白乳化剂[7],大豆蛋白也被广泛研究和使用[8]。绿豆蛋白的氨基酸组成均衡[9],是一种优质的植物蛋白来源。已有的研究表明绿豆蛋白及其消化产物具有机体多种代谢的调节作用,例如降低胆固醇、改善血糖和血脂水平[10],改善非酒精性脂肪肝[11]等。此外,绿豆蛋白可以通过调节宿主的胆酸代谢,从而改善脂质代谢紊乱和调节肠道微生物的组成[12]。然而,关于绿豆蛋白在乳液中的应用研究相对较少,仍需对其结构与功能性质进行更多系统的研究以拓宽其应用空间。
为了拓展绿豆蛋白在乳液体系中的应用,本研究以大豆蛋白为对照,系统探究了热处理前后绿豆蛋白结构、表面疏水性、油水界面的吸附行为,以及绿豆蛋白稳定的油水乳液的稳定性和胃肠消化行为的变化。
1 材料与方法
1.1 材料与试剂
生绿豆购于广州天河农贸市场;脱脂大豆粕购于山东御馨生物科技有限公司;猪胃蛋白酶(P7012)、胰液素(P1750)均购于西格玛公司;胆盐(B875069)购于麦克林生化科技有限公司;蛋白Marker(11-180 ku)、上样缓冲液(含DTT)和PAGE 胶促凝剂均购于索莱宝生物科技有限公司;其他试剂均为分析纯。
1.2 主要仪器设备
DELTA 冷冻干燥机,德国Christ 公司;DSC 差示量热扫描仪,瑞士Mettler Toledo 公司;OCA-20 光学接触角仪,德国GmbH 公司;F7000 荧光分光光度计,日本Hitachi 公司;Nano-ZS 纳米粒度分析仪,英国Malvern 公司;T25 高速剪切机,德国IKA 公司;M-110EH 高压微射流纳米均质机,美国Microfluidics公司;LUMiSizer 稳定分析仪,德国GmbH 公司;垂直电泳仪,美国BIO-RAD 公司。
1.3 方法
1.3.1 蛋白的分离制备
绿豆分离蛋白(MBI)的提取参考Budseekoad等[13]的方法并稍作修改。去皮绿豆粉碎后过200 目筛得到绿豆粉,绿豆粉以1:10 的料液比分散在去离子水中,用2 mol/L NaOH 调节pH 值至10.0,于室温下搅拌2 h,离心(8 000 r/min×30 min×25 ℃),取上清液。用2 mol/L HCl 调节上清液的pH 值至4.5,离心(8 000 r/min ×30 min×25 ℃),得到沉淀。沉淀用去离子水洗3 次后以6 倍水复溶,调节pH 值至7.0,在4 ℃冰箱中透析48 h,冻干获得绿豆蛋白。
大豆分离蛋白(SPI)以脱脂大豆粕为原料,通过王金梅[14]的方法稍作修改提取获得。豆粕以1:10 的料液比分散在去离子水中,用2 mol/L NaOH 调节pH 值至9.0,室温下搅拌2 h,离心(8 000 r/min×30 min×25 ℃),取上清液,调节清液的pH 值为4.5,再次离心。沉淀用去离子水洗3 次后以6 倍体积的水复溶,4 ℃下透析48 h,冷冻干燥。
经杜马斯燃烧法测定制备的绿豆分离蛋白和大豆分离蛋白的蛋白含量分别为90.69%和91.07%。
1.3.2 热变性蛋白的制备
冻干后的MBI 和SPI 分别分散在去离子水中,配制成浓度为5%的蛋白溶液。于高压灭菌锅中120 ℃加热20 min,取出溶液冷却至室温,使用冷冻干燥机冻干后得到热变性绿豆蛋白(DMBI)和热变性大豆蛋白(DSPI)粉末,将粉末置于干燥柜中以待后续使用。
1.3.3 差示量热扫描(DSC)
样品的热流特征图像由差示量热扫描仪扫描获得,方法参照Mohammadian 等[15]并有修改,加热速率为5 ℃/min,加热范围为25~110 ℃。分别称量2.5 mg的MBI、DMBI、SPI 和DSPI 蛋白粉末于铝盘中,加入10 μL 磷酸盐缓冲液(10 mmol/L,pH 值7.0)密封铝盘。测试时用一个空铝盘作为对照。手动设定吸热峰的起点和终点,利用DSC 软件计算变性焓(ΔH)和变性温度(Td)。
1.3.4 界面张力
利用光学接触角仪记录表面张力的时间变化,监测蛋白质在葵花籽油-水界面处的动态表面性质。实验在25 ℃下进行,将注射器顶端没入装有纯化葵花籽油的玻璃皿中,注射器推出体积为10 μL 的蛋白溶液(0.1%蛋白浓度),保持2 h,在油水界面实现蛋白质吸附。表面压力数值通过杨氏模量方程计π=γ0-γt算得到,其中π为界面压力,γ0为蒸馏水的界面张力,γt为受试样品随时间变化的界面张力。蛋白质在油水处的吸附过程可简单分为三个阶段。分别是体系中蛋白质向油水界面的迁移,附着在界面上的蛋白质的展开以及被吸附的蛋白质的重排形成更有利的构象[16]。
在第一阶段,蛋白质的迁移受扩散控制,迁移过程中不存在吸附能垒。当界面压力较低时,界面压力随时间的变化可以用公式(1)描述[17]:

式中:
C0——体相浓度,mg/mL;
K——玻尔兹曼常数;
T——绝对温度,K;
D——扩散系数;
t——时间,s。
当吸附过程中扩散是决定因素时,π关于t1/2的拟合曲线呈现出良好的线性,曲线的斜率为扩散速率(kdiff)。
蛋白质迁移到界面后,吸附过程的二、三阶段即蛋白在界面处展开和重排的速率可以通过公式(2)来模拟[18]:
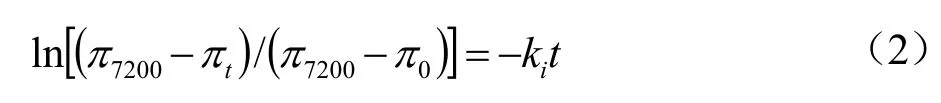
式中:
π0、πt、π7200——分别为实验开始时刻、任意时刻和最终吸附时刻的界面压力。
ln[(π7200-πt)/(π7200-π0)] =-kit随时间的变化会呈现出两个线性区域。第一个斜率对应蛋白质展开的速率常数(ku),第二个斜率表示蛋白质重排的速率常数(kr)。
1.3.5 表面疏水性
通过ANS 探针法测定蛋白质的表面疏水性[19]。蛋白质溶液用磷酸缓冲液(10 mmol/L,pH 值7.0)分别稀释为0.05、0.1、0.15、0.2 及0.25 mg/mL。取4 mL蛋白溶液与50 μL 8 mmol/L ANS 溶液(溶于10 mmol/L PBS,pH 值7.0)混合,置于比色皿中。荧光测定条件为:激发波长为390 nm,发射波长为470 nm,狭缝宽度为5 nm。荧光强度与蛋白浓度线性回归曲线的斜率表示蛋白表面疏水性(S0)。
1.3.6 乳液的制备
分别将MBI、DMBI、SPI 或DSPI 分散于去离子水中配制成质量分数为2%或6%的蛋白溶液,缓慢搅拌2 h,在4 ℃中静置过夜。乳液的制备方法参考Xu等[20]并稍作修改。将蛋白质分散液与葵花籽油混合,油相含量为15%(m/m),用均质器均质2 min 进行预乳化,随后通过高压微射流在50 MPa 下均质三次。加入质量分数0.02%叠氮化钠作为抑菌剂。
1.3.7 乳液的热稳定性
将新制备的乳液转移到密封的玻璃瓶中,在121 ℃下加热15 min,待加热后的乳液后冷却至室温。对加热前后乳液的平均粒径进行测定,乳液的热稳定性通过乳液粒径的变化表示。乳液的粒径通过Nano-ZS 纳米粒度分析仪测量,测量前用10 mmol/L 磷酸缓冲液适当稀释乳液以避免多次散射造成的影响,所有的测试在25 ℃下进行三次。
1.3.8 乳液的贮藏稳定性
通过测量室温下密封保存的乳液在第1、7、14、21、30 天的粒径变化观察乳液的储存稳定性。
1.3.9 乳液的物理稳定性
蛋白质乳液的物理稳定性通过LUMiSizer 进行评估。测量的仪器参数为:转速2 828 r/min,实验时间250 min,温度25 ℃,扫描间隔时间15 s。
1.3.10 体外模拟胃肠消化
采用两步体外静态消化模型[21]评价2%的蛋白质乳状液的消化情况。乳液在37 ℃下保温后与模拟胃液(SGF)混合,消化液中需加入2 000 U/mL 猪胃蛋白酶及0.075 mmol/L CaCl2,使用1 mol/L HCl 调节混合物的pH 值至3.0,最终使乳液与SGF 的比例为1:1(V/V)。将消化液置于37 ℃水浴中,缓慢搅拌2 h。
用2 mol/L NaOH 将消化物调至pH 值7.0,与模拟肠液(SIF)混合,混合物中加入胆盐至最终浓度为10 mmol/L,CaCl2浓度为0.3 mmol/L,加入胰液素使最终浓度为100 U/mL,最终的消化物与SIF 比例为1:1(V/V)。用2 mol/L NaOH 重新调节pH 至7.0,37 ℃搅拌2 h。结束消化时将混合物在90 ℃下加热10 min。分别取乳液在胃消化过程中0、10、30、120 min 和肠消化过程中1、10、30、120 min 的样品用作后续分析。
1.3.1 0.1 激光共聚焦显微镜观察(CLSM)
通过激光共聚焦扫描显微镜观察消化程中乳液微观结构的变化。分别将初始乳液和胃消化、肠消化过程中的样品与0.1%(m/V)尼罗红混合,以染色脂质相。用63×油镜观察,激发波长为488 nm,吸收波长为510~610 nm。
1.3.1 0.2 SDS-PAGE 凝胶电泳
以未经消化的蛋白质乳液为对照,按照Chen 等[22]的方法对模拟胃、肠道消化过程中不同时间所取的样品进行SDS-PAGE 分析。SDS-PAGE 在不连续缓冲系统上进行,使用4%的浓缩胶和12%的分离凝胶。将不同样品与含上样缓冲液混合,90 ℃加热10 min。电泳凝胶每孔加入10 μL 样品。电泳进行条件为60 V 电压持续运行30 min 后以120 V 电压运行至结束。电泳胶片使用考马斯亮蓝R-250 染色后,用含20%无水乙醇和8%醋酸的脱色溶液脱色过夜。
1.3.11 数据分析处理
所有样品测定均进行三次独立重复实验,利用SPSS 22.0 软件进行独立样本t检验比较两组样本间的显著性差异(p<0.05),采用单因素方差分析(AVOVA)结合Duncan 多种检验比较多样本间的显著性差异(p<0.05)。
2 结果与讨论
2.1 蛋白质的热力学性质
DSC 可以揭示蛋白质的结构构象变化,图1 中所示包括蛋白质的变性温度(Td)和焓变(ΔH)。MBI有一个主要的吸热峰,Td为85.38 ℃,这可能是MBI 中的8S球蛋白的热变性所致。8S球蛋白的ΔH为10.82 J/g。DSC测量的结果与Tang等[23]之前的研究结果相似。SPI有两个主要的吸热峰,分别对应SPI 中有两个主要的球蛋白的热变性,7S 蛋白变性温度较低,在较高温度下,11S 蛋白发生变性。第一个峰值出现在76.90 ℃,第二个峰值出现在93.54 ℃,变性焓分别为1.14 J/g 和5.11 J/g,这与Wang 等[24]的研究结果一致。变性温度与蛋白质的热稳定性有关,对于球状蛋白质来说,较高的Td值通常代表着较高的热稳定性,而焓变通常与蛋白质结构的紧密性相关[24]。在DMBI 和DSPI 的特征图中未观察到吸热峰,即120 ℃的热处理使绿豆分离蛋白和大豆分离蛋白彻底变性,改变了蛋白质的结构。
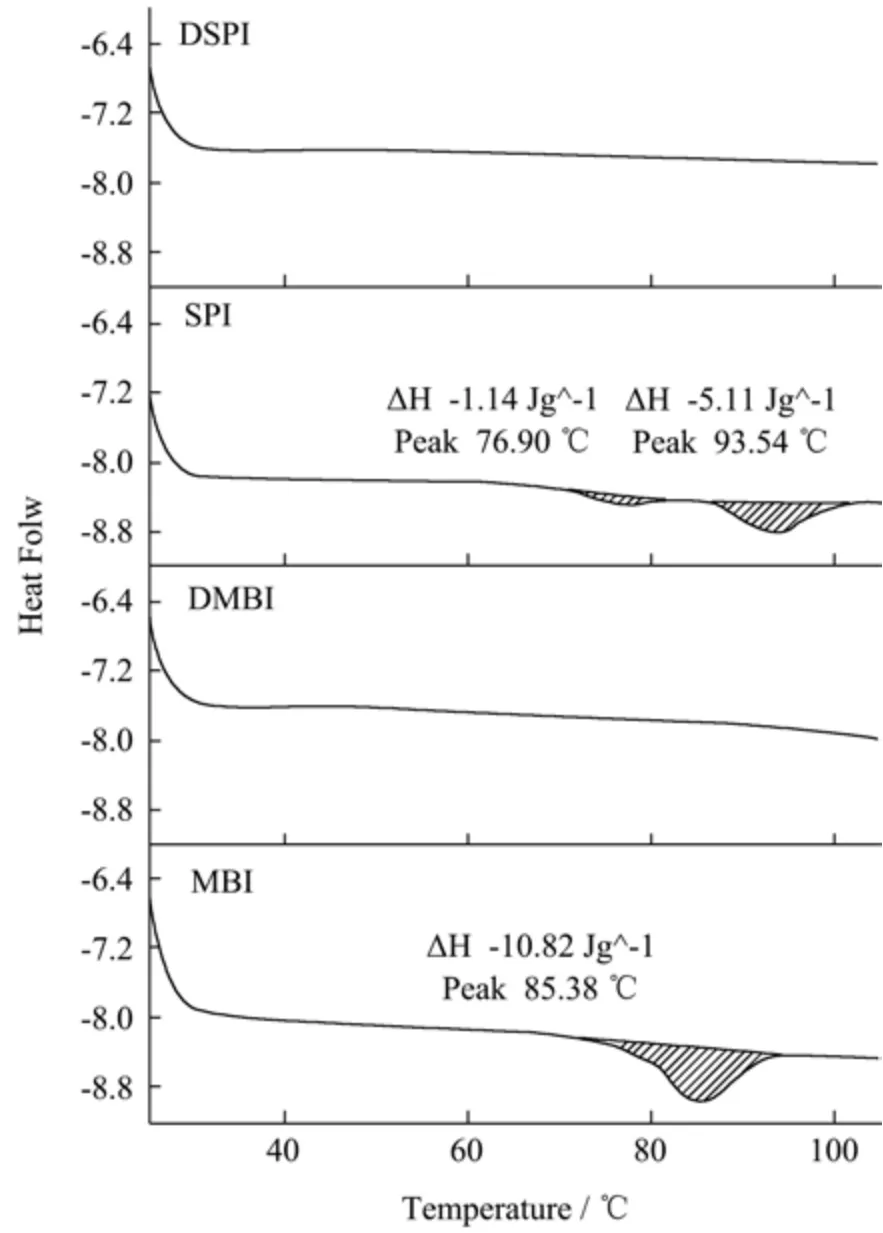
图1 MBI、MBI、SPI 和DSPI 的热流曲线Fig.1 Heat flow curves of MBI,DMBI,SPI and DSPI
2.2 蛋白质的界面性质
图2 所示为不同蛋白的界面压力(π)随时间的变化。所有蛋白质的界面压力随吸附时间的增加而增大,π的增长速率随着时间的推移而降低,这一现象是由于界面蛋白质已饱和,进一步吸附的静电能垒增加[25]。蛋白质在较短的时间内的吸附过程是由蛋白质从原本的体相向界面扩散控制的。无论是绿豆分离蛋白或大豆分离蛋白,在经120 ℃热处理后的蛋白质的吸附动力学都与天然蛋白质相似,而DMBI 的kdiff(0.45)和DSPI 的kdiff(0.43)相对MBI(0.33)与SPI(0.34)增加,表明加热后的蛋白质具有柔性构象和较高的表面活性。在王金梅[14]的研究中得到了相似的吸附曲线,并提出蛋白质去折叠引起的疏水基团暴露可以减小吸附的能垒,并改善蛋白质在油水界面吸附的效率。
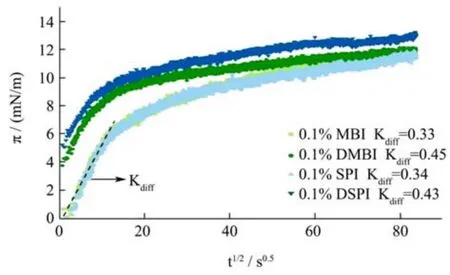
图2 经热处理与非热处理的蛋白稳定的油水界面的界面压力(π)与时间(s1/2)的关系Fig.2 Interfacial pressure (π) as a function of time (s1/2) for non or heat-treated protein stabilized O/W interfaces
在最开始的迁移阶段过去后,吸附在界面上的蛋白质的渗透、展开和构象重排产生能垒,使吸附速率逐渐降低。常数ku和kr可以反映蛋白在界面上的渗透速率、展开速率和构象重排速率。在本实验中,MBI 的ku(4.50E-4)和kr(11.90E-4)值高于DMBI(3.11E-4 和6.89E-4)(图3),说明在界面上天然的蛋白能够更有效地渗透和重排,这可能与热处理引起了蛋白质的聚集有关。蛋白质聚集态比自然折叠态具有更低的自由能,且热力学更稳定[16]。
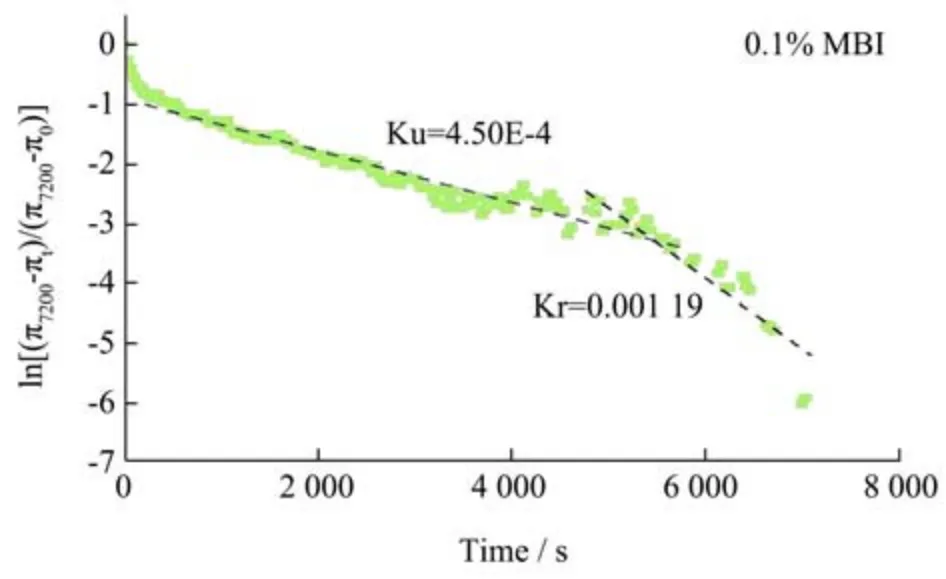

图3 蛋白质在油水界面展开和重排的一级速率常数拟合Fig.3 Fit of first-order rate constants of unfolding (ku) and rearrangement (kr) for protein at O/W interfaces
2.3 表面疏水性
表面疏水性是蛋白质重要的表面性质之一,这一特性反应了蛋白质结构变化引起的表面疏水基团分布的变化。从实验结果中可以观察到,对于天然的未变性的蛋白样品,SPI 的表面疏水性(5 750.35)高于MBI(4 870.80)。经过120 ℃,20 min 的热处理后,两种蛋白的表面疏水性都显著提高,经热处理后,蛋白质的结构展开,球状蛋白内部更疏水的部分暴露[14]。表面疏水性与蛋白质的乳化性能密切相关,换言之,热处理后的绿豆分离蛋白和大豆分离蛋白变现出了更高的乳化潜力。Tang 等[26]和Zhong 等[27]都观察到了类似的实验结果,即绿豆分离蛋白经高温热处理后疏水性显著提升。经热处理后DMBI 的表面疏水性(9 482.50)相比未处理前MBI 的疏水性提高94.68%,经热处理后DSPI 的表面疏水性(7 983.35)相比SPI 提高38.83%。这可能反应了不同蛋白质结构构象的差异,MBI 更容易发生变性或随后的聚集。
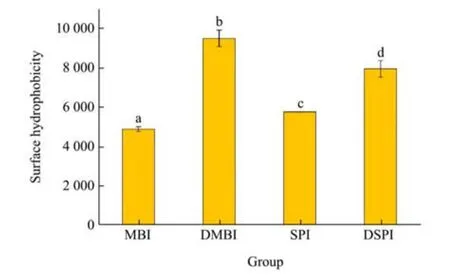
图4 不同蛋白样品的的表面疏水性Fig.4 Surface hydrophobicity of different proteins
2.4 乳液的粒径
2.4.1 乳液的初始粒径
图5 显示了几种新鲜乳液的粒径分布,蛋白质加热后乳化性能得到提升,使用加热后的蛋白质作为乳化剂都能使乳液的粒径降低,蛋白浓度高的乳液比蛋白浓度低的乳液具有更小的粒径,这是因为更多的蛋白质吸附在小油滴的表面,形成了具有更强的内聚力、抗断裂能力更强的界面膜[20]。对比低浓度的MBI(498.55nm)和DMBI(372.46 nm)乳液粒径分布可以发现,热变性后的绿豆分离蛋白作为乳化剂不仅可以使乳液的液滴尺寸减小,还能改善蛋白乳液的分散性。这是热处理后天然蛋白质中隐藏的疏水氨基酸暴露出来的结果,表面疏水性的增加与界面张力的快速下降有关,这促进了液滴的破碎和液滴尺寸的减小[28]。

图5 不同浓度的蛋白(a)2%和(b)6%稳定的乳液的初始粒径分布Fig.5 Initial particle size distribution of protein-stabilized emulsions at different concentrations (a) 2% and (b) 6%
2.4.2 乳液的热稳定性
乳液经121 ℃,15 min 的灭菌后粒径的变化显示在图6 中,当乳液中蛋白浓度为2%时,加热使MBI乳液的粒径显著上升(加热前为484.00 nm 加热后为599.80 nm),用DMBI、SPI 和DSPI 稳定的乳液粒径没有明显的增加,当乳液中蛋白浓度为6%时,乳液经热处理后粒径皆增大,其中DMBI 显示出对乳液更好的稳定效果,加热前后的粒径分别为263.93 nm 和293.17 nm,而SPI 和DSPI 稳定的乳液在灭菌后粒径存在显著性差异。在高蛋白浓度的乳液中,除了吸附在油水界面上的蛋白质,还有一部分分散在连续项中非吸附蛋白质。非吸附蛋白质在加热时展开并相互作用,产生蛋白质聚集体,进而对乳液的颗粒尺寸分布产生影响[29]。在Ma 等[28]的研究中观察到相似的实验结果,与1%~4%的大豆蛋白稳定的乳液相比,蛋白质浓度为8%的乳液在加热后粒径变化更大。
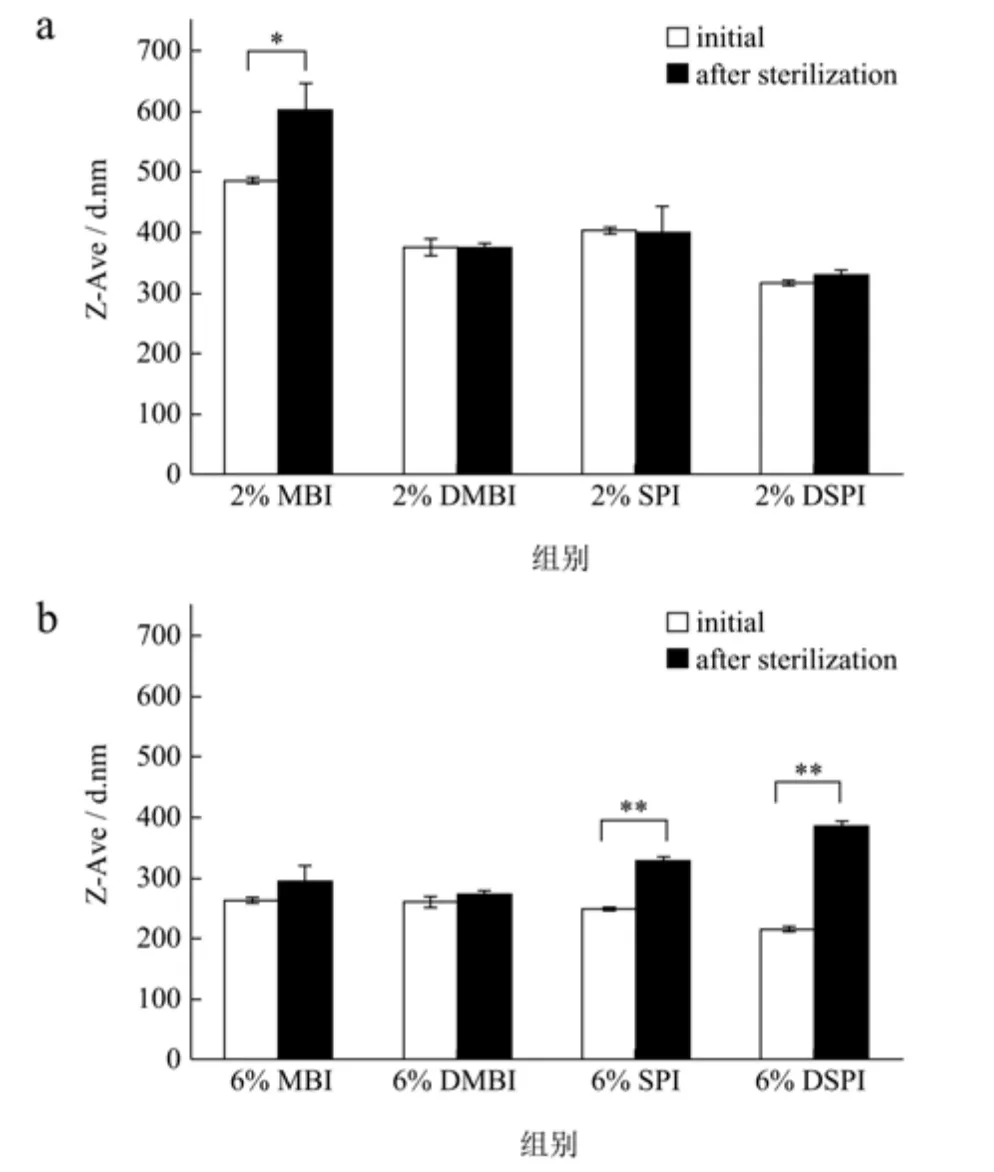
图6 高温灭菌后乳液的粒径变化Fig.6 Particle size change of emulsion after high temperature sterilization
2.4.3 乳液的贮藏稳定性
观察在25 ℃贮藏条件下的乳液的粒径随时间的变化,乳液的粒径在总体上随贮藏时间的增加而增大,在低浓度的蛋白乳液中,MBI 和DMBI 稳定的乳液在检测期内粒径增幅更大,分别增加至636.10 nm 和491.93 nm,可能是因为它们的初始粒径更大,而小液滴有助于减缓重力分离,降低乳液絮凝的速率[30]。在高蛋白浓度的乳液中,MBI 稳定的乳液粒径显著增加,第30 天的粒径为1 011.60 nm,可能是由于稳定小液滴的绿豆蛋白在储存过程中从液滴界面解吸到水相中,水相中的蛋白浓度增加后通过疏水相互作用结合形成更大的聚集体,导致液滴絮凝[31]。经热处理后的绿豆分离蛋白稳定的油水乳液的贮藏稳定性与未处理前相比显著上升。
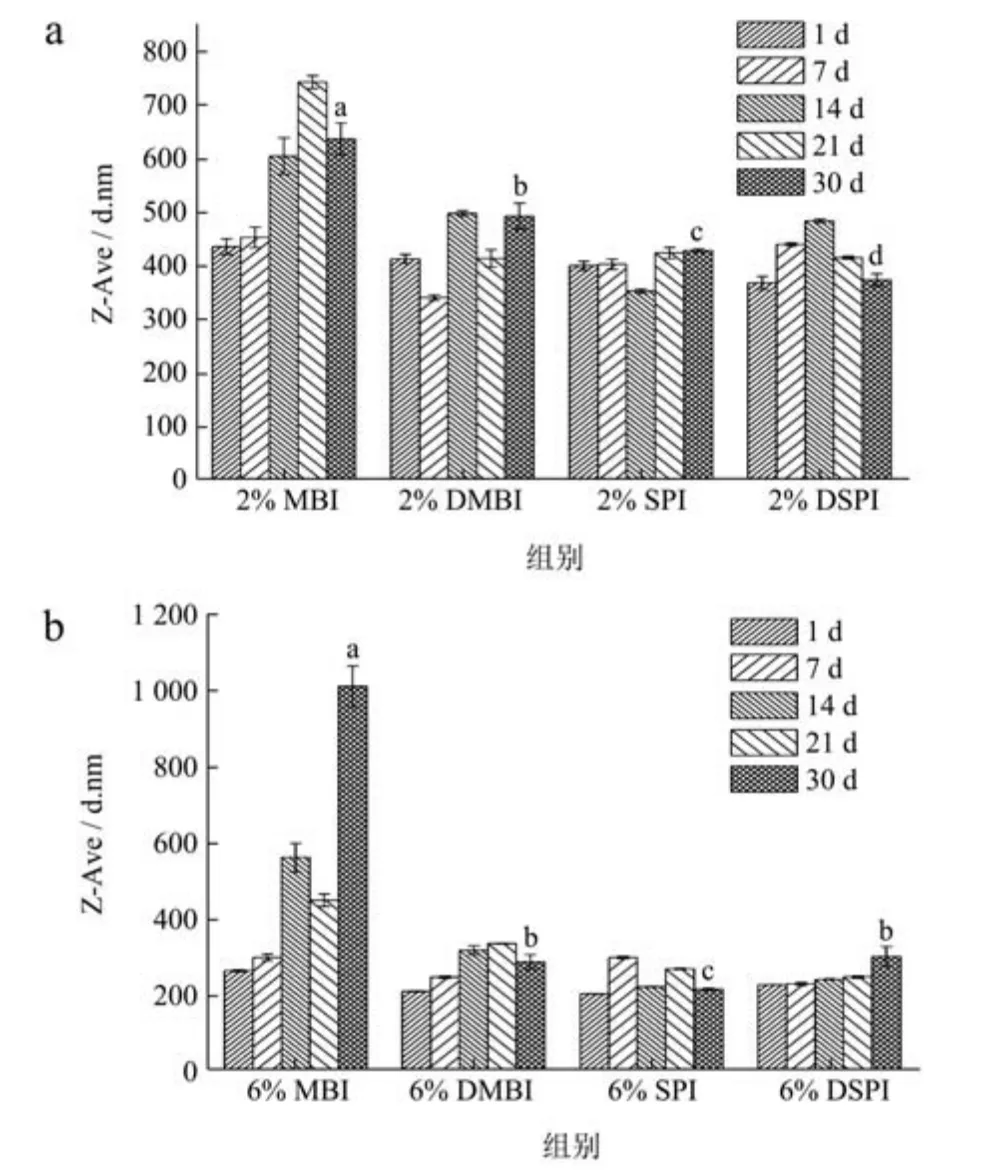
图7 乳液粒径随时间的变化Fig.7 Variation of emulsion particle size with time
2.5 乳液的物理稳定性
利用LUMiSizer 光分析离心机对不同蛋白样品和不同蛋白浓度稳定的乳液进行长期分散稳定性的评估,图8 是不同乳液样品在测试过程中的时-空分辨消光剖面图,透射曲线反应了离心过程中样品内蛋白的沉降速率,透射曲线随离心时间变化越大则说明样品的分散稳定性越差[32]。
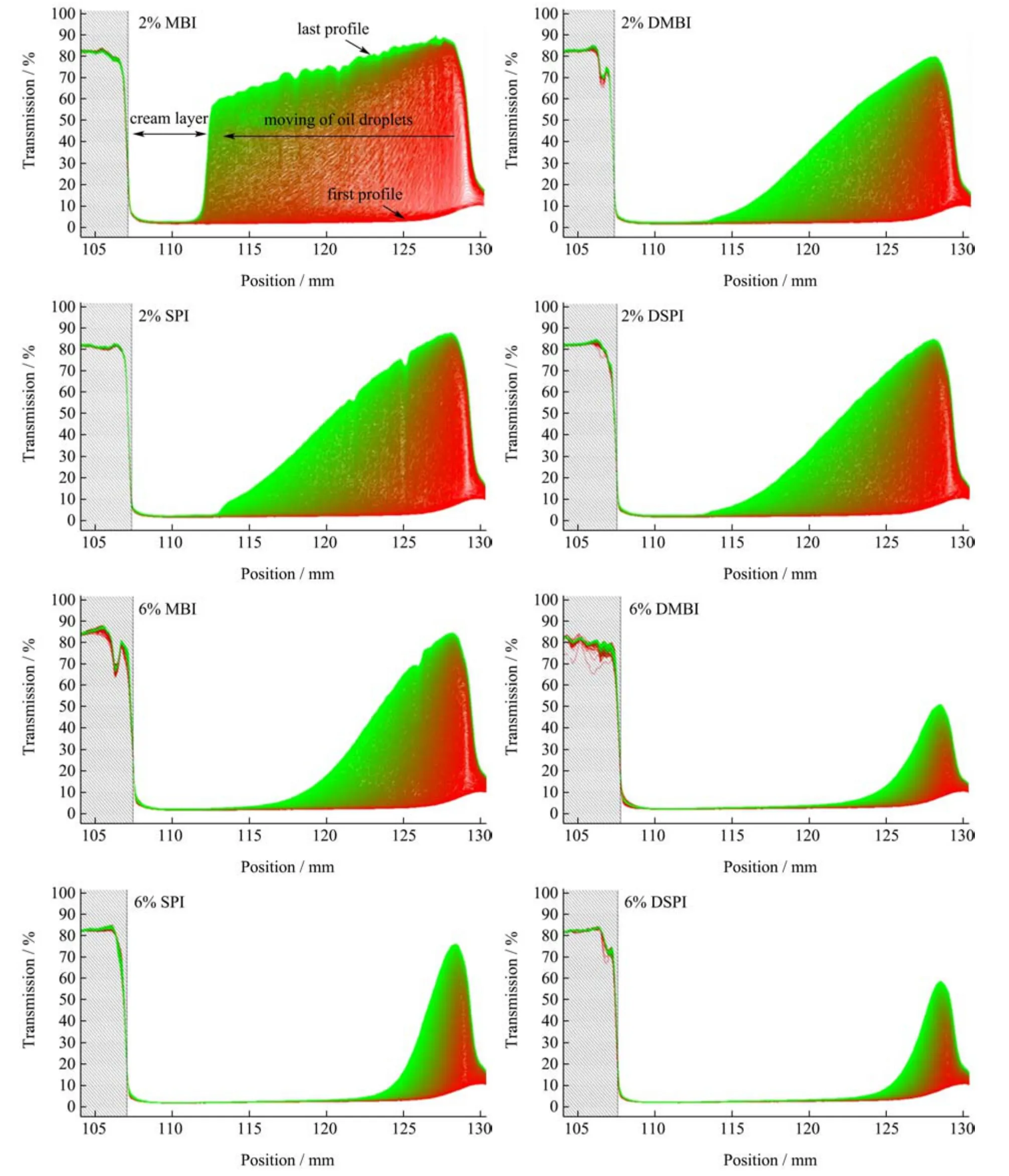
图8 不同蛋白样品稳定的乳液的透射剖面图演变Fig.8 Evolution of transmission profiles of emulsions stabilized by different protein samples
观察各个乳液样品对应的谱线图可以发现随时间推移,顶部的透射曲线逐渐增大,说明乳液从底部向上产生乳析,在离心过程中乳状液分层。观察下图中不同蛋白稳定的乳液样品的透射谱演变可以明显看出2% MBI 稳定的蛋白乳液稳定性最差,乳析现象严重,乳液中的油滴几乎集中在试管的顶部,而同一浓度下DMBI、SPI 和DSPI 稳定的乳液都显示出更好的稳定性。当乳液中的蛋白浓度提高到6%,所有乳液样品的物理稳定性提升,MBI 稳定的乳液仍有明显的乳析现象,而DMBI 和DSPI 乳液仅在底部出现微量的乳析。这可以与前面乳液在储存期间粒径的变化对照,6%的DMBI、SPI、DSPI 乳液在储存期间粒径变化较小,蛋白质的聚集程度降低从而体现了较高的稳定性。
2.6 乳液的胃肠消化行为
2.6.1 SDS-PAGE 凝胶电泳
通过SDS-PAGE 凝胶电泳分析乳液中的蛋白质在消化过程中的水解情况。在蛋白质开始水解之前即胃消化的零时刻,MBI 的主要组分8S 球蛋白和SPI 的主要蛋白质组分7S 蛋白和11S 蛋白都能被清晰地识别出来,而经过热处理的蛋白质DMBI 和DSPI 对应组分的条带强度降低,这表明热处理破坏了蛋白质部分亚基结构。
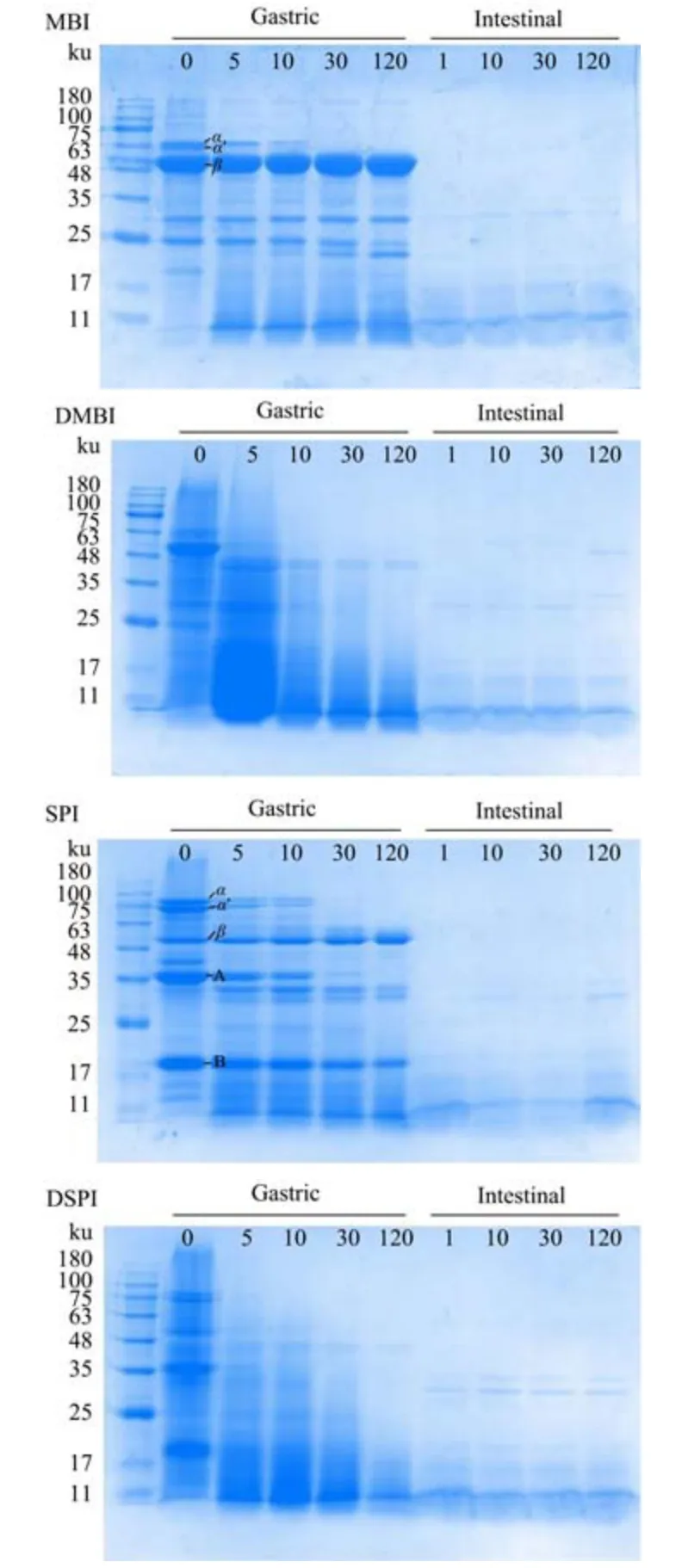
图9 乳液中蛋白质在消化过程中的SDS-PAGE 图谱Fig.9 SDS-PAGE analysis of proteins in emulsions during digestion
MBI 乳液的电泳结果中大分子量的条带随时间增加逐渐水解变浅,分子量小于20 ku 的肽段增加,其中8S蛋白的α亚基和α′亚基在胃消化阶段的前30 min 内逐渐水解消失,而β亚基则在胃消化过程中表现出较强的抗消化性。与之相似的是SPI 中7S 蛋白的水解过程,此外SPI 中的另一主要组分11S 蛋白中的酸性亚基A 也在胃消化的前段被逐渐水解,而碱性亚基B 在胃消化结束时仍有明显的条带,这些条带表现出的消化特性与周志红等[33]的实验结果一致,即β亚基最不容易被胃蛋白消化,亚基A 相比亚基B 更容易被胃蛋白酶消化。
可以看出蛋白质经过热处理后消化性得到明显改善,在胃消化过程中能被胃蛋白酶快速水解。经加热蛋白质的天然有序的折叠结构被展开,可以增强胃蛋白酶作用所需的特定肽键的可及性[34,35]。在Tang 等[36]的实验中同样发现100 ℃的热处理能促进蛋白水解成更多的小片段肽。进入到肠消化阶段,不同蛋白乳液中的蛋白片段被快速水解,产生小分子量的肽段,有研究报道[37]在此过程中胆盐可能取代界面上的肽成为乳化剂,使肽段转移至溶液中增加与酶的接触从而加速蛋白质的水解。
2.6.2 乳液的微观结构
消化过程中液滴的界面组成发生变化可能会导致乳液的聚集和絮凝,使乳液的粒径增大。未经消化的乳液液滴尺度细小且分布均匀,MBI 稳定的乳液在胃消化中迅速聚集形成大的油滴,而后在整个胃消化的过程中油滴的尺度逐渐减小。DMBI 和DSPI 稳定的乳液展示出相似的现象即在胃消化过程中逐渐发生聚集,由前面电泳观察到的结果可知,此时蛋白质正被快速水解,并不足以维持液滴界面的稳定。由于蛋白质的构象不同且对疏水和亲水环境具有不同亲和力的区域,胃蛋白酶对不同蛋白质的水解能力也有差别,无序的蛋白质能被胃蛋白酶快速水解,而具有高度折叠构象的蛋白质在天然状态下对胃消化具有一定的抵抗力[38,39]。而SPI 稳定的乳液在胃消化过程中并没有聚集形成大的油滴,这似乎表明SPI 在实验中具有更明显的抵抗胃消化的特性,而这与Bellesi 等[40]研究中发现的大豆蛋白稳定的乳液在胃消化过程中粒径增加的结果不一致。但另有研究报道称SPI 在胃消化过程中聚集而不是形成大油滴,消化后的SPI 肽能够维持较低的表面张力,但不能维持粒子间结合的空间位阻或静电屏障[22]。
进入肠消化后,四种蛋白乳液均被快速水解分散成小的油滴。在模拟肠消化中pH 值的增加导致蛋白质电荷反转,也可能会影响蛋白质稳定油滴的静电相互作用。在此相中,吸附在界面上或存在于体系中未吸附的蛋白质和肽段被进一步水解成更小的肽或氨基酸。与此同时消化液中存在的胆盐具有高表面活性,残留在液滴表面的蛋白质或蛋白肽有可能被胆盐置换。有研究称胆盐可使脂质水解产物在水相中再次乳化,防止其在界面上聚集,并进一步促进水解[37]。因此,大量被胆盐稳定的小囊泡会降低肠消化期油滴的总体平均粒径。
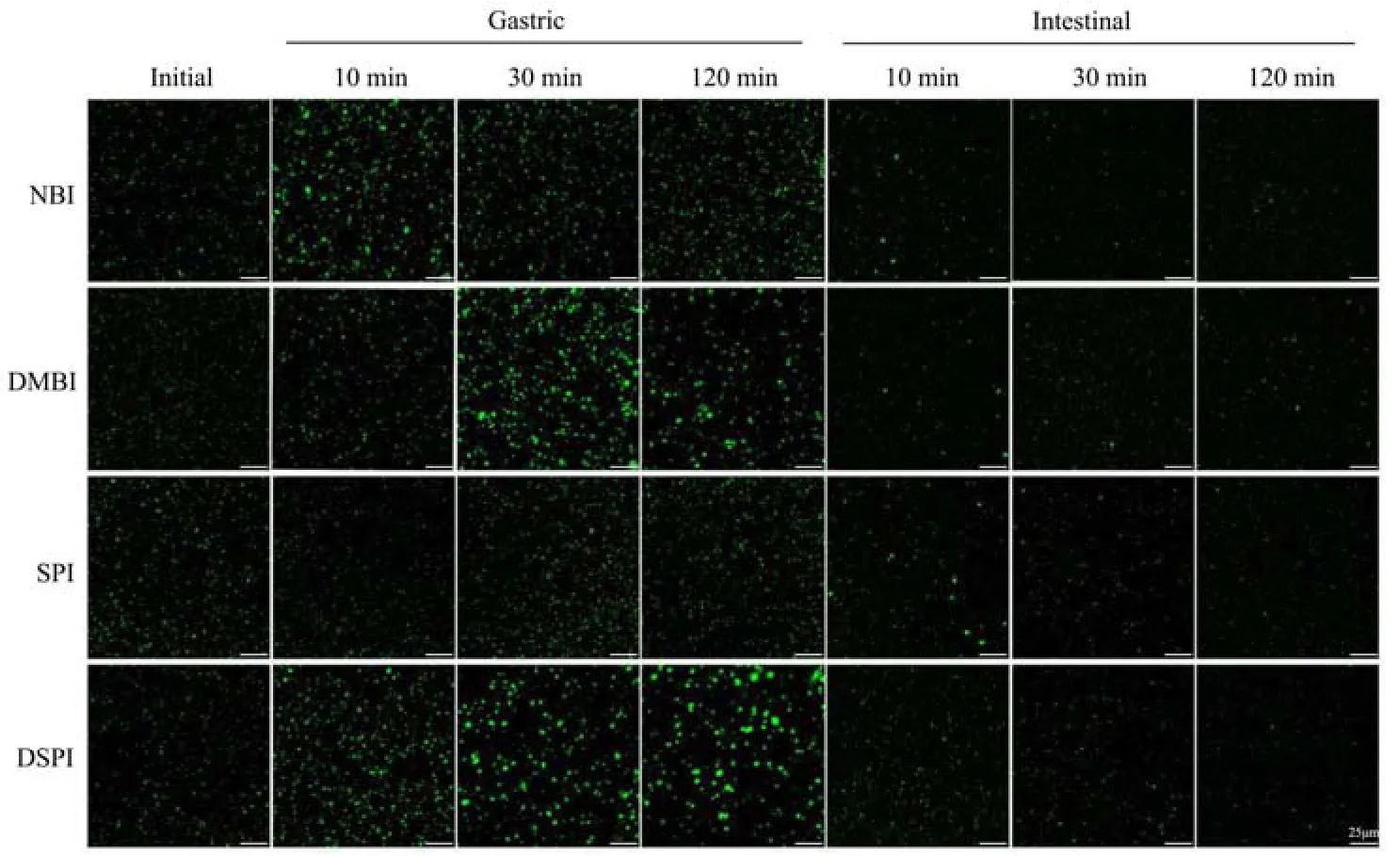
图10 消化过程中乳液液滴的聚集情况Fig.10 Aggregation of emulsion droplets during digestion
3 结论
本研究以大豆蛋白为对照,系统探究了湿热处理对绿豆蛋白结构、表面疏水性、油水界面的吸附行为及绿豆蛋白稳定的油水乳液的稳定性与消化行为的影响。研究表明湿热处理改变了绿豆蛋白的二级结构,β-转角结构的比例增加,内部疏水集团暴露从而导致表面疏水性提高。与天然的绿豆蛋白相比,经湿热处理得到的绿豆蛋白稳定的油水乳液初始粒径更小,分散性提高,贮藏稳定性增加。此外6%的热处理绿豆蛋白稳定的乳液具有更好的热稳定性和物理稳定性。实验表明绿豆蛋白作为一种优质的植物蛋白来源,具有应用于植物基食品乳液开发的潜力。
