十聚甘油单油酸酯-酪蛋白酸钠复合物的构建与对柠檬醛的稳定作用
2023-01-12程映雪王梦露贺军波林红胡志雄齐玉堂张维农
程映雪,王梦露,贺军波,2*,林红,胡志雄,2,齐玉堂,2,张维农,2
(1.武汉轻工大学食品科学与工程学院,农产品加工与转化湖北省重点实验室,湖北武汉 430023)(2.湖北省油脂精细化工工程技术研究中心,湖北武汉 430023)
蛋白质与小分子表面活性剂的复合物具有降低表面张力、促进乳状液形成等重要的物理化学性质,在食品和其他工业中受到广泛关注[1,2]。蛋白质可以通过空间和静电稳定机理吸附于油滴表面,提供乳液的长期稳定性。但是,蛋白质的乳化活性和乳化能力通常低于小分子表面活性剂。与蛋白质相比,小分子表面活性剂能更有效地降低界面张力[3],然而,由于缺乏空间斥力和界面粘弹性,油滴聚结的阻力较低[4],乳化稳定性不如蛋白质。因此,蛋白质和小分子表面活性剂的复合物可以结合两者优点来改善乳化性质。
酪蛋白酸钠(Sodium Caseinate,NaCas)具有良好的乳化稳定性,是一种广泛应用的食品蛋白质乳化剂[5]。NaCas 由αs1-、αs2-、β和κ-酪蛋白组成,αs1-和β是影响NaCas 表面活性的主要成分[6]。然而,NaCas稳定的食品乳状液在酸化过程中会由于静电排斥作用减弱而容易失稳[7,8],并且NaCas 降低界面张力的能力不够理想而具有较低的油体积分数。为了改善这些缺陷,通常将NaCas 与蔗糖酯[9]、卵磷脂[10]、吐温-80[11]等复合来提高体系的乳化性质。
聚甘油脂肪酸酯(Polyglycerol Fatty Acid Esters,PGFEs)是一种安全、有效降低油水界面张力的非离子型表面活性剂,广泛应用于食品、化妆品、医药等领域[12,13]。改变甘油的聚合物和脂肪酸的结构,可以合成具有优良的两亲性和特定亲水亲油平衡值(HLB)的PGFEs[14]。有文献表明二聚甘油单油酸酯与酪蛋白复配时会发生界面处的竞争作用,导致乳液的不稳定性[15]。基于PGFEs 的两亲性及脂肪酸与NaCas 间的潜在非共价结合[16],NaCas 与PGFEs 可通过氢键、疏水相互作用等形成复合物,从而提高蛋白质的乳化性能。
本研究构建了 NaCas 与十聚甘油单油酸酯(Decaglycerol Monooleate,DGMO)复合物,并用动态光散射和Zeta-电位进行了表征,用紫外-可见分光光度计、荧光光谱、傅里叶变换红外光谱研究了NaCas 与DGMO 的相互作用,考察了温度、pH 和盐离子浓度对复合物稳定性的影响及复合物对水包油(Oil-in-Water,O/W)乳液的乳化性能和柠檬醛的稳定作用。
1 材料与方法
1.1 原料
1.1.1 原料与试剂
酪蛋白酸钠(来自牛乳,蛋白含量90%),梯希爱(上海)化成工业发展有限公司;十聚甘油单油酸酯(HLB=12.9[14]),山东滨州金盛新材料科技有限责任公司;荧光素-5-异硫氰酸酯(FITC)、尼罗红和1-苯胺基-8-萘磺酸盐(ANS),Sigma-Aldrich 公司;米糠油,武商超市;氢氧化钠、氯化钠、0.1 mol/L 盐酸、磷酸氢二钠、柠檬酸,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
Lambda 650 紫外分光光度计,德国珀金埃尔默公司;Malvern Zetasizer Nano ZS90 粒度分析仪,英国马尔文仪器有限公司;Spectrum 100 傅里叶变换红外光谱仪,美国珀金埃尔默公司;F-4600 荧光分光光度计,日本日立;FV1200-OSR 激光共聚焦显微镜,日本奥林巴斯。
1.2 实验方法
1.2.1 NaCas-DGMO 复合物分散液的制备
NaCas 溶于Milli-Q 水中制备40 mg/mL 的储备液。称取DGMO 溶于Milli-Q 水中制得160 mg/mL 的溶液,然后用Milli-Q 水稀释得到不同浓度的储备液(20、40、80 mg/mL)。用0.1 mol/L HCl 溶液将所有储备液调节至pH 值7.0。将1 mL NaCas 储备液和1 mL DGMO 储备液添加到6 mL Milli-Q 水中,达到最终体积8 mL,NaCas 和DGMO 的终浓度分别为5 mg/mL 和2.5~20 mg/mL,对应NaCas 和DGMO 质量比为2:1、1:1、1:2、1:4。样品在80 ℃搅拌1 h 后水浴冷却至25 ℃,然后添加0.02 wt%的叠氮化钠抑制微生物生长。所有样品均保存在25 ℃下进行进一步分析。
1.2.2 粒径、PDI 和Zeta-电位测定
用Malvern Zetasizer Nnano ZS 粒径分析仪测定制备的NaCas-DGMO 复合物分散液的粒径、PDI 及Zeta-电位。使用Milli-Q 水稀释复合物分散液80 倍测定粒径和PDI,Zeta-电位不稀释直接测定。
1.2.3 浊度测定
用Lambda 650 紫外分光光度计测定NaCas-DGMO复合物分散液在室温(25 ℃)和600 nm 波长处的吸光度以表征浊度[17]。
1.2.4 荧光光谱表征
用F-4600 型荧光分光光度计进行荧光实验。固定激发和发射狭缝为5 nm,激发波长设置为280 nm,发射光谱采集范围为290~500 nm,扫描速度为2 400 nm/min,电压为500 V,所有样品稀释10 倍后测定。
1.2.5 表面疏水性测定
用1-苯胺基-8-萘磺酸盐(ANS)荧光法测定NaCas-DGMO 复合物的表面疏水性。用磷酸盐缓冲溶液(0.01 mol/L,pH 值7.0)将复合物分散液稀释至酪蛋白酸钠浓度为0.05~0.25 mg/mL。将4 mL 稀释液与相同磷酸盐缓冲溶液中制备的20 μL 8 mmol/L ANS 溶液混合,然后在室温下静置15min。使用F-4600 荧光分光光度计测定激发波长390 nm 和发射波长470 nm处的荧光强度。荧光强度与NaCas 浓度曲线的初始斜率即被认为是表面疏水性[18]。
1.2.6 FT-IR 分析
分别取 NaCas、DGMO 和质量比 1:2 的NaCas-DGMO 复合物在80 ℃制备的复合物冻干粉与KBr 粉末混合研磨压片,在4 000~400 cm-1波数范围内进行FT-IR 扫描。扫描次数16 次,分辨率4 cm-1。DGMO作为液体样品采用ATR 方法在600~4 000 cm-1范围内进行FT-IR 扫描,扫描次数16 次,分辨率4 cm-1。
1.2.7 NaCas-DGMO 复合物对pH 值和离子强度的稳定性
用柠檬酸-磷酸氢二钠缓冲溶液将NaCas-DGMO复合物分散液的pH 值调节至2.0、3.0、4.0、5.0、6.0和7.0,评价pH 值对复合物分散液稳定性的影响。评估复合物分散液在NaCl 浓度为0.05、0.10、0.15、0.30 mol/L的稳定性。测定室温下12 和24 h 后的粒径和PDI。
1.2.8 NaCas-DGMO 复合物稳定乳液的制备
采用超声均质方法制备NaCas-DGMO复合物稳定水包油乳液。取NaCas 与DGMO 质量比1:2 的复合物分散液6 mL,分别加入复合物质量5 倍、10 倍、15 倍和20 倍的米糠油,将混合液在斡旋仪上混合2 min 后,用探头超声器将混合物于20 kHz 下连续超声5 min,形成乳白均一的水包油乳液。NaCas 和DGMO 的水分散液作为对照用于稳定水包油乳液。分别测定0、15、30 d的粒径和PDI 用于表征水包油乳液。
1.2.9 激光共聚焦显微镜表征
用100 μg/mL 的异硫氰酸荧光素(FITC)和尼罗红溶液分别添加到NaCas-DGMO复合物分散液和米糠油中,用来标记蛋白和油样(复合物与油相质量比为1:10),避光染色过夜后,取10 μL 乳液滴到载玻片上,盖上载破片后放置显微镜下放大80 倍观察。其中染料FITC和尼罗红的激发波长分别为488 nm和543 nm[19]。单独NaCas 和DGMO 稳定的O/W 乳液作为对照。
1.2.10 负载柠檬醛米糠油乳液的制备
向1.2.8 制备的米糠油O/W 乳液中加入柠檬醛,柠檬醛的载药量为米糠油质量的5%、10%、15%和20%。利用高压微射流在10 000 Psi 压力下循环均质3 次制备出负载柠檬醛的米糠油乳液,乳液中米糠油是酪蛋白酸钠质量的10 倍。NaCas 稳定米糠油乳液包埋作用对照,柠檬醛的载药量为15%。测定乳液的粒径、PDI和Zeta-电势进行表征。
1.2.11 柠檬醛储存稳定性测定
取20 mL 新制的柠檬醛乳液,25 ℃避光保存28 d,测定柠檬醛的保留率(A,%)。保留率测定方法:取50 μL 柠檬醛乳液用乙腈稀释100 倍,并超声处理10 min,使所载柠檬醛全部游离出来,然后通过HPLC检测柠檬醛保留量(W保留),定义新制备的乳液的柠檬醛含量为W总。
A=W保留/W总×100%。
HPLC 色谱条件:流动相为水和乙腈,0~12 min:乙腈占40%~70%,12~16 min:乙腈占70%~40%;固定相为C18柱(250 mm×4.6 mm,5 μm),柱温为30 ℃;流速为1 mL/min;检测波长为237 nm。柠檬醛标准曲线拟合方程为Y=51 912X+1.584 0,R2=0.999 9。
1.2.12 数据统计分析
每组进行3 次平行实验,实验数据以平均值±标准差表示,并用SPSS 20.0 软件进行显著性差异分析(p<0.05)。采用Origin 8.5 软件制图。
2 结果与讨论
2.1 质量比对NaCas-DGMO 复合物的影响
由表1 可知,NaCas 与DGMO 复合后粒径与PDI均较NaCas 显著下降(p<0.05),说明两种物质可能以某种形式相互结合。DGMO 的添加量对复合物的形成也有显著影响(p<0.05),当NaCas 与DGMO 质量比小于1:1 时,复合物的PDI 均小于0.3,表明能形成稳定的复合体系,且在25 ℃储存7 d 后的粒径和Zeta-电位变化不明显(p>0.05),仍保持着相似的趋势,表明该复合物能稳定存在。
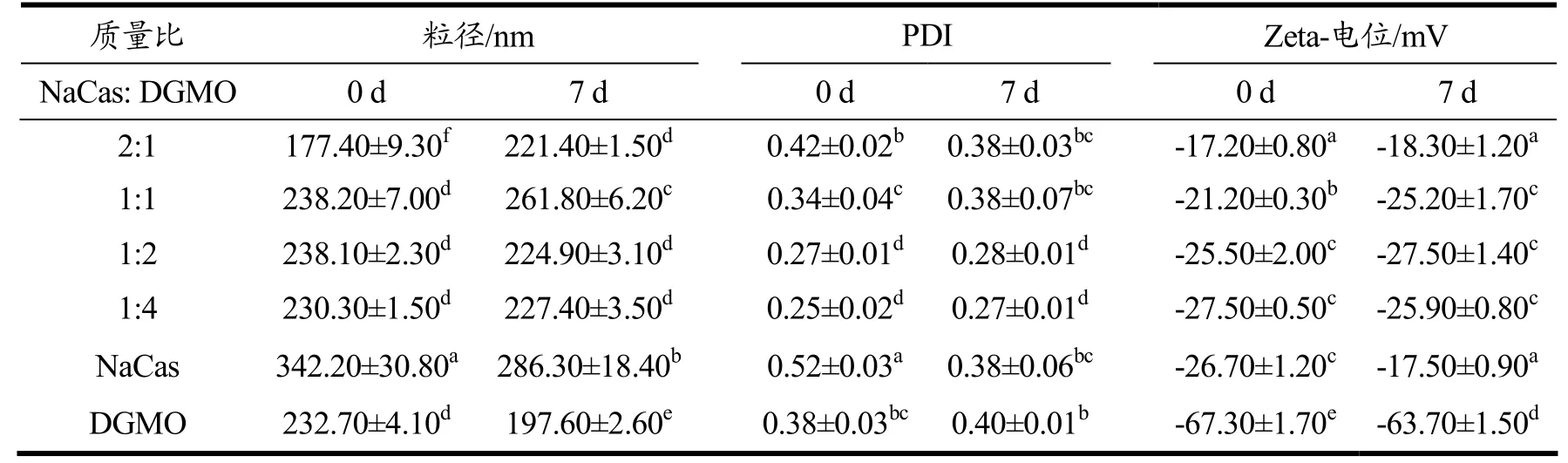
表1 不同质量比制备的NaCas、DGMO 及其复合物的粒径、PDI、Zeta-电位Table 1 Particle size,PDI,Zeta-potential of NaCas,DGMO,and their complexes prepared with different mass ratios
NaCas 是常用的蛋白质类食品乳化剂,在水中以胶束存在,本身具有较强的表面活性和乳化性[20]。Panja等[16]研究了酪蛋白胶束与不同饱和度脂肪酸的结合能力,发现油酸与酪蛋白胶束具有更强的疏水相互作用。DGMO 是一种高HLB 值(12.9)的非离子型食品乳化剂,具有优异的水溶性。NaCas 与DGMO 的相互作用可能是油酸链与NaCas 以疏水相互作用嵌入胶束中,同时十聚甘油基团的强亲水性改变了NaCas 胶束的表面性质,使得分子间斥力作用增强而具有更好的分散性,即表现出更小的粒径和PDI。
2.2 NaCas-DGMO 复合物分散液浊度
静态浊度法可以用来表征乳液或分散系的稳定性[21],即测量乳液或分散系的浊度随放置时间的变化。不同质量比的NaCas-DGMO复合物分散液的浊度与放置时间的关系如图1 所示。图1 表明随着DGMO 添加量的增加,复合物分散液的浊度呈现上升趋势,而且7 d储存期内浊度值基本无明显变化,进一步说明NaCas-DGMO 复合物分散液具有很好的稳定性。

图1 NaCas-DGMO 复合物的浊度与质量比和储藏时间的关系Fig.1 The relationship between the turbidity of the complex NaCas-DGMO and its mass ratio and storage time
2.3 NaCas 荧光光谱的变化
NaCas 中的色氨酸和酪氨酸残基在受到特定波长光激发后发射一定强度的荧光[22],其强度变化可反映蛋白质微结构的改变。图2 所示是NaCas-DGMO 复合物中NaCas 荧光光谱图,固定280 nm 的激发波长时,NaCas 在346 nm 处有最大发射波长,为色氨酸残基产生的荧光。与DGMO 复配后,NaCas 的最大发射波长发生轻微红移(λmax=349 nm),说明DGMO 的加入引起NaCas 的结构变化,色氨酸暴露到亲水环境而引起荧光淬灭效应。随着DGMO 添加量的增加,NaCas 的荧光淬灭效应越发明显。当NaCas 与DGMO 质量比1:2 时,NaCas 的荧光强度下降了48%,表明在此比例下,DGMO 与NaCas 相互作用明显增强。Gan 等[23]利用NaCas-果胶包埋植物甾醇,发现植物甾醇对NaCas产生了荧光淬灭效果,两者间发生了疏水相互作用。
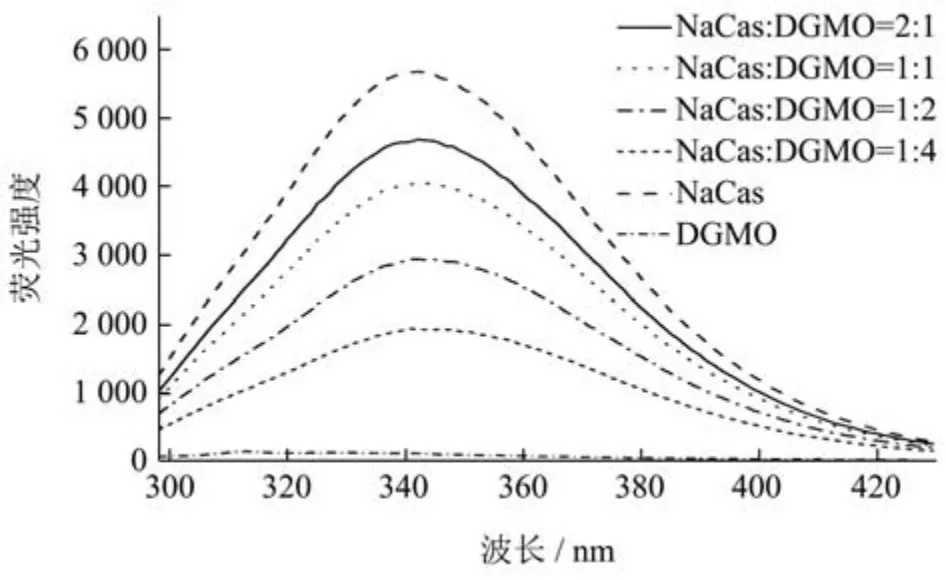
图2 NaCas 与DGMO 相互作用后荧光光谱变化Fig.2 Changes in fluorescence spectra after interaction of NaCas with DGMO
结合NaCas-DGMO 复合物的粒径、PDI、Zeta-电位、浊度和荧光光谱,可以推断NaCas 与DGMO 质量比为1:2 时形成复合物最佳,并用于后续所有研究。
2.4 NaCas 表面疏水性变化
蛋白质表面疏水性的变化可反映蛋白质结构的改变及疏水性氨基酸残基的分布变化,与蛋白质的功能性质紧密相关。图3 表示NaCas 与DGMO 以质量比1:2形成复合物后的表面疏水性变化。相比单纯NaCas 而言,NaCas-DGMO 复合物的表面疏水性增加了一倍(319.46 增至596.45),说明DGMO 与NaCas 作用后,蛋白质内部疏水区逐渐暴露,导致表面疏水性增强。王碧璇[24]的研究发现:糖接枝后的大豆分离蛋白表面疏水性呈现先增加后降低的趋势。接枝度在44.73%以内时,表面疏水性最高达到2 043.33,相对于天然大豆分离蛋白提升了163.66%。NaCas 表面疏水性的增大也可能增强其与DGMO 中油酸链的疏水相互作用,促进复合物的形成。另一方面,NaCas 内部疏水区的暴露增加了蛋白质中色氨酸残基与水相的接触,引起荧光淬灭效应,从而证明了前面复配致使NaCas 荧光强度降低的现象。
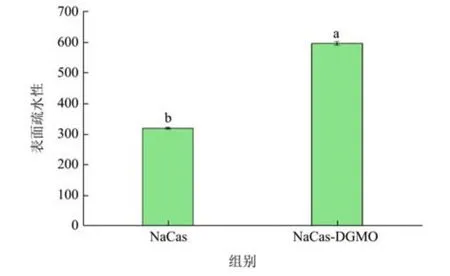
图3 NaCas 和NaCas-DGMO 复合物(1:2,m/m)的表面疏水性Fig.3 Surface hydrophobicity of NaCas and NaCas-DGMO complexes (1:2,m/m)
2.5 NaCas-DGMO 复合物的红外光谱表征
图4 为NaCas、DGMO 和两者复合物的红外光谱图,DGMO 红外光谱图中3 371 cm-1为聚甘油基团的-OH 伸缩振动峰;2 923、2 854 cm-1为油酸链的C-H 键伸缩振动峰;1 737 cm-1为油酸中C=O 伸缩振动峰;1 117 cm-1为典型的聚甘油中C-O-C伸缩振动峰。NaCas红外光谱图中3 309 cm-1吸收峰为O-H 伸缩振动峰;2 961、2 875 cm-1为C-H 键伸缩振动峰;1 659 cm-1为蛋白质酰胺I 带(C=O)伸缩振动峰;1 400~1 550 cm-1为酰胺II带的N-H变形振动和C-N伸缩振动峰;1 241 cm-1为酰胺III 带的N-H 面内弯曲振动和C-H 伸缩振动峰。DGMO 与NaCas 复合后,蛋白质的O-H 伸缩振动峰向3 317 cm-1波数移动,产生轻微蓝移,说明DGMO 与NaCas 间的氢键作用影响了O-H 的吸收峰。NaCas 的酰胺基团的红外光谱在复合后基本没有变化,说明两者间没有共价键的形成,而是以弱相互作用力结合[25]。
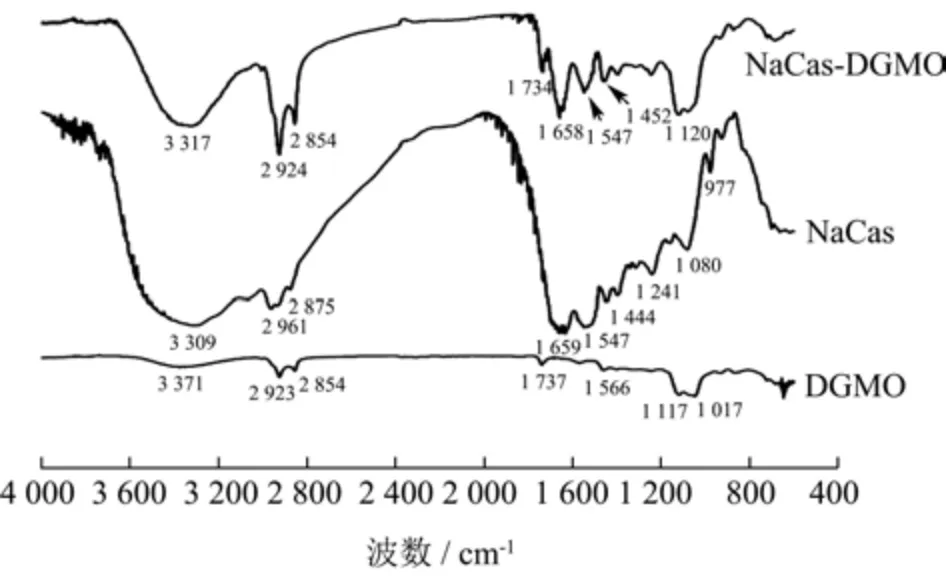
图4 NaCas、DGMO 和NaCas-DGMO 复合物FT-IR 图Fig.4 FT-IR of NaCas,DGMO and NaCas-DGMO complex
2.6 pH 对NaCas-DGMO 复合物分散液的影响
蛋白质功能性质受pH 值的影响显著,而聚甘油脂肪酸酯的水解敏感性小,具有较强的热稳定性和抗酸性[12],因此考察了NaCas-DGMO 复合物受pH 值的影响。图5a 和5b 为NaCas、DGMO 及在80 ℃制备的两者复合物分散液在不同pH 值条件下放置12 h 的粒径和PDI,图5c 和5d 为放置24 h 中,表明DGMO 与NaCas 的复配并未改变NaCas 在等电点处的溶解性。除pH 值4.0 外,NaCas 均以纳米尺度(250~450 nm)分散于水相中,但PDI 值均较大(0.35~0.70),说明蛋白质粒径分布不均。Qian 等[26]研究了β-乳球蛋白稳定的乳液在接近蛋白质等电点的pH 值(pH 值4 和5)、高离子强度(NaC>0.2 mol/L,pH 值7)和较高的储存温度(55 ℃)下稳定性,结果表明在此条件下乳液不稳定,乳液中油滴容易聚集。相比而言,DGMO 则在不同pH 值下均以优异的纳米胶束存在,粒径处于180~250 nm 范围,PDI 处于0.07~0.16,不受pH 值变化的影响。NaCas-DGMO 复合物分散液在pH 值为2.0、3.0、5.0、6.0 和7.0 时均具有明显更低的粒径,复合体系的PDI 值也显著低于NaCas 本身,说明DGMO 的加入可改善NaCas 的分散性,抑制蛋白质的聚集效应。随着不同pH 值条件下放置时间延长至24 h,NaCas 本身在pH 值6和7条件下的粒径均有显著增加,达到400 nm(图5c),但其PDI 却呈降低趋势(图5d),说明NaCas分子间的聚集效应降低了分散的不均匀性。而NaCas-DGMO 复合物的粒径整体变化幅度不大(图5c),进一步表明NaCas-DGMO 复合物受pH 值影响不显著。

图5 NaCas、DGMO 及两者复合物分散液在不同pH 条件下放置12 h(a、b)和24 h(c、d)的粒径和PDIFig.5 Particle size and PDI of NaCas,DGMO and their complex dispersions at different pH for 12 hours (a,b) and 24 hours (c,d)
2.7 NaCl 浓度对NaCas-DGMO 复合物分散液的影响
盐离子强度会改变蛋白质界面的静电作用而影响其对乳液的稳定性。图6 为不同NaCl 浓度对NaCas、DGMO及两者复合物的影响,可以看出在0.05~0.30 mol/L NaCl 浓度范围内,放置12 h(图6a、6b)和24 h(图6c、6d)后的粒径和PDI 值均变化不大,说明离子强度对NaCas-DGMO 复合物的稳定性影响较小。相反,NaCas 分散液在同样NaCl 浓度下的PDI 值处于0.48~0.66 之间,较高的PDI 说明NaCas 胶束在水中粒度分散性不均匀,孙勤等[27]的实验结果也表明,当离子强度为0.2 mol/L 时,采用微射流高压均质法制备的酪蛋白酸钠-海藻油纳米乳液的PDI 从0.22 变成0.31。这可能是因为较多盐离子竞争吸附蛋白质界面水分,一定程度上破坏了蛋白质水化层,导致NaCas 胶束的聚集[28]。从而影响粒径分布均一性。DGMO 未受NaCl浓度的影响,粒径和PDI 均保持稳定。粒径和PDI 变化说明DGMO 能显著改变NaCas 的表面性质,使其耐受盐离子强度,能增强NaCas 的分散性与均一性,抑制其团聚。
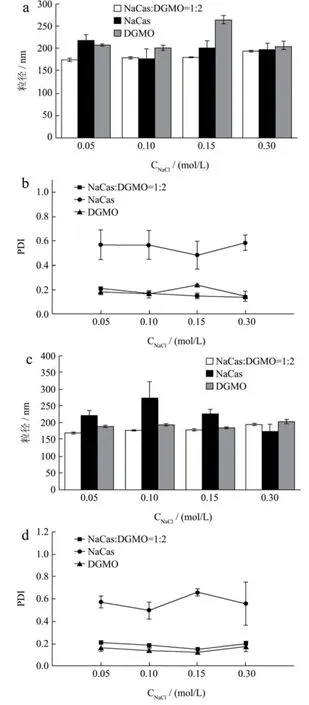
图6 NaCas、DGMO 及两者复合物在不同NaCl 浓度下放置12 h(a、b)和24 h(c、d)的粒径和PDIFig.6 Particle size and PDI of NaCas,DGMO and their complexes at different NaCl concentrations for 12 hours (a,b)and 24 hours (c,d)
2.8 NaCas-DGMO 复合物稳定O/W 乳液
在获得稳定NaCas-DGMO 复合物的基础上,进一步对其乳化性能进行研究。图7a、7b 和7c 分别为NaCas、DGMO 及80 ℃制备的两者复合物稳定O/W 乳液在0~30 d 的粒径和PDI 变化。图7a 可以看出,新制乳液样品中随着油相添加量的增加,NaCas 稳定O/W乳液的粒径逐渐增大,除油相添加量为5 倍的O/W 乳液的PDI 为0.24 外,其余均较高(PDI=0.37~0.42),表明NaCas 乳化油相能力有限,是因为随油相增加缺乏足够蛋白覆盖于乳液界面而导致桥架凝聚(Bridging Flocculation)[29]。随着储存时间延长至15 d 和30 d,粒径虽变化不大,但在样品储存过程中发现高于5 倍油相的O/W 乳液均出现分层现象,进一步表明NaCas较弱乳化能力。DGMO 稳定O/W 乳液的粒径和PDI在储存过程中虽均有一定降低(图7b),但除5 倍油相样品外,也均出现破乳现象,亦说明其较弱乳化能力。然而,NaCas-DGMO 复合物稳定的O/W 乳液在0~30 d的储存期内,对不同油相比例的O/W 乳液均表现出较低的粒径(160.8~203.0 nm)和更低的PDI(图7c)。前面研究可知,与DGMO 形成复合物后,NaCas 的表面疏水性增强,会使蛋白质展开而增强乳化性,此外,DGMO 也与NaCas 竞争吸附油滴界面而提供稳定作用。这与Cheong 等[30]研究结果一致。NaCas-DGMO 复合体系稳定的O/W 乳液也表现出很好宏观稳定性,30 d 的储存期内无破乳现象。研究结果表明DGMO 能显著增强NaCas 的乳化能力和乳液稳定性。
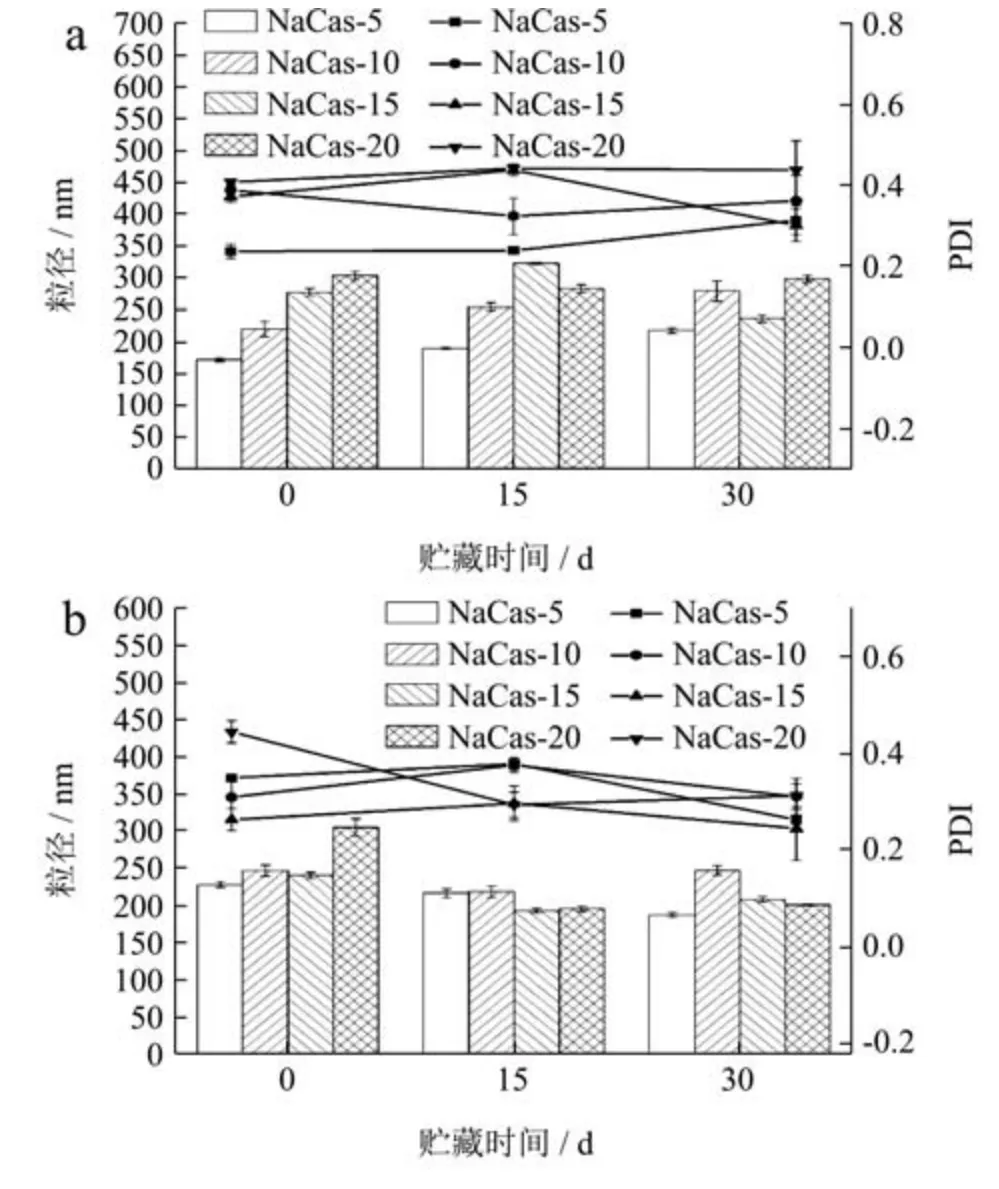
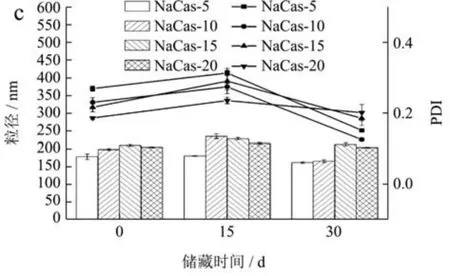
图7 NaCas(a),DGMO(b),NaCas-DGMO 复合物(c)稳定不同油相比例O/W 乳液在储存期间的粒径和PDI 变化Fig.7 Particle size and PDI during storage of NaCas (a),DGMO(b),and NaCas-DGMO complex (c) stabilized O/W emulsions with different oil-phase ratios
2.9 激光共聚焦显微镜表征
激光共聚焦显微镜能从微观角度解析NaCas、DGMO 和两者复合物对O/W 乳液的稳定情况,所述米糠油的添加量为乳化剂(NaCas、DGMO 和两者复合物)质量的10 倍。图8 显示了O/W 乳液储存0 d 和30 d 后的激光共聚焦显微图(米糠油油滴被尼罗红标记为红色,NaCas 和DGMO 被FITC 标记为绿色)。图8a 表明新制NaCas 稳定乳液主要为亚微米级的液滴,而储存30 d 后小液滴聚集形成大颗粒油滴(图8d),说明纳米级油滴在储存过程中因为界面层蛋白质量不足而发生桥架凝聚[29],逐渐聚集形成微米级油滴。新制的DGMO 稳定油相为粒径分布均匀的油滴(图8b),且油滴表面具有清晰的绿色界面层(DGMO 所含羟基与FITC 反应后形成的吸附层),表明经FITC 染色的DGMO 提供了很好的乳化稳定作用。经30 d 储存后,油滴产生了明显的因聚集作用而形成的多重乳液(图8e),可以看出多重乳液表面有很清晰的绿色界面层(DGMO 吸附层)。总之,单独NaCas 和DGMO 乳化O/W 纳米乳液的稳定性均有限,与前面粒径和PDI 表征结果一致。相反,DGMO 与NaCas 复配后的乳液稳定性得到很大改善(图8c),一方面弥补了蛋白质覆盖量的不足,另一方面表面活性剂更好的乳化能力改善了乳化油相的效果。同时,图8f 表明油滴表面具有明显的界面层(FITC 染色的NaCas-DGMO 复合物)稳定O/W 乳液,在放置30 d 后体系依旧稳定(图8f)。

图8 O/W 乳液储存0 d 和30 d 后CLSM 图NaCas(a、d)、DGMO(b、e)、NaCas-DGMO 复合物(c、f)Fig.8 CLSM of NaCas (a,d),DGMO (b,e),NaCas-DGMO complex (c,f) after O/W emulsion storage for 0 and 30 days
2.10 负载柠檬醛米糠油乳液的表征
柠檬醛是一种具有浓烈柠檬香气的天然香精,应用遍及饮料、食品、医药业等[31,32]。但是,柠檬醛易因氧化反应而变质,是需要克服的主要障碍。在NaCas-DGMO 复合物稳定的米糠油乳液体系基础上,我们进一步研究了米糠油乳液对柠檬醛的负载效应。负载柠檬醛后,米糠油乳液的粒径和PDI 与柠檬醛的载量相关性不大(p>0.05),在28 d 的储存中保持着较为稳定的存在。Kanafusa 等[33]将β-胡萝卜素溶解于三油酸甘油酯中,并在含有NaCas 的水相中进行微流态化。在140 MPa 下微流化制得平均液滴直径约为120 nm 的O/W 乳状液,但可惜的是该乳液在4 ℃下的稳定性仅为2 周。值得指出的是,所有乳液都具有较高的Zeta-电位绝对值(>30 mV),说明乳液液滴之间的静电斥力为稳定的粒径和PDI 提供了充足的保证。
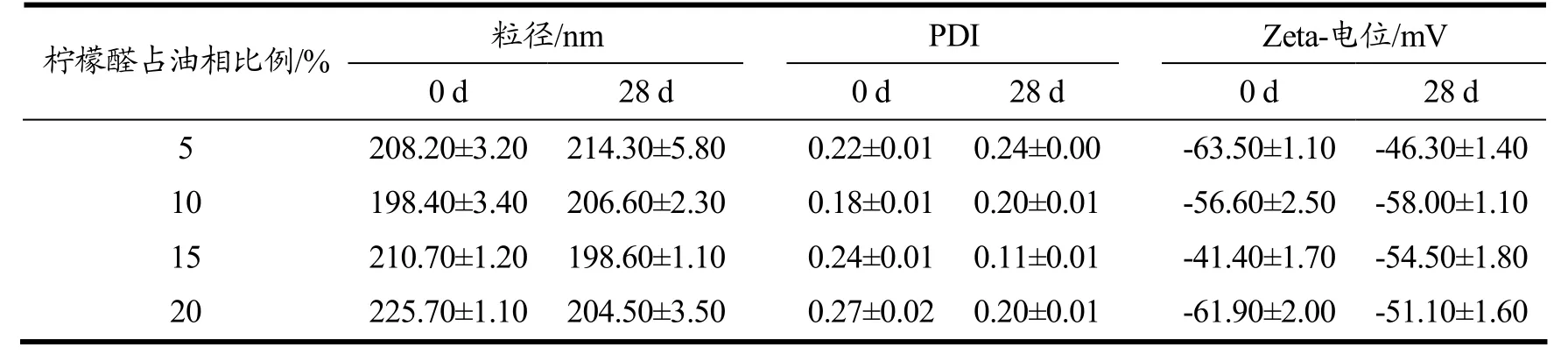
表2 负载柠檬醛米糠油乳液的粒径、PDI 和Zeta-电势Table 2 Particle size,PDI,and Zeta-potential of citral-loaded rice bran oil emulsion
2.11 乳液中柠檬醛的稳定性
柠檬醛存在孤立的C=C、C=O 双键,容易发生氧化反应,表3 显示了乳液包封柠檬醛对其稳定性的影响。在28 d 储藏期,柠檬醛在第7 天的保留率基本一致,随着时间延长,不同负载量的柠檬醛开始出现稳定性差异,基本规律是柠檬醛占油相比例越高,保留率越高。与对照相比(NaCas 稳定乳液),柠檬醛第28天的保留率为70.66%,显著低于NaCas-DGMO 复合物稳定的米糠油乳液77.61%,说明DGMO 的加入能提高乳液对柠檬醛的保护作用。柠檬醛的分解主要发生于乳液中油水界面处,NaCas-DGMO 复合物在米糠油表面形成更好的界面保护层,降低了柠檬醛向水相迁移的量,从而具有更高的保留率。与文献报道的固体脂质纳米粒包封柠檬醛相比[34](12 d 的保留率为67%),基于NaCas-DGMO复合物稳定性的米糠油乳液对柠檬醛的保护作用更显著。根据前述的NaCas-DGMO 复合物具有耐酸、耐盐离子的特点,本文构建的负载柠檬醛米糠油O/W 乳液可作为柠檬醛良好的递送载体用于食品体系。
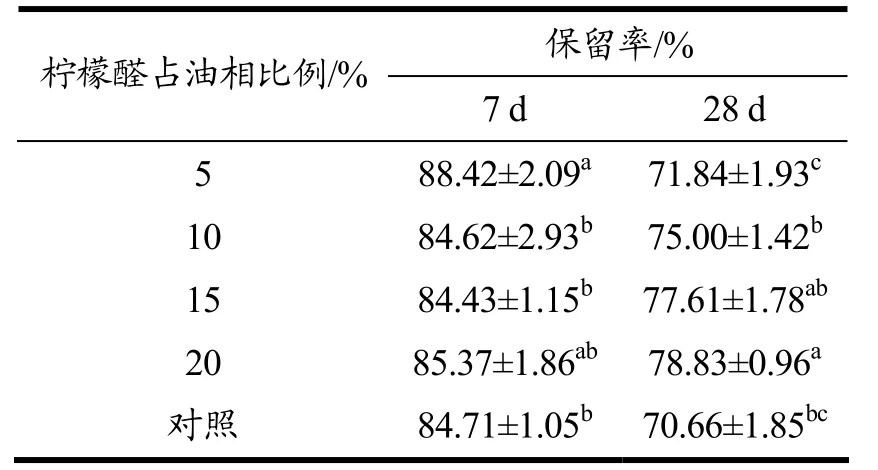
表3 柠檬醛在米糠油乳液中保留率变化Fig.3 Changes in the retention rate of citral in rice bran oil emulsion
3 结论
本研究利用DGMO与NaCas形成复合物显著改善了NaCas 的水分散性,NaCas-DGMO 复合物的最佳制备条件为:质量比为1:2(m/m),反应温度80 ℃,反应时间1 h,此时复合物具有较低粒径(238.10 nm)和很好分散性(0.27)。荧光光谱法和FT-IR 研究证明了复合物的形成,且复合体系显著增强了NaCas 表面疏水性,由319.46 增长到596.46。与NaCas 相比,NaCas-DGMO 复合物在pH 值2、3、5、6、7 均具有更好的稳定性和分散性,但在pH 值4 时不稳定;在0.05~0.30 mol/L 的盐离子浓度下,盐离子对复合物稳定性影响较小,而对NaCas 的影响很大,表明复合物显著改善了NaCas 的离子稳定性。NaCas-DGMO 复合物明显改善了NaCas 稳定O/W 乳液能力,负载柠檬醛的O/W 乳液仍具有很好稳定性(粒径为208~225 nm,PDI 为0.18~0.27)和对柠檬醛的保护作用(储存28 d柠檬醛保留率达78.83%)。NaCas-DGMO 复合物体系有望用于稳定乳液和脂溶性功能活性物质的纳米递送。
