马铃薯StMAPKK4基因表达分析及互作蛋白筛选与鉴定
2023-01-12王凯彤司怀军
濮 雪 王凯彤 张 宁,2,* 司怀军,2
马铃薯基因表达分析及互作蛋白筛选与鉴定
濮 雪1王凯彤1张 宁1,2,*司怀军1,2
1甘肃农业大学生命科学技术学院, 甘肃兰州730070;2甘肃省干旱生境作物学省部共建国家重点实验室, 甘肃兰州 730070
MAPKKs是促丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应主要成员之一, 位于该级联反应通路中间, 对信号传递起着收集和发散的关键作用。有研究表明马铃薯基因响应干旱胁迫, 为进一步探究该基因的生物学功能, 本研究对基因进行了生物信息学分析。结果表明, StMAPKK4与科民茄亲缘关系最近。其含有蛋白激酶家族的Protein kinase domain (PF00069)结构域, 位置定位于64~302 aa之间。含有多个激素(茉莉酸甲酯、乙烯、脱落酸、ABA)及胁迫相关响应元件。qRT-PCR分析结果表明,基因在马铃薯茎中表达量最高, 且在干旱及盐处理下均上调表达。亚细胞定位表明该基因定位于细胞膜上。利用酵母双杂交方法筛选出8个与StMAPKK4相互作用的蛋白, 并通过回转试验验证了其互作的真实性。对互作蛋白进行Blast比对结果显示, StMAPKK4与多酚氧化酶、藻蓝蛋白、天冬氨酸转氨酶、渗透素、磷酸盐转运蛋白等多种蛋白互作, 初步判断StMAPKK4可能参与光合作用响应机制、植物体低温、干旱及盐胁迫等一系列非生物胁迫、促进根系对磷元素的吸收等生理生化过程。
马铃薯; StMAPKK4; 生物信息学; qRT-PCR; 亚细胞定位; 酵母双杂交
马铃薯根系较浅, 茎块的产量、数量和质量受水分条件影响较大[1], 属于干旱敏感型作物。马铃薯整个生长周期经常会遭受各种非生物胁迫(干旱、洪涝、盐碱、高温等)及生物胁迫因子的影响[2], 从而影响马铃薯的品质, 并造成其产量的降低。在诸因素当中, 干旱和盐胁迫是危害作物生产的主要因素[3], 且干旱对马铃薯的影响尤为重要[4]。
促丝裂原活化蛋白激酶级联反应在调节植物生长发育和植物对胁迫的反应中起到关键作用[5]。该级联反应由3种蛋白激酶(MAPKKK-MAPKK- MAPK)组成, 通过依次磷酸化将上游信号传递至下游应答分子。近年来, 已经在多种植物中鉴定和报道MAPK级联成员, 其中, MAPKKs在拟南芥中有10个[6-8], 水稻中有8个[9-11], 玉米中有9个[12-13], 番茄中有6个[14], 黄瓜中有6个[15]。
研究表明, MAPK级联及其单个组分在调控植物的生长发育和逆境响应中发挥着重要作用。迄今为止, 一些参与生长、发育和胁迫反应的功能完整的MAPK级联反应已经被鉴定[16-18]。在植物中发现的第一个信号模块是拟南芥MEKK1-MKK4/5- MPK3/6级联, 在植物固有免疫中起重要作用[19-20]。此外, 一些与MAPK级联途径相关的基因在环境胁迫反应中同样发挥重要作用。如过表达可以增强水稻的耐旱、耐盐和耐冷性[21]。转基因植物过表达激活和导致拟南芥耐盐性增加[22]。MAP激酶、和的基因修饰增强了对高盐胁迫的耐受性[23-25]。
目前, MAPK级联反应的研究多局限于模式植物拟南芥及有限的植物物种, 对马铃薯鲜有报道。我们前期分析了马铃薯基因在非生物胁迫下的表达模式[26], 结果表明, 在胁迫处理下MAPKKs中多数基因(除)表达量均上调, 其中和表现最为明显,基因由廖钰秋[27]再次验证。因此, 本研究选择马铃薯为目的基因进行PCR扩增, 并通过生物信息学分析、组织表达差异及干旱和盐胁迫响应差异, 对StMAPKK4进行亚细胞定位分析, 运用酵母双杂交技术筛选StMAPKK4的互作蛋白, 以期为深入探究马铃薯StMAPKK4的生物学功能提供理论依据。
1 材料与方法
1.1 植物材料与处理
亚细胞定位表达载体pCEGFP-1300、酵母双杂交诱饵载体pGBKT7、酵母双杂交cDNA文库保存于酵母菌株AH109, 农杆菌菌株为LBA4404, 大肠杆菌菌株为DH5α, 酵母菌株为AH109及Y187。PrimeSTAR HS (Premix)及限制性内切酶II、II购自宝日医生物技术有限公司(TaKaRa,北京)。总RNA提取试剂盒、FastKing一步法除基因组cDNA第一条链合成预混试剂、实时荧光定量试剂盒购自天根生化科技有限公司(TIANGEN, 北京), onExpress II One Step Cloning Kit购自诺唯赞生物科技股份有限公司(Vazyme, 南京)。酵母双杂交缺陷培养基(SDO/-Trp、DDO/-His/-Trp、QDO/-Leu/- Trp/-His/-Ade)购自酷来搏科技有限公司(Coolaber, 北京)。由生工生物工程(上海)股份有限公司完成引物合成及测序, 引物序列见表1。
以马铃薯栽培品种“大西洋”为试验材料。将马铃薯块茎种植于营养土和蛭石1∶1混合的花盆中, 于(23±2)℃条件下生长4~5周, 选取长势一致的植株进行处理, 具体操作为: 用20% PEG-6000、200 mmol L–1NaCl及200 μmol L-1ABA浇灌植株, 处理0、4、8、12、24、36 h后分别取样, 液氮速冻后于–80℃保存。
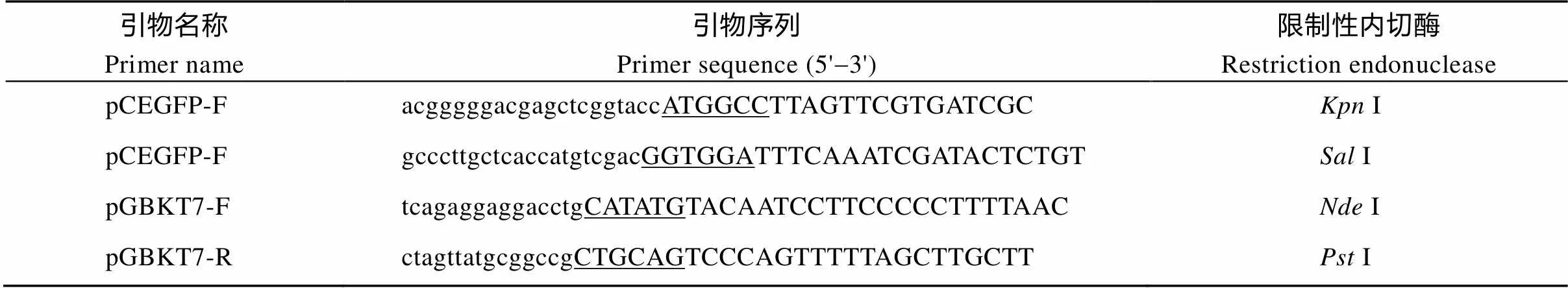
表1 引物名称及序列
小写部分为载体同源序列, 下画线部分为酶切位点。
The lowercase parts are the homologous sequences of the vectors, and the underlined parts are the enzyme digestion sites.
1.2 StMAPKK4生物信息学分析
使用MEGA7.0软件并通过邻近法(Neighbor- Joining, NJ)构建马铃薯StMAPKK4与科民茄()、番茄()、风铃辣椒()、本氏烟草()等9个物种同源基因的系统发育树。由在线软件SOPMA获得马铃薯StMAPKK4蛋白的二级结构。使用在线软件HMMER对马铃薯StMAPKK4蛋白质的保守结构域进行预测分析。运用在线网站Net Phos 3.1 Server预测马铃薯StMAPKK4蛋白质磷酸化位点。选用在线软件plant CARE对马铃薯基因启动子区(基因上游2000 bp)顺式作用元件进行预测分析。
1.3 qRT-PCR分析
提取马铃薯“大西洋”盆栽苗的组织及胁迫处理下0、4、8、12、24、36 h叶片的总RNA, 并反转录合成cDNA第一条链,基因为内参基因, qRT-PCR检测基因的特异性表达情况, 引物序列见表2。

表2 引物名称及序列
反应条件为95℃ 35 s; 95℃ 15 s, 60℃ 35 s, 共39个循环。2-ΔΔCt法计算基因的相对表达量, 试验处理为3次重复。
1.4 亚细胞定位载体构建
以反转录的cDNA为模板, 进行引物扩增, 反应体系包含PrimeSTAR HS (Premix) 12.5 μL、cDNA模板1 μL、上游引物1 μL、下游引物1 μL、ddH2O 9.5 μL。PCR反应条件为98℃ 3 min; 98℃ 10 s, 57℃ 15 s, 72℃ 74 s, 共30个循环; 72℃ 10 min; 4℃保存。1%琼脂糖凝胶电泳检测得到目的条带。使用限制性内切酶I和I对表达载体pCEGFP进行线性化, 回收凝胶产物。同源重组法连接目的片段与线性化载体。重组产物转化大肠杆菌(DH5α)感受态, 涂布于含有卡那霉素(Kan, 50 μg mL-1)的LB固体平板, 37℃倒置培养。单克隆菌株于含有相应抗性的LB液体培养基中, 37℃ 260转 min-1过夜培养。大肠杆菌菌液进行PCR检测, 将检测结果合适的菌液送公司测序, 检验目的基因是否正确插入载体, 测序结果正确的载体命名为pCEGFP-StMAPKK4, 载体转化农杆菌(LBA4404)感受态。
1.5 StMAPKK4亚细胞定位
将含有表达载体和空载体的农杆菌菌液作为侵染液, 分别注射长势良好的烟草叶片下表皮, 于25℃下避光培养54~72 h, 使用激光共聚焦显微镜(488 nm激光波长)观察叶片中荧光分布状况。
1.6 诱饵载体pGBKT7-StMAPKK4构建
使用限制性内切酶I和I对诱饵载体pGBKT7进行线性化, 回收凝胶产物。同源重组法构建重组载体参照1.4部分。测序结果正确的载体命名为pGBKT7-StMAPKK4。
1.7 诱饵载体自激活活性及毒性检测
用PEG/LiAC法将诱饵载体pGBKT7- StMAPKK4、pGBKT7空载体、pGBKT7-StMAPKK4+ pGADT7、阳性对照载体pGADT7-RecT+pGBKT7- 53、阴性对照载体pGADT7-RecT+pGBKT7-Lam分别转化Y187酵母感受态。
自激活活性检测: 将SD/-Leu/-Trp/-His/-Ade/X- α-Gal固体平板分成6等份, 取阴性对照、阳性对照、pGBKT7-StMAPKK4+pGADT7的转化产物均匀涂布于平板, 30℃黑暗培养3~4 d, 观察菌落的生长情况, 判断诱饵载体是否具有自激活活性。
毒性检测: 将诱饵载体及pGBKT7空载体的转化产物分别涂布SD/-Trp、SD/-His/-Trp固体平板, 30℃黑暗培养2~3 d, 根据平板上菌落的生长状况判断诱饵载体是否有毒性。
1.8 诱饵蛋白与文库菌液杂交(Mating法)
诱饵载体在SD/-Trp固体平板上生长2~3 d后, 挑取单克隆菌落于60 mL SD/-Trp/Kan液体培养基, 30℃ 220转 min-1培养过夜, 离心后用5 mL SD/-Trp培养基重悬沉淀。混合5 mL诱饵载体菌液(Y187)和1 mL文库菌液(AH109)于2 L烧瓶中, 加入60 mL 2×YPDA/Kan, 轻摇混匀, 30℃ 40转 min-1温育24 h。混合液转移至50 mL离心管中, 6000´离心10 min, 弃上清, 8 mL 0.5×YPDA/Kan重悬沉淀,重悬液涂布SD/-Leu/-Trp/-His/-Ade固体平板, 每个平板加90 μL杂交液, 30℃黑暗培养7 d, 直至长出菌落。挑取单克隆菌落接种至15 μL 0.9% NaCl中, 点涂到SD/-Leu/-Trp/-His/-Ade/X-α-Gal固体平板上, 30℃培养2 d, 观察菌落的显色情况。
1.9 阳性克隆菌液PCR检测
候选阳性克隆菌液作为模板, 进行PCR检测。反应体系包含2× PowerPCR Master MIX 10.0 μL、阳性克隆菌液1.0 μL、pGADT7-F 1.0 μL、pGADT7-R 1.0 μL、ddH2O 7.0 μL。反应条件为95℃ 4 min; 95℃ 30 s, 60℃ 30 s, 72℃ 90 s, 共34个循环; 72℃ 10 min; 4℃保存。1%琼脂糖凝胶进行电泳检测, 含有目的条带的菌液送公司测序。
1.10 酵母双杂交回转验证
将筛选获得的互作蛋白编码基因, 使用在线网站(http://crm.vazyme.com/cetool/singlefragment.html)设计引物, 并进行PCR扩增, 目的片段与线性化载体重组后, 构建pGADT7-互作蛋白编码基因载体。构建成功的载体转化大肠杆菌(DH5α)感受态, 提取质粒后, 分别与诱饵载体pGBKT7-StMAPKK4共转化酵母(Y187)感受态, 阳性对照载体和阴性对照载体作为对照, 于SD/-His/-Trp (DDO)和SD/-Leu/-Trp/- His/-Ade/X-α-Gal (QDO-X)培养基上培养3~5 d, 观察菌落生长及颜色变化情况, 验证其互作真实性。
2 结果与分析
2.1 StMAPKK4生物信息学分析
通过构建马铃薯StMAPKK4与科民茄、番茄、风铃辣椒等9个物种的系统发育树发现, 该基因与科民茄和番茄的亲缘关系最近(图1)。SOPMA分析马铃薯StMAPKK4蛋白结构域二级结构主要包括27.91% α-螺旋、23.52%延伸链、5.05% β-转角及43.52%无规则卷曲。马铃薯StMAPKK4蛋白保守结构域预测分析如图2, 其含有蛋白激酶家族的Protein kinase domain (PF00069)结构域, 结果显示其位置定位于64~302 aa之间。Net Phos 3.1 Server预测马铃薯StMAPKK4蛋白质磷酸化位点结果如图3,对磷酸化位点(阈值>0.5)数量进行统计, 其中23个丝氨酸(Serine)位点, 13个苏氨酸(Threonine)位点, 5个酪氨酸(Tyrosine)位点, 印证了MAPKKs家族通过其丝氨酸/苏氨酸被上游MAPKKKs磷酸化而激活, 从而继续向下游传递信号。从基因顺式作用元件分析结果看(表3), 其含有多种激素相关(茉莉酸甲酯、乙烯、脱落酸、ABA)及胁迫相关(干旱、厌氧等)响应元件。
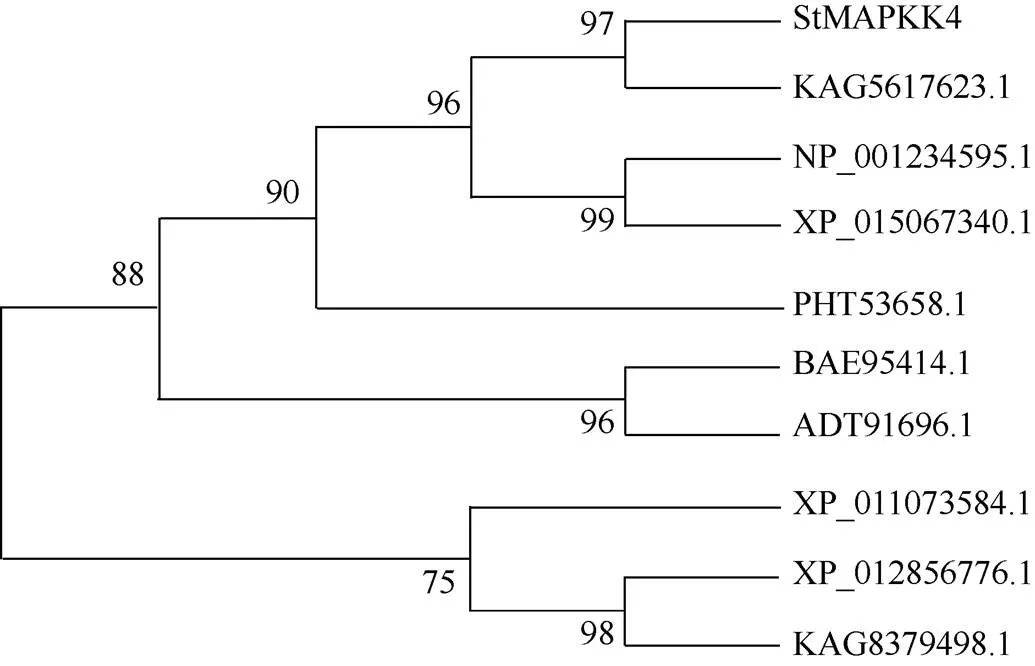
图1 马铃薯StMAPKK4基因与其他9个物种同源基因发生树

图2 马铃薯StMAPKK4蛋白保守结构域分析
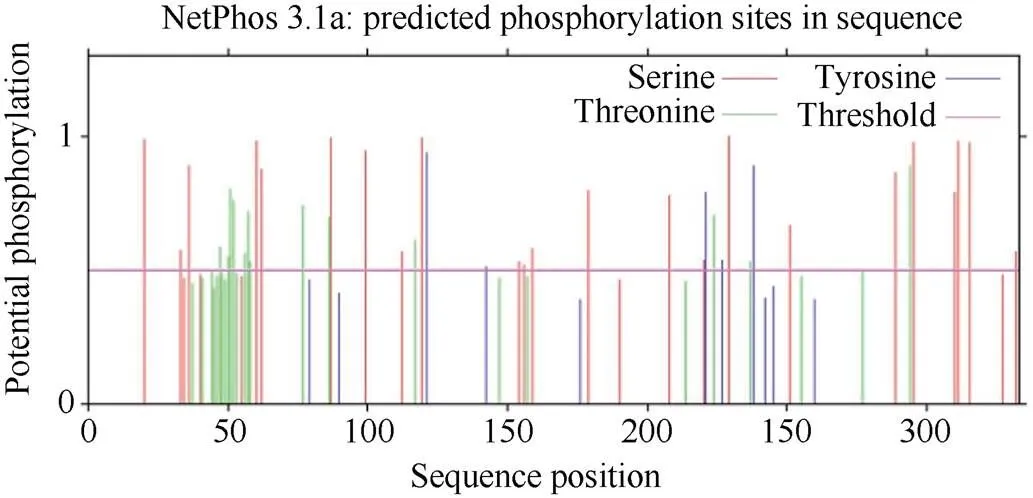
图3 马铃薯StMAPKK4蛋白质磷酸化位点分析

表3 马铃薯StMAPKK4基因启动子区顺式作用元件分析

(续表3)
2.2 StMAPKK4组织特异性表达分析
通过qRT-PCR分析基因在马铃薯品种“大西洋”中的组织特异性表达发现,在茎中表达量最高, 其次为叶和根(图4)。
2.3 胁迫处理下StMAPKK4基因表达分析
在干旱(20% PEG-6000)、盐(200 mmol L-1NaCl)及ABA处理下分析基因的相对表达量表明,的表达量在胁迫处理下呈现先上升后下降的趋势, 且均高于对照。干旱处理下,基因表达量在8 h达到峰值, 与对照形成显著差异; 盐处理下, 其表达量在12 h达到最大, 为对照的16倍; ABA处理下, 与对照相比,的基因表达量也明显上调(图5)。

图4 马铃薯StMAPKK4基因的组织特异性表达分析
柱上不同小写字母表示差异显著(< 0.05)。
Different lowercase letters above the bars mean significant difference at< 0.05.
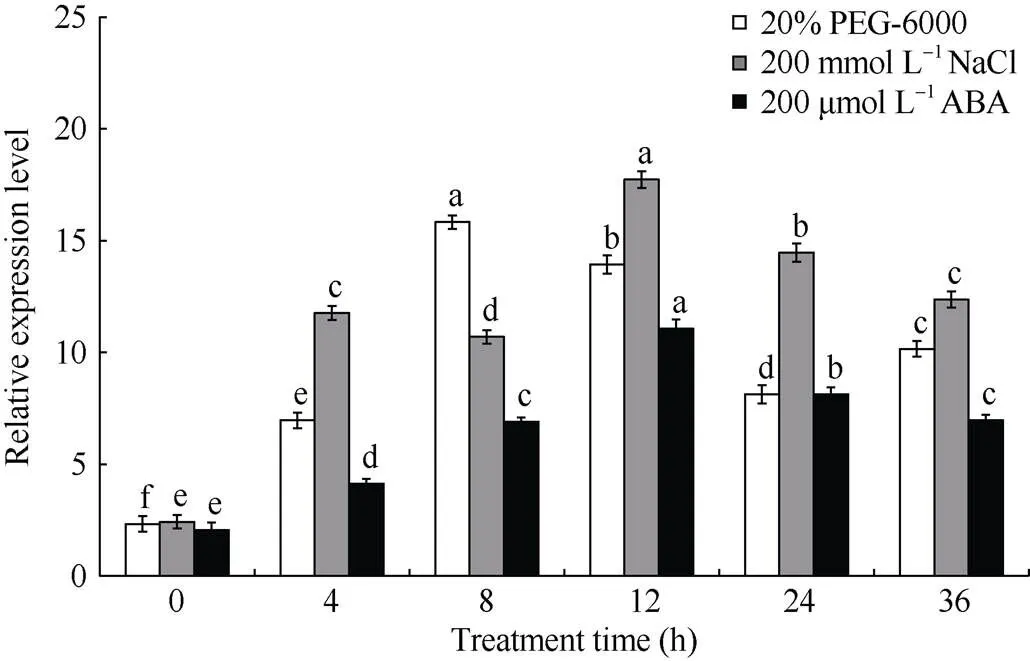
图5 干旱和盐胁迫下StMAPKK4基因表达量分析
柱上不同小写字母表示差异显著(< 0.05)。
Different lowercase letters above the bars mean significant difference at< 0.05.
2.4 StMAPKK4亚细胞定位
的重组产物大肠杆菌菌液PCR电泳检测结果显示与预期相符, 表明马铃薯基因已正确插入亚细胞定位载体。将注射有表达载体和空载体菌液的烟草叶片制成的玻片, 分别置于激光共聚焦显微镜(488 nm激光波长)下观察, 荧光分布状况显示: 对照组GFP空载体在细胞质、细胞膜和细胞核上均有分布, 而实验组基因判定定位于细胞膜上(图6)。
2.5 诱饵载体与文库菌液杂交及阳性克隆菌液PCR检测
分别涂布有诱饵载体和pGBKT7空载体的SD/-Trp平板生长菌落大小和数量基本一致; SD/- His/-Trp平板上则没有菌落生长, 说明诱饵载体无毒性(图7)。SD/-Leu/-Trp/-His/-Ade/X-α-Gal固体平板上, 只有阳性对照长出菌落, 阴性对照和试验组无菌落生长, 说明诱饵载体无自激活活性(图7)。表明, 可进行酵母双杂交文库筛选试验。
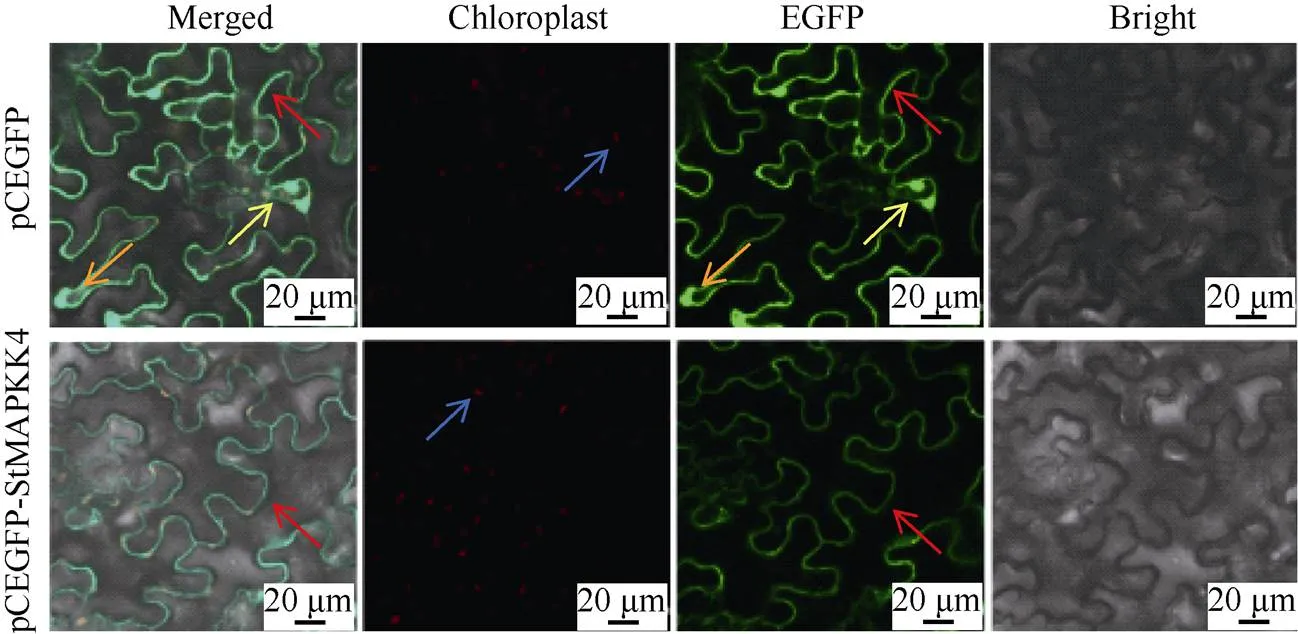
图6 马铃薯StMAPKK4亚细胞定位
pCEGFP: 空白对照(无基因的pCEGFP空载体); pCEGFP-StMAPKK4: pCEGFP-StMAPKK4融合蛋白; 黄色、橙色、红色、蓝色箭头分别表示细胞核、细胞质、细胞膜和叶绿体。
pCEGFP: blank control (pCEGFP empty vector withoutgene); pCEGFP-StMAPKK4: pCEGFP-StMAPKK4 fusion protein; Yellow, orange, red, and blue arrows indicate nucleus, cytoplasm, cell membrane, and chloroplast, respectively.

图7 酵母双杂交诱饵载体pGBKT7-StMAPKK4的毒性检测与自激活活性检测
诱饵载体与酵母文库的杂交液共涂布30个SD/-Leu/-Trp/-His/-Ade固体平板进行互作筛选, 于30℃倒置培养7 d后, 挑选直径较大、呈淡粉色或白色的单克隆菌落96个, 点涂到SD/-Leu/-Trp/-His/- Ade/X-α-Gal选择培养基上进行染色筛选, 48 h后呈现蓝色的候选阳性克隆有68个。候选阳性克隆进行菌液PCR电泳检测, 结果显示均为单一的明亮条带, 选取阳性克隆进行测序。
2.6 酵母双杂交回转验证
测序成功的阳性克隆有8个不同的StMAPKK4互作蛋白(表4)。将构建成功的互作蛋白双杂交载体分别与pGBKT7-StMAPKK4共转化到Y187, 阳性对照载体和阴性对照载体作为对照, 于SD/-His/-Trp (DDO)和SD/-Leu/-Trp/-His/-Ade/X-α-Gal (QDO-X)培养基上培养3~5 d, 除阴性对照未出现蓝色菌落外,阳性对照和互作蛋白与pGBKT7-StMAPKK4共转酵母后均在QDO-X培养基上长出蓝色菌落(图8), 说明pGBKT7-StMAPKK4与上述8个基因编码的蛋白存在互作。
3 讨论
MAPKK作为MAPK级联信号通路的重要组成部分, 广泛参与盐、干旱、损伤等非生物胁迫响应。当植物遭受非生物胁迫时, 体内ABA水平显著升高,气孔关闭, 水分流失减少, 以抵抗非生物胁迫对自身的危害[28]。玉米通过ABA依赖的方式促进气孔关闭, 诱导ABA依赖的胁迫响应基因和表达, 有效清除过量的活性氧, 增加盐胁迫的耐受性[29]。同样, ABA依赖的被磷酸化激活后能够增强拟南芥的抗旱性[30]。通过磷酸化激活MPK3介导的ABA信号通路, 可提高水稻对干旱胁迫的耐受性[31]。马铃薯基因启动子区含有多种ABA响应元件(ABRE)、干旱诱导相关元件(MYB、STRE), 且qRT-PCR显示该基因在干旱、盐及ABA处理下表达量均显著上调, 由此表明在非生物胁迫下发挥着重要作用。

表4 StMAPKK4互作蛋白信息

图8 StMAPKK4互作蛋白的酵母双杂交验证
各菌落上方的序号为表4中互作蛋白的编号。
The sequence numbers above each colony are the numbers of interacting proteins in Table 4.
酵母双杂交技术(yeast two-hybrid system)是Fields和Song[32]在研究真核基因转录调控中提出并建立起来的一种检测蛋白-蛋白相互作用的遗传方法。酵母双杂交技术被广泛应用于不同生物体的互作蛋白筛选。本试验在诱饵载体构建成功后对其进行了自激活检测, 利用MATa型酵母(AH109)和MATα型酵母(Y187)的接合生殖方式筛选互作蛋白, 并通过回转验证的方法检验蛋白间互作的真实性, 最大限度避免了假阳性的发生[33]。
本研究共筛选出8个StMAPKK4相互作用的蛋白, 分别涉及多酚氧化酶、渗透素合成、磷吸收等不同的生物学过程。其中, 多酚氧化酶(Polyphenol oxidase, PPO)是一类广泛存在于植物、动物和微生物中, 结构复杂的含铜氧化还原酶, PPO在果蔬褐变过程中发挥重要作用[34]。此外, PPO在生物胁迫及非生物胁迫下对环境都有着不同的响应。有研究表明, 多酚氧化酶调控丹参中丹酚酸B的积累, 且能响应干旱[35]。渗透素是一种抗真菌细胞毒素, 也是一种植物致病相关蛋白, 可导致酵母细胞快速死亡[36]。在橄榄树中, 渗透素通过与程序性细胞死亡相关的不同机制提供冷保护[37]。Jami等[38]报道龙葵渗透蛋白(osmotinlike protein, SniOLP)是一种PR蛋白, 具有抗真菌活性。此外, 渗透素还具有低温保护功能, 是PR5致病相关蛋白家族的一员[39-40]。已有研究表明, 马铃薯中渗透蛋白基因的过表达提供了对盐胁迫的耐受性[41]。利用渗透素启动子结合蛋白OPBP1再生的水稻转基因植株对盐胁迫的耐受性增强[42]。矿物质营养磷元素是植物正常生长发育最重要的物质之一。在植物生长的初期, 足量的磷素能够有效促进根系的快速生长发育、提升幼苗抵御逆境灾害的能力以及促进新器官的形成。植物的磷酸盐转运蛋白(phoosphate transporter, PT)能够从土壤中直接吸收无机磷酸盐并且它是将磷素进行再分配的载体[43]。磷转运蛋白基因家族分为PHT1、PHT2、PHT3、PHT4、PHT5及PHO1亚族[44]。其中, PHT1负责从土壤中摄取磷元素到植物中, PHT2通过介导叶绿体对磷的吸收影响植物光合作用, PHT3负责线粒体中磷的转运, PHT4负责细胞质与类囊体、高尔基体间磷的平衡, PHT5维持着细胞内整体磷浓度的稳定[45]。综上所述, 推测StMAPKK4可能参与光合作用响应机制、植物体低温、干旱及盐胁迫等一系列的非生物胁迫、促进植物体对磷元素的吸收等生理生化反应。
4 结论
本研究证明了马铃薯响应干旱及盐胁迫; 克隆了基因, 利用同源重组的方法构建其亚细胞定位表达载体pCEGFP-StMAPKK4并定位于细胞膜。通过酵母双杂交方法筛选得到8个StMAPKK4互作蛋白, 分别为多酚氧化酶、渗透素、磷酸盐转运蛋白等。
[1] Eiasu B K, Soundy P, Hammes P S. Response of potato () tuber yield components to gel-polymer soil amendments and irrigation regimes., 2007, 35: 25–31.
[2] 邓文红, 沈应柏, 陈华君, 李镇宇, 蒋湘宁. 昆虫取食和药剂熏蒸对马尾松针叶脱落酸和茉莉酸含量的影响. 应用生态学报, 2009, 20: 1166–1170.
Deng W H, Shen Y B, Chen H J, Li Z Y, Jiang X N. Effects of insect feeding and fumigation on abscisic acid and jasmonic acid contents inmassoniana needles., 2009, 20: 1166–1170 (in Chinese with English abstract).
[3] 蒙姜宇, 梁光伟, 贺亚军, 钱伟. 甘蓝型油菜耐盐和耐旱相关性状的QTL分析. 作物学报, 2021, 47: 462–471.
Meng J Y, Liang G W, He Y J, Qian W. QTL analysis of salt and drought tolerance traits inL., 2021, 47: 462–471 (in Chinese with English abstract).
[4] 秦天元, 刘玉汇, 孙超, 毕真真, 李安一, 许德蓉, 王一好, 张俊莲, 白江平. 马铃薯基因家族的鉴定及其对干旱胁迫的响应分析. 作物学报, 2021, 47: 780–786.
Qin T Y, Liu Y H, Sun C, Bi Z Z, Li A Y, Xu D R, Wang Y H, Zhang J L, Bai J P. Identification ofgene family and its response to drought stress in potato., 2021, 47: 780–786 (in Chinese with English abstract).
[5] 冯亚, 朱熙, 罗红玉, 李世贵, 张宁, 司怀军. 马铃薯响应低温胁迫的功能解析. 作物学报, 2022, 48: 896–907.
Feng Y, Zhu X, Luo H Y, Li S G, Zhang N, Si H J. Functional analysis ofin response to low temperature stress in potato., 2022, 48: 896–907 (in Chinese with English abstract).
[6] Ichimura K, Shinozaki K, Tena G. Mitogen-activated protein kinase cascades in plants: a new nomenclature., 2002, 7: 301–808.
[7] Jonak C, Ökrész L, Bögre L. Complexity, cross talk and integration of plant MAP kinase signalling., 2002, 5: 415–424.
[8] Colcombet J, Hirt H.MAPKs: a complex signalling network involved in multiple biological processes., 2008, 413: 217–26.
[9] Rohila J S, Yang Y. Rice mitogen-activated protein kinase gene family and its role in biotic and abiotic stress response., 2007, 49: 751–759.
[10] Rao K P, Richa T, Kumar K. In silico analysis reveals 75 members of mitogen-activated protein kinase kinase kinase gene family in rice., 2010, 17: 139–153.
[11] Wankhede D P, Misra M, Singh P. Rice mitogen activated protein kinase kinase and mitogen activated protein kinase interaction network revealed by in-silico docking and yeast two-hybrid approaches., 2013, 8: e65011.
[12] Kong X P, Pan J W, Zhang D. Identification of mitogen-activated protein kinase kinase gene family and MKK-MAPK interaction network in maize., 2013, 441: 964–969.
[13] Liu Y, Zhang D, Wang L. Genome-wide analysis of mitogen-activated protein kinase gene family in maize., 2013, 31: 1446–1460.
[14] Wu J, Wang J, Pan C. Genome-wide identification of MAPKK and MAPKKK gene families in tomato and transcriptional profiling analysis during development and stress response., 2014, 9: e103032.
[15] Wang J, Wang Y, Ye L. Genome-wide identification of MAPK, MAPKK, and MAPKKK gene families and transcriptional profiling analysis during development and stress response in cucumber., 2015, 16: 386.
[16] Suarez-Rodriguez MC, Petersen M, Mundy J. Mitogen-activated protein kinase signaling in plants., 2010, 61: 621–649.
[17] Meng X, Zhang S. MAPK cascades in plant disease resistance signaling., 2013, 51: 245–266.
[18] Xu J, Zhang S. Mitogen-activated protein kinase cascades in signaling plant growth and development., 2015, 20: 56–64.
[19] Asai T, Tena G, Plotnikova J. MAP kinase signaling cascade ininnate immunity., 2002, 415: 977–983.
[20] Galletti R, Ferrari S, De Lorenzo G.MPK3 and MPK6 play different roles in basal and oligogalacturonide- or flagellin-induced resistance against., 2011, 157: 804–814.
[21] Xiong L, Yang Y. Disease resistance and abiotic stress tolerance in rice are inversely modulated by an abscisic acid-inducible mitogen-activated protein kinase., 2003, 15: 745–759.
[22] Hua Z M, Yang X C, Fromm M E. Activation of the NaCl- and drought-induced RD29A and RD29B promoters by constitutively activeMAPKK or MAPK proteins., 2006, 29: 1761–1770.
[23] Gu L, Liu Y, Zong X. Overexpression of maize mitogen-activated protein kinase gene, ZmSIMK1 inincreases tolerance to salt stress., 2010, 37: 4067–4073.
[24] Xu H, Li K, Yang F. Overexpression of CsNMAPK in tobacco enhanced seed germination under salt and osmotic stresses., 2010, 37: 3157–3163.
[25] Zhang L, Xi D, Li S. A cotton group C MAP kinase gene,, positively regulates salt and drought tolerance in tobacco., 2011, 77: 17–31.
[26] 刘雪. 马铃薯MAPKK基因鉴定及其抗旱相关功能基因筛选. 甘肃农业大学硕士学位论文, 甘肃兰州, 2017.
Liu X. Identification of MAPKK Gene and Screening of Drought Resistance Related Functional Genes in Potato. MS Thesis of Gansu Agricultural University, Lanzhou, Gansu, China, 2017 (in Chinese with English abstract).
[27] 廖钰秋. 马铃薯StMAPKK1互作蛋白筛选及其互作蛋白基因功能解析. 甘肃农业大学硕士学位论文, 甘肃兰州, 2020.
Liao Y Q. Screening and Functional Analysis of Potato StMAPKK1 Interacting Protein Gene. MS Thesis of Gansu Agricultural University, Lanzhou, Gansu, China, 2020 (in Chinese with English abstract).
[28] 王国瑞, 袁珍, 张鹏钰, 仇晓, 刘志学, 王同朝, 卫丽. 玉米基因的表达及互作蛋白分析. 农业生物技术学报, 2020, 28: 389–398.
Wang G R, Yuan Z, Zhang P Y, Qiu X, Liu Z X, Wang T C, Wei L. Expression and interaction protein analysis ofgene in maize., 2020, 28: 389–398 (in Chinese with English abstract).
[29] Cai G, Wang G, Wang L. A maize mitogen-activated protein kinase kinase, ZmMKK1, positively regulated the salt and drought tolerance in transgenic., 2014, 171: 1003–1016.
[30] Li Y Y, Cai H X, Liu P.MAPKKK18 positively regulates drought stress resistance via down-stream MAPKK3., 2017, 484: 292–297.
[31] Ma H, Chen J, Zhang Z. MAPK kinase 10.2 promotes disease resistance and drought tolerance by activating different MAPKs in rice., 2017, 92: 557–570.
[32] Fields S, Song O. A novel genetic system to detect protein- protein interactions., 1989, 340: 245–246.
[33] 房宸曦, 车妍, 廖钰秋, 王一凡, 张宁, 司怀军. 酵母双杂交系统筛选马铃薯基因的互作蛋白. 农业生物技术学报, 2019, 27: 972–981.
Fang C X, Che Y, Liao Y Q, Wang Y F, Zhang N, Si H J. Screening of potatogene interaction protein by yeast two-hybrid system., 2019, 27: 972–981 (in Chinese with English abstract).
[34] 陈明俊. 应用基因编辑技术抑制马铃薯多酚氧化酶的研究. 贵州大学硕士学位论文, 贵州贵阳, 2018.
Chen M J. Inhibition of Polyphenol Oxidase in Potato by Gene Editing. MS Thesis of Guizhou University, Guiyang, Guizhou, China, 2018 (in Chinese with English abstract).
[35] 张海星. 丹参多酚氧化酶互作蛋白的筛选与验证. 西北农林科技大学硕士学位论文, 陕西杨凌, 2019.
Zhang H X. Screening and Validation ofPolyphenol Oxidase Interacting Proteins. MS Thesis of Northwest A&F University, Yangling, Shaanxi, China, 2019 (in Chinese with English abstract).
[36] Kupchak B R, Villa N Y, Kulemina L V. Dissecting the regulation of yeast genes by the osmotin receptor., 2008, 374: 210–213.
[37] D’Angeli S, Altamura M M. Osmotin induces cold protection in olive trees by affecting programmed cell death and cytoskeleton organization., 2007, 225: 1147–1163.
[38] Jami S K, Swathi A T, Guruprasad L. Molecular, biochemical and structural characterization of osmotin-like protein from black nightshade ()., 2007, 164: 238–252.
[39] Yun D J, Ibeas J I, Lee H. Osmotin, a plant antifungal protein, subverts signal transduction to enhance fungal cell susceptibility., 1998, 1: 807–817.
[40] Lee H, Damsz B, Woloshuk C P. Use of the plant defense protein osmotin to identifygenes that control cell wall properties., 2010, 9: 558–568.
[41] Evers D, Overney S, Simon P. Salt tolerance ofL., overexpressing a heterologous osmotin-like protein., 1999, 42: 105–112.
[42] Chen X, Guo Z. Tobacco OPBP1 enhances salt tolerance and disease resistance of transgenic rice., 2008, 9: 2601–2613.
[43] Zhang C, Meng S, Li M. Genomic identification and expression analysis of the phophate transporter gene family in popar., 2016, 7: 1398–1412.
[44] Lhamo D, Shao Q, Tang R. Genome-wide analysis of the five phosphate transporter families inand their expressions in response to low-P., 2020, 21: 8365.
[45] 王晓丹. 甜菜磷酸盐转运蛋白基因的克隆及表达分析. 黑龙江大学硕士学位论文, 黑龙江哈尔滨, 2021.
Wang X D. Cloning and Expression Analysis of Phosphate Transporter Gene in Sugar Beet. MS Thesis of Heilongjiang University, Harbin, Heilongjiang, China, 2021 (in Chinese with English abstract).
Relative expression analysis ofgene and screening and identification of its interacting proteins in potato (L.)
PU Xue1,WANG Kai-Tong1,ZHANG Ning1,2,*, and SI Huai-Jun1,2
1College of Life Science and Technology, Gansu Agricultural University,Lanzhou 730070, Gansu, China;2State Key Laboratory of Aridland Crop Science, Gansu Agricultural University,Lanzhou 730070, Gansu, China
MAPKKs, one of the main members of mitogen-activated protein kinase (MAPK) cascade, are located in the middle of the cascade pathway and play a key role in signal transduction. Studies have shown that potatogene responds to drought stress. To further explore the biological function ofgene, bioinformatics analysis was conducted in the study. The results showed thatwas most closely related to. It contained the protein kinase domain (PF00069) of the protein kinase family, which located between 64 aa and 302 aa.contained multiple hormones (methyl jasmonate, ethylene, and abscisic acid) and stress-related response elements. The qRT-PCR analysis revealed thatgene expression was the highest in potato stem. The relative expression levels were up-regulated under drought and salt treatments. Subcellular localization indicated that StMAPKK4 was localized on the cell membrane. Furthermore, eight proteins interacting with StMAPKK4 were screened by yeast two-hybrid method, and their interaction was verified by rotation experiment. Blast comparison of the interacting proteins indicated that StMAPKK4 interacted with polyphenol oxidase, phycocyanin, aspartate aminotransferase, osmotin, phosphate transporter, and other proteins. It was preliminarily concluded that StMAPKK4 may be involved in the response mechanism of photosynthesis, a series of abiotic stresses such as low temperature, drought, and salt stresses in plants, and promote the uptake of phosphorus in roots.
potato;gene; bioinformatics; qRT-PCR; subcellular localization; yeast two-hybrid
本研究由国家自然科学基金项目(31960444)和甘肃省干旱生境作物学重点实验室——省部共建国家重点实验室培育基地主任基金课题(GSCS-2019-Z03)资助。
This study was supported by the National Natural Science Foundation of China (31960444) and the Gansu Provincial Key Laboratory of Aridland Crop Science, Gansu Agricultural University (GSCS-2019-Z03).
通信作者(Corresponding author):张宁, E-mail: ningzh@gsau.edu.cn
E-mail: 824153833@qq.com
2022-01-04;
2022-05-05;
2022-05-23.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20220520.1753.004.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
