CD19蛋白结构、功能及其工程化改造的研究进展
2023-01-11孙瑞雪叶子弘
孙瑞雪,米 薇,叶子弘
(1.中国计量大学 生命科学学院,浙江 杭州 310018;2.中国计量科学研究院,北京 100029)
CD19蛋白是B细胞表面的Ⅰ型跨膜糖蛋白,其相对分子质量为95 ku,属于免疫球蛋白超家族成员(IgSF),具有单一的跨膜区、胞内C末端和胞外N末端,是淋巴瘤B细胞以及滤泡树突状细胞的生物标记物,在其他谱系或其他组织中不表达或低表达,因此它是包括急性淋巴细胞白血病和淋巴瘤在内的B细胞恶性肿瘤的最佳靶点[1,2]。CD19在B细胞反应调节因子中发挥正向调节作用,参与B细胞抗原受体(B-cell receptor,BCR)识别抗原的过程,同时还在维持体液及抗原诱导的免疫反应和耐受诱导之间的平衡方面起着关键作用[3-5]。CD19是成熟B细胞表面多分子复合物的重要成员,与补体受体CD21、CD81和CD225共同发挥作用[6]。该复合物通过调节内源性和受体诱导的信号可降低BCR介导的B细胞激活阈值。CD19与BCR相结合可促进细胞内钙释放和细胞增殖,触发下游Akt-PI3K和MAPKs信号通路[7]。CD19的表达量在B细胞的发育过程中起着至关重要的作用[8],其表达异常往往会影响各种细胞以及疾病的发生[9]。
CD19是目前CAR-T细胞治疗的主要靶点,然而CD19-ECD容易错误折叠和聚集[10,11],导致蛋白难以表达,该特性对体外和体内定量评估CAR-T细胞的功能造成了严重的阻碍,因此需要对CD19蛋白进行结构改造,以提高CD19蛋白的稳定性和表达水平。此外,对CD19蛋白结构和功能进行深入研究,有助于研发和优化改造CD19相关药物。无论抗体还是CAR-T产品,都需要以CD19蛋白的结构为基础展开,这有利于药物的早期研发以及后续的优化改造。本文首先介绍了CD19蛋白的结构特征,而后阐述了临床上基因自然突变与疾病的关系,最后总结了近年来国内外为提高工程化CD19-ECD的稳定性和表达水平的各种策略,从而为临床上检测或激活CAR-T细胞提供参考。
1 CD19蛋白的结构特征
1.1 CD19蛋白的一级结构
CD19蛋白由位于16号染色体16p11.2短臂上的CD19基因编码,该基因共由15个外显子组成,4个编码细胞外结构域,9个编码细胞质结构域。CD19分子包含556个氨基酸残基,信号肽由前19位氨基酸组成,具有两个C2组Ig样的细胞外结构域由20—294位的氨基酸组成,其中第一个Ig样环对于CD19的正确3D折叠及最终运输到质膜是至关重要的。跨膜域由23个氨基酸组成,高度保守的细胞质结构域由240个氨基酸组成。CD19的细胞质结构域含有19%的酸性氨基酸残基和10%的碱性氨基酸残基,部分区域具有较强的净负电荷。在C末端附近的9个酪氨酸残基,对BCR的信号起到传导作用[12,13]。部分酪氨酸残基在与BCR连接后,会被迅速磷酸化,以产生功能活跃的Src同源结构域2识别基序,介导调节分子向细胞表面募集[14]。除了参与BCR信号调节外,CD19还参与人类疱疹病毒和甲型病毒性肝炎的感染[15]。细胞质结构域中的三个酪氨酸残基Y391,Y482和Y513已被证明对CD19的生物学功能至关重要[16]。CD19独特的胞外区与含有多个酪氨酸磷酸化位点的胞质尾部结合,构成了理想的信号调节剂。值得注意的是,苯丙氨酸取代Y482和Y513上两个位置的酪氨酸,会抑制其他七种酪氨酸的磷酸化[3]。
1.2 CD19蛋白的二级结构
俞小娟等[15]使用ProtParam tool软件分析了CD19蛋白的稳定性,结果显示该蛋白在体外不稳定。再通过SOPM预测了全长CD19蛋白的高级结构,各组分所占比例从高到低依次为无规则卷曲,α-螺旋,β-转角。近年来,Teplyakov等[17]使用X-射线晶体学方法解析了CD19胞外区与抗CD19单抗B43复合物的结构。结果显示胞外域含有2种类型的二级结构,一种是β-折叠片,另一种是无规则卷曲,由6链β-折叠和10链β-折叠组成了一个夹心结构。环由二硫键Cys134-Cys173连接,另外两个二硫键Cys38-Cys261和Cys97-Cys200分别从与β-夹心相对的β-折叠片连接链B-R和G-M[18]。CD19蛋白的晶体结构显示了基于两个Ig折叠互换排列的独特分子拓扑结构,这与人们普遍接受的两个串联Ig样结构域形成鲜明对比[19,20]。该晶体结构有助于研究CD19与其他信号复合体的相互作用。
Susa等[21]使用冷冻电镜法解析了CD81与CD19共受体复合物与考妥昔单抗结合的结构,其中CD19由全长的胞外域和跨膜域组成。结果表明胞外域主要由无规卷曲组成,跨膜域为含有15个氨基酸残基的α-螺旋结构。该研究揭示了CD19与CD81共受体复合物组合的结构基础,这有助于合理设计B细胞功能障碍药物,还揭示了目前抗体选择策略主要集中在一个CD19胞外区表位上[22,23]。Jumper等[24,25]使用AlphaFold蛋白结构数据库对CD19蛋白的高级结构进行了预测,预测结构如图1,(https://www.alphafold.ebi.ac.uk/entry/P15391)。图中不同的颜色表示预测结果的准确性,准确性从高到低依次是深蓝色、浅蓝色、黄色和红色。预测的高级结构主要为无规则卷曲,α-螺旋,β-折叠。其中跨膜结构域与实验所得结果一致,含1个α-螺旋结构。胞外域包括多组通过loop环相连的β-折叠片,其环状区域是抗原结合表位,如包含两个赖氨酸和两个组氨酸的环216—224,所带的正电荷会与带负电荷的相关抗体产生静电相互作用。由于环是表位的中心元件,若基因插入将破坏大多数抗原抗体的相互作用,提示研究者们在体外重组表达CD19蛋白时,应重点关注该蛋白的环状区域。
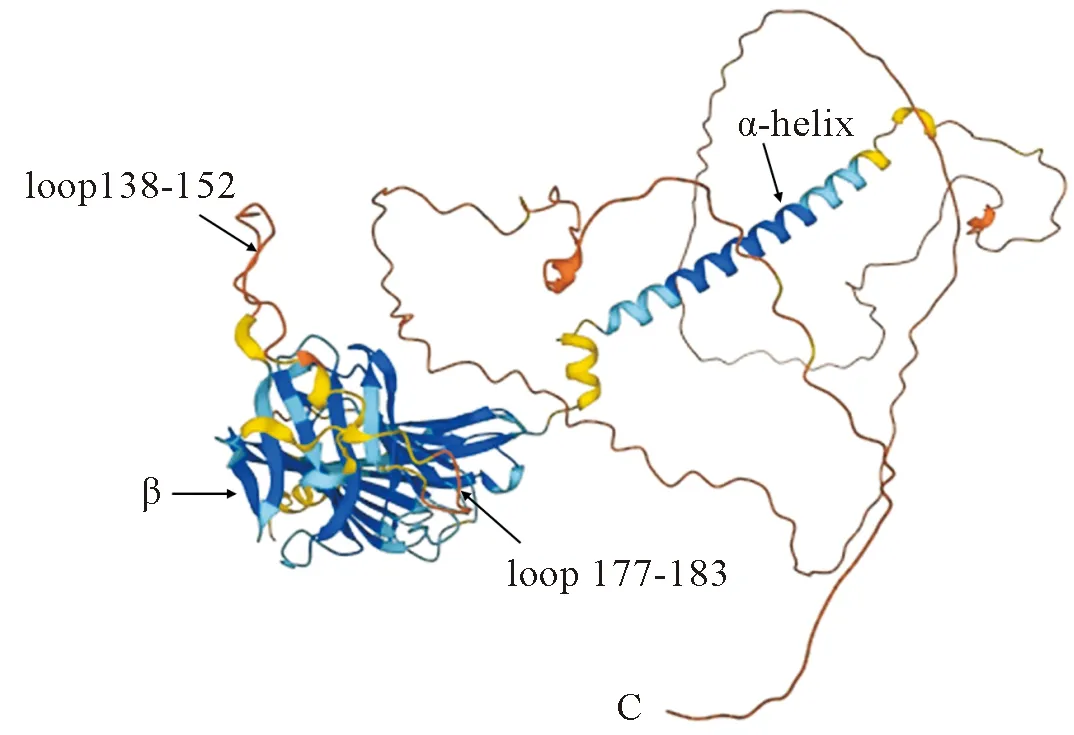
图1 CD19高级结构预测
1.3 CD19蛋白的糖基化修饰
UniProt数据库中有5个已报道的N糖基化位点,分别为86、125、138、181和265。多项研究发现,PNGase-F糖苷酶会使CD19蛋白的相对分子质量减小,这表明CD19蛋白的N-端连接了一些聚糖分子。Lobner等[26]用PNGase-F糖苷酶处理CD19胞外区融合蛋白,该融合蛋白切糖前相对分子质量为60~65 ku,切糖后相对分子质量减少了15 ku,该结果表明CD19蛋白存在糖基化修饰。Heard等[27]用两种糖苷酶处理CD19,其中Endo H糖苷酶只切割内质网中添加的核心(甘露糖)残基,而PNGase-F糖苷酶切割添加在高尔基体中的支链聚糖。结果显示PNGase-F处理导致CD19分子量显著减少,Endo H未显示分子量变化,这表明分子量的相对增加的原因是高尔基体上的糖基化。Laurent等[28]通过SDS-PAGE对CD19-ECD进行了分子量测定,预期总分子质量为44 ku,结果显示条带位于60 ku左右,5个潜在的N糖基化位点,每个贡献2~3 ku。X-射线晶体学方法发现Asn86和Asn125上的两个位点是糖基化的,Asn181和Asn265位于完全或部分无序的环中,因此它们的糖基化状态未知,其中一个位点被N138Q突变敲除[17]。
2 CD19突变与疾病
临床研究发现,CD19在免疫细胞中发挥着重要的功能,CD19基因突变会使B细胞受体信号缺陷,从而导致抗体缺乏综合征。Reisli等[29]发现CD19基因突变的患者会患上共同变异性免疫缺陷病,该疾病的特征是反复和严重感染,这突显了CD19在免疫细胞功能中的重要性。Menno等[30]对一名抗体缺陷综合症患者的CD19序列进行分析后,发现纯合错义突变导致色氨酸变为半胱氨酸(W52C),受影响的色氨酸位于CD19第一个胞外IgSF结构域的C链上,并被发现高度保守,该研究证明了高度保守的色氨酸在IgSF结构域的正确折叠或稳定性中的关键作用。由此可见,临床上CD19基因突变会使蛋白异常折叠和表达异常,从而导致该蛋白稳定性降低,丧失蛋白原有的生物学功能,提示人们在体外重组表达该蛋白时应关注此保守氨基酸残基,进行残基取代时不能对其活性和功能性产生不利影响。
CD19蛋白的糖基化也会影响它在体内的功能,研究表明翻译后修饰是CD19靶向CAR-T细胞有效性的重要调节因素。Heard等[27]研究发现CD19的N125位低糖基化会导致蛋白表达缺失,这严重损害了CAR-T细胞抗白血病的疗效。此外,CD19的N125位高糖基化会阻止CAR-T的活性,从而使CAR-T治疗产生耐药性,阻止N125的高糖基化会增强与FMC63抗体的结合。因此,CD19蛋白的糖基化与CAR-T治疗的效果密切相关,提示人们在体外开发CD19类蛋白探针时,需重点关注和严密监控它的糖基化,以获得满足临床CAR-T检测需求的探针。
3 针对CD19 CAR-T检测与激活的CD19蛋白工程的策略
3.1 蛋白质工程提高CD19稳定性
CD19-ECD容易错误折叠和聚集,这是CD19相关药物开发的主要障碍。由于蛋白质中单个或多个氨基酸突变,会导致蛋白质稳定性的改变。因此可通过氨基酸突变对CD19蛋白进行结构改造以提高其稳定性。研究表明,对CD19-ECD进行氨基酸突变,可以提高该蛋白的稳定性,并增强相关抗体的结合,改造后的蛋白在临床治疗中能发挥更大作用,并且推动了以CD19为靶向的细胞疗法的发展。截至目前,研究者们对于CD19-ECD工程化改造的研究较少,2019年,Klesmith等[31]通过基因突变得到了一个名为CD19.1ECD的特定改进突变体,与野生型相比有26个突变,突变后的CD19蛋白在热稳定性方面有了适度的改善,与FMC63和酵母表面的CD19抗体4G7的结合均有了很大的改善。Klesmith等[32]使用高通量筛选策略全面绘制了CD19 ECD变异体CD19.1与临床抗体结合的序列-功能图谱,为CD19靶向治疗提供了有价值的结构见解,提高了人们对CD19序列-功能关系的理解,并强调了深度测序在辅助蛋白工程方面的应用。2020年,Robb等[33]针对CD19胞外区构建了一系列突变体,每个突变体至少含1个氨基酸突变,突变后的CD19蛋白热稳定性水平均显著提高,对蛋白酶裂解更具有抗性,与抗体的亲和力增强。
CD19靶向免疫治疗的发展和监测的主要限制是缺乏稳定的,特别是单体CD19-ECD蛋白。解决CAR-T细胞检测问题的最好方案是产生一种稳定且易于使用的抗原,它能与CAR分子特异性地相互作用。近年有研究发现,对CD19-ECD进行基因突变,不仅能够提高该蛋白的稳定性,且突变体能够检测CAR-T细胞,这种分子改造解决了CAR-T细胞检测的难题。2021年,Laurent等[28]构建了一个名为SF05的CD19突变体,该突变体基本上保留了野生型序列,表现出了更好的折叠性能,且能以单体的形式进行纯化,提高了酵母表达水平和热稳定性。此外,它能够监测和表征淋巴瘤患者血液中CD19靶向的CAR-T细胞表型,非常适合体内检测和跟踪CD19 CAR-T细胞,并与其他标记相结合,确定其分化和激活状态。Delaney等[34]构建了一个名为gmCD19的糖突变试剂,改造的突变体为N138Q,突变后的CD19蛋白稳定性显著提高,可与CAR结构中CD19靶向的单链抗体结合,能够准确检测低至0.25%的CAR-T细胞。2022年,赵云等[35]构建了一个可用于CAR-T细胞高效检测的CD19突变体,突变后的CD19蛋白检测CAR-T细胞的灵敏度显著提高,能够更准确地判定CAR-T细胞阳性率,与单链抗体的亲和力和野生型CD19相比显著增强。近年来,通过蛋白质工程策略提高CD19蛋白稳定性的研究结果如表1。
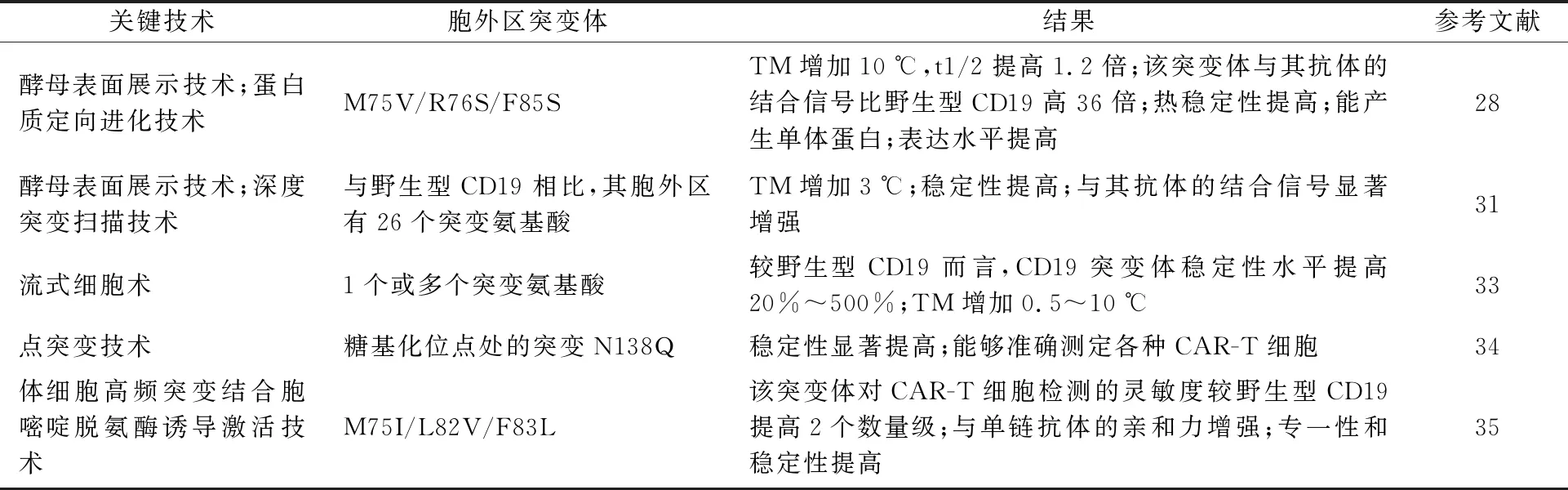
表1 基因突变提高CD19蛋白稳定性
3.2 构建CD19融合蛋白可改善CD19表达水平并激活和扩增CAR-T细胞
CD19-ECD是一种“难以表达”的蛋白质,该特性在靶向CD19免疫疗法的发展和机制分析方面造成了严重的障碍。为了克服与蛋白质表达困难相关的瓶颈,研究者们通过不同的策略产生了可溶性和有活性的蛋白质,以促进靶向CD19免疫疗法的发展。
研究发现,构建CD19融合蛋白不仅可产生稳定和产量高的蛋白质,还可用于激活和检测CAR-T细胞。例如Lobner等[26]将CD19-ECD C端与人血清白蛋白(HSA)的结构域2(AD2)融合后,显著提高了蛋白质的表达产量。表达和纯化的可溶性CD19-AD2融合蛋白以单体形式存在,高度稳定,天然折叠,最后通过对CD19 CAR-T细胞的有效刺激和突触形成证实了CD19-AD2的结构完整性和生物活性。De Oliveira等[36]最初将CD19胞外区基因的外显子1-3(CD19sIg1-3)或外显子1-4(CD19sIg1-4)与人IgG1Fc片段融合,发现融合到Fc结构域的CD19胞外区具有增强的溶解性和稳定性。且只有CD19sIg1-4融合蛋白能够与FMC63抗体特异性相互作用,该融合蛋白能够检测到低至0.5%的CAR-T细胞,可作为检测抗CD19 CAR-T的灵敏试剂。
众所周知,获得足够的CAR-T细胞是免疫治疗成功的关键,构建CD19融合蛋白不仅能改善CD19的表达,还可激活和扩增CAR-T细胞,因此这种结构改造能提供更好的治疗。Lian等[37]构建了一种可溶性的sCD19-SA融合蛋白,它由CD19-ECD和SA(Streptavidin,SA)的核心区组成,该融合蛋白可用于CAR-T细胞表达的功能检测和选择性扩增,且具有很强的激活抗CD19 CAR-T的能力。Ambrose等[38]将CD19-ECD和抗HER2抗体组成一个融合蛋白,构建的CD19融合蛋白有利于正常B细胞上CD19的表达,从而使CD19成为一个容易获得的抗原。此外,该融合蛋白可介导CD19 CAR-T细胞的激活,以允许扩增与免疫相关的CAR-T细胞,并增强持久性。CD19融合蛋白改善CD19表达水平及临床应用的研究结果如表2。

表2 CD19融合蛋白改善CD19表达水平及临床应用
4 总结与展望
CD19蛋白是体内重要的细胞因子,它与BCR相连接可协同增强细胞内钙释放、有丝分裂原激活蛋白激酶的活性和细胞增殖,CD19突变或异常表达会导致B细胞相关疾病的发生。CD19-ECD容易错误折叠和聚集,导致蛋白难以表达,这是CD19相关药物开发的主要障碍。参考CD19结构和功能的关系对其进行工程化改造,如:通过CD19基因突变不仅可以改善折叠性能还能提高稳定性;另外,通过构建融合蛋白可改善CD19蛋白探针的功能。稳定的CD19-ECD蛋白探针是监测治疗患者CAR-T细胞的完美工具;构建融合蛋白可改善蛋白的表达水平并激活和扩增CAR-T细胞。CD19结构和功能的深入研究有助于进一步了解相关疾病的机制,并为CD19蛋白工程化改造提供指导,帮助解决CD19 CAR-T应用中遇到的检测、激活和扩增等瓶颈问题。
