不同寄主植物桑寄生水提物对斑马鱼胚胎心脏发育毒性及机制研究
2023-01-10刘佳莉夏玉苹陈柳燕刘舒宁李健华李永华
刘佳莉,夏玉苹,陈柳燕,刘舒宁,李健华,汝 梅*,李永华*
不同寄主植物桑寄生水提物对斑马鱼胚胎心脏发育毒性及机制研究
刘佳莉1, 2,夏玉苹1,陈柳燕1,刘舒宁1,李健华3,汝 梅1*,李永华1*
1. 广西中医药大学,广西 南宁 530200 2. 广西中药药效研究重点实验室,广西 南宁 530200 3. 广西梧州神农良品农业科技有限公司,广西 梧州 543213
研究不同寄主植物桑寄生水提物对斑马鱼胚胎心脏发育毒性及其机制,为桑寄生用药安全提供理论依据。以受精后6 h(6 h post fertilization,6 hpf)正常发育的斑马鱼胚胎为动物模型,将桑树、柳树、油茶、夹竹桃、苦楝和漆树6种寄主植物桑寄生水提物各设置低、中、高3个药物浓度,分别处理斑马鱼胚胎,检测72 hpf孵化仔鱼的心脏形态、心率、心包面积、静脉窦(sinus venosus,SV)和动脉球(bulbus arteriosus,BA)间距、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性、心肌细胞的凋亡情况以及氧化应激相关酶基因[、、谷胱甘肽S-转移酶2(glutathione S-transferase 2,)]、心脏发育相关基因[GATA结合蛋白5(GATA binding protein 5,)、NK2同源框5(NK2 homeobox 5,)、肌球蛋白重链6(Myosin,heavy chain 6,)]及心肌细胞凋亡相关基因[B淋巴细胞瘤-2(B-cell lymphoma-2,)、Bcl-2相关X蛋白(Bcl-2 associated X protein,)]的表达水平。与空白组比较,除桑树寄主桑寄生外,其他5种桑寄生水提物处理的斑马鱼胚胎均出现不同程度的心包水肿、心率降低、心包面积和SV-BA间距增大(<0.05、0.01),SOD和CAT活性降低(<0.05、0.01),、、、、、的表达表现出明显的上调或下调(<0.05、0.01)。夹竹桃、苦楝和漆树3种寄主桑寄生还观察到心肌细胞凋亡,表达和/值明显降低(<0.05、0.01)。桑寄生对斑马鱼胚胎心脏发育毒性具有明显的寄主相关性,除桑树寄主桑寄生外,其他5种寄主桑寄生均表现出不同程度的心脏发育毒性,寄主植物不同,毒性机制也不同。
桑寄生;寄主;斑马鱼;心脏发育毒性;氧化应激;凋亡
桑寄生为桑寄生科植物桑寄生(DC.) Danser的干燥带叶茎枝,具有祛风湿、补肝肾、强筋骨、安胎元的功效,用于治疗风湿痹痛、腰膝酸软、筋骨无力、崩漏经多、妊娠漏血、安胎不动、头晕目眩等[1]。桑寄生属于半寄生植物药材,其寄主植物种类具有复杂多样性的生物特征,《中药大辞典》记载其寄主植物种类有29科50余种[2]。朱开昕等[3]对广西地区桑寄生寄主植物调查发现,广西境内的桑寄生寄主植物种类多达36科150多种。研究表明,寄主植物会通过向其桑寄生转移属于寄主植物的特征性成分从而对药材质量产生影响,包括转移寄主植物有毒成分至桑寄生使药材产生寄主样毒性[4]。《中国药典》通过对桑寄生进行强心苷成分的排除性检查,即仅排除可能来源于含强心苷的寄主植物的桑寄生,其他任何不含强心苷的寄主植物都有可能成为桑寄生药材来源的寄主植物,桑寄生属于多寄主植物种类来源的药材。
临床上强心苷通常用于慢性心力衰竭、心律失常等疾病治疗,但其使用安全范围十分狭窄并具有一定心脏毒性[5-6]。《中国药典》2020年版要求对桑寄生进行强心苷排除性检查,其主要目的也是防范含强心苷寄主植物来源的桑寄生,尤其是将其作为安胎功效使用时,防范药材可能发生胎儿心脏毒性。刘人源等[7]和柴子舒等[8]采用UPLC-Q-TOF-MS/MS技术对来源于夹竹桃寄主的桑寄生和红花寄生L.及其寄主夹竹桃进行强心苷类化合物鉴定发现,夹竹桃寄主植物能将其特有的强心苷成分向桑寄生和红花寄生转移。周芳等[9]对来源于夹竹桃寄主红花寄生对离体衰竭蛙心强心作用研究发现红花寄生会表现出寄主样的强心作用。本课题组前期采用桑树、漆树、油茶等6种寄主的桑寄生水提物对斑马鱼仔鱼肝毒性进行研究,发现除桑树寄主桑寄生外,其他5种寄主桑寄生均表现出不同程度的肝脏毒性[10]。本研究对桑树、柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生进行斑马鱼胚胎心脏发育毒性研究,探讨寄主对桑寄生心脏发育毒性影响及其机制,为规范寄主来源和保障桑寄生用药安全提供理论依据。
1 材料
1.1 动物
AB系野生型斑马鱼,由广西中医药大学中-加斑马鱼中药筛选联合实验室提供,斑马鱼饲养及繁殖参照《》。将健康的雌雄AB系野生型斑马鱼成鱼在28 ℃、光照14 h/黑暗10 h的条件下分开饲养,每天喂2次丰年虾,实验前一晚,将健康的AB斑马鱼成鱼,按雌雄1∶2放入底部有筛网的交配缸内,用透明隔板隔开,次日清晨移除隔板,产卵1 h内观察产卵量并收集鱼卵,用胚胎水冲洗数次,在体视显微镜下挑选受精发育正常的胚胎用于心脏发育毒性实验。
1.2 药材
桑树L.、柳树L.、油茶Abel.、夹竹桃Mill.、苦楝L.和漆树(Miq.) O. Kuntze 6种寄主桑寄生药材,经广西中医药大学李永华研究员鉴定,其药材基原植物为桑寄生科植物桑寄生(DC.) Danser,将采集的桑寄生样品室温阴干后再于45 ℃烘箱烘2 h,药材密封保存,备用。样品的采集信息见表1。
1.3 试剂
羧甲基纤维素钠(批号20181113)购自天津市大茂化学试剂厂;鱼安定(批号212-956-8)购自常州桌燊医药化工材料有限公司;逆转录试剂盒(批号00422877)购自美国Thermo Fisher Scientific公司;Eastep®Super总RNA提取试剂盒(批号0000394772)、Go Taq®qPCR Master Mix(批号0000480098)购自普洛麦格生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号20200804)、过氧化氢酶(catalase,CAT)试剂盒(批号20200928、20200927)购自南京建成生物科技有限公司。

表1 不同寄主桑寄生药材的样品信息
1.4 仪器
Z-A-D5x型斑马鱼养殖系统(上海海圣生物实验设备有限公司);EP64C型1/10万电子分析天平(梅特勒-托利多公司);SZX2-ILLT型体视显微镜(日本Olympus公司);M165FC型荧光立体显微镜(德国Leica公司);SpecteaMax M5e型多功能酶标仪(美国Molecular Devices);ST16R型低温高速离心机、NanoDrop 2000型超微量分光光度计(美国Thermo Fisher Scientific公司);Alpha 1-4LDplus型冷冻干燥机(上海博登生物科技有限公司);Light Cycler 96型荧光定量PCR仪(Roche公司)。
2 方法
2.1 样品制备
2.1.1 桑寄生水提物的提取与制备 分别称取桑树、柳树、油茶、夹竹桃、苦楝和漆树6种寄主桑寄生各75 g,分别加10、8、6倍量蒸馏水煎煮保持微沸状态45 min,合并3次滤液,浓缩成为浸膏,冷冻干燥,分别得到桑树、漆树、油茶、柳树、苦楝和夹竹桃寄主桑寄生水提物冻干粉末11.80、13.31、12.60、14.81、16.65、14.85 g。
分别准确称取桑树、漆树、油茶、柳树、苦楝和夹竹桃6种寄主桑寄生水提物冻干粉末0.16、0.18、0.17、0.20、0.22、0.20 g(相当于生药1.00 g),分别加入胚胎水,超声溶解,转移至100 mL量瓶中,定容,得生药质量浓度为10 mg/mL的水提物贮备液母液,分装,冻存,备用。
2.1.2 斑马鱼胚胎水溶液配制 按照斑马鱼国际资源中心(Zebrafish International Resource Center)养殖要求配制斑马鱼胚胎水,配制磷酸氢二钠0.25 mol/L、氯化钠0.14 mol/L、氯化钾5.40 mol/L、无水氯化钙1.30 mol/L、磷酸二氢钾0.44 mol/L、无水硫酸镁1.00 mol/L、碳酸氢钠4.20 mol/L的水溶液。
2.2 不同寄主桑寄生水提物对斑马鱼胚胎心脏发育的毒性剂量研究
2.2.1 桑寄生水提物对斑马鱼胚胎发育毒性影响预实验 在体视显微镜下选取受精后6 h(6 h post fertilization,6 hpf)发育正常的斑马鱼胚胎,并转移至含有不同质量浓度桑寄生水提物胚胎水的12孔板中,每孔10枚胚胎,设置3个复孔,置28 ℃恒温培养箱中培养,每隔24 h更换1次含相应桑寄生药液质量浓度的胚胎水,培育至72 hpf,统计不同寄主桑寄生的斑马鱼胚胎孵化和胚胎死亡情况,得出6种寄主桑寄生水提物的斑马鱼胚胎最小全致死浓度(LC100)和最大全不致死浓度(LC0)。
2.2.2 桑寄生水提物对斑马鱼胚胎发育毒性影响研究 根据预实验结果,分别在不同寄主桑寄生水提物的LC100与LC0范围内设置6个梯度药物质量浓度组,其中桑树寄主桑寄生6个药物质量浓度组为9.00、8.00、7.00、6.00、5.00、4.00 mg/mL,柳树寄主桑树寄生6个药物质量浓度组为6.00、5.20、4.40、3.60、2.80、2.00 mg/mL,油茶寄主桑寄生6个药物质量浓度组为5.00、4.12、3.24、2.36、1.48、0.60 mg/mL,夹竹桃寄主桑寄生6个药物质量浓度组为2.00、1.70、1.40、1.10、0.80、0.50 mg/mL,苦楝寄主桑寄生6个药物质量浓度组为2.00、1.70、1.40、1.10、0.80、0.50 mg/mL,漆树寄主桑寄生6个药物质量浓度组为0.60、0.52、0.44、0.36、0.28、0.20 mg/mL,空白组为不含有任何桑寄生药物的胚胎水。每孔10枚,设置3个复孔,每孔体积为4 mL,每隔24 h更换1次含有相应药物质量浓度的胚胎水,72 h统计各质量浓度斑马鱼胚胎孵化率和死亡率。通过Graphpad prism 8.0软件绘制量-毒曲线,计算出6种寄主桑寄生水提物的斑马鱼胚胎10%致死浓度(LC10)。根据上述实验得出的LC0和LC10,确定开展斑马鱼胚胎心脏发育毒性研究的不同寄主植物桑寄生药物剂量。
2.3 不同寄主桑寄生水提物对斑马鱼心脏毒性的影响
将不同寄主桑寄生水提物分别以1/2LC10、LC0和LC10设置为桑寄生水提物低、中、高3个质量浓度组,以观察各剂量组的心脏毒性情况,以不含任何桑寄生药物的胚胎水为空白组。在体视显微镜下挑选受精后发育正常6 hpf的斑马鱼胚胎,随机分组移入6孔板中,每孔30枚,每孔体积为6 mL,给药后置28 ℃的恒温培养箱培养,每隔24 h更换1次含有相应药物质量浓度的胚胎水,培养至72 hpf时移除药液,用胚胎水清洗3次,滴入0.05%的鱼安定溶液将其麻醉,用3%甲基纤维素钠固定斑马鱼仔鱼,仔鱼侧卧,在体视显微镜下观察和拍照,并录像记录1 min内斑马鱼仔鱼心跳次数,用Image-J软件测量仔鱼心包面积和静脉窦(sinus venosus,SV)和动脉球(bulbus arteriosus,BA)间距。
2.4 不同寄主桑寄生水提物对斑马鱼体内SOD和CAT活性的影响
给药方法同“2.3”项,培养至72 hpf,移除药液,用胚胎水清洗3次,将仔鱼转入1.5 mL离心管中,每管80尾,在−80 ℃下贮存。加入裂解液将仔鱼匀浆,离心取上清液,按照试剂盒说明书检测各药物组仔鱼体内SOD和CAT活性。
2.5 不同寄主桑寄生水提物对斑马鱼仔鱼心肌细胞凋亡的影响
采用吖啶橙(acridine orange,AO)荧光染色法检测不同药物质量浓度组仔鱼心肌细胞凋亡情况。给药方法同“2.3”项,培养至72 hpf,移除药液,用胚胎水清洗3次,吸除胚胎水后每孔加入2 mL AO染色溶液(2.5 µg/mL),避光,放置培养箱中孵育30 min,用胚胎水清洗3次,滴入0.05%的鱼安定溶液,将仔鱼麻醉,转移至含有3%甲基纤维素钠水溶液的培养皿中,在荧光显微镜下观察并拍照。
2.6 不同寄主桑寄生水提物对斑马鱼心脏发育毒性相关基因表达的影响
给药方法同“2.3”项,培养至72 hpf,移除药液,用胚胎水清洗3次,将仔鱼转入1.5 mL无酶EP管中,每个药物组收集尾斑马鱼仔鱼,在−80 ℃下贮存。使用Eastep®Super RNA提取试剂盒提取仔鱼总RNA,调整总RNA浓度后,使用逆转录试剂盒将不同组的等量总RNA样品逆转录为cDNA。设计相关基因的定量引物,引物序列见表2,作为内参,用Go Taq®qPCR Master Mix进行实时定量PCR分析相关基因的表达情况,两步PCR扩增程序为95 ℃、2 min,95 ℃、15 s,60 ℃、30 s,95 ℃、15 s,45个循环,结果采用2−ΔΔCt法计算氧化应激相关酶基因[、、谷胱甘肽S-转移酶2(glutathione S-transferase 2,)]、心脏发育相关基因[GATA结合蛋白5(GATA binding protein 5,)、NK2同源框5(NK2 homeobox 5,)、肌球蛋白重链6(Myosin,heavy chain 6,)]及心肌细胞凋亡相关基因[B淋巴细胞瘤-2(B-cell lymphoma-2,)、Bcl-2相关X蛋白(Bcl-2 associated X protein,)]的表达水平。

表2 引物序列
2.7 数据处理

3 结果
3.1 不同寄主桑寄生水提物的斑马鱼胚胎心脏发育毒性剂量确定结果
根据毒性实验中桑寄生各剂量组的斑马鱼仔鱼孵化和胚胎死亡统计结果,用GraphPad Prism 8.0软件绘制量-毒曲线,见图1,计算不同寄主桑寄生水提物的LC10。结合预实验结果,得到桑树、柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物的LC100、LC10和LC0。从表3可以看出,依据LC100和LC10判断,6种寄主桑寄生的毒性大小依次为漆树、苦楝、夹竹桃、油茶、柳树和桑树寄主的桑寄生。根据不同寄主桑寄生水提物的LC0和LC10,分别以其1/2LC10、LC0、LC10值设置为各寄主桑寄生水提物的低、中、高剂量组,以观察各剂量组的心脏毒性情况。不同寄主桑寄生水提物的低、中、高质量浓度如表4所示。

图1 不同寄主桑寄生水提物对斑马鱼胚胎发育毒性的量-毒曲线
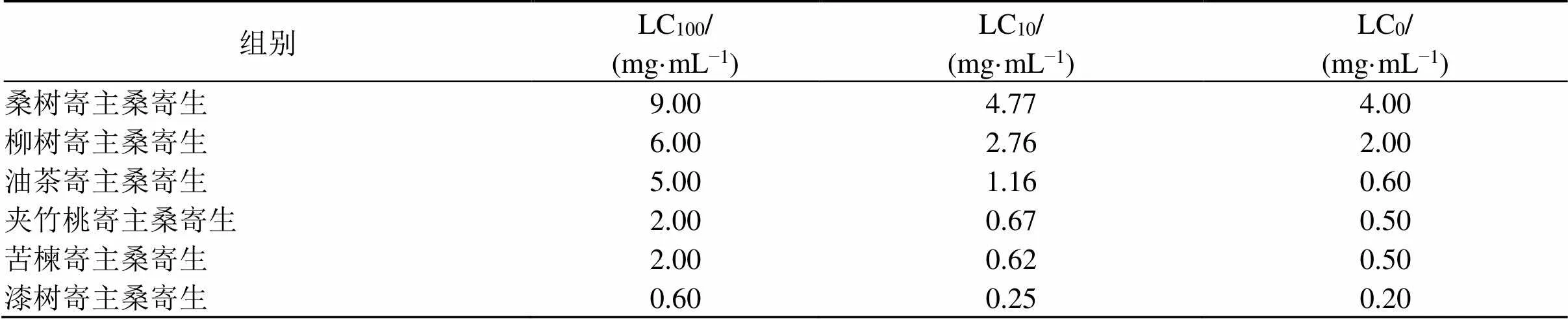
表3 不同寄主桑寄生水提物对斑马鱼胚胎72 hpf的LC100、LC10和LC0

表4 不同寄主桑寄生水提物3个药物质量浓度
3.2 不同寄主桑寄生水提物对斑马鱼仔鱼心率的影响
心率是直接反映斑马鱼心脏功能是否正常的重要指标,斑马鱼仔鱼在正常发育下心率约为120次/min[11]。如表5所示,空白组斑马鱼仔鱼心率为(125.20±9.27)次/min,与文献报道[11]基本一致。与空白组比较,桑树寄主桑寄生水提物低、中、高质量浓度组仔鱼心率均没有明显变化;柳树和油茶寄主桑寄生水提物高质量浓度组仔鱼心率均明显降低(<0.01),低、中质量浓度组仔鱼心率则没有明显变化;苦楝、夹竹桃寄主桑寄生水提物中、高质量浓度组仔鱼心率均明显降低(<0.01),低质量浓度组仔鱼心率没有明显变化;漆树寄主桑寄生水提物低、中、高质量浓度组斑马鱼仔鱼心率均明显降低(<0.01)。结果表明,除桑树寄主桑寄生外,柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物均具有降低斑马鱼仔鱼心率的作用,并表现出寄主和剂量的相关性。
3.3 不同寄主桑寄生水提物对斑马鱼仔鱼心脏形态发育的影响
如图2和表6所示,空白组仔鱼心脏发育正常,心血管系统完好,未见心包水肿。与空白组比较,桑树寄主桑寄生水提物低、中、高质量浓度组仔鱼心脏未出现心包水肿现象,心包面积和SV-BA间距没有明显变化;柳树和夹竹桃寄主桑寄生水提物中、高质量浓度组仔鱼出现心包水肿现象,心包面积和SV-BA间距明显增大(<0.05、0.01),低质量浓度组仔鱼心包面积和SV-BA间距没有明显增大;苦楝寄主桑寄生水提物中、高质量浓度组仔鱼出现心包水肿现象,心包面积和SV-BA间距明显增大(<0.05、0.01),低质量浓度组仔鱼SV-BA间距明显增大(<0.01),但心包面积没有明显变化;油茶和漆树寄主桑寄生水提物高质量浓度组仔鱼出现心包水肿,心包面积和SV-BA间距明显增大(<0.05、0.01),低、中质量浓度组仔鱼心包未出现心包水肿,心包面积和SV-BA间距没有明显变化。结果表明,除桑树寄主桑寄生水提物外,柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物对斑马鱼胚胎心脏发育表现出不同程度的毒性,出现心包水肿、心包面积和SV-BA间距增大,其毒性具有寄主和剂量的相关性。

表5 不同寄主桑寄生水提物对斑马鱼心率的影响 (, n = 10)
与空白组比较:*<0.05**<0.01,下表同
*0.05**0.01blank group, same as below tables

图2 不同寄主桑寄生水提物对斑马鱼心脏形态的影响

表6 不同寄主桑寄生水提物对斑马鱼心包面积和SV-BA间距的影响(, n = 10)
3.4 不同寄主桑寄生水提物对斑马鱼仔鱼SOD和CAT的影响
SOD和CAT是生物体内抗氧化防御体系中的关键酶。如表7所示,与空白组比较,桑树寄主桑寄生水提物低、中、高质量浓度组仔鱼SOD和CAT的活性没有明显变化;柳树寄主桑寄生水提物低、中、高质量浓度组仔鱼SOD活性明显降低(<0.05、0.01),油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物中、高质量浓度组仔鱼SOD活性均显著降低(<0.05、0.01),但低质量浓度组仔鱼SOD的活性没有明显降低;柳树、油茶和漆树寄主桑寄生中、高质量浓度组仔鱼CTA活性明显降低(<0.01),低质量浓度组仔鱼体内CAT活性没有明显降低;苦楝和夹竹桃寄主桑寄生水提物低、中、高质量浓度组仔鱼体内CAT活性明显降低(<0.05、0.01)。结果表明,除桑树寄主桑寄生外,柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物使斑马鱼SOD和CAT活性降低,也表现出寄主和剂量的相关性。

表7 不同寄主桑寄生水提物对斑马鱼SOD和CAT活性的影响(, n = 3)
3.5 不同寄主桑寄生水提物对斑马鱼仔鱼心肌细胞凋亡的影响
AO染色30 min后在荧光显微镜下观察斑马鱼仔鱼心肌细胞凋亡情况,结果见图3。空白组仔鱼心肌细胞没有观察到片状或点状致密的黄绿色亮点,表明没有存在心肌细胞凋亡。与空白组比较,桑树、柳树和油茶寄主桑寄生水提物低、中、高质量浓度组仔鱼心肌细胞未观察到片状或点状致密的黄绿色亮点;夹竹桃、苦楝和漆树寄主桑寄生水提物的中、高质量浓度组仔鱼心肌细胞观察到片状或点状致密的黄绿色荧光亮点,低质量浓度组仔鱼心肌细胞观察到稀疏点状黄绿色荧光亮点。结果表明,桑树、柳树、油茶寄主桑寄生水提物不会导致斑马鱼仔鱼心肌细胞凋亡,夹竹桃、苦楝和漆树寄主桑寄生水提物导致斑马鱼仔鱼心肌细胞凋亡。
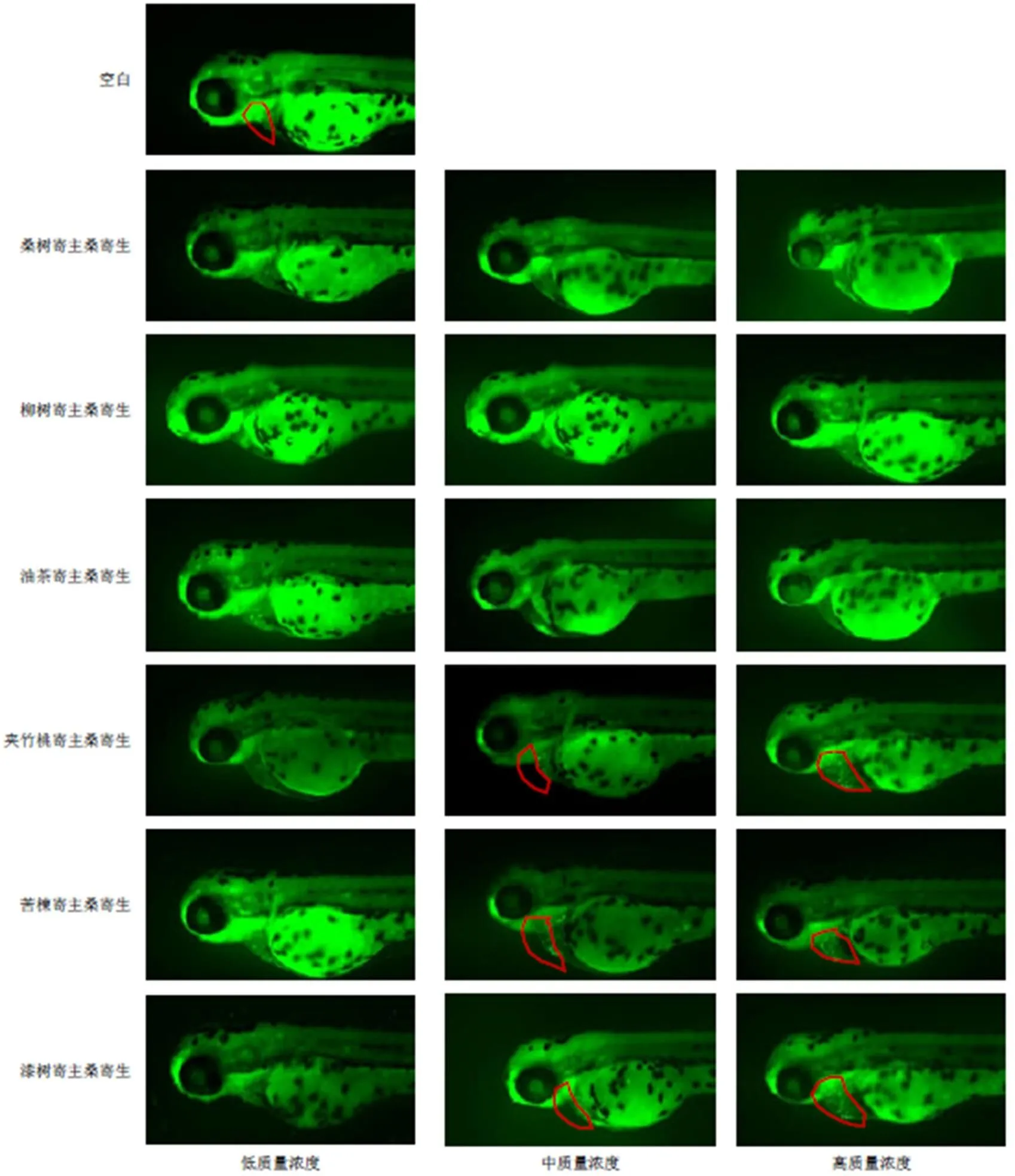
图3 不同寄主桑寄生水提物对斑马鱼心肌细胞凋亡的影响
3.6 不同寄主桑寄生水提物对斑马鱼胚胎心脏发育毒性相关基因表达的影响
3.6.1 对氧化应激相关基因表达的影响 如图4所示,与空白组比较,桑树寄主桑寄生水提物、、基因表达水平没有明显差异;柳树、夹竹桃和漆树寄主桑寄生水提物、、基因表达明显下调(<0.05、0.01);油茶寄主桑寄生水提物、基因表达明显下调(<0.05、0.01),基因表达明显上调(<0.01);苦楝寄主桑寄生水提物、基因表达明显下调(<0.01),而基因表达没有下调。结果表明,除桑树寄主桑寄生水提物外,柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物导致斑马鱼出现氧化应激反应可能与、、基因表达有关,相关基因表达水平出现明显的上调或下调,表现出具有寄主相关性。
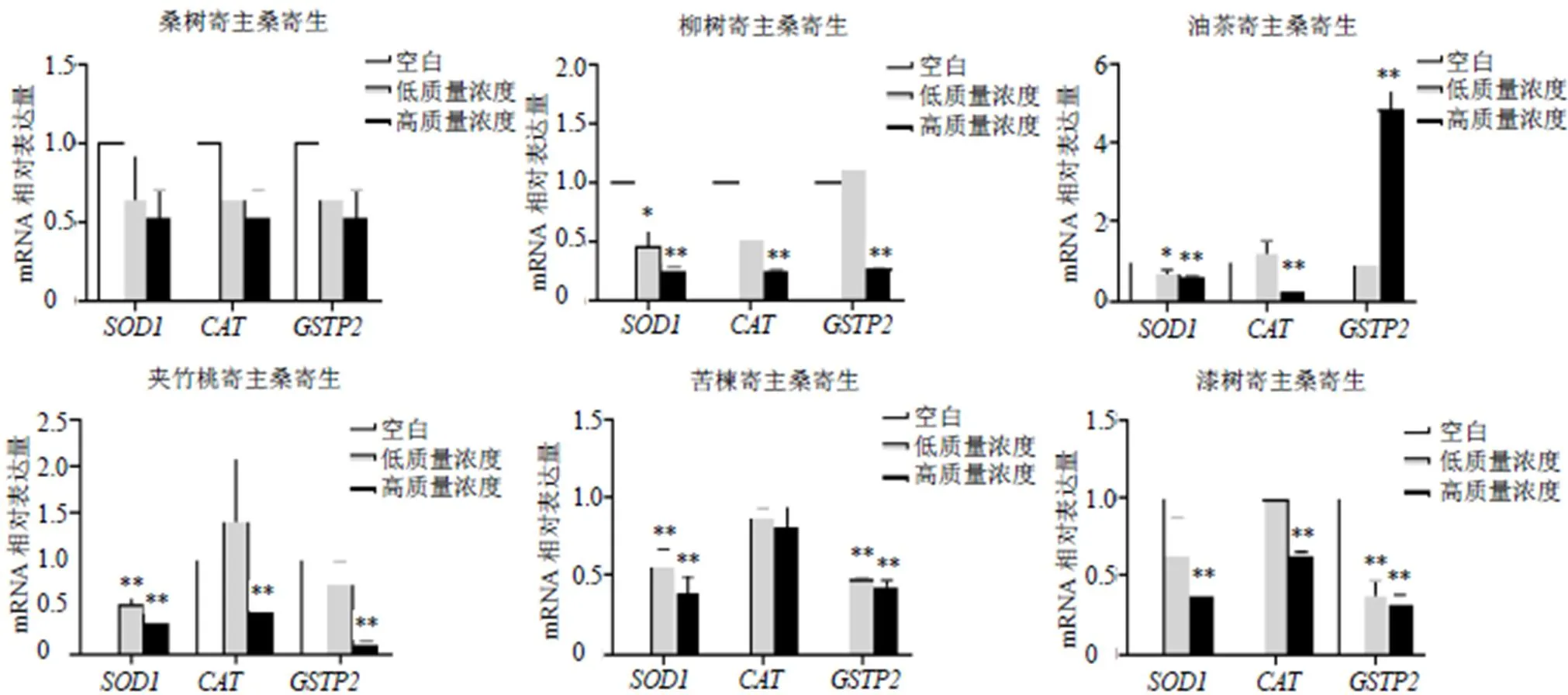
与空白组比较:*P<0.05 **P<0.01,下图同
3.6.2 对心脏发育相关基因表达的影响 如图5所示,与空白组比较,桑树寄主桑寄生水提物、、基因表达没有明显差异;柳树寄主桑寄生水提物基因表达明显下调(<0.05、0.01),、基因表达没有明显差异;油茶寄主桑寄生水提物基因表达明显下调(<0.01),、基因表达没有明显差异;夹竹桃寄主寄主桑寄生水提物、基因表达明显下调(<0.05、0.01),基因表达没有明显差异;苦楝寄主桑寄生水提物基因表达明显下调(<0.05、0.01),基因表达明显上调(<0.05),基因没有明显差异;漆树寄主桑寄生水提物基因表达明显下调(<0.01),和基因没有明显差异。结果表明,除桑树寄主桑寄生水提物外,柳树、油茶、夹竹桃、苦楝和漆树寄主桑寄生水提物导致斑马鱼胚胎心脏发育异常可能与、、基因表达有关,相关基因表达水平出现明显的上调或下调,表现出具有寄主相关性。

图5 不同寄主桑寄生组斑马鱼心脏发育相关基因的表达(, n = 3)
3.6.3 对心肌细胞凋亡相关基因表达的影响 如图6所示,与空白组比较,桑树寄主桑寄生水提物组、基因表达上调(<0.05、0.01),/值没有明显变化;柳树和油茶寄主桑寄生水提物、基因表达水平没有明显差异,/值没有明显差异;夹竹桃、苦楝和漆树寄主桑寄生基因表达下调(<0.01),基因表达没有明显差异,/值明显降低(<0.05、0.01)。结果表明,除桑树、柳树、油茶寄主桑寄生水提物外,夹竹桃、苦楝和漆树寄主桑寄生水提物诱导斑马鱼仔鱼心肌细胞凋亡可能与、基因表达有关,相关基因表达水平或表达的比值出现明显的下调或降低,表现出寄主相关性。

图6 各寄生组斑马鱼心肌细胞凋亡相关基因的表达(, n = 3)
4 讨论
心脏是斑马鱼胚胎发育过程中最早发育和发挥功能的器官,发育5 hpf后心脏祖细胞出现,22 hpf后心脏开始跳动,72 hpf后心脏发育完全[12],且斑马鱼心脏结构与人心脏结构相似[13]。斑马鱼胚胎透明,能直接在显微镜下观察到其心脏大小、形态、心率的变化,成为评价药物心脏毒性的理想动物模型[14-15]。对于可能以安胎功效入药使用的桑寄生而言,是否具有胚胎发育毒性,是桑寄生药材质量控制需要解决的首要问题。对于具有复杂寄主植物来源的桑寄生,《中国药典》2020年版通过对药材进行强心苷的排除性检查,即排除来自于含强心苷寄主植物的桑寄生可能造成的药材心脏毒性。但是,除了含强心苷寄主植物的桑寄生具有心脏毒性外,其他不含强心苷的寄主植物桑寄生是否也有心脏毒性,为本研究的主要目的所在。
采用柳树、油茶、夹竹桃、苦楝、漆树和桑树6种寄主桑寄生对斑马鱼胚胎进行心脏发育毒性与机制研究,除夹竹桃有强心苷成分相关报道外[7-8],其他5种寄主植物均未有任何相关研究报道。从6种寄主桑寄生的LC100和LC10可以看出,不含强心苷成分寄主(漆树、苦楝)的桑寄生比含有强心苷成分夹竹桃寄主的桑寄生毒性强。除桑树寄主桑寄生组斑马鱼未观察到心脏发育毒性外,其他不含强心苷成分寄主(柳树、油茶、苦楝和漆树)的桑寄生与含强心苷成分夹竹桃寄主的桑寄生在处理斑马鱼胚胎后,均观察到心包水肿、心包面积和SV-BA间距增大以及心率降低等异常现象,表现出不同程度的心脏发育毒性。提示《中国药典》对桑寄生进行强心苷成分的排除性检查,还不足以对有毒桑寄生的全面排除,表明规范寄主植物来源是实现桑寄生安全用药的重要途径。
SOD能够清除动物体内活性自由基,CAT可促使H2O2分解为分子氧和水,清除体内的过氧化氢[16-17]。本研究检测到除了桑树寄主桑寄生外,其他5种寄主植物桑寄生处理的斑马鱼仔鱼体内SOD和CAT活性均表现出不同程度的显著降低,表明斑马鱼仔鱼所受氧化损伤超出其自我修复能力,并引发明显毒性,本研究结果与斑马鱼胚胎长时间暴露在有毒物质硝酸铊和抗肿瘤药物卡培他滨的环境中实验结果一致[18-19]。
心肌细胞凋亡是药物诱发心脏毒性的重要毒性机制[20]。进一步对6种寄主植物桑寄生水提物处理的斑马鱼仔鱼的心肌细胞凋亡情况进行检测,结果显示,夹竹桃、苦楝和漆树3种寄主桑寄生水提物会导致斑马鱼仔鱼心肌细胞凋亡,而柳树和油茶树寄主桑寄生水提物表现出具有心脏发育毒性,却未观察到斑马鱼仔鱼心肌细胞凋亡,其机制值得进一步深入研究。
本研究选择了、、、、、、、8个基因进行表达量检测,其中、、与氧化应激有关[21],、、与心脏发育有关[22],、与心肌细胞凋亡有关[20]。结果显示,除了桑树寄主桑寄生药材外,其他5种寄主桑寄生水提物处理的斑马鱼胚胎,上述8种基因出现不同程度的表达水平异常,其中,与氧化应激有关的基因、、在柳树、油茶、夹竹桃、苦楝和漆树5种寄主桑寄生处理的斑马鱼胚胎中表达异常,出现明显的上调或下调,与这5种寄主植物桑寄生水提物处理的斑马鱼胚胎SOD和CAT活性降低、心包水肿和心率降低等结果一致,表明这5种寄主桑寄生心脏毒性可能与药材造成的氧化应激反应有关。与心脏发育有关的基因、、在5种寄主植物桑寄生水提物处理的斑马鱼胚胎中也出现明显的上调或下调,这5种寄主桑寄生可能会影响斑马鱼的心脏发育。与心肌细胞凋亡有关的基因、在6种寄主桑寄生水提物处理的斑马鱼胚胎中,夹竹桃、苦楝和漆树寄主桑寄生水提物处理的斑马鱼胚胎基因表达明显下调,/值明显降低,而桑树、柳树和油茶树桑寄生水提物处理的斑马鱼胚胎相关基因的表达则没有表现出同样的变化,心肌细胞凋亡相关基因的表达结果与实验观察到的心肌细胞凋亡现象结果一致。
综上所述,桑寄生心脏发育毒性具有寄主相关性,除桑树寄主桑寄生外,其他5种寄主桑寄生均表现出不同程度的心脏发育毒性,其中,柳树和油茶寄主桑寄生的心脏发育毒性可能与氧化应激反应、心脏发育异常有关,而夹竹桃、苦楝和漆树寄主桑寄生的心脏发育毒性则可能与氧化应激反应、心脏发育异常、心肌细胞凋亡有关。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S]. 一部. 2020: 312.
[2] 江苏新医学院. 中药大辞典-上册 [M]. 缩印本. 上海: 上海科学技术出版社, 1986: 1970-1973.
[3] 朱开昕, 卢栋, 裴河欢, 等. 桑寄生在广西的分布及其寄主状况调查 [J]. 广西中医药, 2010, 33(2): 59-61.
[4] 柴子舒, 刘人源, 李立章, 等. 中药桑寄生使用与存在问题及对策研究 [J]. 中华中医药杂志, 2020, 35(4): 2066-2069.
[5] St-Onge M. Cardiovascular drug toxicity [J]., 2021, 37(3): 563-576.
[6] Kanji S, MacLean R D. Cardiac glycoside toxicity: More than 200 years and counting [J]., 2012, 28(4): 527-535.
[7] 刘人源, 黄蜚颖, 郭敏, 等. 基于UPLC-Q-TOF-MS/MS技术的夹竹桃寄主及其桑寄生强心苷成分相关性研究 [J]. 中国中药杂志, 2019, 44(11): 2283-2291.
[8] 柴子舒, 刘人源, 李立章, 等. 基于UPLC-Q-TOF-MS/MS技术的红花寄生及其寄主夹竹桃强心苷成分相关性分析 [J]. 中国实验方剂学杂志, 2019, 25(22): 138-146.
[9] 周芳, 李爱媛, 廖月葵, 等. 桑寄生与红花寄生强心作用的比较研究 [J]. 时珍国医国药, 2008, 19(9): 2236-2237.
[10] 夏玉苹, 何春花, 柴子舒, 等. 不同寄主桑寄生水提物对斑马鱼模型的急性毒性及肝损伤 [J]. 中国实验方剂学杂志, 2021, 27(21): 91-97.
[11] 许中石, 刘佳杰, 陈辰, 等. 生物活性物质对斑马鱼急性毒性和发育毒性的研究进展 [J]. 山东化工, 2021, 50(14): 93-95.
[12] Park M J, Lee K R, Shin D S,. Predicted drug-induced bradycardia related cardio toxicity using a zebrafishmodel is highly correlated with results fromtests [J]., 2013, 216(1): 9-15.
[13] 王新栋, 孙雪婧, 赵巧雅, 等. 斑马鱼心脏的显微与超微结构 [J]. 水产学报, 2019, 43(8): 1733-1748.
[14] Zakaria Z Z, Benslimane F M, Nasrallah G K,. Using zebrafish for investigating the molecular mechanisms of drug-induced cardiotoxicity [J]., 2018, 2018: 1642684.
[15] Han Y, Zhang J P, Qian J Q,. Cardiotoxicity evaluation of anthracyclines in zebrafish () [J]., 2015, 35(3): 241-252.
[16] Maharajan K, Muthulakshmi S, Nataraj B,. Toxicity assessment of pyriproxyfen in vertebrate model zebrafish embryos (): A multi biomarker study [J]., 2018, 196: 132-145.
[17] Wang C X, Harwood J D, Zhang Q M. Oxidative stress and DNA damage in common carp () exposed to the herbicide mesotrione [J]., 2018, 193: 1080-1086.
[18] 范力海, 张欣彤, 侯丽萍. 硝酸铊对斑马鱼胚胎的发育毒性 [J]. 湖南农业科学, 2021(9): 32-37.
[19] 王利利, 赵文广, 丁壮, 等. 卡培他滨对非靶标生物斑马鱼胚胎的发育毒性研究 [J]. 生态科学, 2019, 38(4): 85-90.
[20] Wang X, Yang X L, Wang J Z,. Cardiotoxicity of sanguinarine via regulating apoptosis and MAPK pathways in zebrafish and HL1 cardiomyocytes [J]., 2022, 252: 109228.
[21] Yan R, Ding J, Wei Y J,. Melatonin prevents NaAsO2-induced developmental cardiotoxicity in zebrafish through regulating oxidative stress and apoptosis [J]., 2022, 11(7): 1301.
[22] Lu J, Wang W G, Xu W P,. Induction of developmental toxicity and cardiotoxicity in zebrafish embryos by Emamectin benzoate through oxidative stress [J]., 2022, 825: 15404.
Cardiac developmental toxicity and mechanism of aqueous extracts offrom different hosts in zebrafish embryo
LIU Jia-li1, 2, XIA Yu-ping1, CHEN Liu-yan1, LIU Shu-ning1, LI Jian-hua3, RU Mei1, LI Yong-hua1
1. Guangxi University of Chinese Medicine, Nanning 530200, China 2. Guangxi Key Laboratory of Efficacy Study on Chinese Materia Medica, Nanning 530200, China 3. Guangxi Wuzhou Shennong LiangpinAgricultural Technology Co., LTd., Wuzhou 543213, China
To study the cardiac developmental toxicity and mechanism of aqueous extracts of Sangjisheng () from different hosts in zebrafish embryo, and provide theoretical basis for drug safety of.The normally developed zebrafish embryos at 6 h post fertilization (6 hpf) was used as the animal model. Zebrafish embryos were treated with low-, medium-, high-concentrations of aqueous extracts offrom(mulberry, THM),(willow, THW),(THC),(oleander, THO),(neem, THN) and(hoggum, THH). Then, heart morphology, heart rate, pericardial area, and sinus venosus-bulbus arteriosus (SV-BA) spacing length, activities of superoxide dismutase (SOD) and catalase (CAT), and cardiomyocytes apoptosis of zebrafish at 72 hpf were observed and measured. The expression levels of oxidative stress-related genes [,, glutathione S-transferase 2 ()], cardiac development-related genes [GATA binding protein 5(), NK2 homeobox 5(), myosin heavy chain 6 ()] and cardiomyocyte apoptosis-related genes [B-cell lymphoma-2 (), Bcl-2-related X protein ()] were detected.Compared with control group, except for the zebrafish of THM, the other five groups all presented pericardial edema, decreased heart rate, increased SV-BA in varying degrees (< 0.05, 0.01), activities of SOD and CAT were all reduced (< 0.05, 0.01),,,,andexpression levels were significantly up- or down-regulated (< 0.05, 0.01)Cardiomyocytes appeared apoptosis in the groups of THO, THN and THH,expression and/were also significantly decreased (< 0.05, 0.01).Cardiac developmental toxicity ofto zebrafish embryos is obviously host-dependent. Except for THM, the others all show varying degrees of cardiac developmental toxicity. The toxicity mechanism is also dependent on the host plants.
; host; zebrafish; cardiac developmental toxicity; oxidative stress; apoptosis
R285.5
A
0253 - 2670(2023)01 - 0160 - 12
10.7501/j.issn.0253-2670.2023.01.019
2022-10-10
国家自然科学基金资助项目(82160754);国家自然科学基金资助项目(81960722);广西科技基地和人才专项(桂科AD19245087);中药学广西一流学科建设项目(桂教科研[2022]1号);中药学广西一流学科建设项目(2018XK027,2019XK091,2019XK097);广西研究生教育创新计划资助项目(JGY2020102);广西食品安全地方标准制定计划项目(2022007)
刘佳莉(1998—),硕士研究生,研究方向为中药质量控制与中药资源开发。E-mail: 2360535705@qq.com
通信作者:李永华(1964—),博士,研究员,研究方向为中药质量控制与中药资源开发。E-mail: liyonghua185@126.com
汝 梅(1987—),博士,讲师,研究方向为药用植物资源与开发。E-mail: rumei2015@163.com
[责任编辑 李亚楠]
