基于回肠顶端钠依赖性胆酸转运体探究栀子水提物对小鼠胆汁淤积的治疗作用
2023-01-10张国强文苑洁董毓松石晓盼魏玉辉
张国强,文苑洁,董毓松,石晓盼,魏玉辉
基于回肠顶端钠依赖性胆酸转运体探究栀子水提物对小鼠胆汁淤积的治疗作用
张国强1, 4,文苑洁3, 4,董毓松1, 2,石晓盼1, 2,魏玉辉1, 4*
1. 兰州大学第一医院 药剂科,甘肃 兰州 730000 2. 兰州大学第一临床医学院,甘肃 兰州 730000 3. 兰州大学药学院,甘肃 兰州 730000 4. 甘肃省医院中药制剂产业技术创新联盟,甘肃 兰州 730000
基于回肠顶端钠依赖性胆酸转运体(apical sodium-dependent bile acid transporter,ASBT)考察栀子水提物对α-异硫氰酸萘酯(α-naphthyl isothiocyanate,ANIT)诱导的胆汁淤积小鼠的治疗作用,并筛选潜在的活性化合物。C57BL/6小鼠随机分为对照组、栀子对照(240 mg/kg)组、ANIT组及栀子水提物低、中、高剂量(60、120、240 mg/kg)组和熊去氧胆酸(60 mg/kg)组,每组10只。给予药物进行干预,2次/d,连续14 d;于第12天单次ig ANIT(50 mg/kg)诱导小鼠胆汁淤积模型。采用栀子水提物干预ANIT诱导的小鼠小肠上皮MODE-K细胞;测定血清生化指标及肝脏、血清、胆囊、回肠及粪便中胆酸盐含量;测定小鼠回肠及MODE-K细胞ASBT及法尼酯X受体(farnesoid X receptor,FXR)的表达;采用原位肠灌流及外翻肠囊法测定回肠组织及肝门静脉中牛磺胆酸钠(taurocholate sodium,TCA)含量;采用定性代谢组学技术测定给予栀子水提物2 h后血清及回肠组织中的化合物。与ANIT组比较,栀子水提物能缓解肝脏病变,减少肝脏胆酸盐及回肠TCA含量(<0.05、0.01),增加粪便胆酸盐的含量(<0.05);增加小鼠回肠及MODE-K细胞FXR表达(<0.05、0.01、0.001),减少ASBT的表达(<0.01、0.001)。同时,筛选出潜在的活性化合物37个。栀子水提物可通过激活回肠FXR而抑制回肠ASBT的表达和功能,减少回肠胆酸盐重吸收并促进粪便排泄,减少肝脏胆酸盐蓄积,从而缓解ANIT诱导的小鼠肝内胆汁淤积。
栀子;胆汁淤积;顶端钠依赖性胆盐转运体;法尼醇X受体;京尼平;京尼平苷;京尼平龙胆二糖苷
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠,体质量19~21 g,8周龄,购自中国农业科学院兰州畜牧与兽药研究所,许可证号SCXK(甘)2020-0002。动物饲养于温度20~25 ℃、相对湿度40%~60%及通风良好的动物房里,给予小鼠标准维持饲料并自由饮水,每日光照12 h。小鼠于实验前适应性喂养1周。动物实验经兰州大学第一医院伦理委员会批准(批准号LDYYLL2017-72)。
1.2 细胞
小鼠小肠上皮MODE-K细胞(批号BNCC338300)购自北纳生物。
1.3 药材
栀子购自甘肃冠兰中药饮片有限公司,产地为江西省樟树市,经甘肃省药品检验研究院宋平顺教授鉴定为茜草科植物栀子Ellis的干燥成熟果实。
1.4 药品与试剂
α-异硫氰酸萘酯(α-naphthyl isothiocyanate,ANIT,批号STBH7289)购自美国Sigma-Aldrich公司;牛磺胆酸钠(taurocholate sodium,TCA,批号B26949)购自上海源叶生物科技有限公司;RIPA裂解液(批号P0013B)购自碧云天生物技术研究所;天冬氨酸氨基转移酶(aspartate aminotransferase,AST)试剂盒(批号C010-2-1)、总胆汁酸(total bile acids,TBA)试剂盒(批号E003-2-1)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(批号C009-2-1)、碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(批号A059-2-2)、总胆红素(total bilirubin,TBIL)试剂盒(批号C019-1-1)购自南京建成生物工程研究所;法尼酯X受体(farnesoid X receptor,FXR)抗体(批号sc-25309)购自Santa Cruz公司;β-actin抗体(批号TA-09)购自北京中杉金桥生物技术有限公司;ASBT抗体(批号ab203205)、HRP标记的山羊抗兔抗体(批号ab6721)、HRP标记的山羊抗大鼠抗体(批号ab6789)购自英国Abcam公司;其他试剂均为国产分析纯;纯化水为兰州大学第一医院自制。
1.5 仪器
1260型高效液相色谱仪、6460型质谱仪(美国安捷伦公司);3k15型高速离心机(美国Sigma公司);DYY-6C型电泳仪(北京市六一仪器厂);TP-24型组织细胞破碎仪(北京飞驰科学仪器公司);AU400型全自动生化分析仪(日本Olympus公司);LT-224S型电子天平(德国Sartorius公司)。
2 方法
2.1 栀子水提物的制备
栀子水提物与本课题组前期研究[5]为同一批,栀子采用水煎法提取2次,合并滤液,喷雾干燥得粉末,药材提取率为10%。测定栀子提取物中9种主成分含量用于质量控制,其中京尼平苷115 660.02 ng/mL、木犀草苷4 422.28 ng/mL、京尼平龙胆二糖苷1 279.94 ng/mL、木犀草素1 020.7 ng/mL、京尼平苷酸962.46 ng/mL、鼠李柠檬素175.84 ng/mL、6α-羟基栀子苷181.08 ng/mL、栀子苷B 124.86 ng/mL、滨蒿内酯101.46 ng/mL。
初中数学是培养学生逻辑思维的重要学科。在这个过程中,我们不仅要传授数学基础知识,同样还需培养学生的核心素养。因此教师需要在进行数学知识教学的过程中,逐步培养学生的逻辑能力,推理能力,空间想象等能力,同时强化学生利用数学知识解决问题的能力,综合提升学生核心素养。而令学生具有利用数学知识解决问题的能力,首要之急便是将数学与实践联系起来。因此教师在教学过程中需要通过各种各样的实践活动,令学生在实践之中习得新知识,感受知识与实际生活的联系。同时在实验之中,学生自己动手进行探索解决问题更可以提升其核心素养。
2.2 动物分组、给药及造模
C57BL/6雄性小鼠随机分为对照组、栀子对照(240 mg/kg)组、模型组及栀子水提物低、中、高剂量(60、120、240 mg/kg)组和熊去氧胆酸(60 mg/kg)组,每组10只。对照组ig蒸馏水(0.2 mL/只),栀子对照组ig栀子水提物,2次/d,连续14 d,并于第12天单次ig玉米油(0.2 mL/只);模型组ig蒸馏水(0.2 mL/只),各给药组ig相应药物,2次/d,连续14 d,并于第12天单次ig ANIT(50 mg/kg,以玉米油溶解)。实验结束后,大鼠禁食并收集2 h内粪便,ip 10%水合氯醛麻醉后,摘眼球取血,离心后用于后续生化分析;取小鼠肝脏、胆囊、结肠组织,称定肝脏及胆囊(含胆汁)质量,计算肝脏指数和胆囊指数;部分肝脏及回肠组织采用10%甲醛溶液固定,苏木素-伊红(HE)染色,观察组织病变情况;部分回肠样品提取总蛋白,采用Western blotting法分析蛋白表达。
肝脏指数=肝脏质量/体质量
胆囊指数=胆囊(含胆汁)质量/肝质量
2.3 血清生化及肝脏、回肠组织HE染色
采用试剂盒说明书测定血清中AST、ALP、ALT活性及TBIL水平,肝脏组织、回肠组织、胆汁、粪便及血清中TBA水平;肝脏及回肠组织采用常规HE染色,于显微镜下观察组织病理形态学变化。
2.4 Western blotting检测回肠组织ASBT和FXR蛋白表达
称取各组大鼠新鲜的回肠组织0.04 g,加入RIPA裂解液300 µL,提取总蛋白,BCA法测定蛋白含量,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭,分别加入ASBT(1∶1000)、FXR(1∶500)和β-actin(1∶2000)抗体,4 ℃孵育过夜;洗膜,孵育二抗,曝光,采用Image J软件对条带进行灰度分析。
2.5 在体肠灌流实验
按“2.2”项下方法进行分组和给药,每组5只小鼠,不设置熊去氧胆酸组。于实验结束后,小鼠禁食12 h,ip 10%水合氯醛麻醉后,游离出回肠10 cm并两端结扎,注入10 μmol/L TCA 200 μL,于10 min后一次性取肝门静脉血,离心取上清,−80 ℃冻存用于后续分析。
2.6 外翻肠囊实验
按“2.5”项下方法进行分组和给药,每组5只小鼠。于实验结束后,小鼠禁食12 h,ip 10%水合氯醛麻醉后,从回盲交界处向上5 cm游离并截取10 cm回肠,立即放入冰的PBS中,剪去肠系膜,外翻肠道并清洗,灌入Krebs-Ringer缓冲液(Krebs-Ringer buffer,KRB)200 μL并夹紧两头,将肠囊置入氧饱和的含10 μmol/L TCA的KRB中,37 ℃孵育30 min,收集肠囊内液及肠组织,−80 ℃冻存用于后续分析。
2.7 HPLC-MS/MS分析[13]
血样及肠内液离心取上清液,回肠组织加入甲醇匀浆后离心并取上清,取适量血样、肠内液、回肠组织匀浆上清液,用含内标(d4-CDCA)的甲醇沉淀各生物样品中的蛋白,涡旋离心后取上清,按照本课题组前期研究方法[13]检测各生物样品中TCA的含量。
2.8 MODE-K细胞培养及药物干预
MODE-K细胞采用DMEM培养基常规培养、传代,MTT法分别评价栀子水提物(25~800 μg/mL)及ANIT(12.5~200 μmol/L)对MODE-K细胞活性的影响;筛选出ANIT 70 μmol/L作为细胞模型浓度,进一步采用MTT评价栀子水提物在ANIT干预下对MODE-K细胞活性的影响;采用50、100、200 μg/mL栀子水提物干预MODE-K细胞24 h,按“2.4”项下方法评价其对ASBT及FXR蛋白表达的影响。
2.9 栀子水提物中潜在药效化合物的筛选
C57BL/6J小鼠分为模型组和给药组,每组4只。各组ig ANIT(50 mg/kg)48 h后,给药组ig栀子水提物(240 mg/kg),给药2 h后采集小鼠的血液和回肠组织。采用UHPLC-QTOF-MS中药非靶标代谢组学检测栀子水提物、血清和回肠中共有的化合物;并从蛋白质三维结构数据库(PDB)中筛选FXR-OCA复合物晶体结构(PDB代码:4QE6),采用Maestro 11.5软件进行分子对接,筛选潜在的FXR激动剂。
2.10 统计学分析
实验数据采用Microsoft Excel 2016软件进行统计分析,各组间两两比较,采用检验。
3 结果
3.1 栀子水提物对ANIT诱导小鼠胆汁淤积的治疗作用
如图1-A~C所示,与对照组比较,模型组小鼠血清中ALT、AST、ALP活性及TBIL、胆囊指数均显著升高(<0.05、0.001);与模型组比较,各给药组血清中ALT、ALP活性均显著降低(<0.01、0.001);熊去氧胆酸组血清中AST活性显著降低(<0.01),肝脏指数显著升高(<0.05);栀子水提物高剂量组和熊去氧胆酸组血清中TBIL水平及胆囊指数显著降低(<0.05、0.01)。
如图1-D、E所示,对照组和栀子对照组胆囊较小且胆汁颜色淡黄色,肝组织肝脏组织结构清晰,肝板结构排列整齐;ANIT干预后,可见胆囊充盈且胆汁颜色偏黑;肝组织出现大面积的桥接性坏死及局部点状坏死,且肝脏坏死区域数目较多;栀子提取物及熊去氧胆酸干预后,胆囊充盈度降低,且胆汁颜色呈淡黄色;肝脏坏死区域的数目明显减少(<0.05、0.01)。

A-血清生化指标 B-肝脏指数 C-胆囊指数 D-肝脏坏死病理评分 E-胆囊形态及肝脏、回肠病理图片(×100),其中绿色箭头指示胆囊,肝脏主要病变呈现肝细胞坏死及炎症,依据坏死区域的大小,将肝损伤程度分为:①重度肝损伤:直径大于200 μm的肝脏坏死区域(红色箭头);②中度肝损伤:直径100~200 μm的肝脏坏死区域(蓝色箭头);③轻度肝损伤:直径为0~100 μm的肝脏坏死区域(黑色箭头),坏死区域的直径通过软件Motic Images plus 2.0 ML软件的测量功能计算 AZ60-栀子水提物60 mg·kg−1 AZ120-栀子水提物120 mg·kg−1 AZ240-栀子水提物240 mg·kg−1 AU-熊去氧胆酸 与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,下图同
3.2 栀子水提物对ANIT诱导胆汁淤积小鼠胆酸盐的影响
如图2-A所示,与对照组比较,模型组肝脏、血清、胆囊中TBA水平均显著升高(<0.05、0.001),但粪便中TBA水平显著降低(<0.001);与模型组比较,栀子水提物高剂量组肝脏、血清、回肠中TBA水平均有不同程度的降低(<0.05、0.01),粪便中TBA水平显著升高(<0.05),提示栀子水提物可能通过促进TBA的粪便排泄而利胆。
为了进一步明确栀子水提物对回肠重吸收的影响,采用在体肠灌流和外翻肠囊实验评价了回肠对TCA的摄取。如图2-B~G所示,与对照组比较,模型组在体肠组织、门静脉血、回肠囊内液、肠囊组织中TCA水平均显著降低(<0.05、0.01);与模型组比较,栀子水提物高剂量组在体肠组织、门静脉血、回肠囊内液中TCA进一步降低(<0.05、0.01),提示栀子水提物可抑制TCA的回肠重吸收。此外,栀子水提物也可抑制正常小鼠回肠TCA的重吸收(图2-D)。
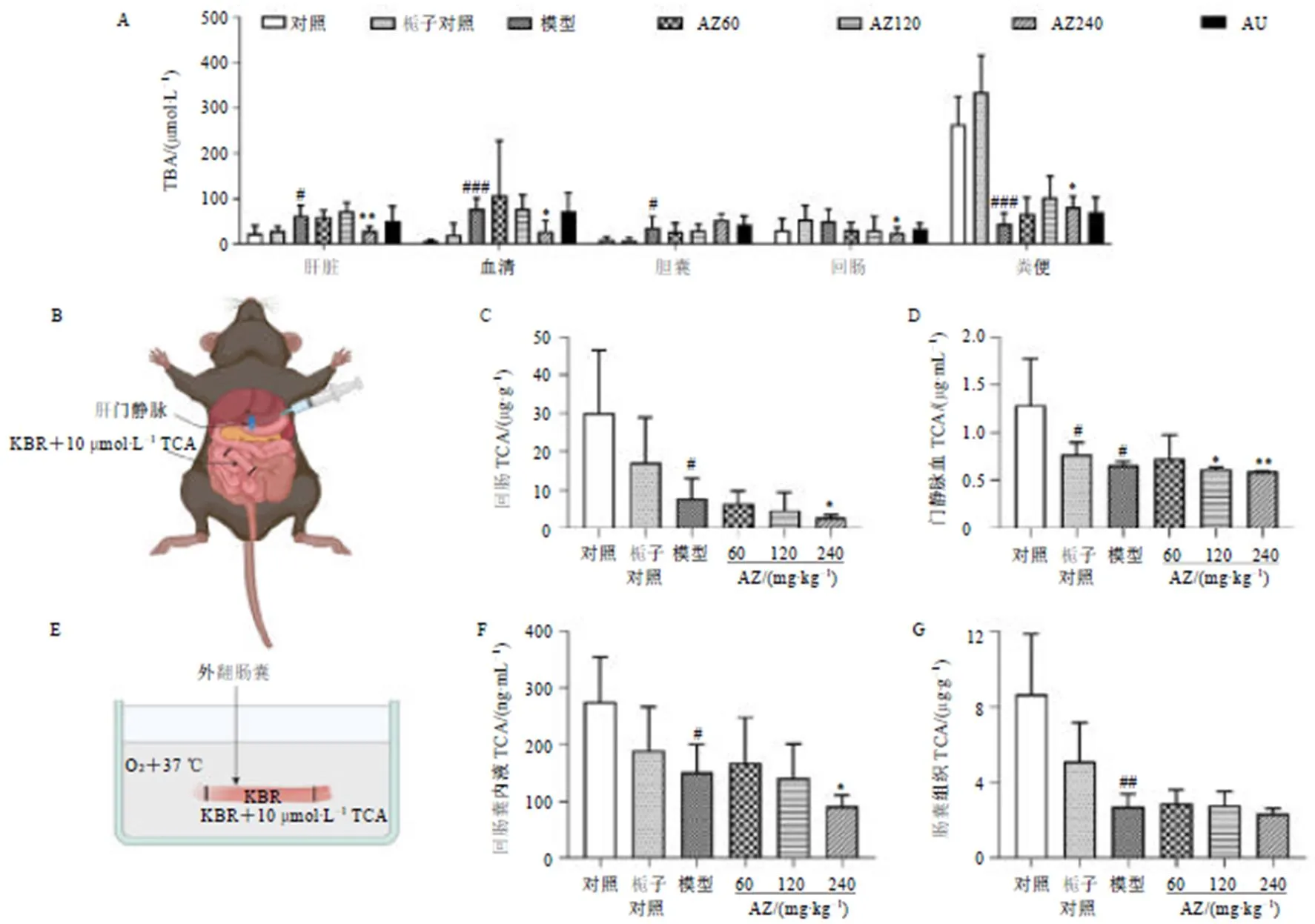
A-血清、肝脏、胆囊、回肠及粪便中TBA水平(n = 10) B-在体肠灌流实验示意图 C-在体肠灌流回肠段组织中TCA水平(n = 5) D-在体肠灌流肝门静脉血中TCA水平(n = 5) E-外翻肠囊实验示意图 F-外翻肠囊囊内液中TCA水平(n = 5) G-外翻肠囊肠囊组织中TCA水平(n = 5)
3.3 栀子水提物对小鼠回肠及MODE-K细胞ASBT及FXR表达的影响
回肠ASBT是介导胆酸盐肠道重吸收的关键蛋白,其表达受回肠FXR的负调控。如图3-A、B所示,与对照组比较,模型组小鼠回肠ASBT及FXR蛋白表达均显著降低(<0.05、0.01);与模型组比较,栀子水提物中、高剂量组和熊去氧胆酸组回肠ASBT蛋白表达进一步降低(<0.01、0.001),各给药组回肠FXR蛋白表达均显著升高(<0.05、0.01、0.001)。

A-小鼠回肠组织ASBT蛋白表达(n = 3) B-小鼠回肠组织FXR蛋白表达(n = 3) C-栀子水提物对MODE-K细胞活性的影响(n = 6) D-ANIT对MODE-K细胞活性的影响(n = 6) E-栀子水提物对ANIT细胞毒性的拮抗作用(n = 6) F-MODE-K细胞ASBT蛋白表达(n = 3) G-MODE-K细胞FXR蛋白表达(n = 3)
为了进一步明确FXR对ASBT表达及功能的调控作用,采用小鼠小肠MODE-K细胞评价栀子水提物对ASBT表达的影响。如图3-C~E所示,栀子水提物在800 μg/mL对MODE-K细胞活性无显著影响;ANIT(70~200 μmol/L)显著抑制MODE-K细胞活性(<0.001);与ANIT组比较,栀子水提物(200、400 μg/mL)对ANIT导致的细胞毒性具有明显的保护作用(<0.05)。如图3-F、G所示,与对照组比较,ANIT可明显降低细胞ASBT的表达(<0.01);与ANIT组比较,100、200 μg/mL的栀子水提物能显著降低细胞ASBT的表达(<0.01、0.001),上调FXR的表达(<0.05)。
3.4 筛选栀子水提物中潜在的药效物质
通过UHPLC-QTOF-MS中药非靶标代谢组学检测,如图4所示,通过阳离子及阴离子模式下,栀子提取物、血中及回肠组织中共有的已知化合物37个,阳离子检测模式下有麦芽三糖、麦芽五糖、2-乙酰基-5-(四羟基丁基)咪唑、5,6-二甲基苯并咪唑、2,4-二羟基苯乙酮、(9,11)-13-酮基-亚油酸、(−)-异松蒎醇、5-羟甲基-2-呋喃甲醛、玉叶金花苷酸、木樨榄苷-11-甲酯、9--11-(3-戊基-2-环氧乙烷)-10-十一碳烯酸、6-羟基-7-甲氧基香豆素、4-羟基苯甲酸异丁酯、京尼平龙胆二糖苷、对甲氧基肉桂酸甲酯、1-苯基乙醇、京尼平、京尼平苷、3,5-二甲氧基-4-羟基肉桂酸、7,8-二羟基-4-甲基香豆素、斑蝥素、10-羟基-2-癸烯酸、4-香豆酸、刺五加苷E、丹皮酚、(1)-(+)-樟脑醌、吲哚-3-乳酸、3,6-壬二烯醇、7-羟基-4-甲基香豆素-3-乙酸、2,6-二叔丁基-4-羟甲基苯酚、crocusatin C、2-hydroxyethyl gardemide A、jasminodiol、6′--sinapoyljasminoside C、epijasminoside A,阴离子检测模式下有戟叶马鞭草苷、京尼平苷、jasminoside A。提示这些化合物可能是潜在的活性物质,能到达靶部位发挥药效或激活肠道FXR。
进一步对37个化合物通过计算机分子对接技术,初步筛选出23种化合物可能为FXR受体潜在的激动剂(表1),其通过激活肠道FXR而抑制ASBT对胆酸盐的重吸收作用,促进了胆酸盐的粪便排泄而缓解了肝脏胆酸盐蓄积。
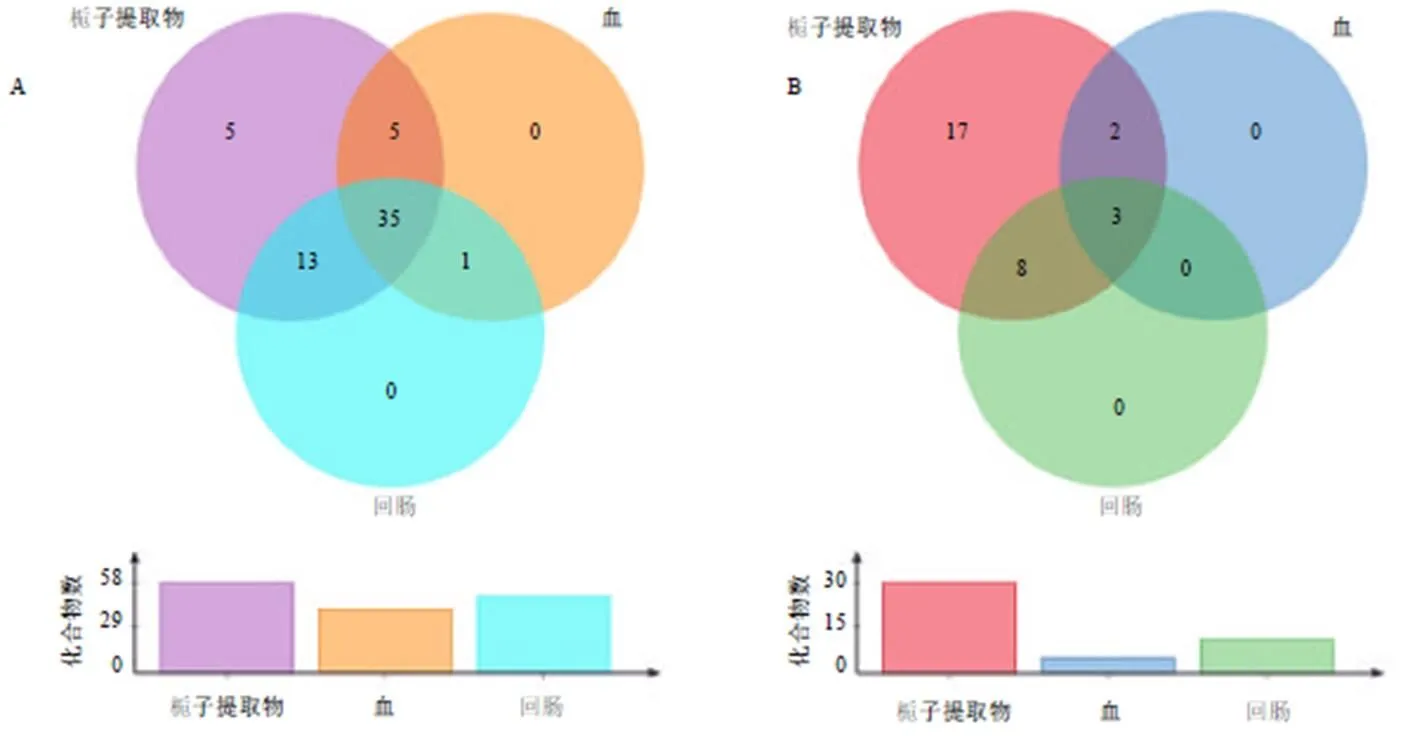
图4 栀子水提物、血液及回肠组织中质谱阳(A) 和阴(B) 离子监测模式下的化合物

表1 基于FXR-OCA晶体结构筛选栀子水提物中潜在的FXR激动剂
4 讨论
肝内胆汁淤积主要是胆酸盐肝肠循环障碍,使肝脏胆酸盐蓄积而引起肝毒性[14]。本研究采用ig ANIT(75 mg/kg)诱导小鼠肝内胆汁淤积模型,血清中ALT、AST、ALP活性及TBIL、TBA水平均显著升高,且肝脏出现大面积桥接性坏死,胆囊充盈且胆汁颜色偏黑,与本课题组前期研究的结果一致[15]。栀子水提物干预14 d后,血清生化指标均显著降低,且肝脏病理及胆囊形态均趋于正常小鼠,以高剂量效果最好,提示栀子水提物对ANIT诱导的肝内胆汁淤积具有明显的治疗作用,且这种作用存在剂量相关性。
肝脏胆酸盐蓄积是导致胆汁淤积肝损伤的主要原因。ANIT诱导的肝内胆汁淤积可导致肝脏、胆囊、血清中胆酸盐显著升高,但粪便中胆酸盐降低,提示胆酸盐在肝脏蓄积,且肠道排泄途径受阻。栀子水提物(240 mg/kg)可显著减少肝脏及血清胆酸盐,增加粪便胆酸盐含量,提示栀子水提物可促进胆酸盐的粪便排泄。本课题组前期研究发现,栀子水提物可促进胆酸盐的尿液排泄[5],本研究从另一个角度证实了栀子水提物的利胆作用。TCA是回肠胆酸盐重吸收转运体ASBT的底物,且TCA常用作探针评价回肠ASBT的功能[16]。在体肠灌流及外翻肠囊研究发现,ANIT干预后,TCA的回肠重吸收减少,而栀子水提物干预后TCA的回肠重吸收进一步减少,提示ANIT和栀子水提物均能抑制回肠ASBT对TCA的摄取。ANIT诱导胆汁淤积模型后,虽然抑制了回肠对ASBT对TCA的重吸收过程,但粪便胆酸盐相比正常小鼠,其含量并未增加;然而,与ANIT组小鼠相比,栀子水提物却增加了粪便胆酸盐的排泄,提示栀子水提物除了进一步抑制了回肠ASBT对TCA的重吸收外,还可能促进了胆酸盐从回肠向粪便的排泄,如增加肠蠕动等,但尚需更多的研究证实。
回肠ASBT是介导胆酸盐重吸收的关键蛋白,约95%的胆酸盐经重吸收进入肝门静脉,再次入肝[9],因此,阻断胆酸盐的重吸收途径、促进胆酸盐的粪便排泄,是近年来利胆药物开发的新思路,而ASBT也成为了治疗胆汁淤积的新靶点。研究证实抑制回肠ASBT可明显缓解小鼠胆汁淤积肝损伤[8,10],且以ASBT为靶点治疗胆汁淤积相关疾病的药物A4250及BAT117213(二者均为ASBT抑制剂)也进入了临床研究阶段[11-12]。本研究发现,栀子水提物能明显抑制小鼠回肠及肠道细胞中ASBT的表达,提示栀子水提物可阻断胆酸盐的回肠重吸收,从而减少胆酸盐的肝脏蓄积,而粪便胆酸盐的增加,则提示栀子进一步促进了胆酸盐的粪便排泄。回肠ASBT的表达和功能受回肠FXR的负调控[14],因此,本研究进一步考察了栀子水提物对FXR的影响,发现栀子水提物可上调小鼠回肠及肠道细胞中FXR的表达,这可能是其抑制回肠ASBT表达的主要原因。此外,激动回肠FXR受体后,可通过回肠FXR-成纤维细胞生长因子15(fibroblast growth factor 15,FGF15)通路负反馈抑制肝脏胆固醇7α-羟化酶(cholesterol 7α-hydroxylase,Cyp7a1)的表达及功能,减少肝脏胆酸盐的合成[14],这可能是栀子水提物缓解肝脏胆酸盐蓄积毒性的另一途径,但尚需进一步验证。
药物通常吸收入血并由血液循环运送至靶部位,才能发挥相应的药物活性。因此,分析栀子水提物、血液及回肠中可能存在的化合物,或可找到潜在的栀子水提物的活性物质。本研究通过代谢组学技术分析发现,栀子水提物、血液及回肠组织中共有的并且已鉴定出的化合物共37个,并对这37个化合物通过计算机分子对接发现,有23个化合物可能是FXR的潜在激动剂,因此,基于这些化合物的进一步研究或可开发出以回肠FXR-ASBT通路为靶点的胆汁淤积治疗药物。
综上所述,栀子水提物可通过激活回肠FXR的功能,抑制回肠ASBT的表达和功能,减少胆酸盐的回肠重吸收,并促进回肠胆酸盐的粪便排泄,减少胆酸盐在肝脏的蓄积毒性,缓解了ANIT诱导的小鼠肝内胆汁淤积。
利益冲突 所有作者均声明不存在利益冲突
[1] 吴先昊, 邓绍勇, 王小青, 等. 栀子果实性状、化学成分与其消炎利胆作用的关系研究 [J]. 中草药, 2021, 52(23): 7229-7235.
[2] Zhang F, Wei Y H, Duan Y T,. Potential mechanism of cholagogic effect aboutEllis (Zhizi)-mediated increase of bile acids urinary excretion in normal rats [J]., 2018, 10(4): 431-436.
[3] Chen P, Chen Y, Wang Y R,. Comparative evaluation of hepatoprotective activities of geniposide, crocins and crocetin by CCl4-induced liver injury in mice [J]., 2016, 24(2): 156-162.
[4] Wang L L, Wu G X, Wu F H,. Geniposide attenuates ANIT-induced cholestasis through regulation of transporters and enzymes involved in bile acids homeostasis in rats [J]., 2017, 196: 178-185.
[5] 张国强, 魏玉辉, 文苑洁, 等. 栀子水提物对雌激素诱导的胆汁淤积大鼠中硫酸化胆酸盐的影响及机制研究 [J]. 中国药学杂志, 2020, 55(20): 1680-1685.
[6] Chiang J Y L, Ferrell J M. Discovery of farnesoid X receptor and its role in bile acid metabolism [J]., 2022, 548: 111618.
[7] Duan S N, Li X, Fan G F,. Targeting bile acid signaling for the treatment of liver diseases: From bench to bed [J]., 2022, 152: 113154.
[8] Yang N, Dong Y Q, Jia G X,. ASBT(SLC10A2): A promising target for treatment of diseases and drug discovery [J]., 2020, 132: 110835.
[9] Li M, Wang Q, Li Y,. Apical sodium-dependent bile acid transporter, drug target for bile acid related diseases and delivery target for prodrugs: Current and future challenges [J]., 2020, 212: 107539.
[10] Matye D J, Li Y, Chen C,. Gut-restricted apical sodium-dependent bile acid transporter inhibitor attenuates alcohol-induced liver steatosis and injury in mice [J]., 2021, 45(6): 1188-1199.
[11] Graffner H, Gillberg P G, Rikner L,. The ileal bile acid transporter inhibitor A4250 decreases serum bile acids by interrupting the enterohepatic circulation [J]., 2016, 43(2): 303-310.
[12] Hegade V S, Kendrick S F, Dobbins R L,. BAT117213: Ileal bile acid transporter (IBAT) inhibition as a treatment for pruritus in primary biliary cirrhosis: Study protocol for a randomised controlled trial [J]., 2016, 16(1): 71.
[13] Jin Y W, Rao Z, Zhou Y,. Development of a LC-MS/MS method for simultaneous determination of bile acids and their conjugates in hepatocytes, tissue and fluids in rat [J]., 2018, 14 (3): 331-341.
[14] Molinaro A, Marschall H U. Bile acid metabolism and FXR-mediated effects in human cholestatic liver disorders [J]., 2022, 50(1): 361-373.
[15] Zhang G Q, Sun X H, Wen Y J,. Hesperidin alleviates cholestasis via activation of the farnesoid X receptorand[J]., 2020, 885: 173498.
[16] Takashima Y, Ishikawa K, Miyawaki R,. Modulatory effect of theaflavins on apical sodium-dependent bile acid transporter (ASBT) activity [J]., 2021, 69(33): 9585-9596.
Effect ofwater extract on cholestasis in mice based on apical sodium-dependent bile acid transporter of ileum
ZHANG Guo-qiang1, 4, WEN Yuan-jie3, 4, DONG Yu-song1, 2, SHI Xiao-pan1, 2, WEI Yu-hui1, 4
1. Department of Pharmacy, the First Hospital of Lanzhou University, Lanzhou 730000, China 2. The First Clinical Medical College of Lanzhou University, Lanzhou 730000, China 3. College of Pharmaceutical Science, Lanzhou University, Lanzhou 730000, China 4. Industry Technology Innovation Alliance of Hospital Traditional Chinese Medicine Preparation, Lanzhou 730000, China
To investigate the effect ofwater extract on α-naphthyl isothiocyanate (ANIT)-induced cholestasis in mice based on apical sodium dependent bile acid transporter (ASBT) of ileum, and screen the potential active compounds.C57BL/6 mice were randomly divided into control group,control group (240 mg/kg), ANIT group,water extractlow-, medium- and high-dose (60, 120, 240 mg/kg) groups and ursodeoxycholic acid (60 mg/kg) group, with 10 mice in each group. Drug intervention was given twice a day for 14 d; Cholestasis model of mice was induced by single ig ANIT (50 mg/kg) on 12th day.water extract was used to interfere with ANIT-induced MODE-K cells; Serum biochemical indexes and bile salt content in liver, serum, gallbladder, ileum and feces were measured; The expressions of ASBT and farnesoid X receptor (FXR) in ileum of mice and MODE-K cells were measured; The contents of sodium taurocholate (TCA) in ileum and hepatic portal vein were determined byintestinal perfusion and everted intestinal sac method; Qualitative metabonomics was used to determine the compounds in serum and ileum tissue after 2 h of igwater extract.Compared with ANIT group,water extract could alleviate liver diseases, reduce the content of bile salts in liver and TCA in ileum (< 0.05, 0.01), and increase the content of fecal bile salts (< 0.05);water extract increased the expression of FXR in ileum of mice and MODE-K cells (< 0.05, 0.01, 0.001), and decreased the expression of ASBT (< 0.01, 0.001). At the same time, 37 potential active compounds were screened.water extract can inhibit the expression and function of ASBT by activating FXR in ileum, reduce bile salt reabsorption in ileum, promote fecal excretion, and reduce hepatic bile salt accumulation, thereby relieving ANIT-induced intrahepatic cholestasis in mice.
Ellis; cholestasis; apical sodium-dependent bile acid transporter; farnesoid X receptor; genipin; geniposide; genipin-1-β--gentiobioside
R285.5
A
0253 - 2670(2023)01 - 0122 - 09
10.7501/j.issn.0253-2670.2023.01.015
2022-07-27
国家自然科学基金资助项目(82160711);国家自然科学基金资助项目(82174067);国家自然科学基金资助项目(81960646);国家自然科学基金资助项目(81702853);兰州市科技指导性计划项目(2022-ZD-94);兰州大学第一医院院内基金优秀博士科研启动基金资助项目(ldyyyn2020-94)
张国强,男,博士,主管药师,研究方向为药物肝损伤及中药药理。E-mail: zhanggq15@lzu.edu.cn
通信作者:魏玉辉,男,博士,副教授,硕士生导师,研究方向中药药理研究及临床药学。E-mail: yhwei@lzu.edu.cn
[责任编辑 李亚楠]
