甘草酸新型离子液体微乳的制备及体外评价
2023-01-10薛玉叶李方琴秦祉剑袁海龙
闫 巧,薛玉叶,李方琴,王 芳,秦祉剑,戴 博,袁海龙*
甘草酸新型离子液体微乳的制备及体外评价
闫 巧1, 2,薛玉叶2,李方琴2,王 芳2,秦祉剑2,戴 博2,袁海龙2*
1. 成都中医药大学药学院,四川 成都 611137 2. 空军特色医学中心药学部,北京 100142
采用亲油性离子液体1-丁基-3-甲基咪唑六氟磷酸盐(1-butyl-3-methylimidazolium hexafluorophosphate,BMIMPF6)取代传统微乳油相制备甘草酸(glycyrrhizic acid,GA)离子液体微乳(ionic liquid microemulsion,IL-ME)(GA-IL-ME),以改善甘草酸的透皮吸收。通过溶解度实验、配伍实验和绘制伪三元相图筛选微乳处方;利用D-最优混料设计法以粒径为考察指标进行处方优化,并对最优处方制备的微乳进行理化性质、稳定性、体外透皮吸收以及细胞毒性评价。GA-IL-ME的最佳处方为BMIMPF6-聚山梨酯80-PEG400-蒸馏水(5.8∶32.4∶10.8∶51.0);所得微乳为黄色澄清透明状液体,透射电子显微镜(transmission electron microscope,TEM)显示GA-IL-ME呈均匀的球形或类球形,平均粒径为(10.61±0.63)nm,多分散系数(polydispersity index,PDI)为0.130±0.022,ζ电位为(−10.29±0.22)mV;GA-IL-ME在高速离心、储存稳定性、高温以及冷热和冻融循环实验中均表现出良好的稳定性;体外透皮结果显示,GA-IL-ME在24 h内单位面积累积渗透量为(310.37±33.65)μg/cm2,为甘草酸传统水包油(O/W)型微乳的1.34倍,甘草酸水溶液的6.76倍;细胞毒性实验表明GA-IL-ME毒性低,生物相容性良好。BMIMPF6能显著增加甘草酸的溶解度,将其引入微乳体系制备新型水包离子液体型微乳,明显增加了甘草酸的经皮累积渗透量,可为中药透皮给药系统新剂型的开发提供参考,同时为甘草酸的进一步研究应用奠定基础。
甘草酸;离子液体;微乳;D-最优混料设计;透皮吸收;细胞毒性;伪三元相图
甘草酸(glycyrrhizic acid,GA),又称甘草甜素,是从豆科植物甘草中分离纯化得到的一种三萜皂苷,具有抗炎、抗氧化、抑制黑色素沉着、抗肿瘤、抗紫外线辐射等多重药理作用[1-3],被广泛用于各种皮肤病的治疗如银屑病、特应性皮炎、光老化、皮肤癌以及黑色素瘤等[4-7]。目前,甘草酸的给药途径主要为口服与注射,前者生物利用度低,后者易产生水钠潴留、高血压、低血钾、水肿等不良反应。经皮给药具有无痛、避免首过消除、安全性好、患者顺应性好等特点,可有效解决以上问题。但甘草酸存在水溶性差、相对分子质量大(822.93)、透皮吸收差等问题,严重制约了其在经皮给药方面的应用和发展[8-9]。因此,需要寻找合适的药物载体以改善甘草酸的透皮吸收,促进其药效的发挥。
微乳是由水、油、乳化剂和助乳化剂以适当比例自发形成的一种低黏度、透明或半透明、光学各向同性的热力学稳定体系[10],具有增溶、促渗、易于制备等优点,是经皮给药的常用剂型,但传统微乳的增溶和促渗能力是有限的。离子液体是由大体积有机阳离子和无机或有机阴离子构成的熔点低于100 ℃的盐,在室温或室温附近呈液态[11],具有良好的溶解和促渗能力、热稳定性以及抗菌活性[12]。研究发现,将离子液体引入微乳体系制备的新型离子液体微乳(ionic liquid mircroemulsion,IL-ME)可以结合微乳和离子液体的双重优势,在保持传统微乳特性的基础上,还可显著提高其增溶和促渗能力以及热稳定性,克服传统微乳无法溶解多种水不溶性药物的缺陷,尤其是在水和有机溶剂中都不能溶解的药物,部分离子液体还可作为微乳的抑菌剂[12-15]。Goindi等[16]以1-丁基-3-甲基咪唑六氟磷酸盐(1- butyl-3-methylimidazolium hexafluorophosphate,BMIMPF6)为油相制备了依托度酸IL-ME,发现BMIMPF6对依托度酸有一定的增溶作用,体外透皮结果显示该IL-ME的累积经皮渗透率大约为传统水包油(O/W)型微乳的1.6倍;Salabat等[13]和Parsi等[17]同样以离子液体BMIMPF6为油相制备了塞来昔布IL-ME,发现塞来昔布在IL-ME的溶解度是传统O/W型微乳的7.8倍,且前者经皮渗透速率为后者的5.6倍。因此,本研究以甘草酸为原料药,将离子液体BMIMPF6引入微乳组分中,制备具有双重特性的甘草酸离子液体微乳(glycyrrhizic acid ionic liquid mircroemulsion,GA-IL-ME),以达到增加甘草酸溶解度、改善其透皮效果、提高药物疗效的目的,为甘草酸治疗皮肤病提供一种有效的治疗途径和给药方式。
1 仪器与材料
1.1 仪器
LC-20AD型高效液相色谱仪,日本岛津公司;Winner 802型纳米激光粒度仪,济南微纳颗粒仪器股份有限公司;BY-G20型高速离心机,北京白洋医疗器械有限公司;DF-101S型集热式恒温加热磁力搅拌器,上海凌科实业发展有限公司;BT125D型电子天平,赛多利斯科学仪器有限公司;TP-6型智能透皮扩散仪,天津市鑫洲科技有限公司;Tecnai G2 F30型场发射透射电子显微镜(TEM),美国FEI公司;MCO-15AC型二氧化碳培养箱,日本三洋公司;Synergy H1型全功能酶标仪,美国伯腾仪器有限公司。
1.2 药材与试剂
甘草酸对照品,批号PS010448,质量分数≥99.0%,成都普思生物科技股份有限公司;甘草酸原料药,批号190421,质量分数≥95.0%,北京世纪奥科生物技术有限公司;BMIMPF6(批号RH326318,质量分数≥97%)、橄榄油、蓖麻油、肉豆蔻酸异丙酯(isopropyl myristate,IPM)、辛癸酸甘油酯(caprylic capric triglycerride,GTCC)、聚氧乙烯氢化蓖麻油(RH-40)、油酸,均购自上海易恩化学技术有限公司;油酸乙酯,国药集团化学试剂有限公司;聚山梨酯80,四川金山制药有限公司;蓖麻油聚氧乙烯醚(EL-35),北京索莱宝科技有限公司;1,2-丙二醇、聚乙二醇(polyethyleneglycol,PEG)400、丙三醇,均购自江西益普生药业有限公司;无水乙醇,天津福晨化学试剂有限公司;CCK-8细胞增殖检测试剂盒,武汉伊莱瑞特生物科技股份有限公司;乙腈、甲醇为色谱纯,美国赛默飞世尔科技公司,其余试剂均为分析纯。
1.3 细胞及动物
人永生化角质形成细胞(human immortal keratinocyte line,HaCaT)购自北京协和细胞库。BALB/c小鼠,雌性,体质量(20±2)g,SPF级,购自北京斯贝福生物技术有限公司,动物许可证号SCXK(京)2019-0010。动物实验伦理经空军特色医学中心批准,批准号:空特(科研)第2022-187- PJ01。
2 方法与结果
2.1 甘草酸含量分析方法的建立
2.1.1 对照品储备液的配制 精密称取甘草酸对照品10.00 mg于25 mL量瓶中,加入适量甲醇超声使其溶解,甲醇稀释至刻度线,摇匀,即得质量浓度为400.00 μg/mL的对照品储备液。
2.1.2 供试品溶液的配制 精密移取GA-IL-ME 100 μL,加入适量甲醇,超声(80 W,20 kHz)5 min,定容至10 mL,摇匀,即得供试品溶液。同法制备空白离子液体微乳溶液。
2.1.3 色谱条件 C18色谱柱为Inertsil ODS-3柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液(40∶60);体积流量1.0 mL/min;检测波长254 nm;柱温30 ℃;进样体积20 μL。
2.1.4 专属性考察 取甘草酸对照品溶液和经“2.1.2”项下方法处理的GA-IL-ME、空白离子液体微乳溶液,按“2.1.3”项下色谱条件进行检测,结果如图1所示。结果表明,该色谱条件下,色谱峰分离度好,峰形稳定,无干扰。
2.1.5 线性关系考察 精密移取甘草酸对照品储备液,加甲醇配制成质量浓度分别为400.00、100.00、50.00、25.00、12.50、6.25 μg/mL的对照品溶液,滤过后按“2.1.3”项下色谱条件进行测定,以峰面积为纵坐标(),甘草酸质量浓度为横坐标(),进行线性回归,得回归方程为=15 887-53 186,2=0.999 9,表明甘草酸在6.25~400.00 μg/mL与峰面积线性关系良好。
2.1.6 精密度试验 取质量浓度为50 μg/mL的对照品溶液,按“2.1.3”项下色谱条件连续进样测定6次,记录峰面积,计算其RSD为0.27%,表明仪器精密度良好。

图1 空白离子液体微乳(A)、甘草酸对照品(B)和GA-IL-ME样品 (C) 的HPLC图
2.1.7 重复性试验 取“2.1.2”项下的供试品溶液6份,按“2.1.3”项下色谱条件进样测定峰面积,计算甘草酸质量浓度。结果表明,甘草酸的平均质量分数为19.50 mg/g,RSD值为0.15%,表明该方法重复性良好。
2.1.8 稳定性试验 将同一批次供试品溶液室温下放置,分别于0、2、4、6、8、10、12、24 h后,按“2.1.3”项下色谱条件进样。结果表明,甘草酸峰面积的RSD为0.30%,表明供试品溶液于室温下放置24 h内稳定性良好。
2.1.9 加样回收率试验 精密移取已知质量浓度的GA-IL-ME 9份,分别加入相当于样品中甘草酸含量80%、100%、120%的甘草酸对照品,每个比例3份,按“2.1.2”项下方法处理后,依“2.1.3”项下色谱条件进样分析,计算得平均加样回收率分别为98.27%、101.67%、100.66%,RSD分别为0.15%、0.36%、0.90%,表明该方法回收率良好。
2.2 甘草酸在各辅料中溶解度的测定
取待筛选的油相、乳化剂和助乳化剂(表1)各1 g至2 mL EP管中,加入过量甘草酸,涡旋混匀后超声4 h,室温下放置24 h,于10 000 r/min下离心10 min(离心半径为8.5 cm),取上清液用甲醇适当稀释,0.45 μm微孔滤膜滤过后,采用“2.1.3”项下色谱条件,测定甘草酸含量。原则上选择对甘草酸有较高溶解度的辅料作为微乳的组成成分,以达到对药物的最大溶解能力,防止药物在微乳储存过程中析出结晶体[18]。由实验结果(表1)可知,甘草酸在离子液体BMIMPF6中的溶解度明显高于其他油相,说明BMIMPF6有一定的增溶作用;在所考察的乳化剂中,聚山梨酯80和EL-35对甘草酸的溶解能力更大;助乳化剂中,1,2-丙二醇、甘油和PEG400对甘草酸的溶解度均较高,无显著差异。基于以上结果,最终选择BMIMPF6为油相,聚山梨酯80和EL-35为乳化剂,甘油、1,2-丙二醇和PEG400为助乳化剂用于进一步的处方筛选。

表1 甘草酸在各辅料中的饱和溶解度(, n = 3)
2.3 配伍实验
2.3.1 乳化剂的筛选 为了进一步考察辅料的相容性,筛选出适宜的乳化剂,将BMIMPF6分别与乳化剂(聚山梨酯80、EL-35)以质量比1∶9、2∶8、3∶7、4∶6、5∶5涡旋混合均匀,于室温下静置,观察是否分层。按如下方法进行配伍实验:取空白微乳0.5 g,在100 r/min磁力搅拌下加入到50 mL 37 ℃的蒸馏水中,观察乳化情况,根据表2的目测评价标准进行等级分类[19],因BMIMPF6的密度比水大,因此略做改动。由相容性和配伍结果(表3)可知,乳化剂聚山梨酯80与BMIMPF6配伍后相容性和乳化性较好,所以最终选取聚山梨酯80作为乳化剂。
2.3.2 助乳化剂的筛选 分别将聚山梨酯80和助乳化剂甘油、PEG400、1,2-丙二醇以2∶1混匀后,再将BMIMPF6与上述混合物按质量比1∶9、2∶8、3∶7、4∶6、5∶5涡旋混合均匀,室温下静置,观察是否分层,评测方法同“2.3.1”项。结果(表4)显示,PEG400的乳化能力最优,因此最终选择PEG400为助乳化剂。

表2 乳化等级分类
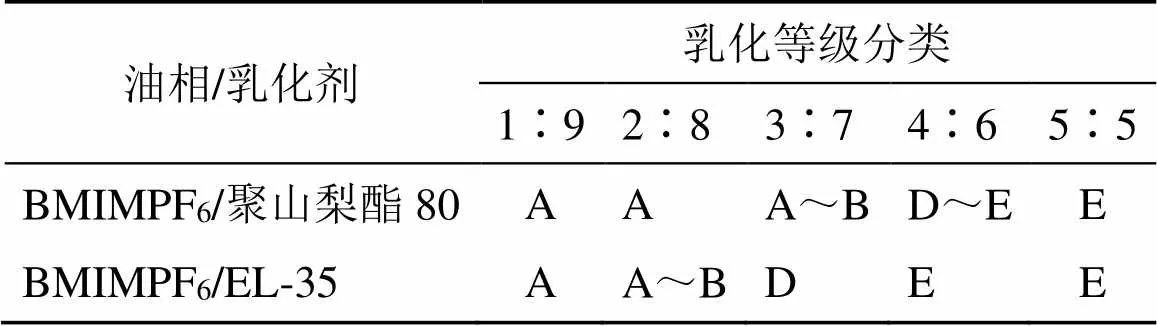
表3 不同油相与乳化剂的配伍实验

表4 油相与混合乳化剂的配伍实验
2.4 绘制伪三元相图
通过绘制伪三元相图确定乳化剂和助乳化剂的比例(m)以及成乳区域。将聚山梨酯80与PEG400分别以2∶1、3∶1、4∶1混合均匀形成混合乳化剂(Smix),然后将BMIMPF6与Smix按质量比1∶9~9∶1混匀,37 ℃、100 r/min磁力搅拌下滴加蒸馏水至体系从澄清透明状变为淡蓝色乳光或浑浊时,记录加水量。通过Origin 2019b软件绘制伪三元相图,将能形成澄清或带有蓝色乳光的实验点定为伪三元相图中可形成微乳的处方点,这些点连接后与水相顶点形成的封闭区域,即为成乳区,结果见图2。微乳区域面积越大,说明微乳处方越稳定,最终确定m为3∶1。为进一步开发最优处方,采用D-最优混料设计进行处方优化。
2.5 D-最优混料设计优化微乳处方
2.5.1 试验设计 D-最优混料设计是一种常用的混料设计方法,具有设计简单、预测精度高、多目标同步优化等特点。本研究以BMIMPF6的用量(1)、Smix的用量(2)和水的用量(3)为自变量(3相质量分数总和始终为1),平均粒径()为因变量,采用D-最优混料设计对微乳处方进行优化。根据伪三元相图确定BMIMPF6、Smix、水的用量分别为2.6%~10%、37.8%~50%、47.3%~55.6%,实验设计和结果见表5。按照表5中处方称取BMIMPF6、Smix,于37 ℃、100 r/min磁力搅拌5 min混匀后,加入甘草酸原料药,磁力搅拌混匀,再加入处方量的蒸馏水,同等转速下磁力搅拌1 h,即得GA-IL-ME,其中甘草酸质量分数为20 mg/g。

图2 不同Km (2∶1、3∶1、4∶1) 下的伪三元相图
2.5.2 模型拟合及效应面分析 用Design Expert 13软件对实验结果进行方差及2次多项式回归拟合分析,得到粒径的非线性回归方程为=33.861+8.692+9.493-26.7812-22.2413+0.079 723,2=0.989 1,<0.000 1,失拟项=0.449 4,拟合方程的相关系数较好,显著性水平值<0.05,失拟项值>0.05,表明该模型与真实数据之间具有较高的拟合度,模型预测可信度良好,可用于最优处方的分析及预测。

表5 D-最优混料设计及结果(, n = 3)
根据回归模型绘制等高线图和3D响应面图(图3),可以直观地反映各因素对响应值的影响以及最优条件下各因素的取值。由图可知随着BMIMPF6用量的增加以及Smix用量的减少,微乳粒径随之增大,适当的减少BMIMPF6用量或增加乳化剂比例可以使粒径减小。
2.5.3 验证实验 根据Design Expert 13软件综合评价后得微乳最优处方(以粒径最小为优):BMIMPF6-Smix-水5.8∶43.2∶51.0,在此条件下,粒径的预测值为10.76 nm。根据最优处方构建目标微乳,精密称取BMIMPF60.58 g、聚山梨酯80 3.24 g,PEG400 1.08 g,于37 ℃、100 r/min磁力搅拌5 min混匀后,加入甘草酸原料药,磁力搅拌混匀,再加入5.10 g蒸馏水,同等转速下磁力搅拌1 h,即得GA-IL-ME,处方中甘草酸质量分数为20 mg/g。平行制备3份GA-IL-ME进行处方验证。所制3份微乳粒径分别为9.77、11.27、10.80 nm,平均粒径为(10.61±0.63)nm,实测值与预测结果相近,说明采用D-最优混料设计优化GA-IL-ME处方具有良好的预测性和重现性。
2.6 GA-IL-ME的质量评价
2.6.1 外观和形态 如图4-A所示,在室温下,GA- IL-ME外观呈黄色澄清透明的均一状液体,静置不分层,具有良好的流动性和丁达尔现象。取GA-IL- ME适量,蒸馏水稀释10倍后取适量滴加到铜网上,待挥干后,2%磷钨酸溶液负染10 min,晾干后,于TEM下观察,结果如图4-B、C所示,GA-IL-ME粒径较小,大小分布均匀,呈均匀的球形或类球形。
2.6.2 粒径、PDI和ζ电位 取GA-IL-ME用蒸馏水稀释10倍,纳米粒度仪测定其粒径及PDI,每个样品重复测定3次。结果表明,GA-IL-ME的平均粒径为(10.61±0.63)nm,PDI为0.130±0.022,粒径分布见图5;取上述微乳稀释液用电位仪测得其ζ电位为(−10.29±0.22)mV。PDI值是反映微乳均一性的重要指标,PDI越小,体系均一性越好,越易保持稳定,本实验所制备的微乳粒径小且分布均匀;一般ζ电位控制在−20~−50 mV时体系较为稳定,本实验所制备的微乳ζ电位不在该界限范围内,但这并不能说明GA-IL-ME不稳定,有研究表明,ζ电位的测定对评价非离子型表面活性剂制备的乳剂稳定性价值不大,此外,不少文献制备的稳定性微乳ζ电位也不高[20-23]。因此,从粒径及粒径分布初步分析GA-IL-ME具有较好的稳定性。
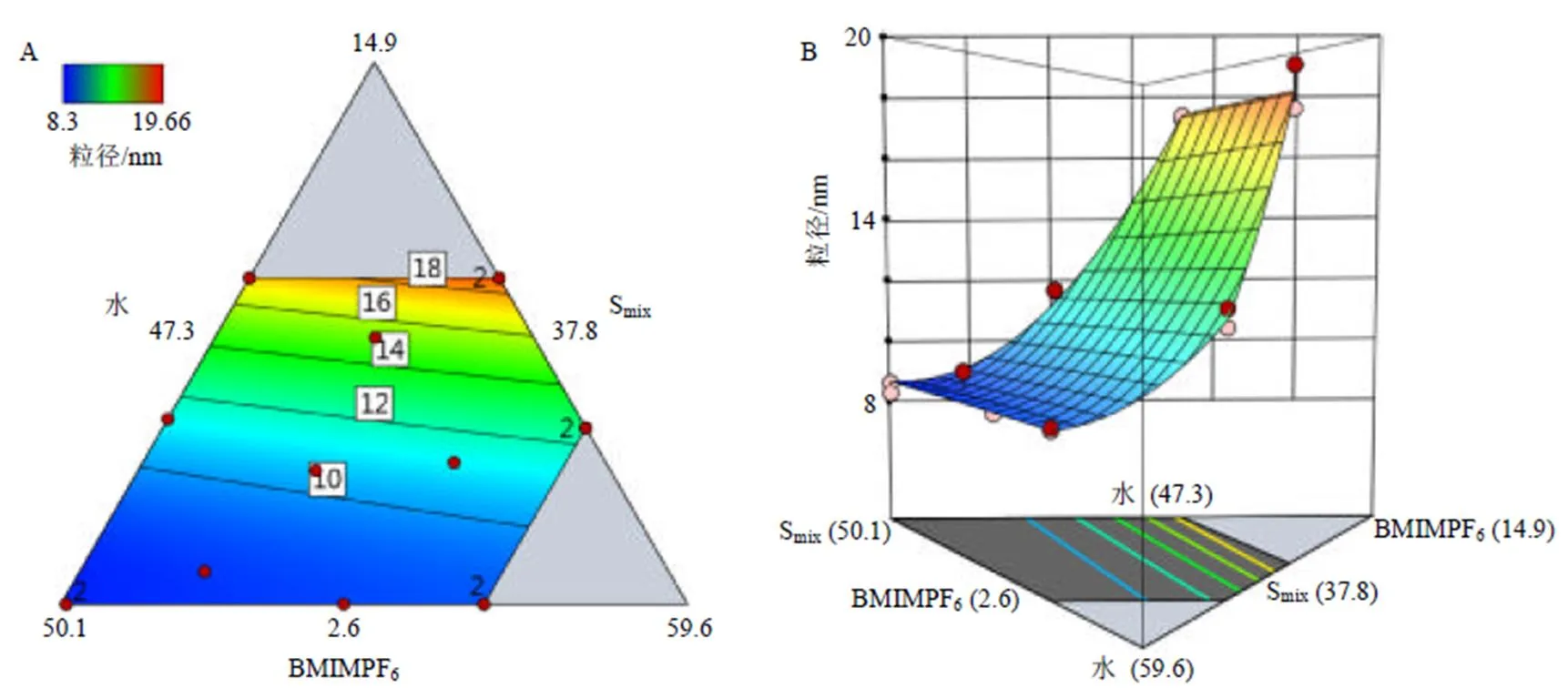
图3 配方变量对粒径影响的等高线图(A)和3D响应面图(B)

图4 GA-IL-ME的外观及丁达尔效应图(A)、TEM图(100 nm, B; 20 nm, C)

图5 GA-IL-ME的粒径分布
2.7 稳定性实验
2.7.1 高速离心稳定性 取2 g微乳于5000 r/min离心30 min(离心半径8.5 cm),离心后微乳外观依然澄清透明,无沉淀和无分层现象。
2.7.2 储存稳定性考察 取GA-IL-ME 3份,分别于4 ℃、室温(25 ℃)、40 ℃下储存30 d,于第0、1、3、5、10、20、30天取样,观察微乳外观性状、粒径及药物含量的变化情况。结果表明,在储存期间微乳外观保持不变,未出现分层或沉淀;粒径和药物含量的变化如表6所示,随着储存时间的增加,微乳粒径略有增大,药物含量略有下降,且温度越高,越不利于微乳的储存,相较于室温和40 ℃,4 ℃低温储存更有利于保持微乳的稳定性。
2.7.3 高温实验 将3份等量微乳(与储存稳定性实验同一批次)密封于西林瓶中,分别于70、80、90、100 ℃下水浴加热30 min,室温放置24 h后,考察微乳的外观、粒径及粒径分布、ζ电位及药物含量有无变化[18]。70~100 ℃处理后,外观上微乳未出现分层、沉淀等现象;粒径随着温度升高而增大,但PDI却随之减小(表7),这可能是因为温度的升高降低了表面活性剂亲水性头部基团与水分子之间的氢键或水化作用,减小了界面曲率,导致团聚体尺寸增大,从而使微乳粒径变大[24],同时热处理可能使粒子对乳化剂的吸附作用减弱,乳胶粒周围的双电子层变薄,粒子聚集增多,从而使微乳的PDI减小[18];此外,随着温度的升高,ζ电位从(−9.80±0.27)mV上升到(−7.59±0.34)mV,药物含量略有下降。以上结果均表明GA-IL-ME体系对热较稳定。

表6 GA-IL-ME的储存稳定性(, n = 3)

表7 不同温度对GA-IL-ME稳定性的影响(, n = 3)
2.7.4 冷热和冻融循环实验
(1)冷热循环:将3份与储存稳定性实验同一批次的GA-IL-ME密封于西林瓶中,置于4 ℃冰箱存放48 h后,再于45 ℃存放48 h,如此于4 ℃和45 ℃之间循环贮存6次。
(2)冻融循环:将3份GA-IL-ME密封于西林瓶中,置于−20 ℃存放48 h后,再于25 ℃存放48 h,如此于−20 ℃和25 ℃之间循环贮存3次[25]。观察微乳在循环实验中是否发生相分离并测定其粒径、PDI和药物含量。结果表明,冷热循环后微乳粒径、PDI和药物含量分别为(11.82±1.17)nm、0.143±0.013和(18.34±0.67)mg/g,冻融循环后分别为(12.15±0.96)nm、0.144±0.017和(17.43±0.15)mg/g。经过冷热和冻融循环实验后,GA-IL-ME外观仍澄清透明,未出现沉淀、相分离等情况;粒径和PDI略有增加,药物含量略有下降,说明该系统可以在升温或冷冻后自我修复,进一步证明了GA-IL-ME有较好的稳定性。
2.8 GA-IL-ME体外透皮实验
2.8.1 实验皮肤的制备 小鼠实验前1 d用脱毛膏去除腹部毛发,静养1 d后颈椎脱臼处死,剪下腹部皮肤,除去皮下脂肪和其他组织,再用生理盐水冲洗干净,滤纸吸去多余水分后于−20 ℃冰箱中保存,1周内使用。
2.8.2 体外经皮吸收实验 采用Franz扩散池进行体外透皮实验。取预先处理好的鼠皮,用生理盐水浸泡30 min,滤纸吸干备用。鼠皮角质层面向供给池,真皮层面向接收池并与接收液接触,确保接收液和皮肤之间没有气泡,用铁夹固定装置。接收液为PBS缓冲液(pH 7.4),水浴温度(32.0±0.5)℃,搅拌速度350 r/min。
实验开始前,先打开透皮扩散仪,用接收液稳定30 min,然后向供给池中分别加入的1 g的甘草酸水溶液、GA-IL-ME和甘草酸O/W型微乳液(该微乳油相为传统油相中对甘草酸溶解能力最高的IPM,除油相种类外其余均与GA-IL-ME保持一致,记为GA-IPM-ME)。分别于1、2、4、6、8、10、12、24 h从接收池中取出1 mL接收液,取样后补充等量同温的空白接收液。样品经0.45 μm滤膜滤过后HPLC进样分析测定药物含量。按下列公式计算单位面积累积渗透量(Q)、渗透速率(s)和渗透系数(p)。
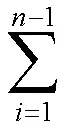
s=dQ/d
p=s/0
C为第个取样点测得的药物质量浓度,0为接收池体积,C为第(=-1)个取样点测得的药物质量浓度,为取样体积,为有效透皮面积,为取样时间,0为药物初始质量浓度,本实验中,0=15 mL,=1 mL,=3.14 cm2,0=20 mg/g
体外透皮吸收曲线如图6所示,相关渗透参数见表8。结果表明,GA-IL-ME的透皮渗透性能优于GA-IPM-ME和甘草酸水溶液。GA-IL-ME的Q值为(310.37±33.65)μg/cm2,分别是GA-IPM-ME的1.35倍和甘草酸水溶液的6.76倍。表明将甘草酸制备成新型离子液体微乳(GA-IL-ME)能够促进甘草酸的经皮渗透,同时,与普通的O/W型微乳(GA-IPM-ME)相比,离子液体的引入能明显增加微乳的促渗活性。动力学结果表明,GA-IL-ME的透皮速率最快,GA-IPM-ME次之,甘草酸水溶液最慢。
2.9 细胞毒性评价
CCK8法比较GA-IL-ME与GA-IPM-ME对HaCaT细胞的毒性大小。取对数生长期且生长状况良好的HaCaT细胞,以5×103个/孔接种于96孔板中,空白组加入等量无细胞培养基,37 ℃贴壁培养72 h[15]。取出96孔板,吸去孔内培养基,分别加入100 μL含甘草酸质量浓度为3.125、6.250、12.500、50.000、100.000 μg/mL的GA-IPM-ME及GA-IL-ME培养基,对照组加空白培养基,置培养箱继续培养24 h后,吸去培养基,每孔加入100 μL含10% CCK8的无血清培养基,于37 ℃继续孵育1 h后,用酶标检测仪于波长450 nm处测定吸光度()值。按下列公式计算细胞存活率。

图6 甘草酸水溶液、GA-IPM-ME、GA-IL-ME的体外透皮吸收曲线(, n = 3)

表8 渗透24 h后甘草酸水溶液、GA-IPM-ME和GA-IL- ME的Qn、Js和Kp(, n = 3)
与甘草酸水溶液比较:***<0.001;与GA-IPM-ME比较:#<0.05
***< 0.001GL aqueous solution;#< 0.05GA-IPM-ME
细胞存活率=(样品-空白)/(对照-空白)
不同质量浓度的GA-IL-ME及GA-IPM-ME对HaCaT细胞存活率的影响结果如表9所示。结果表明,当甘草酸质量浓度在3.125~25.000 μg/mL时,GA-IL-ME和GA-IPM-ME均表现出良好的生物相容性,细胞存活率均大于90%;而当甘草酸质量浓度增大至50.000 μg/mL时,2种微乳均使HaCaT细胞的存活率下降至小于80%。上述结果表明,与传统微乳制剂中常用油相IPM相比,将离子液体引入微乳并未对HaCaT细胞产生明显的细胞毒性作用。
3 讨论
在微乳处方中,油相是微乳的重要载体,影响微乳的载药量和乳化效果;乳化剂主要用来提供基本的微乳化特性;助乳化剂用于降低界面张力,增强乳化效果,稳定乳滴,同时还具有很好的增溶作用[26]。因此,药物的溶解度、处方的相容性以及微乳的稳定性常常作为处方筛选的重要指标。所以,本次研究通过溶解度实验、配伍实验和绘制伪三元相图,选择了溶解性能最优的BMIMPF6作为油相;相容性良好的聚山梨酯80和PEG400作为乳化剂和助乳化剂,并通过伪三元相图确定了两者的最佳比例。在筛选油相时发现BMIMPF6对甘草酸有一定的增溶作用,这可能是由于BMIMPF6和甘草酸之间产生了氢键作用和范德华力[27];绘制伪三元相图时发现一些原本澄清透明的样品放置2 h后底部会出现油滴,说明这些体系不稳定,所以在本次实验中将这些处方进行了剔除,这提示在绘制伪三元相图时,不能仅以微乳外观作为评判指标,还应该考虑其稳定性。

表9 不同质量浓度GA-IL-ME、GA-IPM-ME对HaCaT细胞存活率的影响(, n = 3)
与GA-IPM-ME比较:***<0.001
***< 0.001GA-IPM-ME
粒径是衡量微乳质量的重要指标之一,粒径越小,微乳表面积越大,越有利于药物的透皮吸收。有研究表明,当微乳粒径大于600 nm时,药物主要停留在角质层,无法到达皮肤深层;当粒径小于300 nm时可以有效地将药物传递到皮肤的深层[28]。因此,本实验以粒径为评价指标,采用D-最优混料设计优化处方,以最大程度的增加皮肤透过量。实验中发现,油相的减少和混合乳化剂的增加均有利于粒径的减少,这主要是因为离子液体的浓度越高所形成的油滴越大,要在油滴周围形成稳定的界面膜,需要更多的表面活性剂去调节[29]。
体外透皮结果显示,GA-IL-ME的Q和s均高于GA-IPM-ME和甘草酸水溶液,其中水溶液最差。原因可能有以下几个方面:①药物纳米化后,粒径显著减小,比表面积增大,增加了皮肤接触面,利于甘草酸的透皮吸收;②微乳本身可以通过增溶、增加角质层的水化作用以及破坏脂质双分子层来促进药物渗透;③GA-IL-ME的平均粒径比GA-IPM- ME的平均粒径(11.3±0.6)nm小,更有利于透皮吸收;④BMIMPF6具有增溶作用,同时其阳离子基团咪唑基具有促渗作用[30-31]。
尽管离子液体有众多的优点,但其毒性一直是人们关注的话题,所以,本实验选取HaCaT细胞株进一步评价了GA-IL-ME的体外毒性。IPM无毒性和刺激性、保湿性好,是局部外用制剂和化妆品的常用辅料之一[32],所以在细胞毒性试验中继续将GA-IPM-ME作为参比制剂。结果显示,GA-IL-ME和GA-IPM-ME对HaCaT细胞存活率的影响基本一致,其中GA-IL-ME的毒性略大于GA-IPM-ME。说明在本实验的使用剂量下,GA-IL-ME与GA- IPM-ME的安全性基本一致,可以用于透皮给药。
综上所述,本研究制备的GA-IL-ME粒径均一,具有较好的稳定性、经皮促渗能力以及生物相容性,证明IL-ME对甘草酸的溶解和透皮吸收具有促进作用,为提高甘草酸药效奠定了基础。后期将继续开展皮肤刺激性和药效学评价研究,以期为GA-IL- ME提供更为全面的研究资料,为甘草酸新制剂研究开发提供有价值的参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Pastorino G, Cornara L, Soares S,. Liquorice (): A phytochemical and pharmacological review [J]., 2018, 32(12): 2323-2339.
[2] Rehman M U, Farooq A, Ali R,. Preclinical evidence for the pharmacological actions of glycyrrhizic acid: A comprehensive review [J]., 2020, 21(6): 436-465.
[3] Richard S A. Exploring the pivotal immunomodulatory and anti-inflammatory potentials of glycyrrhizic and glycyrrhetinic acids [J]., 2021, 2021: 6699560.
[4] Qiong H, Han L, Zhang N X,. Glycyrrhizin improves the pathogenesis of psoriasis partially through IL-17A and the SIRT1-STAT3 axis [J]., 2021, 22(1): 34.
[5] Shen C Y, Shen B D, Zhu J J,. Topical delivery of pluronic F127/TPGS mixed micelles-based hydrogel loaded with glycyrrhizic acid for atopic dermatitis treatment [J]., 2021, 47(12): 1975- 1985.
[6] Umar S A, Tanveer M A, Nazir L A,. Glycyrrhizic acid prevents oxidative stress mediated DNA damage response through modulation of autophagy in ultraviolet- B-irradiated human primary dermal fibroblasts [J]., 2019, 53(1): 242-257.
[7] Juin S K, Ghosh S, Majumdar S. Glycyrrhizic acid facilitates anti-tumor immunity by attenuating Tregs and MDSCs: An immunotherapeutic approach [J]., 2020, 88: 106932.
[8] 许文佳, 赵修华, 祖元刚, 等. 反溶剂法制备甘草酸纳米粒的表征与体外透皮特性研究 [J]. 中草药, 2014, 45(8): 1068-1071.
[9] Yamamoto R, Takasuga S, Kominami K,. Iontophoretic transdermal delivery of glycyrrhizin: Effects of pH, drug concentration, co-ions, current intensity, and chemical enhancers [J]., 2013, 61(12): 1275-1281.
[10] Tartaro G, Mateos H, Schirone D,. Microemulsion microstructure(s): A tutorial review [J]., 2020, 10(9): 1657.
[11] 曹建平, 牟永晓, 陈媛媛, 等. 离子液体在药物研究中的应用 [J]. 药学学报, 2019, 54(2): 245-257.
[12] Zhang Y Q, Cao Y Y, Meng X Z,. Enhancement of transdermal delivery of artemisinin using microemulsion vehicle based on ionic liquid and lidocaine ibuprofen [J]., 2020, 189: 110886.
[13] Salabat A, Parsi E.evaluation of celecoxib release from ionic liquid-based microemulsions and microemulgels for topical applications [J]., 2021, 18(6): 1355-1361.
[14] Kontogiannidou E, Meikopoulos T, Gika H,.evaluation of self-nano-emulsifying drug delivery systems (SNEDDS) containing room temperature ionic liquids (RTILs) for the oral delivery of amphotericin B [J]., 2020, 12(8): 699.
[15] Wang C X, Zhu J X, Zhang D,. Ionic liquid - microemulsions assisting in the transdermal delivery of Dencichine: Preparation,andevaluations, and investigation of the permeation mechanism [J]., 2018, 535(1/2): 120-131.
[16] Goindi S, Kaur R, Kaur R. An ionic liquid-in-water microemulsion as a potential carrier for topical delivery of poorly water soluble drug: Development,andevaluation [J]., 2015, 495(2): 913-923.
[17] Parsi E, Salabat A. Comparison of O/W and IL/W microemulsion systems as potential carriers of sparingly soluble celecoxib drug [J]., 2020, 49(1): 68-82.
[18] 王君文, 尹启蒙, 李学艳, 等. 银耳多糖为乳化剂制备槲皮素微乳研究 [J]. 中草药, 2021, 52(2): 378-385.
[19] 张小飞, 果秋婷, 邹俊波, 等. 黄芪甲苷自乳化释药系统的制备及大鼠在体肠吸收研究 [J]. 中草药, 2019, 50(13): 3037-3043.
[20] 杨光, 谢向阳, 宋艳玲. 白藜芦醇微乳的制备及表征 [J]. 中国药师, 2015, 18(3): 414-419.
[21] 陈立亚, 于宝珠, 赵慧芳. Zeta电位及其在药学分散体系研究中的应用 [J]. 药物分析杂志, 2006, 26(2): 281-285.
[22] Zheng Y J, Xu G Z, Ni Q X,. Microemulsion delivery system improves cellular uptake of genipin and its protective effect against Aβ1-42-induced PC12 cell cytotoxicity [J]., 2022, 14(3): 617.
[23] Araújo C, Simon A, Honório T,. Development of rivaroxaban microemulsion-based hydrogel for transdermal treatment and prevention of venous thromboembolism [J]., 2021, 206: 111978.
[24] Gao Y N, Li N, Hilfert L,. Temperature-induced microstructural changes in ionic liquid-based microemulsions [J]., 2009, 25(3): 1360-1365.
[25] Wen M M, Ismail N I K, Nasra M M A,. Repurposing ibuprofen-loaded microemulsion for the management of Alzheimer’s disease: Evidence of potential intranasal brain targeting [J]., 2021, 28(1): 1188-1203.
[26] 赖章婷, 丁海波, 蒋且英, 等. 水飞蓟宾过饱和自微乳给药系统的制备及体外质量评价 [J]. 中草药, 2019, 50(17): 4091-4099.
[27] Jadhav N R, Bhosale S P, Bhosale S S,. Ionic liquids: Formulation avenues, drug delivery and therapeutic updates [J]., 2021, 65: 102694.
[28] He E X, Li H L, Li X K,. Transdermal delivery of indirubin-loaded microemulsion gel: Preparation, characterization and anti-psoriatic activity [J]., 2022, 23(7): 3798.
[29] Shah N, Seth A, Balaraman R,. Oral bioavailability enhancement of raloxifene by developing microemulsion using D-optimal mixture design: Optimization andpharmacokinetic study [J]., 2018, 44(4): 687-696.
[30] Lin Y H, Tsai M J, Fang Y P,. Microemulsion formulation design and evaluation for hydrophobic compound: Catechin topical application [J]., 2018, 161: 121-128.
[31] Zhang D, Wang H J, Cui X M,. Evaluations of imidazolium ionic liquids as novel skin permeation enhancers for drug transdermal delivery [J]., 2017, 22(4): 511-520.
[32] Kung CP, Sil BC, Zhang Y,. Dermal delivery of amitriptyline for topical analgesia [J]., 2022, 12(4): 805-815.
Preparation andevaluation of a novel ionic liquid microemulsion of glycyrrhizic acid
YAN Qiao1, 2, XUE Yu-ye2, LI Fang-qin2, WANG Fang2, QIN Zhi-jian2, DAI Bo2, YUAN Hai-long2
1. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Department of Pharmacy, Air Force Medical Center, PLA, Beijing 100142, China
Glycyrrhizic acid ionic liquid microemulsion (GA-IL-ME) was prepared by replacing the traditional microemulsion oil phase with the lipophilic ionic liquid 1-butyl-3-methylimidazolium hexafluorophosphate (BMIMPF6) to improve the transdermal absorption of glycyrrhizic acid (GA).The formulation of the microemulsion were screened by solubility investigation, compatibility test and pseudo-ternary phase diagrams, and the formulation were further optimized by D-optimal mixture design with the particle size as the evaluation index. Then the physicochemical properties, stability,transdermal absorption and cytotoxicity of the optimized microemulsion were evaluated.The optimized formulation was composed of 5.8% BMIMPF6, 32.4% Tween-80, 10.8% PEG400 and 51.0% water. The prepared microemulsion was a yellow clear transparent liquid. GA-IL-ME was observed to be spherical or nearly spherical by transmission electron microscopy (TEM) and distributed evenly, with an average particle size of (10.61 ± 0.63) nm, a polydispersity index (PDI) of 0.130 ± 0.022 and an average ζ potential of (−10.29 ± 0.22) mV. GA-IL-ME showed good stability in high-speed centrifugation, high-temperature, heating-cooling and freeze- thaw cycles, and storage stability experiments. Results oftransdermal experiments showed that the cumulative permeation per unit area in 24 h of GA-IL-ME was (310.37 ± 33.65) μg/cm2, which was 1.34 times that of glycyrrhizic acid traditional oil in water (O/W) microemulsion and 6.76 times that of glycyrrhizic acid aqueous solution. Cytotoxicity experiments showed that GA-IL- ME had low toxicity and good biocompatibility.BMIMPF6can significantly increase the solubility of GA. Introducing it into microemulsion system to prepare a new ionic liquid in water microemulsion significantly increased the transdermal permeability of GA, which could provide a reference for the development of new dosage forms of traditional Chinese medicine transdermal delivery system and lay a foundation for further research and application of GA.
glycyrrhizic acid; ionic liquid; mircroemulsion; D-optimal mixture design; transdermal absorption; cytotoxicity; pseudo ternary phase diagram
R283.6
A
0253 - 2670(2023)01 - 0062 - 10
10.7501/j.issn.0253-2670.2023.01.009
2022-07-16
国家自然科学基金项目(81873092)
闫 巧(1998—),女,硕士研究生,主要从事中药新型给药系统研究。Tel: 18751921376 E-mail: 1833306142@qq.com
通信作者:袁海龙,研究员,博士生导师,主要从事中药新型给药系统研究。Tel: (010)66928505 E-mail: yhlpharm@126.com
[责任编辑 郑礼胜]
