中药抗冠状病毒的作用机制及临床应用研究进展
2023-01-10李赛娟
李赛娟,苏 娟,靳 灿,丁 侃 *
中药抗冠状病毒的作用机制及临床应用研究进展
李赛娟1, 2,苏 娟1,靳 灿1,丁 侃1, 2 *
1. 中国科学院上海药物研究所,上海 201203 2. 南京中医药大学新中药学院,江苏 南京 211112
冠状病毒(coronaviruses,CoVs)是迄今发现的最大的正链RNA病毒,具有高变异性和高传染性。现已有7种可感染人类的冠状病毒,其中2003年严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、2012年中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,MERS-CoV)和2019年新型冠状病毒(SARS冠状病毒2,severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)均导致全球疫情,对全球公共卫生安全构成严重威胁。针对CoVs的感染研究从未间断,目前的治疗手段主要以改善症状为主。中药在预防和治疗各种疾病方面具有悠久的历史与丰富的经验。在抗CoVs方面,中药因其多组分、多靶点的特点,抗病毒作用显著且不良反应少而备受关注。中药提取物或其化合物可通过直接或间接抑制CoVs的侵入、复制、装配或调节免疫、抑制炎症等途径发挥抗CoVs作用。系统地对中药在抗CoVs及缓解病毒引发的相关症状方面的机制及临床应用进行综述,以期为抗CoVs药物的研发提供理论参考。
中药;抗冠状病毒;严重急性呼吸综合征冠状病毒;中东呼吸综合征冠状病毒;新型冠状病毒
冠状病毒自1937年从鸡身上分离出来已有85年,因在包膜上存在棘突,电子显微镜下整个病毒貌似“皇冠”而得名[1]。冠状病毒属于冠状病毒属,进一步细分为4种,即α、β、γ和δ冠状病毒[2]。α冠状病毒主要包括人冠状病毒229E(human coronavirus 229E,HCoV-229E)、人冠状病毒NL63(human coronavirus NL63,HCoV-NL63)和猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)等。β冠状病毒包括人冠状病毒OC43(human coronavirus OC43,HCoV-OC43)、鼠冠状病毒、家蝠冠状病毒HKU5、果蝠冠状病毒HKU9、严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,MERS-CoV)和新型冠状病毒(SARS冠状病毒2,severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。γ冠状病毒最主要包括禽冠状病毒如鸡传染性支气管炎病毒(infectious bronchitis virus,IBV)。δ冠状病毒主要代表有夜莺冠状病毒、鹅口疮冠状病毒及野鸭冠状病毒[3-5]。
目前发现可感染人的冠状病毒共有7种,除HCoV-229E和NL63属于α冠状病毒外,其他5种均属于β冠状病毒(OC43、HKU1、MERS-CoV、SARS-CoV和SARS-CoV-2)[2,6]。HCoV-229E、OC43、NL63、和HKU1这4种冠状病毒的毒性较弱,通常仅引起急性上呼吸道感染,而很少影响下呼吸道感染,感染者一般也仅出现轻微的感冒症状[7-8]。但另外3种冠状病毒毒性较强,可导致急性的呼吸道感染,在重症患者人群中的致死率较高,2003年SARS疫情中,患者死亡率为10%,65岁以上老年人的致死率高达50%[7]。2013年MERS疫情的患者病死率为30%[7]。SARS-CoV-2作为目前发现的第7种人冠状病毒,因其具有强大的传染力和破坏力,已导致全球超过5.90亿确诊病例和超过644万的死亡病例[9],严重影响了人类的健康与经济的发展[5,10]。目前SARS-CoV-2的变异毒株已超千种,且不断有新的变异毒株出现,这给现有的疫苗、中和性抗体等预防和治疗手段带来持续挑战[11-13]。因此,SARS-CoV-2的突变对未来的潜在威胁仍不可小觑,人类依然迫切需要能特异性拮抗新型冠状病毒的药物。
中医药在历代数百次传染病防治过程中积累了丰富的理论和经验。早在先秦时期,《黄帝内经》中就有关于传染病“五疫之至,皆相染易,无问大小,症状相似”的记载,六经辨证体系、卫气营血辨证、三焦辨证等为防治外感伤寒、温热疾病奠定了理论基础[14]。基于历代经典方剂和本草药物,许多有效的抗病毒中药制剂被研发并应用于临床,在对SARS、甲型H1N1、呼吸道合胞病毒等病毒传染病的防治中发挥了重要作用[15]。研究表明清热解毒类中药,如板蓝根、金银花、鱼腥草、地榆、穿心莲、绿豆、胖大海、连翘等具有抗冠状病毒的作用[16-17];此外,补益类中药黄芪、人参、刺五加、甘草,以及半夏、远志、黄芩、黄连、肉桂等其他类型的中药也具有抗冠状病毒作用[18]。中药复方常以辨证论治、整体治疗来调节机体的免疫功能状态、改善预后,达到祛邪不伤正的目的。以连花清瘟胶囊、血必净注射液、清肺排毒汤、化湿败毒方、宣肺败毒方为代表的中药制剂在应对新型冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情中取得了良好的疗效[19-20]。既往研究表明,中药多组分、多靶点、多途径的作用特点使其在抗冠状病毒新药研发方面具有极大的优势和潜力。因此,本文根据以往研究报道,对中药在抗冠状病毒及缓解病毒引发的相关症状方面的机制及其临床应用进行综述,以期为抗冠状病毒药物的研发提供理论基础。
1 中药抗冠状病毒的作用机制
冠状病毒的结构中有即包膜糖蛋白(envelope protein,E)、膜糖蛋白(membrane protein,M)、核衣壳糖蛋白(nucleocapsid protein,N)和刺突糖蛋白(spike protein,S),它们主要介导病毒与细胞的融合和装配等[5]。冠状病毒通过劫持宿主细胞进行复制,感染周期始于病毒受体与宿主细胞结合并与细胞膜融合。冠状病毒的生命周期分为病毒进入、病毒复制和蛋白合成、组装和出胞释放等过程。当病毒接触细胞时,其通过黏附和侵袭进入宿主细胞,并利用宿主细胞内的物质完成自身的繁殖。中药的抗冠状病毒作用在病毒的整个生命周期中均可以发挥相应作用[21]。在病毒的进入过程中,可直接或间接与病毒相互作用,抑制其对宿主细胞的吸附,阻碍病毒与细胞受体结合从而进入宿主细胞;在病毒复制过程中,其可以通过抑制病毒的核糖核酸(ribonucleic acid,RNA)及蛋白质合成从而阻止病毒大量繁殖;抑或通过抑制病毒蛋白酶、抑制其释放等过程达到抗病毒的效果[22]。此外,部分中药还具有“扶正固本”的功效,可调节机体免疫间接发挥抗病毒作用[23]。根据中药在冠状病毒的各生命周期发挥的抗病毒作用,将其作用机制分为6个方面(图1),并分别进行阐述。
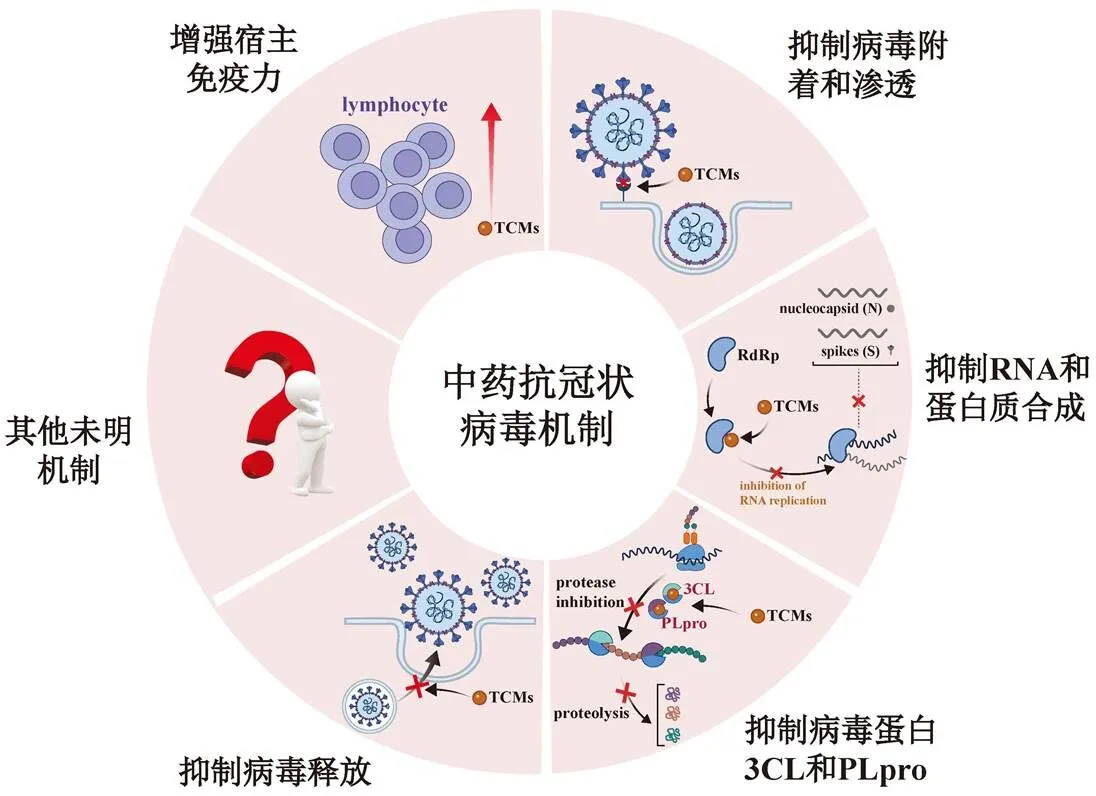
图1 中药抗冠状病毒的作用机制
1.1 抑制病毒附着和渗透
抑制病毒的渗透和附着是抑制冠状病毒感染的有效途径。感染性病毒粒子与细胞膜受体结合,进入细胞质后渗透细胞膜,并去除病毒粒子的蛋白外壳,释放病毒核酸。
冠状病毒S蛋白在病毒附着、融合和进入过程中起着关键作用,使其成为疫苗、抗体和抑制剂开发的潜在靶点[24-26]。病毒的S蛋白可以通过S1亚基上的受体结合结构域与宿主细胞先结合,再使宿主血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)受体通过S2亚基与宿主细胞融合,从而调节病毒的穿透[24]。不同亚型的冠状病毒识别不同的受体。例如,SARS-CoV与SARS-CoV-2特异性识别ACE2受体,而MERS-CoV识别重组人二肽酶4(dipeptidyl peptidase-4,DPP4)受体[27-28]。通过抑制S蛋白或ACE2可能会抑制病毒附着进入宿主细胞。Wu等[29]对121个植物成分进行活性筛选,发现来自五倍子和水蔓菁的4--没食子酰-β--葡萄糖(1,2,3,6-tetragalloylglucose,TGG)和木犀草素与病毒S2亚基的亲和性最高,因此推测这些化合物可能会干扰病毒细胞融合过程。TGG和木犀草素抑制SARS-CoV的半数抑制浓度(median inhibitory concentration,IC50)分别为4.5和10.6 μmol/L,选择性指数(selectivity index,SI)分别为240.0和14.62。SI是根据提取物或化合物的细胞毒性浓度的比例确定,SI值越高,其对宿主细胞毒性越小[29]。因此,认为以上这2种化合物不仅具有很好的抗病毒作用,而且对人类来说是安全的。
甘草根在古代就被认为是一种抗病毒草药,作为传统药物主要用于治疗咽喉感染、哮喘、支气管炎、消化性溃疡、炎症和过敏等[30]。从甘草中分离出的甘草酸也被证实可以抑制病毒的附着和渗透[31-32]。甘草酸是甘草中主要的生物活性成分,其抑制SARS-CoV临床分离株的复制作用(其SI超过67),比几种合成的抗病毒药物(如利巴韦林、吡唑氟尿嘧啶、6-氮杂吡啶和霉酚酸)要更强,安全性也很高。同时,甘草酸还能通过下调促炎介质抑制炎症反应,但其在抗击细胞因子风暴在内的COVID-19严重炎症方面的有效性需要进一步研究[32-33]。大黄块根的水提取物以及何首乌的藤蔓和块根水提物都具有抗病毒作用,其IC50为1~10 μg/mL[34]。大黄素是从大黄中发现的蒽醌苷类活性化合物,其能显著抑制S蛋白且剂量相关性地与ACE2相互作用[34]。该化合物还能抑制S蛋白假逆转录病毒对非洲绿猴肾细胞Vero E6的感染,表现出阻断病毒进入的潜力[34]。此外,研究者们还发现来自海藻类中药的硫酸岩藻多糖、海参硫酸化多糖、硫酸乙酰肝素及其类衍生物具有体外抗SARS-CoV-2作用,其机制是通过靶向S蛋白发挥作用[35-37]。因此,认为S蛋白是硫酸乙酰肝素型多糖最可能的抗病毒靶点[35-37]。
骨木科的丸仔草(又名冇骨消)的乙醇提取物抑制冠状病毒的IC50达1.17 μg/mL,SI为154.37,表现出很强的抗病毒作用[38]。从其中分离出的咖啡酸可以通过抑制病毒进入,削弱HCoV-NL63与ACE2受体和硫酸乙酰肝素蛋白聚糖共受体在宿主细胞表面的结合作用,显示出潜在的抗冠状病毒活性[38-39]。
SARS-CoV也可以通过网格蛋白介导的内吞作用侵入宿主细胞[40]。以网格蛋白为基础的内吞作用可以很好地利用生长因子受体,如转铁蛋白受体(transferrin receptor,TfR)、表皮生长因子受体和角质形成细胞生长因子受体[41-43]。氯丙嗪作为一种网格蛋白依赖性内吞作用的抑制剂,具有明显抑制SARS-CoV复制的作用。此外,肉桂的丁醇提取物也可通过TfR受体抑制网格蛋白介导的内吞作用,抑制野生型SARS-CoV感染、人类免疫缺陷病毒(human immunodeficiency virus,HIV)及SARS-CoV假病毒感染[44]。从肉桂中成功分离得到的原花青素A2、原花青素B1和肉桂酸B1显示出一定的抗野生型SARS-CoV活性(IC50分别为29.9、41.3、32.9 μmol/L),但原花青素无明显的抑制病毒内吞作用,其抑制病毒的机制有待进一步研究[44]。
1.2 抑制病毒RNA和蛋白质的合成
RNA作为冠状病毒的遗传物质,参与其转录和蛋白质的合成。当病毒进入宿主细胞后,以RNA为翻译模板,表达RNA聚合酶,继而完成负链亚基因组RNA的转录合成及和基因组RNA的复制,新的冠状病毒颗粒在内质网中装配后,通过高尔基体分泌至细胞外,形成完整的生命周期。中药石蒜、地榆、粉防己和板蓝根等可以抑制冠状病毒的RNA和蛋白质合成,从而发挥抗病毒活性。其中,从石蒜中分离得到的石蒜碱,通过抑制核糖核蛋白从核到胞质的迁移及延伸,而抑制病毒RNA的复制,其半数效应浓度(median effective concentration,EC50)为(15.7±1.2)nmol/L,SI大于900[45]。地榆提取物可以降低小鼠肝炎病毒(mouse hepatitis virus,MHV)-A59的N蛋白[46]。此外,从粉防己中分离得到的双苄基异喹啉生物碱,如粉防己碱、防己啉和千金藤素(千金藤碱)能够抑制冠状病毒S和N蛋白的表达,从而抑制HCoV-OC43在人成纤维细胞MRC-5的复制,表现出显著的抗冠状病毒活性[47]。从板蓝根叶子中提取得到的色氨酮及靛苷B具有显著的抗病毒活性,能最大限度地减少细胞病变和病毒子代的发育,IC50值分别为1.52和2.60 μmol/L[48]。作用机制研究表明色氨酮可以通过阻断病毒RNA的基因组合成,从而阻止HCoV-NL63在早期和晚期的复制[48]。Kim等[46]发现苦参、五加皮提取物可以降低细胞内病毒RNA浓度,破子草提取物也可以相应地削弱病毒蛋白和MHV-A59的产生。从连翘果实中分离得到连翘苷A可降低病毒复制,与未处理的IBV感染细胞相比,发现连翘苷A降低IBV复制与降低病毒N基因的表达有关[49]。
RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRp)是一种复制酶,参与病毒基因组和亚基因组RNA的合成,对冠状病毒的转录和复制至关重要[50]。由于RdRp在病毒生命周期中发挥至关重要的作用,RdRp聚合酶抑制剂瑞德西韦已被用于治疗各种病毒感染,如HIV-1、人类乙型肝炎病毒、丙型肝炎病毒、寨卡病毒和疱疹病毒[51-53]。探究中药对RdRp的抑制作用,可能会发性具有潜在抗SARS-CoV作用的药物。Lau等[54]发现不同质量浓度(50、100、200、400和800 μg/mL)的鱼腥草水提取物均可表现出显著的抑制RdRp酶活性。急性毒性试验发现,给予小鼠ig鱼腥草提取物16 g/kg[54]或2 g/kg[55]后未产生危害,表明鱼腥草提取物对人类可能是安全的。川黄檗和广豆根(山豆根)以及黄连的提取物也可抑制RdRp活性[56]。这些中药的甲醇提取物不仅可以降低冠状病毒细胞内病毒RNA的生成和蛋白的表达,IC50值在2.0~27.5 μg/mL,还能体外显著降低PEDV的数量[56]。
1.3 抑制病毒蛋白酶——3C样蛋白酶(3C-like protease,3CLpro)和木瓜样蛋白酶(papain-like protease,PLpro)
冠状病毒复制过程中涉及的主要酶和蛋白质都是潜在的作用靶标。其中,3CLpro是一种半胱氨酸水解酶,可在病毒复制过程中裂解较大的聚蛋白复制酶,因其基因具有高度的保守性,可作为药物设计的关键靶标[57]。PLpro因其具有蛋白水解、去泛素化和去糖基化的功能,在病毒的复制中发挥着突出作用。因此,SARS-CoV PLpro也被认为是抗冠状病毒的药物靶点[57-59]。但对3CLpro的研究要比PLpro多,可能是因为3CLpro能够产生12种重要的非结构蛋白(nsp4~nsp16),以及病毒的RdRp(nsp12)和解旋酶(nsp13)等[60]。
中医认为金银花、黄芩、连翘这3味中药具有良好的清热解毒、表里双清的作用[61]。由此3味中药组成的双黄连口服液常用于外感风热所致的感冒、发热、咳嗽、咽痛等。现代药理学研究表明双黄连制剂具有广谱抗病毒及抑菌作用,其机制与提高机体免疫功能相关[62]。现代药理学研究表明,双黄连口服液能显著抑制细胞中SARS-CoV-2的复制,EC50达1.20 μL/mL,且能浓度相关性地抑制RNA合成关键水解酶3CLpro的活性(IC50为0.09 μL/mL)。其中的指标性成分黄芩苷、黄芩素可以有效抑制3CLpro的活性,黄芩苷的IC50达6.41 μmol/L,黄芩素的IC50达0.94 μmol/L[63]。板蓝根提取物对SARS-CoV 3CLpro的顺式切割活性有明显的抑制作用,其IC50为(191.6±8.2)μg/mL[64]。从板蓝根中提取得到的化合物如黑芥子苷、β-谷甾醇和靛蓝等对3CLpro均表现出显著的抑制活性,在细胞实验中,黑芥子苷的IC50为217 μmol/L,比靛蓝(IC50为752 μmol/L)或β-谷甾醇(IC50为1210 μmol/L)更能抑制3CLpro的裂解过程[64]。除此之外,来源于中药昆布的粗多糖375体外可以靶向SARS-CoV-2的3CLpro,其亲和力(D)值为4.23×10−6mol/L,该多糖通过抑制3CLpro的活性(IC50为0.48±0.10 μmol/L),进而抑制新冠病毒对Vero E6细胞的感染,抑制率高达99.9%[65]。从375粗多糖纯化得到的海藻酸盐均一多糖37502(相对分子质量为2.79×104),可在体外直接靶向3CLpro而影响病毒的复制[65]。在体外实验中,鱼腥草水提物表现出对SARS-CoV-2的3CLpro明显的抑制作用,在质量浓度为1000 μg/mL时,能使3CLpro的活性降至50%,表明极性分子对3CLpro有抑制作用[54]。大黄的醋酸乙酯提取物也具有抗SARS-3CLpro的活性,其IC50为13.76 μg/mL,抑制率高达96%[66]。来源于中药黄芪的3种天然黄酮类化合物(黄芩苷、槲皮素和二氢杨梅素)在体外也能有效抑制SARS-CoV-2 3CLpro活性,并能强烈抑制Vero细胞中SARS-CoV-2的复制,IC50分别为5.80、1.27、1.20 μmol/L。不同中药提取物对3CLpro的高抑制率,表明这些中药提取物或分离得到的化合物可能是潜在的抗冠状病毒药物[67]。
另外,通过基于生化水平的酶抑制剂筛选,发现多个来自中药的活性成分,如多酚类[68]、丹参酮[69]、天竺葵酯[70]、肉桂酰胺[71]和姜黄素[72]等具有PLpro抑制活性,但缺少其对细胞水平病毒复制的影响数据。Tsai等[73]从板蓝根叶的甲醇提取物中分离得到色胺菊酯(色胺酮),不仅能够阻止HCoV-NL63早期和晚期复制,还能阻断病毒RNA基因组合成和HCoV-NL63的PLpro活性,该研究表明色胺菊酯(色胺酮)具有潜在的抗病毒HCoV-NL63感染作用。但对于寻找以PLpro为靶点的抗病毒药物还需更多的研究。
1.4 抑制病毒释放
SARS-CoV的基因编码蛋白是其最大的附属蛋白,其参与了3a阳离子通道的形成,装配成熟的病毒颗粒借助该通道完成从宿主细胞的跨膜释放[74]。活病毒的缺失研究表明,对SARS-CoV感染的细胞死亡至关重要[74]。来源于中药的活性化合物可以特异性靶向参与病毒释放机制的3a离子通道蛋白,抑制该离子通道蛋白的中药可能具有防止病毒向其他细胞扩散的作用。例如,被用作SARS替代疗法的大黄素,在浓度为20 μmol/L时,就可以阻断SARS冠状病毒3a蛋白形成的离子通道,抑制病毒的释放[75]。除此之外,还有黄酮醇、山柰酚和山柰苷也显示出对3a离子通道的抑制作用,表明它们在抑制冠状病毒释放方面的潜在价值[75]。
1.5 增强宿主免疫力
对于抗病毒感染的治疗不仅要注重直接作用于病毒,影响细胞的吸附和渗透的过程,还要考虑通过激活先天免疫功能,加强抗氧化防御系统,诱导免疫细胞因子的生产,间接发挥抗病毒作用。作为宿主细胞的入侵者,病毒必须逃脱免疫反应才能生存。宿主针对病毒感染和复制的先天性和适应性反应与其自身针对病毒免疫反应的病毒策略(逃逸和阻断)相反。宿主免疫反应的过度反应也可能导致组织损伤和多器官损伤,进而可能导致相关疾病[76]。因此,中药及其活性成分可通过增强宿主抗病毒免疫应答或阻断病毒免疫逃逸,影响免疫调节机制表现出抗病毒活性。Cho等[77]研究表明淫羊藿可治疗和预防猪感染PEDV的症状,如治疗腹泻和清洁猪的肠道功能。研究还发现淫羊藿的抗病毒作用主要是通过调节免疫反应实现的,包括巨噬细胞和淋巴细胞刺激。槲皮素和淫羊藿苷是淫羊藿中的主要活性成分,此前的1项研究发现槲皮素也可通过特定的病毒诱导活性氧途径抑制PEDV的复制。该化合物对其他冠状病毒亚型如SM98和传染性胃肠炎冠状病毒也有抑制作用,且对宿主细胞无毒,结果表明其可安全地用于病毒感染治疗[77]。Lau等[54]发现鱼腥草水提物能显著刺激小鼠脾淋巴细胞的增殖,从而提高小鼠的免疫系统;可增加CD4+和CD8+T细胞的占比,并诱导小鼠脾淋巴细胞分泌白细胞介素-2和白细胞介素-10,产生免疫刺激作用,可能有助于抑制冠状病毒感染。此外,具有免疫激活作用的中药多糖可以通过作用于免疫细胞,激活并调节机体免疫系统,发挥潜在的抗冠状病毒作用,如香菇β-葡聚糖和黄芪多糖等[78-79]。其他多项研究也表明,包括维生素C和D等微量元素有可能通过增强免疫系统来预防或治疗COVID-19,其中一些已进入临床试验阶段[80]。
1.6 其他未明机制
一些中药或传统药物也具有抗冠状病毒的潜力,但目前其确切的机制仍然未知。例如,研究者从大戟科药用植物玉麒麟叶子的乙醇提取物中成功分离出的化合物3β-木栓醇、3β-乙酰氧基木栓烷、木栓酮和异蒲公英赛醇,发现它们对HCoV感染的MRC-5细胞都表现出较强的抑制活性。构效关系研究表明3β-木栓醇表现出比阳性对照放线菌素D更强的抗病毒活性,进一步证明了芳香烷骨架作为开发新型抗HCoV-229E药物的重要性[81]。香椿作为药食同源的中药,常作为菜肴出现在餐桌上。然而,研究表明其对冠状病毒也具有抑制活性。体外实验发现香椿的水提取物可抑制SARS-CoV复制,其SI为17。虽然从香椿叶子中分离出许多生物活性化合物,包括β-谷甾醇、β-谷甾醇-葡萄糖苷、(+)-儿茶素、(−)-表儿茶素、没食子酸、山柰酚、没食子酸甲酯、叶绿醇、槲皮素、槲皮苷、芦丁、豆甾醇和太仙丹素等,但其抑制SARS-CoV的主要化合物及其相关机制仍然未知[82]。此外,研究者发现鱼腥草的醋酸乙酯提取物抗MHV效果较好,其IC50为0.98 μg/mL,且对正常小鼠肝细胞CCL9.1没有明显的细胞毒性[55]。对活性化合物分析发现,主要是黄酮类化合物槲皮素表现出显著的抗MHV活性,IC50为125 μg/mL[55]。研究还发现槲皮素对SARS-CoV-2具有很强的抗氧化和预防作用,但其具体机制还待研究[80]。以上研究表明这些中药提取物可用于冠状病毒感染的治疗,但需进一步研究来阐明其抗病毒作用的确切机制。
2 中药抗冠状病毒的临床应用
2.1 中药抗SARS及MERS的临床应用
不管是针对2003年的SARS,还是2013年的MERS,中医药在其防治上都发挥了独特的治疗优势。根据中医药“辨证论治”和“对症下药”的治疗方针,国家中医药管理局公布了银翘散合麻杏石甘汤、达原饮、参附汤、生脉散、独参汤、宣白承气汤、安宫牛黄丸、紫雪丹等方剂的加减方用于SARS患者的治疗[83]。这些方剂可减少患者从轻度到中度或重度的发展,改善治愈率,降低死亡率。同时,8种中成药对于SARS的不同病理环节也有明显改善作用[84]。其中,清开灵注射液、鱼腥草注射液及板蓝根冲剂可以较好地改善SARS患者的肺部急性炎症;新雪颗粒和金连清热颗粒对高热症状患者具有快速退热的效果;灯盏细辛注射液和清开灵注射液具有缓解急呼吸窘迫综合征的作用;清开灵注射液、复方苦参注射液及香丹注射液在保护脏器损伤上具有明显效果[85-86]。此外,复方鳖甲软肝片作为我国最先用于治疗SARS肺纤维化的中药,可以降低SARS的病死率、提高治愈率、缩短病程,对恢复期患者肺功能的彻底恢复、防止后遗症的发生具有重要作用[84]。
清热解毒类中成药连花清瘟颗粒对SARS和MERS病毒都具有明显的抑制和杀伤作用。连花清瘟颗粒主要由连翘、金银花、麻黄(炙)等13味中药组成,能有效缓解病毒性呼吸系统疾病[87]。此外,中成药感冒清热颗粒、感冒灵颗粒、血必净注射液、热毒宁注射液、痰热清注射等在MERS的防治中也发挥了很好的作用[87]。在MERS患者的恢复期,还可运用四君子汤、人参五味子汤及沙参麦冬汤等加减进行调理,提高机体免疫功能[88]。
除了临床治疗方面,中医药界专家还根据“不治已病治未病”及冠状病毒传播的途径和特点,提出了SARS预防药方。如主药包括苍术、藿香、银花、贯众、黄芪、防风、沙参、白术等的药方,将其适当方煎后代茶饮。该方具有清热解毒、芳香化湿避秽、补气生津养阴,提高免疫力的作用[85]。在收治SARS患者医院的医务人员中得到广泛使用,使病区的医务人员感染率为零,该药方证明了中药预防冠状病毒是有一定成效和作用的[85]。对于MERS的预防药方,中医认为其为感受异气而发病,所以推荐使用提高机体免疫力的玉屏风散及通治表里、三焦、气血的防风通圣丸等用于MERS的预防,达到预防为主,防重于治的效果[88]。
2.2 中药抗COVID-19中的临床应用
2019年COVID-19爆发伊始,由于对感染源病毒的结构特性认识不全面、不系统,该疾病曾被称为“不明原因肺炎”。这种情况下,西医的多款抗病毒药均未达到理想的临床疗效。而在中医角度,新冠肺炎属于“疫病”范畴,中医在历代防治瘟疫的不断发展与实践中积累了丰富的经验,形成了一部具有中国特色的“战疫史”。因此,疫情爆发初期,提出以中医为主的中西医结合救治方法,推动中医药早期参加、全程介入COVID-19的救治工作。在临床诊察和研究中,张伯礼院士发现中药在减轻患者的发热症状、控制病情进展、减少激素用量、减轻并发症等方面均有疗效。以患者痊愈时间和轻症转重症比例为核心指标,中医药治疗显示出了确切的疗效。
“化湿败毒方”是我国首个具有完全知识产权的治疗COVID-19的中药创新药物,作为中国第1个获批临床试验的中药,其可通过直接杀灭病毒,或增强机体的自身免疫力达到治疗COVID-19的目的[89]。该药由麻杏石甘汤、葶苈大枣泻肺汤、宣白承气汤、藿朴夏苓汤化裁而成。临床数据表明,仅使用化学药对重症患者进行抗感染及抗病毒治疗,患者的症状并无明显改善,加以化湿败毒方联合治疗后重型患者的反复发热、乏力咳嗽、呼吸困难、头昏胸闷等症状得到明显好转,有效降低了重型患者向危重型的转化,促进了重型患者的治疗和康复[90]。化湿败毒方的作用机制可能与阻断机体炎症因子风暴,调节机体免疫反应及改善血流动力学有关[91]。
“清肺排毒汤”在COVID-19治疗中也得以广泛应用,其由出自《伤寒杂病论》的麻黄杏仁甘草石膏汤、射干麻黄汤、小柴胡汤、五苓散等多种方剂化裁而成[92-93]。《新型冠状病毒肺炎诊疗方案(试行第九版)》中推荐清肺排毒汤、清肺排毒颗粒用于轻型、普通型、重型患者[94]。临床数据表明,采用清肺排毒汤治疗9 d后,纳入治疗的98例患者的总有效率达到92.09%,在98例患者中,54例轻型及33例普通型患者均未转为重型或者危重型病例,可以显著改善患者的临床症状,与常规治疗相比,可显著改善患者的肺部炎症吸收、缩短住院时间,具有良好的临床疗效[95]。其作用机制与抑制患者体内内毒素的含量从而避免或延缓细胞因子炎症风暴的发生有关[96]。
“宣肺败毒方”是COVID-19一线治疗中被广泛使用的另一个方剂,由《伤寒论》中的4张经典处方:麻杏石甘汤、麻杏薏甘汤、千金苇茎汤和葶苈大枣泻肺汤化裁而成。在《新型冠状病毒肺炎诊疗方案(试行第九版)》中,其被推荐用于湿毒郁肺证普通型患者。临床数据表明,宣肺败毒颗粒对于感染新冠病毒变异毒株(奥密克戎)的患者具有显著的临床疗效,可以改善其胸闷、咳嗽、呼吸不畅等临床症状,缩短病毒核酸转阴时间,其作用机制与提高患者体内的的淋巴细胞水平、降低降钙素原有关[97]。同时,金花清感颗粒、连花清瘟胶囊(颗粒)、疏风解毒胶囊(颗粒)、藿香正气胶囊(丸、水、口服液)等中成药也在《新型冠状病毒肺炎诊疗方案(试行第九版)》中被推荐用于医学观察期的服用,符合疫情开始时期定制的中医药“早介入,全程参与”方针[94]。对于恢复期的SARS-CoV-2感染者可以应用藿香、砂仁、党参、炙黄芪、茯苓、陈皮等药物进行治疗[94]。
此外,中医药还根据不同体质、不同年龄及不同地域的差异性,进行“辨证论治”,提出相应的抗SARS-CoV-2预防药方。例如,北方地区的预防用药多为滋阴润燥药(有玄参、麦冬、玉竹、沙参以及芦根等);而南方地区例如湖北、江西、湖南、广西、四川以及云南等地多采用芳香化湿药(藿香、苍术、陈皮以及佩兰)等进行预防用药[98]。
2022年3月,来自世界卫生组织6个区域的21名国际专家参加了“世界卫生组织关于中医药治疗新冠肺炎专家评估会”,通过对中国国家专家组提供的临床应用、研究和循证评价报告的评估,世界卫生组织专家组得出结论:中药能有效防治COVID-19,减少轻型、普通型病例转为重症,缩短病毒清除时间,改善轻型和普通型患者的临床预后[99],并鼓励各成员国将中医药等传统医学治疗方法投入到新冠临床治疗中。这一来自世界卫生组织专家会议的认可,使得中医药治疗新冠肺炎的应用更受鼓舞。
中药在SARS、MERS和COVID-19中的临床应用比较见表1。
3 结语和展望
冠状病毒易感染、易变异、易流行和跨物种传播的特点为世界公共卫生带来严重威胁,也为传统抗病毒药物的研发带来巨大挑战。大量研究表明,来源于中药的粗提取物或生物活性化合物,都具有抗冠状病毒作用。TGG、大黄素、甘草酸、乙酸橙酰胺和咖啡酸、硫酸乙酰肝素类化合物等已被鉴定具有抑制病毒附着和渗透的作用。此外,还发现了中药地榆、粉防己、石竹等可以抑制冠状病毒的RNA和蛋白质合成。从连翘从得到的连翘苷A也能抑制病毒RNA和蛋白质合成。其他中药来源的化合物如多糖(375)、山柰酚及槲皮素等可以靶向抑制病毒蛋白酶如3CLpro和PLpro。还有大黄素和山柰酚可能作用于3a离子通道蛋白,进而抑制病毒释放,以及淫羊藿提取物和鱼腥草提取物等可以增强宿主免疫系统功能。同时,一些中药的相关制剂或复方(连花清瘟、血必净注射液、化湿败毒方、清肺排毒汤和宣肺败毒方等)已在临床上作为辅助治疗冠状病毒,并展现较好的疗效。值得注意的是,中药及其提取物在抗冠状病毒的临床应用中依然面临很多难题。中药中的成分相对复杂,其发挥作用的活性化合物结构及其作用机制和靶标分子仍然不是十分明确,需进一步研究。此外,从中药中分离得到的大分子化合物如多糖,已报道具有良好的抗冠状病毒潜力,但仍需深入系统探究多糖发挥抗病毒作用的靶分子及其吸收机制,而且大分子的药动学和质量控制的研究也面临诸多挑战。综上,中药因其多组分、发挥药效的多靶点以及系统调节的特点,在治疗临床常见的多重病毒感染和应对病毒变异和耐药性,以及免疫调节和整体治疗上具有独特的应用价值,也使其在广谱抗冠状病毒新药研发上具有较大的优势和潜力。因此,需要充分利用多学科方法探索新的广谱抗病毒中药的研发策略和途径,突破现阶段的技术问题瓶颈,寻找安全有效的广谱抗冠状病毒药物,为有效应对突发的病毒感染对人类健康带来的严重威胁做出应有的中医药贡献。

表1 中药在SARS、MERS和COVID-19中的临床应用比较
利益冲突 所有作者均声明不存在利益冲突
[1] Lai M M, Cavanagh D. The molecular biology of coronaviruses [J]., 1997, 48: 1-100.
[2] Hu H, Jung K, Wang Q H,. Development of a one-step RT-PCR assay for detection of pancoronaviruses (α-, β-, γ-, and δ-coronaviruses) using newly designed degenerate primers for porcine and avian fecal samples [J]., 2018, 256: 116-122.
[3] Huang C L, Wang Y M, Li X W,. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China [J]., 2020, 395(10223): 497-506.
[4] Zhou P, Yang X L, Wang X G,. A pneumonia outbreak associated with a new coronavirus of probable bat origin [J]., 2020, 579(7798): 270-273.
[5] Fehr A R, Perlman S. Coronaviruses: an overview of their replication and pathogenesis [J]., 2015, 1282: 1-23.
[6] Woo P C Y, Lau S K P, Chu C M,. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia [J]., 2005, 79(2): 884-895.
[7] Gralinski L E, Baric R S. Molecular pathology of emerging coronavirus infections [J]., 2015, 235(2): 185-195.
[8] 郑涛, 陈黎, 郝新才, 等. 中药抗冠状病毒研究进展 [J]. 湖北医药学院学报, 2020, 39(1): 1-6.
[9] World Health Organization. Coronavirus disease (COVID-19) situation dashboard [EB/OL]. (2022-08-19) [2022-08-19]. https://covid19.who.int.
[10] Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species severe acute respiratory syndrome-related coronavirus: Classifying 2019-nCoV and naming it SARS-CoV-2 [J]., 2020, 5(4): 536-544.
[11] Jackson B, Boni M F, Bull M J,. Generation and transmission of interlineage recombinants in the SARS-CoV-2 pandemic [J]., 2021, 184(20): 5179-5188.e8.
[12] Burel E, Colson P, Lagier J C,. Sequential appearance and isolation of a SARS-CoV-2 recombinant between two major SARS-CoV-2 variants in a chronically infected immunocompromised patient [J]., 2022, 14(6): 1266.
[13] Hoffmann M, Krüger N, Schulz S,. Theis highly resistant against antibody-mediated neutralization: Implications for control of the COVID-19 pandemic [J]., 2022, 185(3): 447-456.e11.
[14] 黄玉燕, 胡镜清, 卢红蓉, 等. 《黄帝内经》疫病发病与防治理论概述 [J]. 中国中医基础医学杂志, 2020, 26(4): 421-423, 429.
[15] 白佳坤, 马晓阳, 李霄鹤, 等. 新型冠状病毒治疗靶点及药物研究进展 [J]. 今日药学, 2021, 31(1): 69-72.
[16] 邢世华, 李晓波. 清热解毒类中药抗病毒活性及作用机制研究进展 [J]. 中国药理学通报, 2014, 30(4): 464-468.
[17] 魏雅雯, 李谨彤, 任夏, 等. 基于数据驱动分析的抗病毒中药分布规律 [J]. 中草药, 2021, 52(16): 4959-4972.
[18] 李萍. 流感荧光素酶报告病毒的评价和在中药抗流感筛选中的应用 [D]. 济南: 山东中医药大学, 2019.
[19] 李兵, 张洪春, 杨子峰, 等. 广谱抗呼吸道病毒中药研发的价值与途径 [J]. 中国新药杂志, 2022, 31(1): 33-38.
[20] 王诗恒, 秦培洁, 张凤霞, 等. 连花清瘟联合西医常规治疗新型冠状病毒肺炎系统评价的再评价 [J]. 中草药, 2022, 53(8): 2460-2469.
[21] 全彦妮, 王宜轩, 李艳萍. 人冠状病毒治疗药物研究进展 [J]. 中国医药生物技术, 2020, 15(2): 97-108.
[22] Remali J, Aizat W M. A review on plant bioactive compounds and their modes of action against coronavirus infection [J]., 2021, 11: 589044.
[23] 陈冉, 王婷婷, 李开铃, 等. 免疫调节抗病毒中药的特性与应用 [J]. 中草药, 2020, 51(6): 1412-1426.
[24] Liu S W, Xiao G F, Chen Y B,. Interaction between heptad repeat 1 and 2 regions in spike protein of SARS-associated coronavirus: Implications for virus fusogenic mechanism and identification of fusion inhibitors [J]., 2004, 363(9413): 938-947.
[25] Du L Y, He Y X, Zhou Y S,. The spike protein of SARS-CoV: A target for vaccine and therapeutic development [J]., 2009, 7(3): 226-236.
[26] Du L Y, Yang Y, Zhou Y S,. MERS-CoV spike protein: A key target for antivirals [J]., 2017, 21(2): 131-143.
[27] Zhou P, Yang X L, Wang X G,. A pneumonia outbreak associated with a new coronavirus of probable bat origin [J]., 2020, 579(7798): 270-273.
[28] Raj V S, Mou H H, Smits S L,. Dipeptidyl peptidase 4 is a functional receptor for the emerging human coronavirus-EMC [J]., 2013, 495(7440): 251-254.
[29] Wu C Y, Jan J T, Ma S H,. Small molecules targeting severe acute respiratory syndrome human coronavirus [J]., 2004, 101(27): 10012-10017.
[30] 张鲁, 崔洁, 王文全, 等. 甘草属植物地上部分化学成分和药理作用研究进展 [J]. 中药材, 2018, 41(6): 1501-1505.
[31] Cinatl J, Morgenstern B, Bauer G,. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus [J]., 2003, 361(9374): 2045-2046.
[32] 张明发, 沈雅琴. 甘草及甘草酸类成分抗病毒性肺炎的药理作用研究进展 [J]. 药物评价研究, 2020, 43(7): 1452-1468.
[33] Khanna K, Kohli S K, Kaur R,. Herbal immune-boosters: Substantial warriors of pandemic Covid-19 battle [J]., 2021, 85: 153361.
[34] Ho T Y, Wu S L, Chen J C,. Emodin blocks the SARS coronavirus spike protein and angiotensin-converting enzyme 2 interaction [J]., 2007, 74(2): 92-101.
[35] Song S, Peng H R, Wang Q L,. Inhibitory activities of marine sulfated polysaccharides against SARS-CoV-2 [J]., 2020, 11(9): 7415-7420.
[36] Kwon P S, Oh H, Kwon S J,. Sulfated polysaccharides effectively inhibit SARS-CoV-2[J]., 2020, 6(1): 50.
[37] Jang Y, Shin H, Lee M K,. Antiviral activity of lambda-carrageenan against influenza viruses and severe acute respiratory syndrome coronavirus 2 [J]., 2021, 11(1): 821.
[38] Weng J R, Lin C S, Lai H C,. Antiviral activity ofethanol extract and related phenolic acid constituents against human coronavirus NL63 [J]., 2019, 273: 197767.
[39] Milewska A, Zarebski M, Nowak P,. Human coronavirus NL63 utilizes heparan sulfate proteoglycans for attachment to target cells [J]., 2014, 88(22): 13221-13230.
[40] Inoue Y, Tanaka N, Tanaka Y,. Clathrin-dependent entry of severe acute respiratory syndrome coronavirus into target cells expressing ACE2 with the cytoplasmic tail deleted [J]., 2007, 81(16): 8722-8729.
[41] Mellman I. Endocytosis and molecular sorting [J]., 1996, 12: 575-625.
[42] Stang E, Blystad F D, Kazazic M,. Cbl-dependent ubiquitination is required for progression of EGF receptors into clathrin-coated pits [J]., 2004, 15(8): 3591-3604.
[43] Belleudi F, Visco V, Ceridono M,. Ligand-induced clathrin-mediated endocytosis of the keratinocyte growth factor receptor occurs independently of either phosphorylation or recruitment of eps15 [J]., 2003, 553(3): 262-270.
[44] Zhuang M, Jiang H, Suzuki Y,. Procyanidins and butanol extract ofinhibit SARS-CoV infection [J]., 2009, 82(1): 73-81.
[45] Li S Y, Chen C, Zhang H Q,. Identification of natural compounds with antiviral activities against SARS-associated coronavirus [J]., 2005, 67(1): 18-23.
[46] Kim H Y, Eo E Y, Park H,. Medicinal herbal extracts of,Cortex,andfructus inhibit coronavirus replication[J]., 2010, 15(5): 697-709.
[47] Kim D E, Min J S, Jang M S,. Natural bis-benzylisoquinoline alkaloids-tetrandrine, fangchinoline, and cepharanthine, inhibit human coronavirus OC43 infection of MRC-5 human lung cells [J]., 2019, 9(11): 696.
[48] Tsai Y C, Lee C L, Yen H R,. Antiviral action of tryptanthrin isolated fromleaf against human coronavirus NL63 [J]., 2020, 10(3): 366.
[49] Li H W, Wu J F, Zhang Z W,. Forsythoside a inhibits the avian infectious bronchitis virus in cell culture [J]., 2011, 25(3): 338-342.
[50] Thiel V, Ivanov K A, Putics Á,. Mechanisms and enzymes involved in SARS coronavirus genome expression [J]., 2003, 84(Pt 9): 2305-2315.
[51] Korba B E, Furman P A, Otto M J. Clevudine: A potent inhibitor of hepatitis B virusand[J]., 2006, 4(4): 549-561.
[52] Mercorelli B, Palù G, Loregian A. Drug repurposing for viral infectious diseases: How far are we? [J]., 2018, 26(10): 865-876.
[53] Gordon C J, Tchesnokov E P, Woolner E,. Remdesivir is a direct-acting antiviral that inhibits RNA-dependent RNA polymerase from severe acute respiratory syndrome coronavirus 2 with high potency [J]., 2020, 295(20): 6785-6797.
[54] Lau K M, Lee K M, Koon C M,. Immunomodulatory and anti-SARS activities of[J]., 2008, 118(1): 79-85.
[55] Chiow K H, Phoon M C, Putti T,. Evaluation of antiviral activities ofThunb. extract, quercetin, quercetrin and cinanserin on murine coronavirus and dengue virus infection [J]., 2016, 9(1): 1-7.
[56] Kim H Y, Shin H S, Park H,.inhibition of coronavirus replications by the traditionally used medicinal herbal extracts,,,, andcortex [J]., 2008, 41(2): 122-128.
[57] Gan Y R, Huang H, Huang Y D,. Synthesis and activity of an octapeptide inhibitor designed for SARS coronavirus main proteinase [J]., 2006, 27(4): 622-625.
[58] Han Y S, Chang G G, Juo C G,. Papain-like protease 2 (PLP2) from severe acute respiratory syndrome coronavirus (SARS-CoV): Expression, purification, characterization, and inhibition [J]., 2005, 44(30): 10349-10359.
[59] Zhang D H, Wu K L, Zhang X,. In silico screening of Chinese herbal medicines with the potential to directly inhibit 2019 novel coronavirus [J]., 2020, 18(2): 152-158.
[60] Rut W, Groborz K, Zhang L L,. Substrate specificity profiling of SARS-CoV-2 Mpro protease provides basis for anti-COVID-19 drug design [J]., 2020, doi:10.1101/2020.03.07.981928.
[61] 高鑫, 何正有, 罗璞, 等. 抗新型冠状病毒肺炎(COVID-19)中药复方中高频单味药的研究概述 [J]. 国外医药: 抗生素分册, 2020, 41(4): 283-289.
[62] Tang Y L, Wang Z H, Huo C Y,. Antiviral effects of Shuanghuanglian injection powder against influenza A virus H5N1and[J]., 2018, 121: 318-324.
[63] Su H X, Yao S, Zhao W F,. Anti-SARS-CoV-2 activitiesof Shuanghuanglian preparations and bioactive ingredients [J]., 2020, 41(9): 1167-1177.
[64] Lin C W, Tsai F J, Tsai C H,. Anti-SARS coronavirus 3C-like protease effects ofindigotica root and plant-derived phenolic compounds [J]., 2005, 68(1): 36-42.
[65] Zhang S H, Pei R J, Li M X,. Cocktail polysaccharides isolated fromagainst the SARS-CoV-2 infection [J]., 2022, 275: 118779.
[66] Luo W S, Su X J, Gong S J,. Anti-SARS coronavirus 3C-like protease effects ofL. extracts [J]., 2009, 3(4): 124-126.
[67] Liu H B, Ye F, Sun Q,.extract and baicalein inhibit replication of SARS-CoV-2 and its 3C-like protease[J]., 2021, 36(1): 497-503.
[68] Park J Y, Yuk H J, Ryu H W,. Evaluation of polyphenols fromas coronavirus protease inhibitors [J]., 2017, 32(1): 504-515.
[69] Park J Y, Kim J H, Kim Y M,. Tanshinones as selective and slow-binding inhibitors for SARS-CoV cysteine proteases [J]., 2012, 20(19): 5928-5935.
[70] Cho J K, Curtis-Long M J, Lee K H,. Geranylated flavonoids displaying SARS-CoV papain-like protease inhibition from the fruits of[J]., 2013, 21(11): 3051-3057.
[71] Song Y H, Kim D W, Curtis-Long M J,. Papain-like protease (PLpro) inhibitory effects of cinnamic amides fromfruits [J]., 2014, 37(6): 1021-1028.
[72] Park J Y, Jeong H J, Kim J H,. Diarylheptanoids frominhibit papain-like protease of severe acute respiratory syndrome coronavirus [J]., 2012, 35(11): 2036-2042.
[73] Tsai Y C, Lee C L, Yen H R,. Antiviral action of tryptanthrin isolated fromleaf against human coronavirus NL63 [J]., 2020, 10(3): 366.
[74] Yue Y, Nabar N R, Shi C S,. SARS-Coronavirus open reading frame-3a drives multimodal necrotic cell death [J]., 2018, 9(9): 904.
[75] Schwarz S, Sauter D, Lu W,. Coronaviral ion channels as target for Chinese herbal medicine [J]., 2012, 3(1): 1-13.
[76] Ferrero-Miliani L, Nielsen O H, Andersen P S,. Chronic inflammation: Importance of NOD2 and NALP3 in interleukin-1beta generation [J]., 2007, 147(2): 227-235.
[77] Cho W K, Kim H, Choi Y J,.Nakai water extract exhibits antiviral activity against porcine epidermic diarrhea virusand[J]., 2012, 2012: 985151.
[78] Murphy E J, Masterson C, Rezoagli E,. Β-Glucan extracts from the same edible shiitake mushroomedodes produce differentialimmunomodulatory and pulmonary cytoprotective effects—Implications for coronavirus disease (COVID-19) immunotherapies [J]., 2020, 732: 139330.
[79] Chen X Y, Han W W, Wang G X,. Application prospect of polysaccharides in the development of anti-novel coronavirus drugs and vaccines [J]., 2020, 164: 331-343.
[80] Di Matteo G, Spano M, Grosso M,. Food and COVID-19: Preventive/co-therapeutic strategies explored by current clinical trials and in silico studies [J]., 2020, 9(8): 1036.
[81] Chang F R, Yen C T, Ei-Shazly M,. Anti-human coronavirus (anti-HCoV) triterpenoids from the leaves of[J]., 2012, 7(11): 1415-1417.
[82] Chen C J, Michaelis M, Hsu H K,.Roem tender leaf extract inhibits SARS coronavirus replication [J]., 2008, 120(1): 108-111.
[83] 国家中医药管理局. 非典型肺炎中医药防治技术方案(试行) 预防部分修订方案 [N]. 中国中医药报, 2003-04-21(1936).
[84] 梁爱君, 凌云, 刘贺之. 中药在传染性非典型肺炎(SARS) 防治中的应用 [J]. 解放军药学学报, 2003, 19(5): 367-369.
[85] 朱家勇, 朱盛山. 中医药在防治非典中的作用 [J]. 广东药学院学报, 2003, 19(3): 253-255.
[86] 于勇. 中医药对传染性非典型肺炎的认识与防治研究现状 [J]. 河北中医, 2007, 29(4): 371-373.
[87] 张利英, 史桐凡, 周谷城, 等. 三种冠状病毒流行病学及中药治疗研究比较 [J]. 中药药理与临床, 2020, 36(5): 7-12.
[88] 张尚祖, 李赟, 张宏伟, 等. 中东呼吸综合征中医防治探讨 [J]. 中医药学报, 2020, 48(2): 4-6.
[89] 赵岩松, 侯雪雍, 高子恒, 等. 从化湿败毒方探究新型冠状病毒肺炎用药思路 [J]. 中华中医药学刊, 2020, 38(6): 14-17.
[90] 童欢, 许鑫, 陈汉华. 化湿败毒方联合西医治疗重型新型冠状病毒肺炎23例 [J]. 亚太传统医药, 2022, 18(3): 75-79.
[91] 廖垚, 殷贝, 金镇, 等. 化湿败毒方治疗重型新型冠状病毒肺炎的中医理论分析及现代药理学机制探讨 [J]. 海南医学院学报, 2020, 26(16): 1209-1213.
[92] 薛伯寿, 姚魁武, 薛燕星. “清肺排毒汤”快速有效治疗新型冠状病毒肺炎的中医理论分析 [J]. 中医杂志, 2020, 61(6): 461-462.
[93] 赵静, 田赛赛, 杨健, 等. 清肺排毒汤治疗新型冠状病毒肺炎机制的网络药理学探讨 [J]. 中草药, 2020, 51(4): 829-835.
[94] 国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第九版) [EB/OL]. [2022-03-15]. http://www.nhc.gov. cn/yzygj/s7653p/202203/b74ade1ba4494583805a3d2e40093d88. shtml.
[95] 王饶琼, 杨思进, 谢春光, 等. 清肺排毒汤治疗新型冠状病毒肺炎的临床疗效观察 [J]. 中药药理与临床, 2020, 36(1): 13-18.
[96] 王忆勤, 郝一鸣. 从调节免疫力谈中医药防治新型冠状病毒肺炎 [J]. 上海中医药杂志, 2020, 54(5): 1-5.
[97] 冯利民, 刘晓亚, 张磊. 宣肺败毒颗粒治疗新型冠状病毒肺炎(奥密克戎)的临床疗效观察 [J]. 天津中医药, 2022, 39(5): 545-550.
[98] 邓鑫, 朱文琳, 王建超, 等. 基于“三因制宜”理论探讨新型冠状病毒肺炎的中医药防治 [J]. 西部中医药, 2020, 33(9): 1-5.
[99] World Health Organization, WHO Expert Meeting on Evaluation of Traditional Chinese Medicine in the Treatment of COVID-19 [EB/OL]. [2022-03-02]. https://www.who.int/publications/m/item/who-expert-meeting- on-evaluation-of-traditional-chinese-medicine-in-the-treatment-of-covid-19.
Research progress on mechanism and clinic application of traditional Chinese medicine against coronavirus
LI Sai-juan1, 2, SU Juan1, JIN Can1, DING Kan1, 2
1. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China 2. School of New Chinese Materia Medica, Nanjing University of Chinese Medicine, Nanjing 21112, China
Coronaviruses (CoVs) are the largest positive-strand RNA viruses discovered, with high variability and high infectivity. There are seven kinds of CoVs that can infect humans so far. Among them, severe acute respiratory syndrome coronavirus (SARS-CoV) in 2003, middle east respiratory syndrome coronavirus (MERS-CoV) in 2012 and severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in 2019 have caused global outbreaks, posing a serious threat to global public health security. Research on CoVs infection has never stopped, and the current treatment methods mainly focus on improving symptoms. Traditional Chinese medicine (TCM) has a long history and rich experience in preventing and treating various diseases. In terms of anti-CoVs, TCM has attracted much attention because of its multi-CoVs and multi-targets, significant antiviral effect and few side effect. TCM extracts or their compounds can exert anti-CoVs effects by directly or indirectly inhibiting the invasion, replication, assembly of CoVs, regulating immunity and inhibiting inflammation. This article systematically reviews the mechanism and clinical application of TCM in anti-CoVs and alleviating virus-induced symptoms, in order to provide theoretical reference for the research and development of anti-coronavirus drugs.
traditional Chinese medicine; anti-coronavirus; severe acute respiratory syndrome coronavirus; middle east respiratory syndrome coronavirus; severe acute respiratory syndrome coronavirus 2
R285
A
0253 - 2670(2023)01 - 0334 - 12
10.7501/j.issn.0253-2670.2023.01.034
2022-09-13
国家自然科学基金项目(31870801)
李赛娟(1992—),女,博士研究生,研究方向为中药多糖的结构鉴定及其靶向性研究。Tel: 15685346690 E-mail: 1449253507@qq.com
通信作者 丁 侃,男,研究员,博士生导师,课题组长,中科中山药物创新研究院常务副院长;2011年获得国家杰出青年基金;主要从事中药中多糖的结构与功能,构效关系,多糖的靶向性及其作用机理,细胞膜蛋白聚糖及其相关酶的功能机制以及糖类创新药物研究。E-mail: dingkan@simm.ac.cn
[责任编辑 潘明佳]
