基于DJ-1/Nrf2/HO-1信号通路探讨北柴胡地上部分多糖组分对癫痫小鼠脑内氧化应激的影响
2023-01-10李晓毛匡海学杨炳友
刘 艳,王 敏,李晓毛,匡海学,杨炳友*
基于DJ-1/Nrf2/HO-1信号通路探讨北柴胡地上部分多糖组分对癫痫小鼠脑内氧化应激的影响
刘 艳1,王 敏1,李晓毛2,匡海学1,杨炳友1*
1. 黑龙江中医药大学,教育部北药基础与应用研究重点实验室,黑龙江 哈尔滨 150040 2. 江苏食品药品职业技术学院,江苏 淮安 223023
探讨北柴胡地上部分多糖组分(polysaccharides from aerial parts of,ABP)对戊四唑致痫小鼠的预防作用及作用机制。C57BL/6小鼠随机分为对照组、模型组、丙戊酸钠(125 mg/kg)组、癫痫宁片(1200 mg/kg)组和ABP高、低剂量(100、25 mg/kg)组,每组10只。各给药组ig相应药物,对照组和模型组ig等体积0.5%羧甲基纤维素钠溶液,1次/d,连续7 d。末次给药后60 min,除对照组外,其余各组ip戊四唑(60 mg/kg)。通过行为学评价ABP预防癫痫的作用;采用苏木素-伊红(HE)染色、免疫组化法检测海马神经元病理形态学变化;采用ELISA法测定海马组织中半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、谷氨酸脱羧酶65(glutamic acid decarboxylase 65,GAD65)、GAD67、G蛋白偶联的内向整流钾通道1(G protein gated inwardly rectifying K channels 1,GIRK1)、-甲基--天冬氨酸受体1(-methyl--aspartic acid receptor,NMDAR1)、γ-氨基丁酸A型受体(γ-aminobutyric acid type A,GABA AR)水平;采用Western blotting检测海马组织中DJ-1、特异性蛋白1(specificity protein 1,SP1)、p-SP1、核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)、血红素加氧酶-1(heme oxygenase-1,HO-1)蛋白表达。采用过氧化氢(hydrogen peroxide,H2O2)诱导的PC12细胞氧化应激模型进行验证。与模型组比较,ABP明显改善小鼠癫痫症状,表现为躯体僵直率和死亡率降低等(<0.01);海马锥体细胞排列规则,结构清晰,GFAP阳性表达面积明显降低;显著降低海马组织中Caspase-3、GFAP、GAD65、GAD67、GIRK1及NMDAR1水平(<0.01),升高GABA AR水平(<0.01);显著下调癫痫小鼠海马组织和H2O2诱导的PC12细胞中DJ-1、p-SP1、Nrf2及HO-1蛋白表达(<0.01)。ABP可以减轻癫痫发作期间DJ-1/Nrf2/HO-1介导的癫痫氧化应激,从而发挥预防癫痫的作用。
北柴胡;多糖;癫痫;氧化应激;DJ-1/Nrf2/HO-1通路
癫痫俗称“羊癫风”,是大脑神经元突发异常放电而导致的短暂大脑功能障碍的一种慢性疾病[1]。全世界有近5000万人患有癫痫[2]。癫痫发作涉及氧化应激、炎症反应、神经元损伤等诸多因素[3-4],其常见病理特征是病理和组织学变化,如海马区的神经胶质化和神经元死亡[5-6]。大脑中神经元兴奋性异常增加及过度同步化放电是癫痫发病的基础,神经元的异常放电会产生大量活性氧,触发氧化应激反应,导致神经元凋亡[7]。包括癫痫在内的神经系统病症会出现大脑氧化损伤,并削弱其抗氧化能力[8],氧化应激在此类病症病理中发挥重要作用。癫痫动物模型是分析抗癫痫药物和探析其发病机制的重要环节,戊四唑可使致痫动物产生与人类极为相似的行为及神经病理学改变[1],在戊四唑致痫小鼠的大脑中,氧化应激导致自由基产生,进而促进了癫痫的发展,氧化应激进一步破坏线粒体和内质网等细胞大分子,最终导致神经元细胞的损伤甚至死亡[9]。但到目前为止,癫痫的氧化应激机制仍在探究之中。
北柴胡DC.作为一种被临床广泛应用的传统中药,常在癫痫处方中用作君药,已被临床证明具有较好的抗癫痫作用[10-11]。北柴胡地上部分与其药用部位根具有相似的成分与疗效,其多糖具有较好的抗癫痫及抗氧化作用。为了进一步明确北柴胡地上部分多糖组分(polysaccharides from aerial parts of,ABP)对癫痫的预防效果及可能机制,本研究建立戊四唑致痫小鼠模型,通过行为学、ELISA、Western blotting等技术考察ABP对癫痫的预防作用及作用机制,以期充分利用北柴胡药材植物资源,为ABP治疗癫痫提供实验依据。
1 材料
1.1 动物和细胞
SPF级雄性C57BL/6小鼠60只,4周龄,体质量18~22 g,由辽宁长盛生物科技有限公司提供,许可证号SCXK(辽)2020-0001。动物在20~23 ℃和50%~60%的标准化湿度条件下饲养。动物实验获得黑龙江中医药大学动物实验委员会批准(批准号20201230001)。
PC12细胞由武汉大学细胞保藏中心提供。
1.2 药材
北柴胡地上部分采摘自黑龙江省大庆市,经黑龙江中医药大学药用植物学教研室樊锐锋教授鉴定为伞形科植物北柴胡DC.的干燥茎叶,药材样本(编号20190901)保存在黑龙江中医药大学中药化学实验室。
1.3 药品与试剂
戊四唑(批号MKCC5472)购自美国Sigma-Aldrich公司;丙戊酸钠(批号AHG0462)购自Sanofi公司;癫痫宁片(批号6907911100246,国药准字号Z53020771)购自昆明中药厂有限公司;CCK-8试剂(批号K101819133EF5E)、过氧化氢(hydrogen peroxide,H2O2,批号BCCG3062)购自APEx BIO公司;DMEM培养基(批号8120512)购自美国Gibco公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号710N0314))购自美国Sigma公司;半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)ELISA试剂盒(批号20210315)购自武汉博士德生物工程有限公司;胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)ELISA试剂盒(批号AG02158177)购自北京Bioss生物技术有限公司;谷氨酸脱羧酶65(glutamic acid decarboxylase 65,GAD65)ELISA试剂盒(批号GR3278856-10)、GAD67 ELISA试剂盒(批号GR3278845-10)、血红素加氧酶-1(heme oxygenase-1,HO-1)抗体(批号ab189491)购自英国Abcam公司;γ-氨基丁酸A型受体(γ-aminobutyric acid type A,GABA AR)ELISA试剂盒(批号202106)购自上海酶联生物科技公司;BCA蛋白定量试剂盒(批号042820200814)购自上海碧云天生物技术有限公司;IgG二抗(批号ZB2305)购自北京中杉金桥生物技术有限公司;DJ-1抗体(批号3560506011)、G蛋白偶联的内向整流钾通道1(G protein gated inwardly rectifying K channels 1,GIRK1)ELISA试剂盒(批号A9824)、核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体(批号0072280102)、特异性蛋白1(specificity protein 1,SP1)抗体(批号5500002921)、GAPDH抗体(批号A102264575)、-甲基--天冬氨酸受体1(-methyl--aspartic acid receptor,NMDAR1)ELISA试剂盒(批号4000000684)购自ABclonal Technology公司;p-SP1抗体(批号EXA1384)购自FulenGen公司。
1.4 仪器
EPOCH2酶标仪(美国Bio-Tek公司);BT25S型电子分析天平(德国Sartorius公司);TDL-4型低速离心机(上海安亭科学仪器厂);WT-1ND型超净台(北京王堂蓝翼科技有限公司);BX60型、DP72型显微镜(日本Olympus公司);2695型高效液相色谱(美国Waters公司);Western blotting凝胶成像仪(美国Bio-Rad公司);Odyssey®CLx凝胶成像仪(美国LI-COR公司)。
2 方法
2.1 药物制备与分析
ABP经本课题组实验室制备,并进行了多糖的定性定量分析[12],ABP中含有半乳糖醛酸(45.19%)、半乳糖(36.63%)、阿拉伯鼠李糖(12.13%)和甘露糖(6.05%),ABP的平均相对分子质量为1.38×103。
2.2 分组、给药及造模
将60只C57BL/6小鼠随机分为对照组、模型组、丙戊酸钠(125 mg/kg)组、癫痫宁片(1200 mg/kg)组和ABP高、低剂量(100、25 mg/kg)组,每组10只。各给药组ig相应药物,对照组和模型组ig等体积0.5%羧甲基纤维素钠溶液,1次/d,连续7 d。末次给药后60 min,除对照组外,其余各组ip戊四唑(60 mg/kg)。
2.3 行为学检测
各组小鼠ip戊四唑后立即记录小鼠癫痫发作情况。小鼠痫性发作分级采用Racine标准:0级,无惊厥;I级,口、面部肌肉阵挛;II级,在I级基础上出现节律点头;III级,在II级基础上出现前肢阵挛;IV级,在III级基础上出现后肢伸直;V级,在IV级基础上出现跌倒,记录小鼠癫痫发作潜伏期、发作持续时间、僵直率和躯体死亡率,剔除不达标的小鼠。
2.4 苏木素-伊红(HE)染色观察海马组织病理变化
各组小鼠末次给药后禁食24 h,用10%戊巴比妥钠完全麻醉后置于解剖台,取海马组织,用PBS洗涤后,于4%多聚甲醛中固定6~8 h(4 ℃),然后转移至30%蔗糖溶液(4 ℃)过夜,用石蜡固定。将石蜡切片在水中脱蜡,置于苏木精染料溶液中5 min,并用70%盐酸醇分化10 s。用自来水彻底冲洗切片,使核变蓝,蒸馏,洗涤,并放入伊红染料溶液中1 min,然后进行梯度醇脱水,二甲苯清除和样品的树脂密封,于显微镜下观察。
2.5 免疫组化检测海马组织GFAP阳性表达
将各组小鼠海马组织石蜡切片脱蜡至水,用抗原修复液(pH 6.0)预处理切片,3% H2O2孵育15 min以阻断内源性过氧化物酶,之后用PBS冲洗3次。逐滴加入GFAP抗体(1∶400),4 ℃温育过夜。将组织浸入PBS中,逐滴加入IgG抗体和Fab段-HRP多聚体。将混合物在室温下孵育30 min,然后每次用PBS洗涤细胞5次,每次3 min。DAB显色,于显微镜下观察并拍照,Motic Med 6.0进行图像采集分析,评估GFAP阳性表达的吸光度()。
2.6 ELISA检测海马组织内相关因子水平
取各组小鼠海马组织,PBS冲洗后,制备组织匀浆液,按ELISA试剂盒说明书检测Caspase-3、GFAP、GAD65、GAD67、GIRK1、NMDAR1、GABA AR水平。
2.7 CCK-8法检测ABP对H2O2诱导的PC12细胞活力的影响
取对数生长期的PC12细胞,以1×105个/孔接种于96孔板,培养过夜。加入不同质量浓度(20、40、80 μg/mL)的ABP处理24 h,加入CCK-8试剂,检测细胞存活率。设置对照组、模型组和ABP低、中、高剂量(20、40、80 μg/mL)组,各给药组加入不同质量浓度的ABP溶液培养24 h,模型组和各给药组再加入经DMEM稀释的0.5 mmol/L H2O2诱导培养24 h以建立细胞损伤模型,对照组常规培养,另设置阴性组无细胞只加培养基,加入CCK-8试剂,检测细胞存活率。
细胞存活率=(给药-阴性)/(对照-阴性)
2.8 Western blotting检测海马组织和H2O2诱导的PC12细胞中DJ1、p-SP1、Nrf2、HO-1、SP1蛋白表达
取各组小鼠海马组织,用PBS冲洗2遍,放在冰盒上,加入RIPA裂解液,用组织研磨器研磨后转至离心管,13 500 r/min离心20 min,收集上清蛋白。
取对数生长期的PC12细胞,以1×106个/孔接种于6孔板,培养过夜。设置对照组、模型组、丙戊酸钠(1 μmol/L)组和ABP(80 μg/mL)组,各给药组加入药物培养24 h,模型组和各给药组再加入0.5 mmol/L H2O2培养24 h,对照组常规培养,收集细胞。加入RIPA裂解液提取蛋白。
采用BCA蛋白定量试剂盒测定蛋白浓度,95 ℃金属浴5 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭,加入一抗,4 ℃摇床过夜;TBST缓冲液洗涤3次,每次5 min,加入二抗(1∶5000),室温孵育1 h,荧光发光曝光,采用凝胶成像仪进行成像分析。
2.9 统计学分析
3 结果
3.1 ABP减轻小鼠癫痫症状
如图1所示,与对照组比较,模型组小鼠表现出前肢痉挛并伴随不同程度的直立、强直阵挛和跌倒等的症状;与模型组比较,丙戊酸钠组、癫痫宁片组和ABP高剂量组均能明显改善小鼠癫痫症状,同时能够显著延长小鼠惊厥潜伏期(<0.01),减少癫痫持续时间(<0.01),显著降低躯体强直性痉挛发生率和死亡率(<0.01)。表明高剂量的ABP能够预防癫痫的发生及发展。
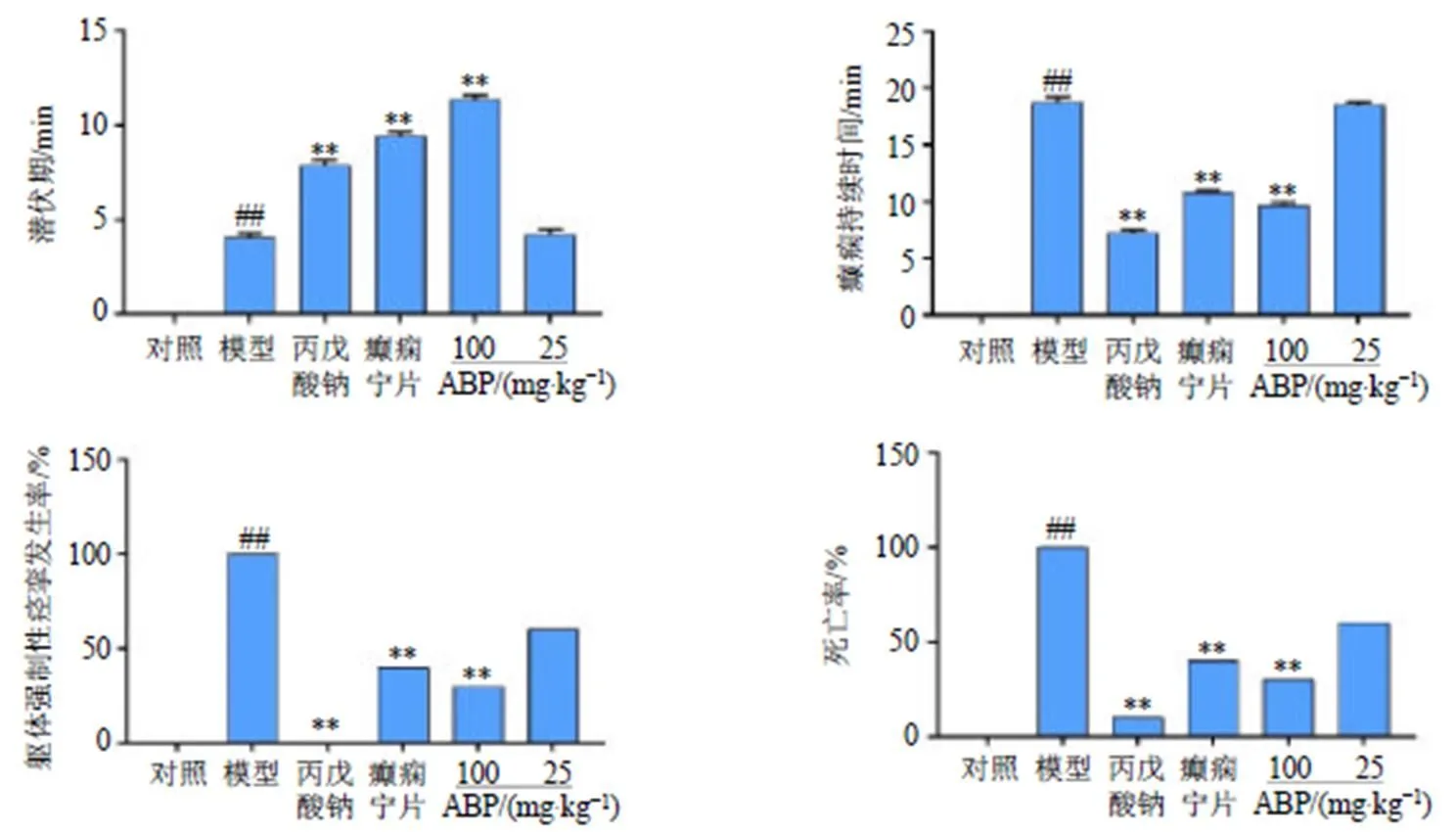
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
3.2 ABP减轻癫痫小鼠海马神经元损伤
如图2所示,对照组小鼠海马CA3区锥体细胞形态规则,呈圆形及椭圆形,胞核大而圆,核仁较清晰,细胞排列有规律;模型组小鼠海马组织CA3区可见少量锥体细胞固缩深染,细胞形状不规则,少量锥体细胞水肿,胞质疏松;丙戊酸钠组、癫痫宁片组和ABP高剂量组小鼠海马锥体细胞排列规则,结构清晰,胞核大而圆,染色质少,核仁明显,未见明显异常。表明ABP能够改善戊四唑诱导的神经元炎症的发生。
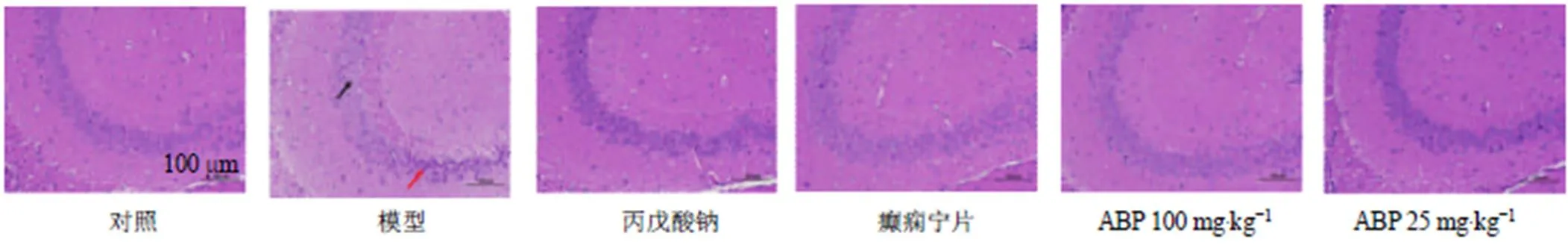
红色箭头:炎症浸润;黑色箭头:少量锥体细胞固缩深染,细胞形状不规则,少量锥体细胞水肿,胞质疏松
3.3 ABP抑制癫痫小鼠海马星形胶质细胞活化
如图3所示,与对照组比较,模型组小鼠海马中GFAP阳性表达面积明显增加;与模型组比较,丙戊酸钠组、癫痫宁片组和ABP高剂量组GFAP阳性表达面积明显降低。表明ABP能够抑制戊四唑诱导的癫痫小鼠海马星形胶质细胞的活化。
3.4 ABP降低癫痫小鼠海马组织中Caspase-3、GFAP、GAD65、GAD67、GIRK1、NMDAR1水平并升高GABA AR水平
如图4所示,与对照组比较,模型组小鼠海马组织中Caspase-3、GFAP、GAD65、GAD67、GIRK1及NMDAR1水平均显著升高(<0.01),GABA AR水平显著降低(<0.01);与模型组比较,丙戊酸钠组、癫痫宁片组和ABP高剂量组海马组织中Caspase-3、GFAP、GAD65、GAD67、GIRK1及NMDAR1水平均显著降低(<0.05、0.01),GABA AR水平显著升高(<0.01)。表明ABP能够逆转戊四唑诱导的凋亡因子、神经递质以及离子受体异常水平。
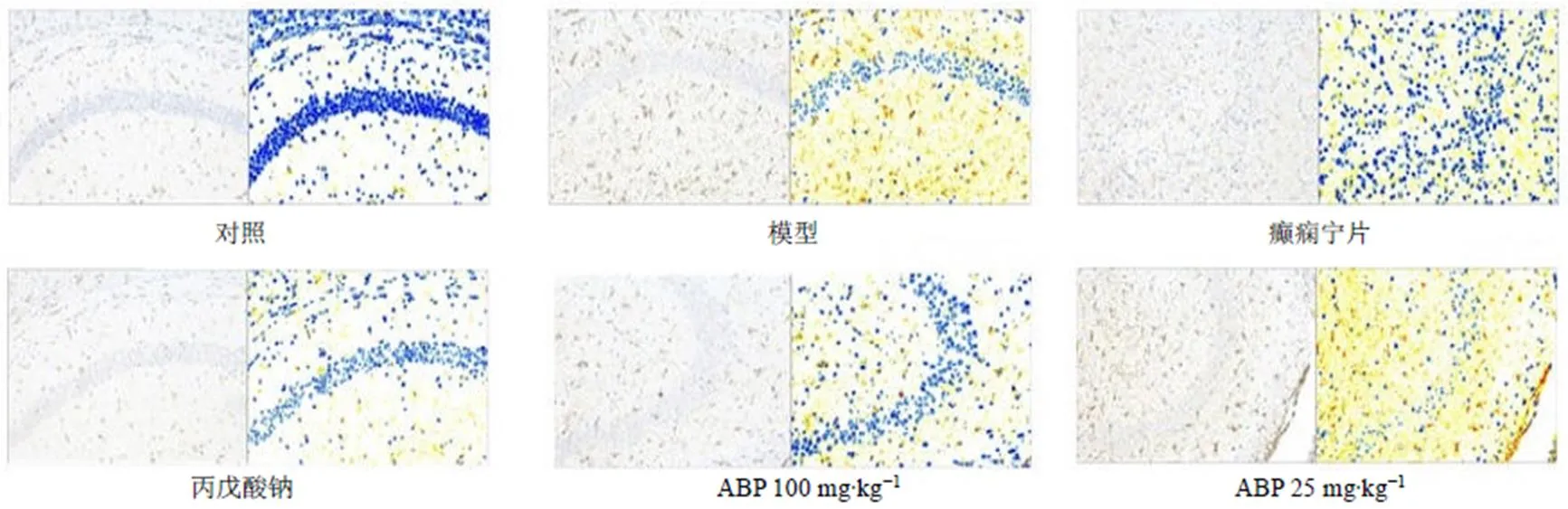
图3 ABP对戊四唑致痫小鼠海马组织GFAP蛋白表达的影响(×200)
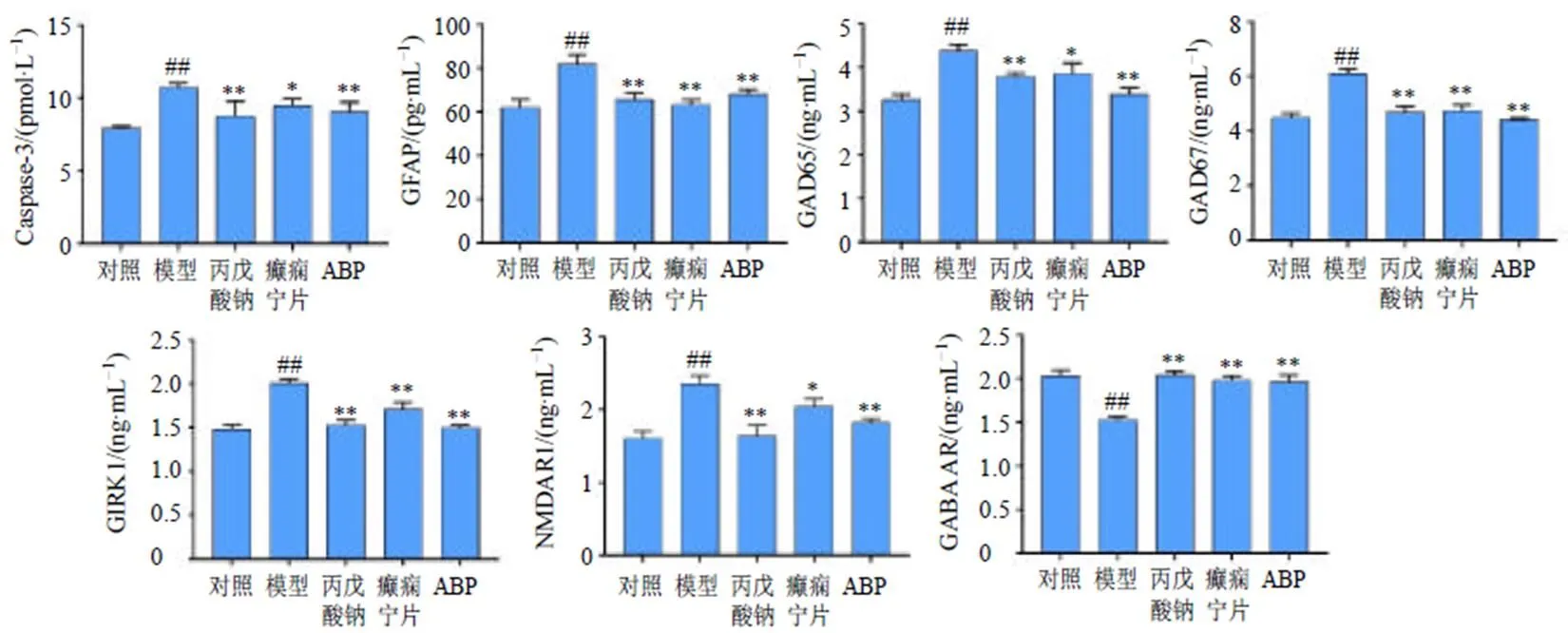
图4 ABP对戊四唑致痫小鼠海马组织中凋亡因子及神经递质水平的影响(, n = 10)
3.5 ABP下调癫痫小鼠海马组织中DJ-1、P-SP1、Nrf2、HO-1蛋白表达
如图5所示,与对照组比较,模型组小鼠海马组织中DJ-1、p-SP1、Nrf2及HO-1蛋白表达水平均显著升高(<0.01),SP1的表达无明显变化;与模型组比较,丙戊酸钠组、癫痫宁片组和ABP高剂量组海马组织中DJ-1、p-SP1、Nrf2及HO-1蛋白表达水平均显著降低(<0.01)。表明戊四唑诱导的癫痫机制与氧化应激密切相关,ABP能够通过抑制氧化应激相关蛋白的表达发挥预防癫痫的作用。
3.6 ABP抑制H2O2诱导的PC12细胞凋亡
如图6所示,ABP(20~80 μg/mL)对PC12细胞无毒性作用。与对照组比较,H2O2诱导24 h后,PC12细胞活力明显下降(<0.01);与模型组比较,40、80 μg/mL的ABP均能预防神经元损伤(<0.01),且80 μg/mL ABP预防神经元损伤作用最强。表明ABP能够抑制H2O2导致的PC12细胞凋亡,发挥抵抗氧化应激反应的作用。
3.7 ABP下调H2O2诱导的PC12细胞中DJ-1、P-SP1、Nrf2、HO-1蛋白表达
如图7所示,与对照组比较,模型组细胞DJ-1、p-SP1、Nrf2及HO-1蛋白表达水平均显著升高(<0.01),SP1表达无明显变化;与模型组比较,丙戊酸钠组和ABP组DJ-1、p-SP1、Nrf2及HO-1蛋白表达水平均显著降低(<0.01)。表明ABP能够抵抗H2O2诱导的氧化应激反应,通过调控氧化应激相关通路来发挥预防癫痫的作用,与体内实验结果一致。

图5 ABP对戊四唑致痫小鼠海马组织中氧化应激相关蛋白表达的影响(, n = 10)

图6 ABP对PC12细胞 (A) 和H2O2诱导的PC12细胞(B) 活力的影响(, n = 5)

图7 ABP对H2O2诱导的PC12细胞中氧化应激相关蛋白表达的影响(, n = 5)
4 讨论
癫痫的发病以脑神经元过度放电导致反复性、发作性和短暂性的中枢神经系统功能失常为特征。海马神经元细胞是癫痫的主要病变部位之一,主要参与记忆、情感认知等功能的神经共病[13],其神经元损伤甚至死亡可引起海马结构完整性丢失[14],可诱发记忆障碍[15-16]。癫痫发作已被证明以多种方式参与海马神经源性级联反应[17]。神经元兴奋性和抑制性的不平衡被认为是癫痫发生的原因之一。
近年来,越来越多的研究表明癫痫发作与氧化应激之间存在密切联系[18]。氧化应激能够通过激活相关信号通路增加神经元细胞的超兴奋性,甚至引起细胞死亡[19],降低癫痫发作的阈值,从而导致癫痫的发生和发展[20]。另外,癫痫发作会产生大量自由基,这时抗氧化系统和增多的氧自由基之间平衡失调[21],导致氧化应激损伤,在多种癫痫动物模型中和癫痫患者脑组织标本及血液标本中,均可检测到氧化应激标记物,如诱导型一氧化氮合酶[22]。针对癫痫的氧化应激研究为进一步明确癫痫的发病机制提供了重要方向。调节氧化应激的过程受诸多因素的影响,因此,更好地了解氧化损伤的发病机制和分子变化,为预防癫痫提供新思路是必要和紧迫的。来自中药的多糖因其独特的抗氧化能力而受到广泛关注[23-24]。本研究对ABP预防癫痫的作用及其机制进行探索。
癫痫发作期间神经系统病理损伤的机制仍有待充分了解。研究表明线粒体功能障碍可能导致广泛的急性和慢性神经系统疾病,包括癫痫和创伤性脑损伤。在线粒体参与癫痫发作的病理过程中,导致活性氧大量蓄积并造成神经元的氧化损伤和死亡[25],加重癫痫的发作,因此神经元的死亡在癫痫发展中起重要作用。此外,线粒体生物能学受损与大多数癫痫诱导的自由基产生有关[19]。当机体处于病态时,体内氧化还原失衡,氧自由基过度堆积,线粒体因此而受到损伤,引起一系列的细胞功能障碍,进而参与癫痫的病理变化。关于癫痫动物模型的研究表明,线粒体内氧化大分子损伤发生在癫痫发生发展的不同阶段[26]。本研究结果表明,80 mg/kg的ABP可显著降低癫痫发作严重程度,延长癫痫发作潜伏期,因此,以80 mg/kg的ABP进行后续机制研究。此外,癫痫发展过程中发生的病理生理变化,如海马细胞丢失等,表明线粒体和氧化还原过程在疾病发展的不同方面具有潜在作用[27]。研究表明,海马CA1区是难治性癫痫神经元病理变化的主要部位[28]。在难治性癫痫的动物研究中推测癫痫的发作和发展与脑组织中神经元的丢失存在关系[20]。经组织病理学图像分析,由戊四唑诱导的小鼠海马CA1和CA3区结果显示有明显的细胞损伤迹象[29]。此外,本研究结果表明ABP对神经元的丢失和细胞凋亡产生显著的影响。
氧化应激和线粒体功能障碍在人类患者和实验模型癫痫的发病机制中起着关键作用[30-31]。DJ-1是一种氧化还原敏感蛋白,保护神经元免受氧化应激和细胞死亡的影响。在分子水平上,当受到氧化应激影响时,DJ-1通过破坏氧化应激传感器蛋白(Kelch-like ECH-associated protein 1,Keap1)/Nrf2复合物来阻止Nrf2与Keap1的相互作用,充当Nrf2的稳定剂[32]。Nrf2是细胞氧化还原稳态的主要调节因子,对维持线粒体完整性和防止自由基产生导致细胞功能障碍至关重要[33]。在稳态条件下,Nrf2与Keap1结合,促进Nrf2泛素化和蛋白质体降解,导致基础Nrf2活性降低[34]。在氧化应激条件下,Keap1被氧化,导致其对Nrf2的亲和力降低,从而使Nrf2易位到细胞核。Nrf2是多种细胞保护、抗氧化和抗炎途径相互干扰的关键拦截点[34]。Nrf2及其下游信号HO-1充当促氧化应激源的传感器,促氧化应激源作为一种代偿机制被诱导。本研究结果显示,戊四唑致痫小鼠海马组织和H2O2诱导的PC12细胞中Nrf2蛋白表达显著高于正常水平,在ABP预处理组中,Nrf2和HO-1蛋白表达均显著降低。
综上所述,ABP使戊四唑致痫小鼠海马组织中DJ-1、Nrf2和HO-1的表达水平恢复正常,表明ABP预处理可以减轻癫痫发作期间DJ-1/Nrf2/HO-1介导的癫痫氧化应激引起的损伤,从而发挥预防癫痫的作用。但这种作用是该组分总体效果的体现,还是某一种或多种成分作用的效果,还需要进一步研究明确。
利益冲突 所有作者均声明不存在利益冲突
[1] 刘小虎, 向绍杰, 齐越, 等. 戊四唑急性癫痫模型海马病理组织的变化 [J]. 中国药理学通报, 2015, 31(4): 514-518.
[2] 沈雁文, 石秀玉, 邹丽萍. 癫痫治疗的机制研究新进展 [J]. 解放军医学院学报, 2020, 41(12): 1240-1246.
[3] Yusuf M, Khan M, Robaian M A,. Biomechanistic insights into the roles of oxidative stress in generating complex neurological disorders [J]., 2018, 399(4): 305-319.
[4] Boison D, Steinhäuser C. Epilepsy and astrocyte energy metabolism [J]., 2018, 66(6): 1235-1243.
[5] Wieser H G, ILAE Commission on Neurosurgery of Epilepsy. ILAE commission report. Mesial temporal lobe epilepsy with hippocampal sclerosis [J]., 2004, 45(6): 695-714.
[6] 夏顺刚, 卢红. 奥卡西平对儿童病毒性脑炎继发癫痫患者的炎性因子、免疫功能及氧化应激的影响 [J]. 中国免疫学杂志, 2019, 35(9): 1122-1125.
[7] Gao J, Yao H, Pan X D,. Alteration of mitochondrial function and ultrastructure in the hippocampus of pilocarpine-treated rat [J]., 2014, 108(2): 162-170.
[8] Pauletti A, Terrone G, Shekh-Ahmad T,. Targeting oxidative stress improves disease outcomes in a rat model of acquired epilepsy [J]., 2019, 142(7): e39.
[9] Hansen S L, Sperling B B, Sánchez C. Anticonvulsant and antiepileptogenic effects of GABAA receptor ligands in pentylenetetrazole-kindled mice [J]., 2004, 28(1): 105-113.
[10] 王瑞娟, 王辉, 晋小军. 甘肃中部柴胡适宜采收期研究 [J]. 甘肃农业科技, 2018(1): 54-58.
[11] 王鹏, 高晓霞, 高耀, 等. 基于整合药理学的柴胡不同部位抗癫痫作用研究[J]. 中草药, 2021, 52(7): 2024-2038.
[12] Li X M, Liu Y, Wang S Y,. The polysaccharides from the aerial parts ofe DC attenuate epilepsy-like behavior through oxidative stress signaling pathways [J]., 2022, 2022: 7907814.
[13] Ravizza T, Terrone G, Salamone A,. High Mobility Group Box 1 is a novel pathogenic factor and a mechanistic biomarker for epilepsy [J]., 2018, 72: 14-21.
[14] Kamaşak T, Dilber B, Yaman S Ö,. HMGB-1, TLR4, IL-1R1, TNF-α, and IL-1β: Novel epilepsy markers? [J]., 2020, 22(2): 183-193.
[15] Maia G H, Quesado J L, Soares J I,. Loss of hippocampal neurons after kainate treatment correlates with behavioral deficits [J]., 2014, 9(1): e84722.
[16] Jardim A P, Neves R S, Caboclo L O S F,. Temporal lobe epilepsy with mesial temporal sclerosis: Hippocampal neuronal loss as a predictor of surgical outcome [J]., 2012, 70(5): 319-324.
[17] Cho K O, Lybrand Z R, Ito N,. Aberrant hippocampal neurogenesis contributes to epilepsy and associated cognitive decline [J]., 2015, 6: 6606.
[18] Patel M N. Oxidative stress, mitochondrial dysfunction, and epilepsy [J]., 2002, 36(11): 1139-1146.
[19] Méndez-Armenta M, Nava-Ruíz C, Juárez-Rebollar D,. Oxidative stress associated with neuronal apoptosis in experimental models of epilepsy [J]., 2014, 2014: 293689.
[20] Zhu X B, Liu J K, Huang S Y,. Neuroprotective effects of isoliquiritigenin against cognitive impairment via suppression of synaptic dysfunction, neuronal injury, and neuroinflammation in rats with kainic acid-induced seizures [J]., 2019, 72: 358-366.
[21] 邵延萱, 罗文哲, 薛晴, 等. 柑橘素对癫痫大鼠海马组织氧化应激因子及Caspase-9的作用 [J]. 中国老年学杂志, 2021, 41(20): 4491-4494.
[22] 张冉冉, 刘学伍. 炎症反应和氧化应激在癫痫中的作用研究进展 [J]. 癫痫杂志, 2021, 7(2): 142-146.
[23] Zhao W, Li J J, Yue S Q,. Antioxidant activity and hepatoprotective effect of a polysaccharide from Bei Chaihu (DC) [J]., 2012, 89(2): 448-452.
[24] Mirzadeh M, Arianejad M R, Khedmat L. Antioxidant, antiradical, and antimicrobial activities of polysaccharides obtained by microwave-assisted extraction method: A review [J]., 2020, 229: 115421.
[25] Napolitano G, Fasciolo G, Venditti P. Mitochondrial management of reactive oxygen species [J]., 2021, 10(11): 1824.
[26] Ryan K, Backos D S, Reigan P,. Post-translational oxidative modification and inactivation of mitochondrial complex I in epileptogenesis [J]., 2012, 32(33): 11250-11258.
[27] Yang H Y, Lee T H. Antioxidant enzymes as redox-based biomarkers: A brief review [J]., 2015, 48(4): 200-208.
[28] Fung S J, Xi M C, Zhang J H,. Apnea produces excitotoxic hippocampal synapses and neuronal apoptosis [J]., 2012, 238(2): 107-113.
[29] Zhu X J, Shen K, Bai Y,. NADPH oxidase activation is required for pentylenetetrazole kindling-induced hippocampal autophagy [J]., 2016, 94: 230-242.
[30] Michel H E, Tadros M G, Esmat A,. Tetramethylpyrazine ameliorates rotenone-induced Parkinson’s disease in rats: Involvement of its anti-inflammatory and anti-apoptotic actions [J]., 2017, 54(7): 4866-4878.
[31] Anusha C, Sumathi T, Joseph L D. Protective role of apigenin on rotenone induced rat model of Parkinson’s disease: Suppression of neuroinflammation and oxidative stress mediated apoptosis [J]., 2017, 269: 67-79.
[32] Han B, Li S Y, Lv Y Y,. Dietary melatonin attenuates chromium-induced lung injury via activating the Sirt1/Pgc-1α/Nrf2 pathway [J]., 2019, 10(9): 5555-5565.
[33] Dai X Z, Yan X Q, Wintergerst K A,. Nrf2: Redox and metabolic regulator of stem cell state and function [J]., 2020, 26(2): 185-200.
[34] Suzuki T, Yamamoto M. Stress-sensing mechanisms and the physiological roles of the Keap1-Nrf2 system during cellular stress [J]., 2017, 292(41): 16817-16824.
Effect of polysaccharides from aerial parts ofon oxidative stress in brains of epileptic mice based on DJ-1/Nrf2/HO-1 signaling pathway
LIU Yan1, WANG Min1, LI Xiao-mao2, KUANG Hai-xue1, YANG Bing-you1
1. Heilongjiang University of Chinese Medicine, Key Laboratory of Basic and Application Research of Beiyao, Ministry of Education, Harbin 150040, China 2. Jiangsu Food & Pharmaceutical Science College, Huai’an 223023, China
To investigate the preventive effect and mechanism of polysaccharide from aerial parts of(ABP) on pentylenetetrazole-induced epilepsy in mice.C57BL/6 mice were randomly divided into control group, model group, sodium valproate (125 mg/kg) group, epileptic tablets (1200 mg/kg) group and ABP high-, low-dose (100, 25 mg/kg) groups, with 10 mice in each group. Each administration group was ig corresponding drug, control group and model group were ig equal volume 0.5% sodium carboxymethyl cellulose solution, once a day for 7 d. 60 min after the last administration, except for control group, other groups were ip pentylenetetrazole (60 mg/kg). The effect of ABP on preventing epilepsy was evaluated by behavior; The pathomorphological changes of hippocampal neurons were detected by hematoxylin eosin (HE) staining and immunohistochemistry; The levels of cystein-asparate protease-3 (Caspase-3), glial fibrillary acidic protein (GFAP), glutamic acid decarboxylase 65 (GAD65), GAD67, G protein gated inwardly rectifying K channels 1 (GIRK1),-methyl--aspartate acid receptor 1 (NMDAR1) and γ-aminobutyric acid type A receptor (GABA AR) in hippocampus were detected by ELISA; Western blotting was used to detect DJ-1, specific protein 1 (SP1), p-SP1, nuclear factor E2 related factor 2 (Nrf2) and heme oxygenase-1 (HO-1) protein expression in hippocampus. The oxidative stress model of PC12 cells induced by hydrogen peroxide (H2O2) was used to verified.Compared with model group, ABP significantly improved the epileptic symptoms of mice, which showed a decrease in rate of body stiffness and mortality (< 0.01); Hippocampal pyramidal cells were regularly arranged with clear structure, and GFAP positive expression area was reduced; The levels of Caspase-3, GFAP, GAD65, GAD67, GIRK1 and NMDAR1 in hippocampus were significantly decreased (< 0.01); DJ-1, p-SP1, Nrf2 and HO-1 protein expressions in hippocampus of epileptic mice and H2O2-induced PC12 cells were significantly decreased (< 0.01).ABP can reduce DJ-1/Nrf2/HO-1 mediated oxidative stress during epileptic seizures, thus playing a role in preventing epilepsy.
DC.; polysaccharides; epilepsy; oxidative stress; DJ-1/Nrf2/HO-1 pathway
R285.5
A
0253 - 2670(2023)01 - 0142 - 09
10.7501/j.issn.0253-2670.2023.01.017
2022-08-03
国家自然科学基金面上项目(81973440);黑龙江省“头雁”团队支持项目(黑龙江省头雁行动领导小组文件[2019]5号)
刘 艳(1987—),博士,副教授,主要研究方向为中药药效物质基础研究。E-mail: lifeliuyan@163.com
通信作者:杨炳友(1970—),博士,教授,主要研究方向为中药药效物质基础研究。Tel: (0451)82193007 E-mail: ybywater@163.com
[责任编辑 李亚楠]
