三七药渣中主要多糖成分的分离纯化及其抗氧化活性研究
2023-01-10曹玉标孙亮亮崔秀明王承潇
曹玉标,孙亮亮,杨 野,崔秀明,邱 斌,王承潇*
三七药渣中主要多糖成分的分离纯化及其抗氧化活性研究
曹玉标1, 2,孙亮亮1, 2,杨 野1, 2,崔秀明1, 2,邱 斌3*,王承潇1, 2*
1. 昆明理工大学生命科学与技术学院,云南 昆明 650500 2. 云南省三七资源可持续利用重点实验室,云南昆明 650500 3. 云南中医药大学中药学院,云南 昆明 650500
分离纯化三七药渣中主要多糖组分,分析其单糖组成,并对比研究各组分多糖的抗氧化活性。采用水提醇沉法提取三七药渣粗多糖;经DEAE Fast Flow阴离子交换柱、Sephadex G-50柱色谱法进行分离纯化。采用高效凝胶渗透色谱(HPGPC)法测定其相对分子质量及纯度,通过扫描电子显微镜(Scanning Electron Microscope,SEM)、傅里叶变换红外光谱仪(Fourier Transform Infrared spectroscopy,FT-IR)、HPLC-衍生化等方法对各组分多糖的单糖组成和初级结构进行分析。分析其抗氧化能力以及对RAW 264.7细胞氧化损伤的保护作用。分离得到3个多糖组分(PNPS-0、PNPS-0.2、PNPS-0.3),3者的单糖组成和比例存在差异:PNPS-0主要由-葡萄糖(52.28%)和-半乳糖(34.14%)组成;PNPS-0.2主要由-半乳糖(40.89%)、-阿拉伯糖(19.38%)和-葡萄糖(12.25%)组成;PNPS-0.3主要由-葡萄糖醛酸(40.43%)、-半乳糖(22.61%)和-葡萄糖(18.32%)组成。抗氧化结果表明,PNPS-0.3的总还原能力最强,对DPPH自由基、OH−自由基、ABTS自由基以及超氧阴离子自由基的清除活性最高,对RAW 264.7细胞氧化损伤保护作用最好,并呈现浓度相关性。从三七药渣中得到了3种具有抗氧化活性的多糖片段,抗氧化活性与多糖结构密切相关。为三七资源的二次开发利用提供了新的研究思路。
三七;多糖;构效关系;单糖组成;抗氧化;药渣;高效凝胶渗透色谱;-葡萄糖;-半乳糖;-阿拉伯糖;-葡萄糖醛酸
中药药渣是指从中药材中提取目标活性成分后所产生的废料、废渣。高湿中药渣较易滋生微生物菌而发霉变质,发出恶臭气味,堆放占用大量空间,掩埋会造成地下水的二次污染,晒干焚烧又会带来环境污染,均不利于生态环保,严重制约中药产业的可持续发展[1]。随着中医药产业持续健康发展目标的提出以及绿色环保和可持续发展理念日益深入人心,越来越多的研究趋向于中药材资源最大化利用[2]。
三七是五加科人参属植物三七(Burk.) F. H. Chen的干燥根及根茎,多数以三七入药的产品(诸如血塞通、复方丹参滴丸等)以皂苷成分入药[3-4],醇提皂苷成分后残留的药渣被丢弃。药渣残留的大量生物活性物质,如多糖、氨基酸类(主要为三七素)、蛋白质类、挥发油等[5]尚未得到有效利用。因此,深入挖掘、利用三七药渣中的活性成分,变废为宝,不仅能增加企业的经济效益,而且对三七的二次开发利用和资源的可持续发展具有重要研究意义和应用价值。
三七多糖(polysaccharides)是三七药渣中大量存在的活性物质。本课题组前期研究表明,三七多糖具有调节机体免疫力、抗肿瘤、抗氧化等多种药理活性[6]。本研究拟以三七药渣废弃物为研究对象,从中获取具有生理活性的多糖片段,系统分析其结构组成,并从离体-细胞水平对其抗氧化活性进行研究。在此基础上,探索并阐明三七多糖结构-活性之间的内在关联。本研究可为中药药渣资源开发利用提供新的研究视角,同时为三七资源的可持续利用提供新的研究思路和技术储备。
1 材料与仪器
1.1 仪器
HF-100 CO2型培养箱,上海力康生物有限公司;Scientz-10ND型冷冻干燥机,宁波新芝生物科技股份有限公司;CTK-32R型高速离心机,湖南湘仪仪器有限公司;UV-2600型紫外可见分光光度计,日本岛津公司;CKX41型倒置显微镜,中国奥林巴斯有限公司;3100高效液相色谱仪,依利特分析仪器有限公司;Varioskan LUX型酶标仪,美国赛默飞世尔科技公司;MIRA LMSALPHAII型扫描电子显微镜(SEM),捷克泰思肯有限公司;EMXplus-6/1型顺磁共振波谱仪、傅里叶变换红外光谱仪,德国布鲁克科技有限公司;Nikon Eclipse C1激光共聚焦显微镜,日本尼康公司。
1.2 材料
三七药渣,皂苷提取工艺中产生的废弃物,批号210813,来源于昆明华润圣火药业有限公司;RAW264.7细胞,购自北京协和细胞资源中心;-无水葡萄糖(Glu),批号1122A0219,质量分数>98%,北京索莱宝科技有限公司;-鼠李糖(Rha,批号O12A10K95105,质量分数>98%)、-阿拉伯糖(Ara,批号J24M10R89091,质量分数>98%)、-木糖(Xyl,批号D17N9S74410,质量分数>99%)、-甘露糖(Man,批号C25D8H51117,质量分数>99%)、-半乳糖(Gal,批号H16N10C102439,质量分数>99%)、-半乳糖醛酸(GalUA,批号M13N10C64281,质量分数>97%)、-葡萄糖醛酸(GluUA,批号P28N10F37892,质量分数>96%),均购于上海源叶生物科技有限公司;DEAE Sepharose Fast Flow填料,美国Cytiva公司;Sephadex G-50填料以及各规格单糖标准品,上海源叶生物科技有限公司。
1-苯基-3-甲基-5-吡唑啉酮(PMP),批号FI190025,萨恩化学技术(上海)有限公司;三氟乙酸(TFA),批号RH240475,广州苏维化工有限公司;抗坏血酸(维生素C,VC),批号20200520,国药集团化学试剂有限公司;1,1-二苯基-2-苦基肼自由基(DPPH),批号C12550543,上海麦克林公司;2,2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,批号091021220530)、荧光红染料(Ample Red,批号030722220414)、MTT(批号020328905117)、DAPI染色液(批号021119313462),均购于碧云天生物技术有限公司;色谱级乙腈,美国Sigma公司;胎牛血清(FBS,批号2148389)、DMEM培养基(批号8122030),均购于美国Gibco公司;总超氧化物歧化酶(SOD)测定试剂盒(批号20210619)、过氧化氢酶(CAT)测定试剂盒(批号20210801)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒(批号20210716),均购于南京建成生物工程研究所;其余试剂均为分析纯。
2 方法与结果
2.1 粗多糖的提取
工业生产中常用70%乙醇提取三七皂苷,用大孔树脂纯化皂苷,而多糖等其他大分子有效成分仍留在废渣、废液中,未得到有效利用。参照于少朋等[7]的方法,取三七药渣200 g,粉碎后过80目筛,加入20倍体积的蒸馏水,浸泡4 h,75 ℃提取3次,每次2 h。合并提取液,减压浓缩至总体积的1/5,4500 r/min(离心半径为13.5 cm)离心10 min,弃沉淀,使用Sevage法[8]脱蛋白质。然后加入3倍体积无水乙醇,4 ℃静置24 h使其完全沉淀,4500 r/min(离心半径为13.5 cm)离心10 min,将离心后的多糖加水复溶后在60 ℃水浴挥发至无明显的乙醇气味,透析[截留相对分子质量(w)3500]后冻干得粗多糖。计算粗多糖提取率(提取率=冻干粗多糖质量/三七药渣质量),重复3次取平均值。粗多糖提取流程见图1,得率为3.12%。
2.2 粗多糖的分离纯化
将粗多糖溶解在蒸馏水中,配制成10 mg/mL溶液,使用DEAE Sepharose Fast Flow阴离子交换柱(60 cm×4 cm,体积流量1 mL/min,0~1.0 mol/L NaCl溶液梯度洗脱)、Sephadex G-50葡聚糖凝胶色谱柱(110 cm×2.4 cm,体积流量0.5 mL/min,0.1 mol/L NaCl洗脱)对粗多糖进一步纯化。以每管10 mL收集洗脱液,苯酚-硫酸法[9]检测洗脱液490 nm处吸光度()值并绘制洗脱曲线。根据洗脱曲线收集样品,透析(截留w3500),真空冷冻干燥。将多糖组分制成质量浓度为1.0 mg/mL的溶液,200~400 nm波长下进行紫外扫描,检测样品中核酸、蛋白质及肽类等杂质的含量。经过进一步分离纯化得到粗多糖中主要含有3个组分PNPS-0、PNPS-0.2、PNPS-0.3,洗脱曲线见图2,得率分别为10.26%、32.15%、23.27%。各组分多糖通过紫外吸收光谱全波长扫描后,均在260、280 nm处均无明显吸收峰,表明纯化后的多糖组分不含核酸、蛋白质及肽类等杂质。
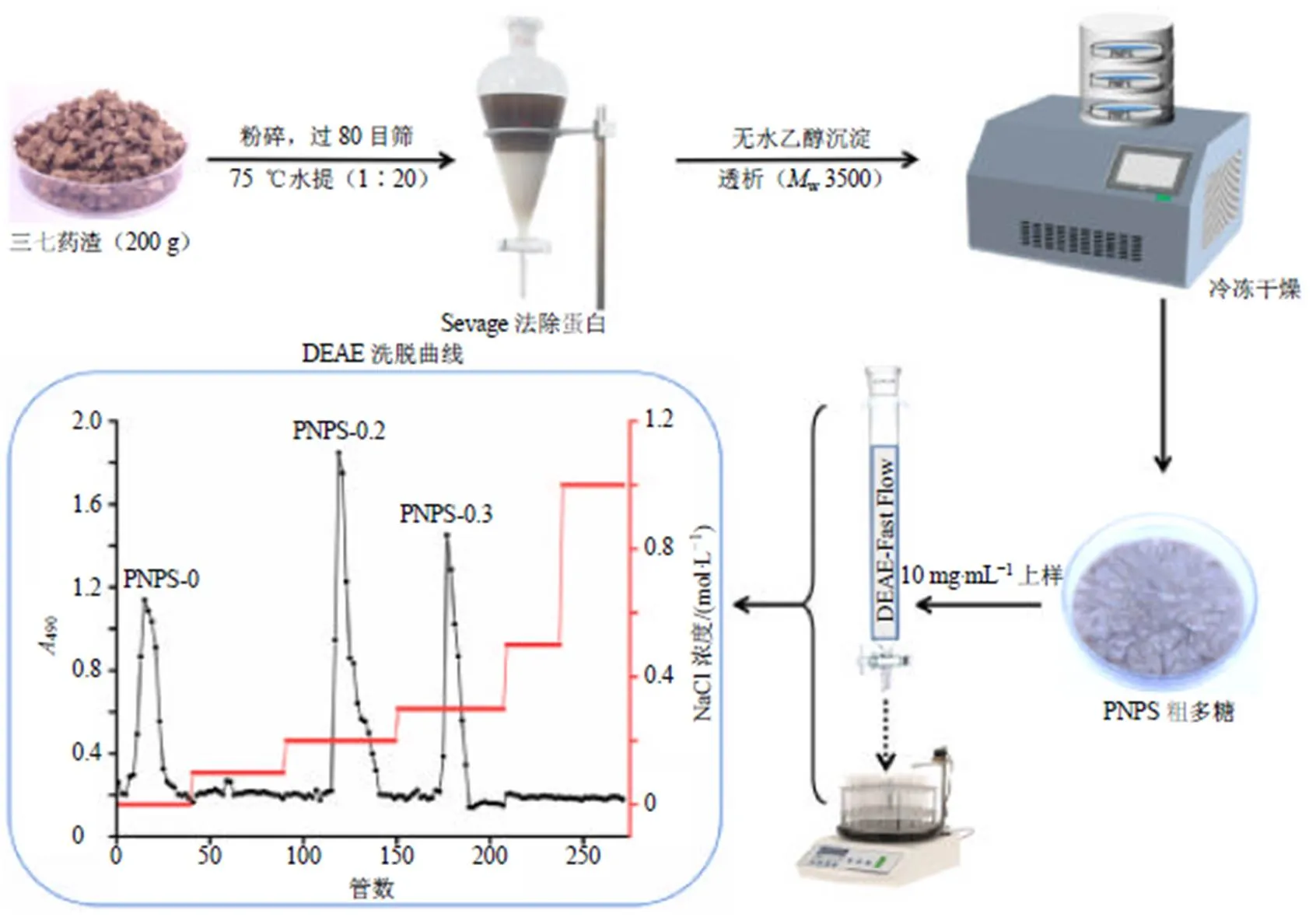
图1 PNPS提取分离工艺流程和DEAE Sepharose Fast Flow琼脂糖凝胶柱洗脱曲线

图2 多糖组分Sephadex G-50凝胶柱的洗脱曲线
2.3 多糖组分的初级结构表征
2.3.1 多糖组分纯度和w测定 精密称定样品和对照品5.0 mg,样品配制成5.0 mg/mL溶液,12 000 r/min(离心半径为 6.3 cm)离心10 min,取上清液过滤(0.22 μm),通过HPGPC测定多糖w和纯度。色谱条件:色谱柱为BRT105-104-102串联凝胶柱(300 mm×8 mm,5 μm);流动相为0.05 mol/L NaCl溶液;体积流量0.6 mL/min;柱温40 ℃;进样量20 μL;检测器:RI-10A示差检测器;lgw-R校正曲线方程为lgw=12.27-0.193 7R,2=0.992 9。结果(图3)表明,3个多糖组分均为单峰,PNPS-0、PNPS-0.2、PNPS-0.3均为纯度较高的均一多糖,w分别为29 152、173 876、104 201。
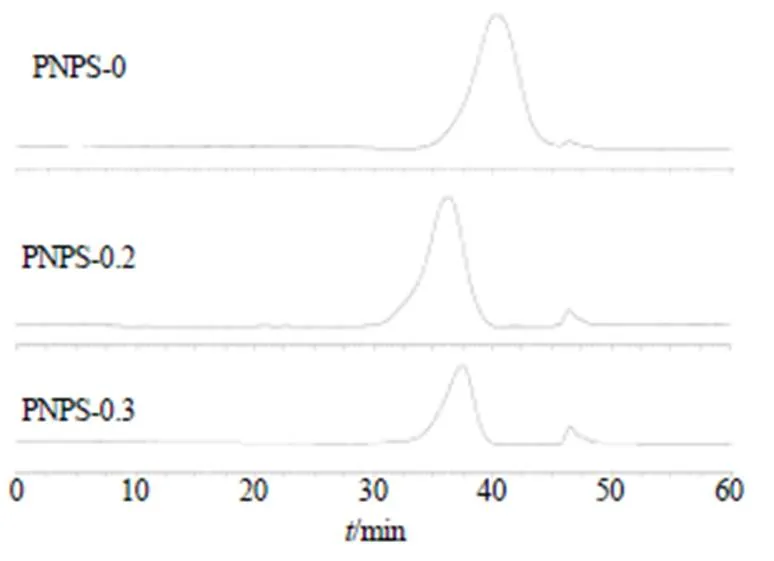
图3 多糖组分HPGPC色谱图
2.3.2 多糖组分的SEM分析 取少量各组分多糖的冻干粉末均匀粘在导电胶上,真空喷金制样,操作电压为3.0 kV,观察其微观结构。结果如图4所示,各组分多糖的表面基本相似,PNPS-0.2和PNPS- 0.3表面光滑丝状,PNPS-0相比于PNPS-0.2和PNPS-0.3表面稍粗糙,没有明显的微观形态变化。

图4 多糖组分SEM图(比例尺1 μm)
2.3.3 多糖组分的FT-IR分析 将2 mg多糖样品与200 mg干燥KBr一起研磨混匀,用压片机压成薄片后用FT-IR光谱仪在4000~500 cm−1进行扫描,记录扫描图谱。结果如图5所示,约在3415 cm−1为多糖的-OH伸缩振动特征峰;在2929 cm−1附近为-C-H的伸缩振动吸收峰。约在1741 cm−1和1630 cm−1处由酯羰基(-COOR)和羧酸酯(-COO−)伸缩振动造成的吸收峰在3组分多糖中区别尤为明显,提示PNPS-0.2、PNPS-0.3中含有羧基官能团[10]。约在906 cm−1处的吸收峰,表明存在-吡喃葡萄糖基[11]。在964~1147 cm−1的值表示含有吡喃糖单位[12],约在1248 cm−1为糖醛酸单元的羧酸部分吸收峰,约在1020、1108 cm−1处相对强的吸收峰,代表糖醛酸含量[13],得出PNPS-0.3中糖醛酸含量较高。

图5 多糖组分FT-IR图谱
2.3.4 多糖组分的单糖组成分析 采用PMP柱前衍生化的方法[14]分析单糖组成。单糖对照品的制备:精密称定甘露糖、鼠李糖、半乳糖醛酸、葡萄糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖各标准单糖5.0 mg,溶于8 mL浓氨水中,取800 μL加入等体积PMP(0.5 mol/L),70 ℃水浴反应30 min,冷却至室温,加入3 mL的水,置于55 ℃真空干燥箱挥干,加水重复2次。加入1 mL去离子水和1 mL氯仿,涡旋萃取3~5次除去多余的PMP,收集上层水相,滤过(0.22 μm),待用。多糖组分样品制备:参考Qiao等方法[15],精密称定5.0 mg多糖,加入2 mL TFA(4 mol/L),120 ℃油浴搅拌6 h至溶液澄清透明,冷却至室温。挥干TFA。随后将水解产物溶于300 μL浓氨水,涡旋混匀。按上述单糖衍生化方法处理,待用。
色谱条件:依利特E3121805色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,流动相配比为磷酸盐缓冲液(0.1 mol/L,pH 6.7)-乙腈(83∶17),体积流量1 mL/min,检测波长245 nm。结果如图6所示,3种多糖具有不同的单糖组成和比例。如表1所示,其中PNPS-0主要由-葡萄糖和-半乳糖组成,物质的量占比分别为52.58%和34.14%;PNPS-0.2主要由-半乳糖、-阿拉伯糖和-葡萄糖组成,物质的量占比分别为40.89%、19.38%和12.25%;PNPS-0.3主要由-葡萄糖醛酸、-半乳糖和-葡萄糖组成,物质的量占比分别为40.43%、22.61%、18.32%。就糖醛酸含量而言,PNPS-0.3中含量最高为42.26%(物质的量占比),明显高于前两者,与FT-IR结果一致。

A-混合对照品 B-PNPS-0 C-PNPS-0.2 D-PNPS-0.3 1-PMP 2-Man 3-Rham 4-GalUA 5-GlcUA 6-Glc 7-Gal 8-Xyl 9-Ara
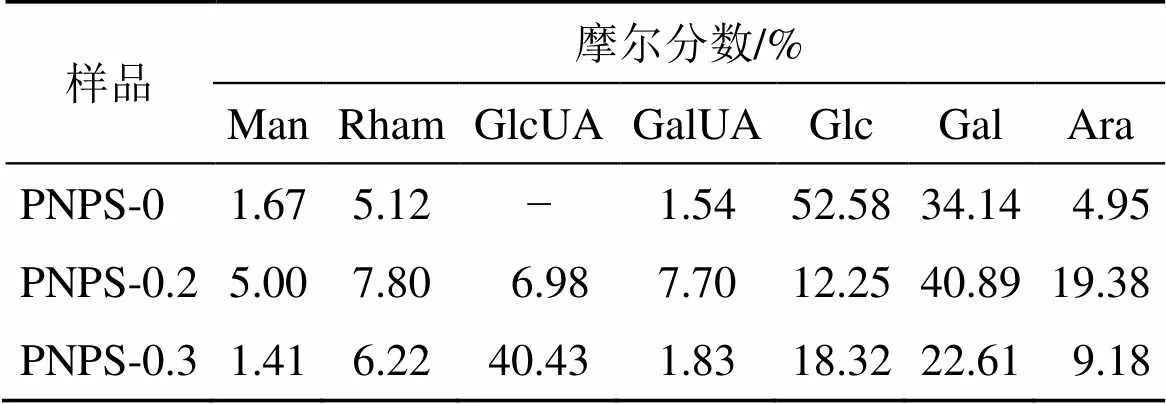
表1 单糖组成
2.4 多糖组分体外抗氧化活性研究
以VC为阳性对照,去离子水为空白对照进行下列抗氧化活性评价。
2.4.1 DPPH自由基清除活性测定 分别准确配制0~5 mg/mL浓度梯度的多糖样品,参考Fan等[16]的方法,取500 μL样品加入500 μL的DPPH溶液,避光涡旋混匀,放置30 min,5000 r/min(离心半径为6.3cm)离心10 min。取上清液于517 nm下测值,按下式计算DPPH自由基清除率。
DPPH自由基清除率=1-(1-2)/3
结果如表2所示,阳性对照VC在5 mg/mL时,对DPPH自由基的清除率为90.07%。PNPS-0、PNPS-0.2、PNPS-0.3在1~5 mg/mL时对DPPH自由基均具有一定的清除率能力,且呈明显浓度相关性。相同剂量下,活性为PNPS-0.3>PNPS-0.2>PNPS-0。PNPS-0.3表现出最强的DPPH自由基清除能力,IC50值为2.94 mg/mL。PNPS-0.3(5 mg/mL)对DPPH自由的清除能力比PNPS-0.2、PNPS-0分别提高8.49%、28.55%(<0.01)。
2.4.2 OH−自由基清除能力测定 分别准确配制0~5 mg/mL质量浓度梯度的多糖样品,参考Xie等[17]方法,取500 μL样品,依次加入等体积6 mmol/L FeSO4溶液、6 mmol/L水杨酸-无水乙醇溶液、8 mmol/L H2O2溶液(启动反应),37 ℃水浴加热60 min,于510 nm测定值。按“2.4.1”项公式计算羟基自由基的清除率。

表2 多糖组分对DPPH自由基的清除能力(, n = 3)
与PNPS-0组比较:*<0.05**<0.01***<0.001;与PNPS-0.2组比较:#<0.05##<0.01###<0.001,下表同
*< 0.05**< 0.01***< 0.001PNPS-0 group;#< 0.05##< 0.01###< 0.001PNPS-0.2 group, same as below tables
结果如表3所示,阳性对照VC在5 mg/mL时,对OH−自由基的清除率为96.09%。PNPS-0、PNPS- 0.2、PNPS-0.3在1~5 mg/mL时对OH−自由基均具有一定的清除率能力,且呈明显浓度相关性。相同剂量下,活性为PNPS-0.3>PNPS-0.2>PNPS-0。PNPS-0.3表现出最强的抗氧化活性,IC50为0.97 mg/mL。PNPS-0.3(5 mg/mL)对OH−自由基的清除能力比PNPS-0.2、PNPS-0分别提高22.23%、53.59%(<0.01)。
2.4.3 ABTS自由基清除活性测定 参考He等[18]方法,将0~5 mg/mL质量浓度梯度的多糖样品10 μL加入200 μL ABTS工作液,室温避光孵育6 min,于734 nm下测值。按“2.4.1”项计算ABTS自由基清除率。
结果如表4所示,阳性对照VC在5 mg/mL时对ABTS自由基的清除率分别为98.73%。PNPS-0、PNPS-0.2、PNPS-0.3在1~5 mg/mL时对ABTS自由基均具有一定的清除能力,且呈明显浓度相关性。相同剂量下,活性为PNPS-0.3>PNPS- 0.2>PNPS-0。PNPS-0.3表现出最强的ABTS自由基清除能力,IC50值为2.15 mg/mL。PNPS-0.3(5 mg/mL)对ABTS自由基的清除能力比PNPS-0.2、PNPS-0分别提高2.07%、34.48%(<0.01)。
2.4.4 总还原力测定 参考Huo等[19]的方法,分别吸取0~5 mg/mL质量浓度梯度的多糖样品溶液250 μL,加入等体积的磷酸盐缓冲液(0.2 mol/L,pH 6.6)和1%铁氰化钾溶液,在50 ℃条件下孵育20 min,随后加入250 μL 10%三氯乙酸,4000 r/min(离心半径为6.3 cm)离心10 min,取上清液500 μL,加入等体积0.1%三氯化铁,在700 nm波长处检测值。检测获得的值即为总还原力。

表3 多糖组分对OH−自由基的清除能力(, n = 3)

表4 多糖组分对ABTS自由基的清除能力(, n = 3)
结果如表5所示,相同剂量下,各组分多糖的总还原能力为PNPS-0.3>PNPS-0.2>PNPS-0,与体外自由基清除趋势一致。
2.4.5 顺磁共振波谱检测多糖组分对DPPH、OH−、超氧阴离子自由基的清除能力 将各组分多糖配置成5 mg/mL溶液,参考Romanet等[20]的方法,取等量的分散液和捕获剂混合,再用毛细管吸取适量混合液,加入石英管后插入样品腔。以自由基捕获剂5,5-二甲基-1-吡咯啉--氧化物(5,5-dimethyl- 1-pyrroline-oxide,DMPO)为对照,对样品进行扫谱,通过EPR谱图分析各组分多糖对DPPH自由基、OH−自由基、超氧阴离子自由基的清除能力。
EPR结果显示(图7),各组分多糖对DPPH自由基、OH−自由基、超氧阴离子自由基存在一定的清除能力,其中PNPS-0.3的清除能力最强,与体外自由基清除趋势一致。

表5 多糖组分的总还原能力(, n = 3)
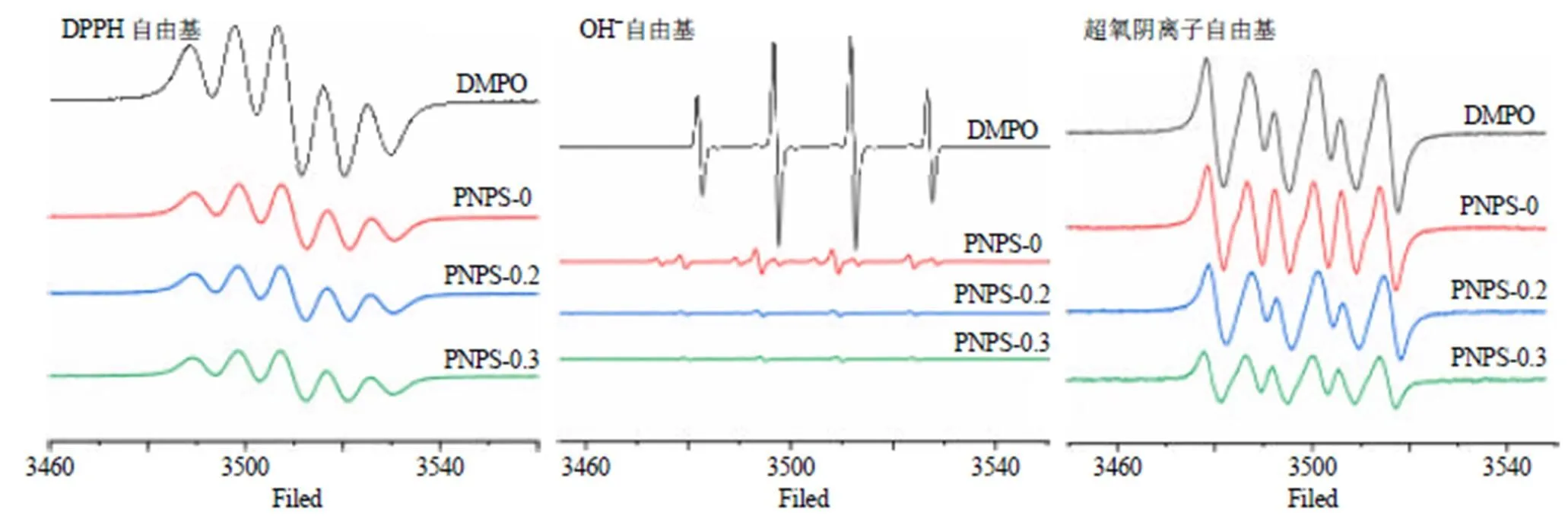
图7 各组分多糖EPR抗氧化分析
2.5 多糖组分对RAW264.7细胞氧化损伤保护作用的研究
2.5.1 RAW264.7细胞的培养 RAW264.7细胞在含有10%胎牛血清、1%青霉素-链霉素溶液的DMEM培养基中,于37 ℃和5% CO2的培养箱中培养。
2.5.2 多糖对H2O2诱导RAW264.7细胞损伤的保护作用 参考Wang等[21]的方法,将指数生长期的RAW264.7细胞以1×104个/孔接种在96孔板中。12 h后给药(多糖终质量浓度为0~200 μg/mL),培养24 h后每孔加入10 μL H2O2溶液(终浓度800 μmol/L),继续培养2 h,参照Yuzbasioglu等[22]的方法进行MTT检测,结果见图8。结果H2O2处理组细胞存活率为50.27%,如表6所示,各组分多糖对H2O2诱导的细胞损伤均具有一定的保护作用,而且呈现出浓度相关性。其中PNPS-0.3对氧化损伤的保护效果最好,在给药质量浓度200 μg/mL时,其细胞存活率比PNPS-0.2、PNPS-0分别提高了9.98%、32.29%(<0.05)。
2.5.3 多糖对RW264.7细胞液抗氧化酶活性的影响 将RAW264.7细胞(2×104个/孔)接种到96孔板中。12 h后给药(多糖终质量浓度为0、50、100、200 μg/mL),继续培养24 h,再用H2O2(400 μmol/L)培养2 h。然后收集培养基上清液,参考Zhou等[23]的方法,测定细胞液中SOD、CAT、GSH- Px含量。结果细胞液中SOD、CAT、GSH-Px 3种抗氧化酶水平分别为未处理组:(7.13±0.21)U/mL、(14.87±0.21)U/mL、(62.62±0.10)μmol/mL;H2O2处理组:(2.47±0.21)U/mL、(6.85±0.24)U/mL、(29.97±1.81)μmol/mL。

图8 给药24 h细胞状态(比例尺40 μm)

表6 多糖对H2O2氧化损伤RAW264.7细胞保护作用(, n = 3)
如表7所示,多糖组分能显著提升细胞液中SOD、CAT、GSH-Px 3种抗氧化酶水平,减轻H2O2对RAW264.7细胞氧化损伤的程度[24]。抗氧化的效果表现为PNPS-0.3>PNPS-0.2>PNPS-0,并呈现明显量效关系。质量浓度200 μg/mL时,PNPS-0.3处理组细胞液中SOD、CAT、GSH-Px 3种抗氧化酶水平比PNPS-0.2组分别增加5.26%、7.42%、4.99%(<0.05);比PNPS-0组分别增加32.7%、15.76%、16.83%(<0.05),说明其展现出良好的抗细胞氧化损伤能力。

表7 多糖组分对RAW264.7细胞液中SOD、CAT、GSH-Px含量的影响(, n = 3)
2.5.4 多糖对RAW264.7细胞氧化损伤保护的荧光定性及定量分析 参考Zhao等[25]的方法,采用“2.4.3”项方法处理细胞,随后加入荧光红染料,37 ℃孵育30 min,用PBS洗3遍,4%多聚甲醛固定,并用DAPI染色10 min。然后使用激光共聚焦显微镜,在激发波长570 nm下观察不同处理条件下的红色荧光强度,以未处理(空白)组,H2O2处理(对照)组为参照,做定性分析。按照上述方法,细胞培养在黑色96孔板中,使用多功能酶标仪对不同处理条件下的细胞(激发波长570 nm,发射波长585 nm)进行荧光定量分析。采用荧光探针(红色)标记H2O2[26]。结果显示,经不同多糖处理后,红色荧光强度:对照>PNPS-0>PNPS-0.2>PNPS- 0.3>空白(图9),进一步证明多糖在H2O2诱导的细胞损伤中发挥着有效的保护作用。
进一步,通过定量分析可知(表8),PNPS-0.3在给药质量浓度200 μg/mL时,荧光强度仅为Con组的27.43%,与Blank组无统计学差异,其相对荧光定量指标比PNPS-0.2、PNPS-0分别降低了17.84%、61.82%(<0.05)。
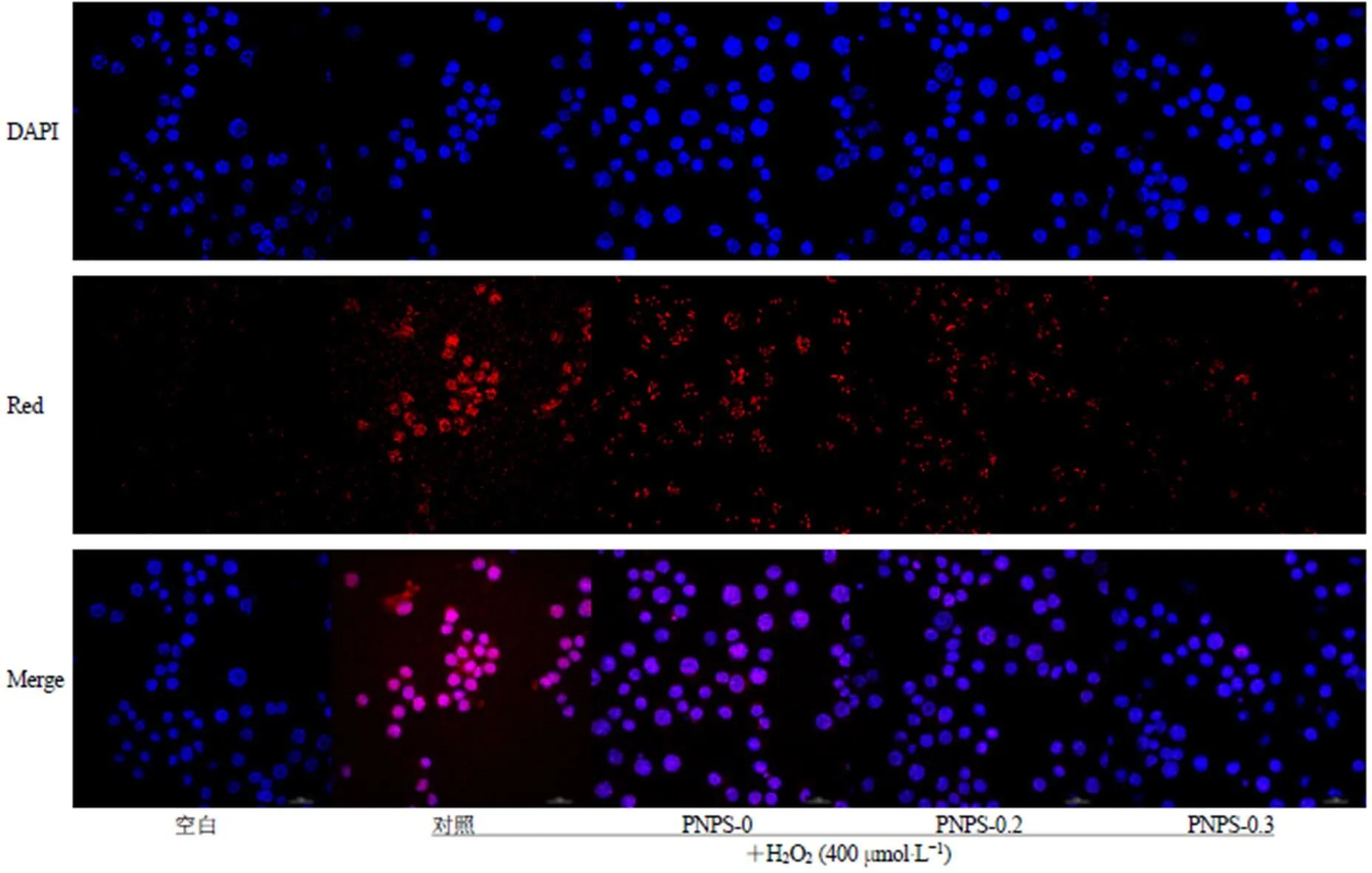
图9 各组分多糖对RAW264.7细胞氧化损伤保护的荧光定性分析(比例尺20 μm)

表8 各组分多糖对RAW264.7细胞氧化损伤保护的荧光定量分析(, n = 3)
与对照组比较:*<0.05***<0.001;与PNPS-0组比较:###<0.001;与PNPS-0.2组比较:ΔΔΔ<0.001
*< 0.05***< 0.001control group;###< 0.001PNPS-0 group;ΔΔΔ< 0.001PNPS-0.2 group
3 讨论
随着心脑血管疾病日益年轻化,三七药材的用量也日益增加,但近年来,可供种植的道地产区日益缺少,加之其种植采收加工消耗大量人力物力,三七药材的品质保证以及综合利用刻不容缓,三七药渣资源的二次开发利用对三七产业的延续至关重要[27]。如果能在三七皂苷生产线的下游搭建三七多糖的生产线,则既能实现三七原药材-三七药渣-药渣提取物之间的质量传递[28-29],使三七药材的生物利用度达到最大化;又能对2种产品同时溯源药 材[30-32],同时保证三七皂苷、多糖两者的品质,提高三七药材的药用价值。
三七作为大宗药材,其多糖成分已经得到广泛的研究。Feng等[33]的从三七根中提取分离得到2种新型多糖,均由鼠李糖、阿拉伯糖、葡萄糖和半乳糖4种单糖组成,研究表明这两种多糖在体外表现出相对较低的抗氧化能力,但对秀丽隐杆线虫的氧化应激有很强的保护作用。本课题组在前期的研究工作中提取分离得到1种三七多糖[34],由鼠李糖、阿拉伯糖、木糖、甘露糖和半乳糖5种单糖组成,研究表明该多糖能提升小鼠体内SOD和GSH-Px含量,防止过氧化物的积累。本研究得出,经过醇溶剂和高温提取皂苷后的药渣,提取出的多糖仍具有抗氧化活性,说明醇提皂苷的过程不会影响三七药材中三七多糖的活性。但提取得到的三七多糖单糖组成发生变化,这种药材-药渣之间的差异性值得深思。
本研究结果表明,三七药渣中粗多糖的提取率约为3%。据研究统计,每年因皂苷提取所产生的三七药渣约为1000 t,若处理不当,约有30 t以上的活性多糖被废弃[34]。因此,对三七药渣中活性成分进行资源回收和二次加工利用,对三七产业的可持续发展无疑具有重要意义。
多糖作为天然高分子化合物,其生物活性与w大小、官能团差异以及单糖的组成及连接方式有关[35-36]。尤其是多糖中的糖醛酸含量和w大小与其生理活性密切相关。Chen等[37]和He等[38]的研究均表明,有相似结构特性的2种多糖,随着糖醛酸含量的增加,对活性氧清除能力也会增强。其原因在于:一方面,糖醛酸含量较高的组分中大量存在的羧基更易于激活异头氢原子与自由基反应[39-40];另一方面,糖醛酸可通过增加巨噬细胞血红素加氧酶(HO-1)、谷氨酸-半胱氨酸连接酶催化亚基(GCLC)以及抗氧化酶的表达,进而激活核因子-红细胞2 p45相关因子2(Nrf2),刺激巨噬细胞表现出抗氧化特性[41-42]。You等[43]和Sun等[44]在对不同w多糖进行抗氧化对比研究时,得出位于较大w和较小w之间的多糖具有最强的抗氧化活性。一般来说,w在3000~100 000时多糖抗氧化活性最佳[45]。其可能归因于w太大会导致活性位点不易暴露,从而限制其抗氧化活性;然而若是w太小,则存在的活性官能团太少,又会使抗氧化活性不佳[46-47]。
本研究从三七药渣中分离纯化得到3种单一组分多糖PNPS-0、PNPS-0.2、PNPS-0.3。分析单糖组成可知,各多糖组分均含有-甘露糖、-鼠李糖、-葡萄糖、-半乳糖、-阿拉伯糖。PNPS-0几乎不含有糖醛酸,w为29 152;PNPS-0.2和PNPS-0.3为酸性多糖,含有-半乳糖醛酸和-葡萄糖醛酸,w分别为173 876和104 201。其中,PNPS-0.3的糖醛酸含量最高,其含量比PNPS-0.2提高27.58%。因此,适中的w和更高的糖醛酸含量导致PNPS-0.3表现出优于PNPS-0.2和PNPS-0的抗氧化活性。本研究表明,在相同的质量浓度下,PNPS-0.3对不同种类的自由基均具良好的清除活性,且清除能力优于PNPS-0.2和PNPS-0。进一步在细胞水平上,本实验也通过检测细胞抗氧化酶指标和进行荧光分析,得到了相同的结果。
综上所述,本研究以资源二次开发利用为切入点,对三七药渣中的多糖资源进行了深入挖掘,明确了其抗氧化能力,并初步阐明了结构和活性之间内在关联,可为中药材资源可持续开发利用提供新的研究思路和研究视角。
利益冲突 所有作者均声明不存在利益冲突
[1] Guo Q Q, Li J, Chen G Y,. A comprehensive comparison study: The impacts of gasifying agents and parameters on Chinese herb medicine residue gasification [J]., 2021, 12(6): 3059-3073.
[2] Li X M, Chen F, Wang X K,. Innovative utilization of herbal residues: Exploring the diversity of mechanisms beneficial to regulate anaerobic fermentation of alfalfa [J]., 2022, 360: 127429.
[3] 徐佩尔, 颜雪芸, 周乐, 等. 血塞通(三七皂苷)对缺氧/复氧诱导的H9c2心肌细胞氧化损伤的抑制作用 [J]. 中国临床药理学杂志, 2022, 38(2): 113-117.
[4] Lei W, Li X, Li L,. Compound Danshen Dripping Pill ameliorates post ischemic myocardial inflammation through synergistically regulating MAPK, PI3K/AKT and PPAR signaling pathways [J]., 2021, 281: 114438.
[5] Liu Y H, Li S, Pu M D,. Structural characterization of polysaccharides isolated frommedicinal residue and its protective effect on myelosuppression induced by cyclophosphamide [J]., 2022, 19(1): e202100681.
[6] Qi H Y, Zhang Z P, Liu J Q,. Comparisons of isolation methods, structural features, and bioactivities of the polysaccharides from three commonspecies: A review of recent progress [J]., 2021, 26(16): 4997.
[7] 于少朋, 曾锐, 韩珍, 等. 粗茎秦艽多糖GCP-1的分离纯化、结构表征及抗炎活性评价 [J]. 中草药, 2021, 52(3): 635-642.
[8] Jia X J, Ding C B, Yuan S,. Extraction, purification and characterization of polysaccharides from hawk tea [J]., 2014, 99: 319-324.
[9] Qin X M, Fan X P, Zhang L Y,. Extraction, purification, and structure characterization of polysaccharides from[J]., 2018, 6(6): 1621-1628.
[10] Fan Y J, Lin M C, Luo A X. Extraction, characterization and antioxidant activities of an acidic polysaccharide from[J]., 2022, 16(1): 867-879.
[11] Xu Y Q, Cai F, Yu Z Y,. Optimisation of pressurised water extraction of polysaccharides from blackcurrant and its antioxidant activity [J]., 2016, 194: 650-658.
[12] Duan S Y, Zhao M M, Wu B Y,. Preparation, characteristics, and antioxidant activities of carboxymethylated polysaccharides from blackcurrant fruits [J]., 2020, 155: 1114-1122.
[13] Zhu R G, Zhang X Y, Wang Y,. Pectin oligosaccharides from hawthorn (Bunge var.): Molecular characterization and potential antiglycation activities [J]., 2019, 286: 129-135.
[14] Lv Y, Yang X B, Zhao Y,. Separation and quantification of component monosaccharides of the tea polysaccharides fromby HPLC with indirect UV detection [J]., 2009, 112(3): 742-746.
[15] Qiao D L, Liu J, Ke C L,. Structural characterization of polysaccharides from[J]., 2010, 82(4): 1184-1190.
[16] Fan J, Feng H B, Yu Y,. Antioxidant activities of the polysaccharides of[J]., 2017, 157: 629-636.
[17] Xie J H, Wang Z J, Shen M Y,. Sulfated modification, characterization and antioxidant activities of polysaccharide from[J]., 2016, 53: 7-15.
[18] He J Z, Xu Y Y, Chen H B,. Extraction, structural characterization, and potential antioxidant activity of the polysaccharides from four seaweeds [J]., 2016, 17(12): 1988.
[19] Huo S H, Wang H Y, Chen J,. A preliminary study on polysaccharide extraction, purification, and antioxidant properties of sugar-rich filamentous microalgae[J]., 2022: 1-13.
[20] Romanet R, Sarhane Z, Bahut F,. Exploring the chemical space of white wine antioxidant capacity: A combined DPPH, EPR and FT-ICR-MS study [J]., 2021, 355: 129566.
[21] Wang L B, Li L Y, Gao J Y,. Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots [J]., 2021, 260: 117796.
[22] Yuzbasioglu D, Mamur S, Avuloglu-Yilmaz E,. Evaluation of the genotoxic and antigenotoxic effects of exopolysaccharide pullulan in human lymphocytes[J]., 2021, 870/871: 503391.
[23] Zhou T Y, Xiang X W, Du M,. Protective effect of polysaccharides of sea cucumberon hydrogen peroxide-induced oxidative injury in RAW264.7cells [J]., 2019, 139: 1133-1140.
[24] Liu M, Li S S, Wang X X,. Characterization, anti-oxidation and anti-inflammation of polysaccharides byagainst LPS-induced toxicity on lung [J]., 2018, 111: 121-128.
[25] Zhao B Z, Summers F A, Mason R P. Photooxidation of Amplex Red to resorufin: Implications of exposing the Amplex Red assay to light [J]., 2012, 53(5): 1080-1087.
[26] Chakraborty S, Hill A L, Shirsekar G,. Quantification of hydrogen peroxide in plant tissues using Amplex Red [J]., 2016, 109: 105-113.
[27] 崔秀明, 黄璐琦. 依靠科技进步促进三七产业创新发展 [J]. 中国现代中药, 2018, 20(3): 247-252.
[28] Liu C X, Cheng Y Y, Guo D A,. A new concept on quality marker for quality assessment and process control of Chinese medicines [J]., 2017, 9(1): 3-13.
[29] 赵鸿鹏, 许浚, 张洪兵, 等. 基于质量传递与溯源的中药质量标志物(Q-Marker)的发现策略及应用 [J]. 中草药, 2021, 52(9): 2557-2565.
[30] 张铁军, 白钢, 陈常青, 等. 基于“五原则”的复方中药质量标志物(Q-marker)研究路径 [J]. 中草药, 2018, 49(1): 1-13.
[31] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9): 1443-1457.
[32] Pan J J, He S Y, Shao J Y,. Critical pharmaceutical process identification considering chemical composition, biological activity, and batch-to-batch consistency: A case study of notoginseng total saponins [J]., 2020, 12(1): 29-35.
[33] Feng S L, Cheng H R, Xu Z,. Antioxidant and anti-aging activities and structural elucidation of polysaccharides fromroot [J]., 2019, 78: 189-199.
[34] Wang C X, Zheng L Y, Liu S N,. A novel acidic polysaccharide from the residue ofand its hepatoprotective effect on alcoholic liver damage in mice [J]., 2020, 149: 1084-1097.
[35] Tang Z J, Huang G L. Extraction, structure, and activity of polysaccharide from[J]., 2022, 150: 113015.
[36] Xu J Q, Zhang J L, Sang Y M,. Polysaccharides from medicine and food homology materials: A review on their extraction, purification, structure, and biological activities [J]., 2022, 27(10): 3215.
[37] Chen H X, Zhang M, Xie B J. Quantification of uronic acids in tea polysaccharide conjugates and their antioxidant properties [J]., 2004, 52(11): 3333-3336.
[38] He P F, Zhang A Q, Zhang F M,. Structure and bioactivity of a polysaccharide containing uronic acid from[J]., 2016, 152: 222-230.
[39] Wu H, Min T, Li X F,. Physicochemical properties and antioxidant activities of acidic polysaccharides from wampee seeds [J]., 2013, 59: 90-95.
[40] Wang Y F, Yang Z W, Wei X L. Antioxidant activities potential of tea polysaccharide fractions obtained by ultra filtration [J]., 2012, 50(3): 558-564.
[41] Cho Y C, Park J, Cho S. Anti-inflammatory and anti- oxidative effects of luteolin-7--glucuronide in LPS- stimulated murine macrophages through TAK1 inhibition and Nrf2 activation [J]., 2020, 21(6): 2007.
[42] Loboda A, Damulewicz M, Pyza E,. Role of Nrf2/ HO-1 system in development, oxidative stress response and diseases: An evolutionarily conserved mechanism [J]., 2016, 73(17): 3221-3247.
[43] You R X, Wang K P, Liu J Y,. A comparison study between different molecular weight polysaccharides derived fromand their antioxidant activities[J]., 2011, 49(12): 1298-1305.
[44] Sun X Y, Wang J M, Ouyang J M,. Antioxidant activities and repair effects on oxidatively damaged HK-2 cells of tea polysaccharides with different molecular weights [J]., 2018, 2018: 5297539.
[45] Xu Z, Li X, Feng S L,. Characteristics and bioactivities of different molecular weight polysaccharides fromseed cake [J]., 2016, 91: 1025-1032.
[46] Zhang X F, Luo Y Y, Wei G,. Physicochemical and antioxidant properties of the degradations of polysaccharides fromand their suitable molecular weight range on inducing HeLa cell apoptosis [J]., 2019, 2019: 4127360.
[47] Liu S, Zhuang X, Zhang X,. Enzymatic modification of rice bran polysaccharides by enzymes from: Natural killer cell cytotoxicity and antioxidant activity [J]., 2018, 83(7): 1948-1955.
Separation and purification of polysaccharides fromresidues and its antioxidant activities
CAO Yu-biao1, 2, SUN Liang-liang1, 2, YANG Ye1, 2, CUI Xiu-ming1, 2, QIU Bin3, WANG Cheng-xiao1, 2
1. School of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500, China 2. Key Laboratory of Sustainable Development and Utilization ofResources, Kunming 650500, China 3. School of Chinese Materia Medica, Yunnan University of Chinese Medicine, Kunming 650500, China
To separate and purify the main polysaccharide components fromresidues, analyze its monosaccharide composition and compare its antioxidant activities.The crude polysaccharides fromresidues (PNPS) were extracted by water extraction and alcohol precipitation, and separated and purified by DEAE Fast Flow anion exchange column and Sephadex G-50 column. The relative molecular mass was analyzed by HPGPC and the monosaccharide composition and primary structure were preliminarily identified by scanning electron microscope (SEM), Fourier transform infrared spectroscopy (FT-IR), HPLC of derivatizing method. The antioxidant capacity and the protective effect of polysaccharide components on oxidative damage of RAW264.7 cells were explored.Three polysaccharide components (PNPS-0, PNPS-0.2, and PNPS-0.3) were isolated and purified. There were differences in monosaccharide composition and proportion among the three: PNPS-0 was mainly composed of-glucose (52.28%) and-galactose (34.14%), PNPS-0.2 was mainly composed of-galactose (40.89%),-arabinose (19.38%) and-glucose (12.25%) and PNPS-0.3 was mainly composed of-glucuronic acid (40.43%),-galactose (22.61%) and-glucose (18.32%). The antioxidant results showed that PNPS-0.3 had the strongest total reducing ability, the highest scavenging activity on DPPH free radical, OH−free radical, ABTS free radical and superoxide anion free radical, and the protective effect on oxidative damage of RAW 264.7 cells was the best in a concentration dependent manner.Three polysaccharide fragments with antioxidant activity were obtained fromresidues. The antioxidant activity was closely related to the structure and composition of polysaccharide. Therefore, this study provides a new research idea for the secondary development and utilization ofresources.
(Burk.) F. H. Chen; polysaccharide; structure-activity relationship; monosaccharide composition; antioxidant; Chinese medicine residue; high performance gel permeation chromatography;-glucose;-galactose;-arabinose;-glucuronic acid
R283.6
A
0253 - 2670(2023)01 - 0100 - 12
10.7501/j.issn.0253-2670.2023.01.013
2022-07-02
国家自然科学基金项目(81760642);国家自然科学基金项目(82060645);云南省科技重大专项(202002AA100004-2);云南省科技重大专项(202102AA310045);云南省科技重大专项(202002AA1000056);云南省应用基础研究计划面上项目(202101AT070099)
曹玉标(1993—),男,硕士研究生,研究方向为中药生物活性成分。E-mail: 1500109072@qq.com
通信作者:邱 斌(1976—),男,硕士,正高级工程师,从事中药质量控制研究。E-mail: yyqiubin@aliyun.com
王承潇(1985—),男,副教授,硕士生导师,从事中药资源的综合开发和合理利用研究。E-mail: wcx1192002@126.com
[责任编辑 郑礼胜]
