麝香舒活灵水凝胶剂的制备与体外评价
2023-01-10彭丽华袁铁军施沐阳
彭丽华,袁铁军,高 进,李 东,施沐阳,尚 强*
麝香舒活灵水凝胶剂的制备与体外评价
彭丽华1, 2,袁铁军1,高 进3,李 东4, 5,施沐阳1,尚 强4, 5*
1. 浙江大学药学院,浙江 杭州 310058 2. 中医药质量研究国家重点实验室,澳门科技大学,澳门 999078 3. 广东省气溶胶吸入制剂工程技术研究中心,广东 珠海 528447 4. 丽珠医药集团股份有限公司,广东 珠海 519090 5. 四川省抗病毒中药产业化工程技术研究中心,四川 成都 611930
通过基于水凝胶的剂型改良,制备麝香舒活灵水凝胶剂(Shexiang Shuohuoling Hydrogel,SS-H),解决原麝香舒活灵酊剂(Shexiang Shuhuoling Tincture,SS-T)的刺激性和亲水性活性成分递送不良等问题,并优化SS-H处方。通过单因素试验筛选SS-H制备的最佳条件,并考察凝胶流变特性、平衡含水量与氧气渗透性等物化表征。在胶原酶模拟体表环境下考察体外生物降解,并比较SS-H与粗提物和SS-T的体外释放,皮肤渗透性能和生物相容性。SS-H的最佳处方为2%卡波姆、5%甘油、1.6%三乙醇胺,不需要促透剂。SS-H具有可观的可涂抹性和物理强度,并表现出一定的保湿性与透氧性,体外降解性能良好。在亲脂性药物的体外释放和皮肤渗透率未受显著影响下,亲水性药物羟基红花黄色素A在SS-H中的累积释放率和皮肤渗透率比在SS-T中分别提高了20%和40%。此外SS-H将皮肤细胞活力相对粗提物提高了20%~60%,显示出良好的生物相容性,而SS-T对细胞活力无明显促进作用。对SS-T进行凝胶制剂的改良,是有效的剂型改良策略,制备的SS-H物化性能良好,可缓解原酊剂对人体的刺激性并增强亲水性活性成分的局部递送效果,为优化基于中药复方的传统外用制剂提供了新的剂型改良策略。
麝香舒活灵;酊剂;水凝胶;外用制剂;药物递送;透皮吸收
麝香舒活灵是由麝香、三七、血竭、红花、地黄、樟脑、冰片、薄荷脑8味药材采用乙醇渗漉提取工艺[1-2]制备的传统中药配方,具有活血化瘀、消肿止痛、舒筋活络的功效[3-4],目前主要以酊剂的形式上市(国药准字Z51020078),用于治疗各种闭合性新旧软组织损伤和肌肉疲劳酸痛。由于酊剂存在生产周期长、所含乙醇可与头孢类药物产生反应且对皮肤具有刺激性[5-6]、涂擦后不易在体表留存和递送不良等问题[7-8],亟需对麝香舒活灵的剂型进行改良[9-10]。水凝胶作为成熟的外用制剂药物载体,具有保证药物在长时间内持续释放、水化角质层,促进药物的透皮吸收等优势[11-13]。同时也可保持受药部位湿润、透气,有利于组织的恢复,减少疼痛或疤痕[14-16]。因此,本研究旨在制备一种麝香舒活灵水凝胶剂(Shexiang Shuohuoling Hydrogel,SS-H),并考察其流变特性、平衡含水量与氧气渗透性、体外生物降解、体外释放研究和生物相容性等多项性能[17],为存在同类不足的中药酊剂改良为凝胶剂奠定基础。
1 仪器与材料
Agilent 1260高效液相色谱仪,安捷伦科技有限公司;HH-6数显恒温水浴锅,常州澳华仪器有限公司;CS101-2EB电热鼓风干燥箱,重庆四达试验设备有限公司;Agilent气相色谱仪、RYJ-6B型药物透皮扩散试验仪,上海黄海药检仪器有限公司;C1820型弗兰兹扩散池,上海锴凯科技贸易有限公司;TK-24BL经皮吸收仪,上海锴凯科技贸易有限公司;Anton Paar MCR302旋转黏度计,奥地利安东帕公司。
麝香舒活灵中间体,按照麝香舒活灵渗漉提取工艺,由丽珠医药集团四川光大制药有限公司提供人工麝香、三七等8味药材制备;卡波姆980NF,黏度40~60 Pa·s,路博润化学(昆山)有限公司;羟丙甲纤维素(黏度400 Pa·s,编号XW900465317)、羧甲基纤维素钠(编号30036328),国药集团化学试剂有限公司;对照品羟基红花黄色素A(hydroxysafflor yellow A,HYA,批号11637-201609,相对分子质量612.53)、樟脑(批号110747-201409,相对分子质量152.23)、龙脑(批号110881-201508,相对分子质量154.25),中国食品药品检定研究院;水凝胶样品,SNCF20-4、SNCF21-4,自制;氮酮,天门科捷制药有限公司,批号160201;脱毛剂,8%硫化钠溶液,自制;0.9%氯化钠注射液,批号S20151226,上海百特医疗用品有限公司;无水乙醇、无水甲醇和乙腈均购自国药集团化学试剂有限公司;其他试剂均为分析纯。
豚鼠,Hartley普通级,雄性,体质量240~260 g,购于广州省医学实验动物中心,许可证号:SCXK(粤)2014-0035。所有动物实验过程均遵守广州省医学实验动物中心动物实验伦理委员会的指导方针和规程。人表皮HaCaT细胞和人皮肤成纤维HSF细胞购自中国科学院ATCC细胞研究所。
2 方法与结果
2.1 凝胶基质的筛选及空白凝胶的制备
选取凝胶常用基质卡波姆980NF(CP)、羟丙甲纤维素(HPMC)和羧甲基纤维素钠(CMC-Na)作为凝胶基质筛选对象,分别按以下2种方法进行制备:①取适量凝胶剂基质,然后逐步加水,放置过夜,使其充分溶胀;②取适量凝胶剂基质,分次撒于水面上,静置过夜,使其充分溶胀。
根据凝胶外观、黏性、流动性为指标进行综合评分,结果见表1、2。采用制备方法2得到的1.5%~2.0%卡波姆空白凝胶较好,表现为白色半固体,黏度适中,成型性好,稳定性好。
2.2 SS-H中指标成分樟脑和龙脑测定方法的建立
2.2.1 色谱条件 以聚乙二醇-20兆为固定相的毛细管柱(30 m×0.32 mm,0.25 µm);程序升温:起始温度为100 ℃,以5 ℃/min的速率升温至200℃;进样口温度为250 ℃;检测器温度为250 ℃;分流比为10∶1;理论板数按龙脑峰计算应不低于20 000。色谱图见图1。

表1 水凝胶制备方法选择试验结果
“−”差(可见气泡>10,难以流动,无黏性) “+”一般(可见气泡3≤≤10,流动缓慢,有一定黏性且易分离) “++”良好(可见气泡<3,易流动,黏性较强且不易分离) “/”无该表征
“−” terrible (visible bubble> 10, difficult to flow, non-viscous) “+” general (visible bubble 3 ≤≤ 10, slow flow, a certain viscosity and easy separation) “++” better (visible bubble< 3, liquid, viscous and not easy to separate) “/” none
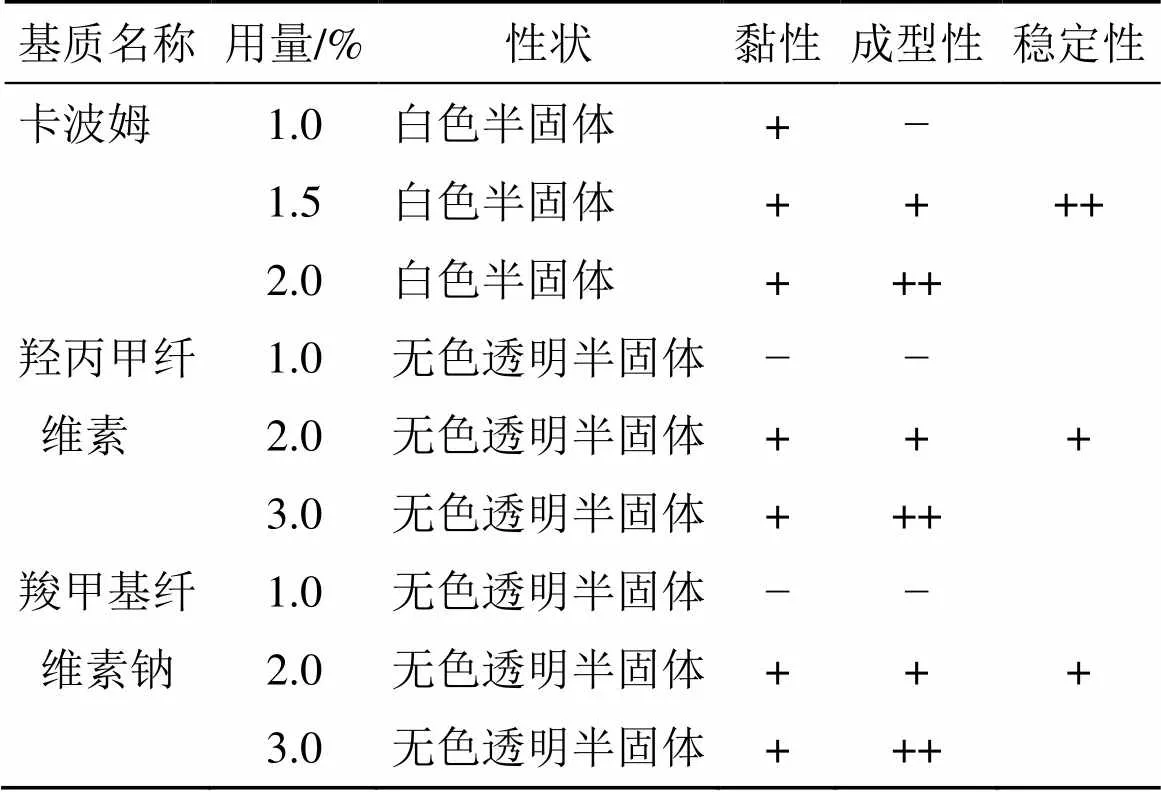
表2 SS-H基质用量筛选试验结果
“−”差(无黏性;很难延展和涂布;稳定性评价出现较严重分层);“+”一般(有一定黏性且易分离;难以延展,不易涂布;稳定性评价出现分层) “++”良好(黏性较强且不易分离;易延展涂布;稳定性评价不分层)
“−” none (it is not sticky; hard to extend and smear; severelystratified in stability evaluation) “+” general (it is sticky and easy to separate; difficult to extend and smear; stratified in stability evaluation) “++” good (strong viscosity and difficult to separate; easy to extend and smear; not stratified in stability evaluation)
2.2.2 供试品溶液的制备 取SS-H约1.0 g,精密称定,置25 mL量瓶中,加甲醇超声处理20 min(功率300 W、40 kHz),放至室温后加甲醇定容至刻度,摇匀,即得。

图1 樟脑、龙脑混合对照品(a)和SS-H样品(b)的GC图
2.2.3 线性关系考察 将按照“2.2.2”项方法精密配制的樟脑、龙脑混合对照品溶液A(其中樟脑质量浓度为8.702 38 mg/mL,龙脑质量浓度为2.908 84 mg/mL),稀释成5种不同质量浓度的混合对照品溶液(樟脑质量浓度分别为8 702.38、4 351.19、 2 175.59、1 087.80、217.56 µg/mL,龙脑质量浓度分别为2 908.84、1 454.42、727.21、363.61、72.72 µg/mL);精密吸取不同质量浓度的对照品溶液各1 µL,注入气相色谱仪,以对照品进样质量浓度()对峰面积()进行线性回归,樟脑的回归方程为=1 660.8-87.9(=0.999 9),龙脑的回归方程为=1 801.3-35.1(=0.999 8),结果表明樟脑在217.56~8 702.38 ng,龙脑在72.72~2 908.84 ng线性关系均良好。
2.2.4 精密度考察 精密吸取樟脑质量浓度为2.0 mg/mL、龙脑质量浓度为0.8 mg/mL的对照品溶液和供试品溶液各1 µL,分别连续进样6次,计算得到樟脑峰面积的RSD为0.50%,龙脑峰面积的RSD为0.51%,结果表明仪器精密度良好。
2.2.5 重复性考察 取SS-H 6份,每份1.0 g,加甲醇适量,超声处理20 min(功率300 W、40 kHz),放冷后甲醇稀释至刻度,摇匀,滤过,取续滤液,注入气相色谱仪,依法测定樟脑和龙脑的含量,计算得樟脑质量分数的RSD为1.0%,龙脑质量分数的RSD为0.97%,结果表明该方法重复性良好。
2.2.6 稳定性考察 分别在制备后0、3、6、9、12、18、24、36 h,精密吸取供试品溶液各1 µL,注入气相色谱仪,记录峰面积,计算得樟脑、龙脑峰面积的RSD分别为0.73%、1.50%,表明供试品溶液在36 h内稳定性良好。
2.2.7 加样回收率考察 精密称定SS-H 0.5 g置量瓶中,每3份为1组(已测定樟脑和龙脑含量),共3组,分别加入一定量的对照品溶液(第1、2、3组分别精密加入2.2.3中混合对照品溶液A 5、10、15 mL),按照“2.2.2”项方法制备供试品溶液,注入气相色谱仪测定樟脑和龙脑的含量,计算得樟脑的平均加样回收率为100.82%,RSD为1.01%,龙脑的平均加样回收率为100.73%,RSD为1.38%,均符合定量测定要求。
2.3 单因素考察试验
2.3.1 保湿剂甘油用量筛选 按“2.1”项下1.5%配方制成空白卡波姆凝胶,边搅匀边加入与卡波姆等量的麝香舒活灵中间体和0、5%、10%、15%甘油,然后加入与卡波姆等量的三乙醇胺,最后加纯化水制成SS-H。以其外观、黏度、涂展性、稳定性(高温、低温、离心)等指标,筛选保湿剂的用量,结果见表3。使用10%、15%甘油时,油腻感太强且15%甘油的凝胶离心时出现分层;而不加甘油时,无保湿性能,故选择甘油使用量为5%,表现为棕色半固体,涂展性好。黏度适中,稳定性好,略有油腻感。
2.3.2 pH调节剂三乙醇胺用量的筛选 按“2.1”项下方法制成空白卡波姆凝胶,边搅匀边加入等量的麝香舒活灵中间体和甘油,然后加入不同量的三乙醇胺调节pH值,最后加纯化水制成SS-H。以其外观、黏度、涂展性、稳定性(高温、低温、离心)等指标,筛选pH调节剂用量,结果见表4。卡波姆与三乙醇胺的比例为1∶0.8时,pH值为6.22,接近人体皮肤的pH值(5.5~7.0),故选择卡波姆与三乙醇胺的质量比为1∶0.8,此时,SS-H表现为棕色半固体,涂展性好,黏度适中,稳定性好。

表3 SS-H中保湿剂甘油用量考察结果
“−”无(很难延展和涂布;无黏性;稳定性评价出现较严重分层;无油腻感);“+”一般(难以延展,不易涂布;有一定黏性且易分离;稳定性评价出现分层) “++”良好(易延展涂布;黏性较强且不易分离;稳定性评价不分层),表4同
“−” none (hard to extend and smear; it is not sticky; severelystratified in stability evaluation; it is not greasy) “+” general (difficult to extend and smear; it is sticky and easy to separate; stratified in stability evaluation) “++” good (easy to extend and smear; strong viscosity and difficult to separate; not stratified in stability evaluation), same as table 4
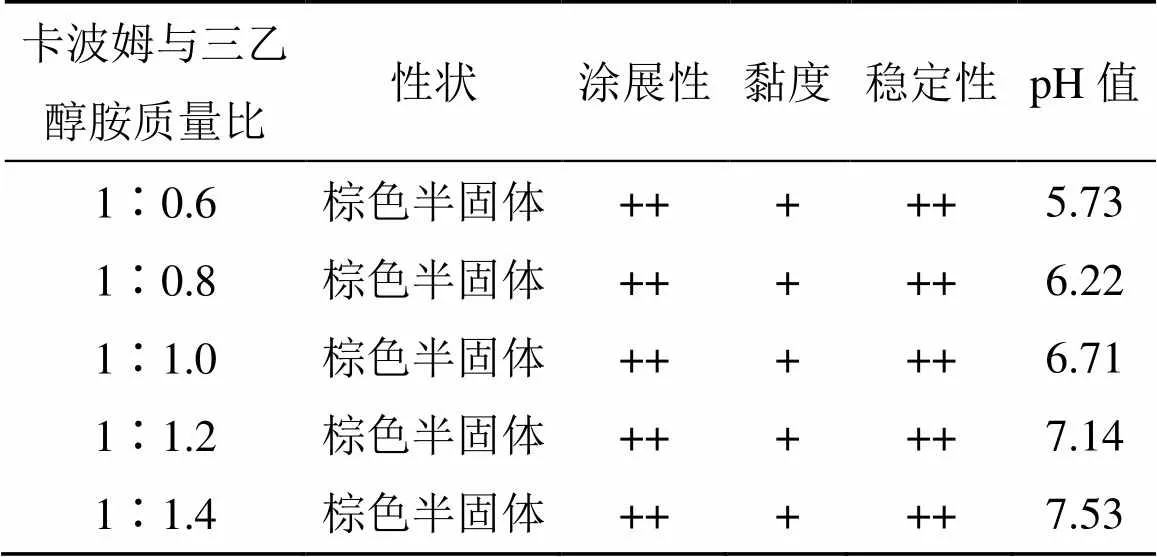
表4 SS-H中pH调节剂三乙醇胺用量考察结果
2.3.3 促透剂氮酮用量的筛选
在“2.3.2”项筛选的配方基础上继续加入不同含量的氮酮以筛选其用量。剪取大小基本相同的鼠皮表皮层面朝向供给池,真皮层面朝向接收池,取麝香舒活灵及其凝胶样品均匀涂布于鼠皮上。固定好后注入接收液6.5 mL。在32 ℃转速设置为300 r/min下开始实验,于2、4、8、12、24 h在接收池中取样1 mL,并补加对应的新鲜接收液。测定样品中樟脑、龙脑和HYA的含量。
(1)樟脑、龙脑含量测定:色谱条件同“2.2.1”项。取“2.2.3”项中质量浓度分别为樟脑217.56 µg/mL和龙脑363.61 µg/mL的对照品溶液作为对照品溶液。取“2.3.3”项中不同时间取出的接收液,用微孔滤膜过滤,取续滤液即得供试品溶液。分别精密吸取对照品溶液与供试品溶液各1 µL,注入液相色谱仪,测定,即得。
(2)HYA含量测定:同“2.3.3(1)”项下方法制备供试品溶液。其余均参照黄珍珍等[2]研究进行检测。
(3)氮酮用量的确定:樟脑和冰片的累积透过量(图2)在8 h内相差较大,在8 h后基本相当,可能是药物在凝胶剂中释放较慢。而凝胶剂中HYA在24 h内的累积透过量明显高于酊剂,原因应该是凝胶制剂比起酊剂在皮肤表面有更长的滞留时间。总体上看,氮酮促进脂溶性成分樟脑和冰片透过皮肤,而抑制水溶性成分HYA的透过,考虑到麝香舒活灵处方中有效成分复杂,加上处方中薄荷脑等本身具有促渗的作用,又因三七、红花等在处方中为君臣药,故选择不加氮酮。
2.3.4 SS-H的制备工艺 优化SS-H的制备工艺为取20 g卡波姆与50 g甘油充分溶胀后加入提取药液与16 g三乙醇胺,搅拌均匀后加纯化水适量制成1000 g凝胶。

图2 麝香舒活灵及其凝胶剂透皮吸收特性曲线
2.4 SS-H制剂学评价
2.4.1 流变特性 采用振荡应力扫频试验和频率扫频试验。样品在25 ℃下以1 Hz的恒定频率承受0.01~110 Pa的递增应力。并在25 ℃的线性黏弹性场中以1 Pa的恒定应力对样品进行从0.01~200 Hz的逐级递增的频率测试。试验过程中监测了弹性模量(′)和黏性模量(″)。研究获得的对数′和对数″与对数频率的力学谱,以确定这些模量的频率相关性[18]。如图3-A所示,SS-H在不同的剪切速率下与其产生的剪切应力之间呈非线性关系,这是非牛顿流体相关的塑性流动行为[19]。同时,SS-H的弹性模量(′)始终大于其黏性模量(″),且随着频率的进一步增加,′并没有降低(图3-B),表明振动没有扭曲凝胶分子的网络结构。以上结果表明,本研究制备的SS-H具有可涂抹性,并且对外力具有一定的抗性和稳定性,在用药部位涂抹后可对抗机体活动产生的机械力保持稳定[20],是流变学性质良好的皮肤外用制剂。

图3 流变学特性曲线
2.4.2 平衡含水率(EWC)的测量 将SS-H完全冻干,准确称量质量记为1。将干凝胶剂浸入过量的蒸馏水中直到水凝胶达到吸水平衡。将其以2500 G的转速离心2 min,去除表面多余水分后准确称量质量记为2。SS-H的EWC计算如下。
EWC=(2-1)/1
完全膨胀的SS-H的EWC值约为629.03%,这说明单位质量的SS-H可以吸收自身质量约6倍的水,具有很强的亲水性。与酊剂相比,该凝胶剂可对病灶施加潮湿环境[21],增强药物的皮肤渗透性。
2.4.3 透氧性 将凝胶剂溶于乙醇并涂在圆柱体上,干燥后用薄膜覆盖,并测量其长度和直径。然后在101 kPa的大气压力下,将圆柱体插入空气性能测量装置。通过记录皂膜达到一定高度的时间来推断透氧率。测得的透氧率为(4.01±1.80)×10−5mL/(s∙kPa),这可能部分归因于较高的EWC值。因其所引起的皮肤水化作用会促进皮肤对氧的吸收[22],保证凝胶剂涂抹后的皮肤组织有充足的氧气供应,促进组织修复并降低凝胶剂对皮肤的刺激性。
2.4.4 体外生物降解试验 胶原在皮肤中含量丰富,而胶原酶由于其分解胶原的功能,有着维持皮肤生理功能以及伤口修复的作用[23],因此,在研究凝胶外用制剂的降解中,胶原酶可作为一种模拟体表环境的生物酶。本研究选用胶原酶条件来模拟体表环境,并主要研究了水凝胶在该环境下的降解行为。在含有胶原蛋白酶的PBS中,在37 ℃下孵育若干质量相同的冻干水凝胶(1)。在预定的时间点,取回水凝胶用去除表面多余的液体,再进行冻干。将冻干水凝胶的质量记录为2。降解率的计算方法如下。
降解率=(1-2)/2
如图4所示,在该条件下SS-H在4 h降解约60%,随后降解速度趋于平稳。并在随后的20 h中保持几乎相同的质量,最终质量分数为42.76%,表现出良好的生物降解性,可用于药物释放和透皮给药。
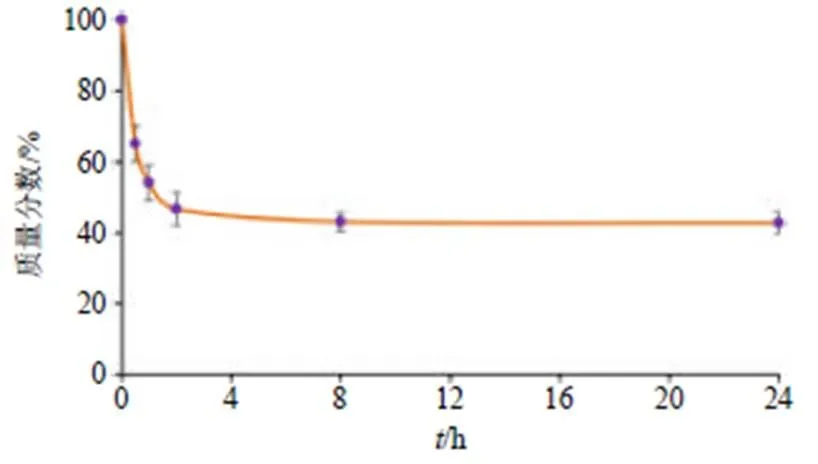
图4 体外生物降解曲线
2.4.5 体外释放研究 取4 g SS-H、10 mL SS-T和1 mL粗提物分别放入透析膜中(截留相对分子质量3500)并从两端绑好,再放入由30 mL生理盐水组成的试管里,在37 ℃下以100 r/min的速率摇动。每隔一段时间,收集1 mL释放介质,并补充新鲜生理盐水。测定释放药物的质量浓度[24]。如图5测定亲水性药物HYA与疏水性药物樟脑、薄荷醇和冰片的体外释放。这些曲线表明,水凝胶与传统酊剂相比,凝胶剂中HYA的最高释放率提高了约18%,最终释放率提高了20%,总体趋势均显著提高(图5-A),表明SS-H对促进HYA的释放有一定的作用,更重要的是,说明水凝胶可避免该成分分解。而粗提物中几乎检测不到HYA的释放。对于其它脂溶性成分,3种制剂的释放效率没有显著差异(图5-B~D)。各药物成分在前8 h内释放达到峰值,而后逐渐减小。
2.4.6 体外皮肤渗透研究 从SD大鼠背部切除皮肤置于供给和接收池之间,角质层朝供给池。将麝香舒活灵凝胶剂、酊剂和粗提取物沉积在皮肤表面,接收池中注入20 mL正常生理盐水,在32.5 ℃恒温水浴中保持不断搅拌。在不同的时间间隔收集1 mL等份接收液并补充等体积,测定取样液中的药物浓度[25]。如图6所示,SS-H中HYA在72 h内经皮累积渗透率比SS-T提高了40%,这可归因于SS-H的皮肤水化能力。与释放试验结果类似,粗提物中几乎检测不到HYA的经皮渗透。相比之下,对于樟脑、薄荷醇和冰片等脂溶性成分,SS-H、SS-T和粗提取物没有显著差异。水凝胶被证明是一个能够兼具保证脂溶性成分透皮不受影响的同时,显著加强水溶性成分的经皮转运,超越了SS-T显示出相当高的皮肤渗透能力。
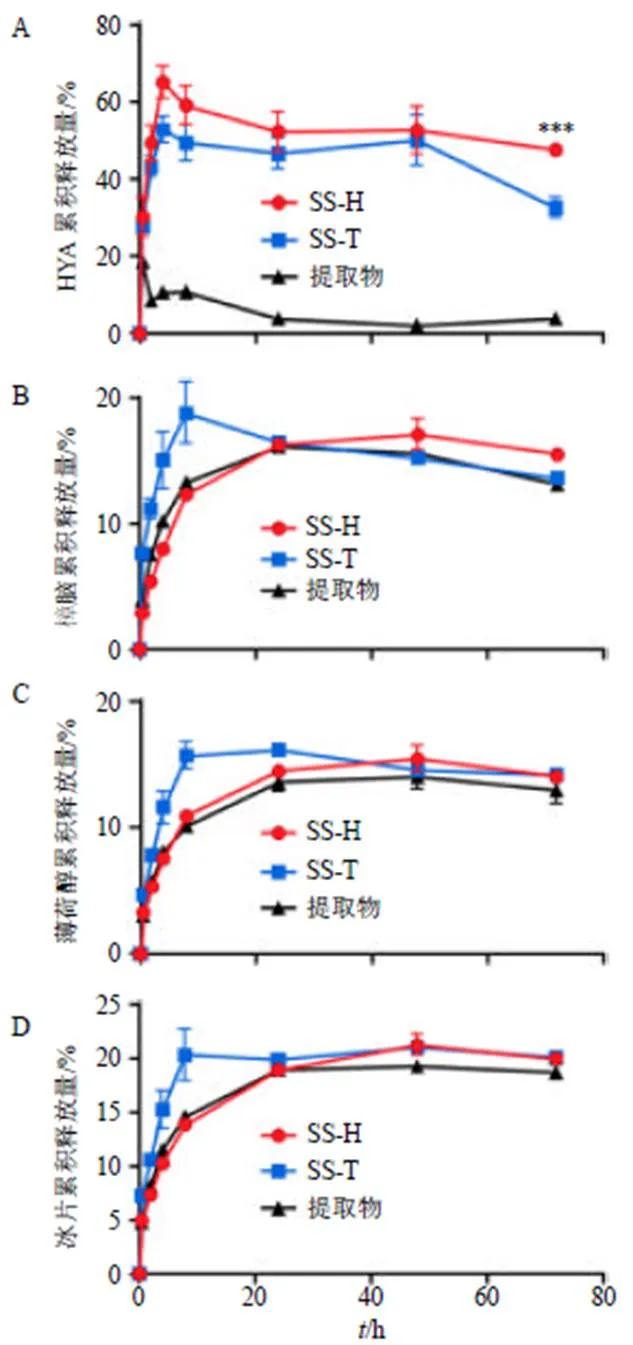
图5 体外药物释放曲线
2.4.7 生物相容性评价 以HSF细胞和HaCaT细胞为研究对象,以5×104/mL的密度接种到96孔板中,在加入SS-H、SS-T和粗提物之前,在37 ℃、5% CO2加湿培养箱中培养过夜,再培养24 h后,进行MTT检测[26]。从表5可以看出,与粗提物活性相比,用SS-H处理的细胞活力最强,与细胞的生物相容性最高,且对HSF的生长表现出剂量依赖的促进作用,在高浓度下对HaCaT的生长同样表现出促增殖作用。而SS-T和粗提物对2种皮肤细胞的增殖均有一定的抑制作用。该结果进一步证明SS-H的生物相容性优于SS-T和粗提物。

图6 皮肤渗透释放曲线

表5 各组HSF和HaCaT存活率
与粗提物同剂量组比较:**<0.01
**< 0.01the same dose group of crude extract
3 讨论
以麝香舒活灵为代表的众多药用植物提取物中药配方具有多种医疗作用,但传统的剂型如膜剂、酊剂等存在制剂应用不方便、药物透皮效率低、制剂中所含的乙醇等有机溶剂对皮肤的刺激性等明显的不足。因此,本研究设计采用水凝胶携载麝香舒活灵提取物来改良SS-T。所制备的SS-H具有良好的涂抹性和稳定性,对皮肤具有良好的透氧性、保湿性,能够保证局部给药的微环境中充足的氧气供应与水分截留,从而减少酊剂等传统中药外用制剂在使用过程中导致的脱水以及乙醇等有机溶剂浓度过高而引起的皮肤刺激性,从而大大改善对各种局部病变组织的生物相容性。
在愈合伤口边缘表皮会主动合成胶原酶并与真皮作用[27],即水凝胶作用的皮肤环境中生物酶会以胶原蛋白酶为主,故选用胶原蛋白酶条件来模拟皮肤环境,确定SS-H在生理条件下有良好的生物降解性,能自发降解以控制药物释放和实现多样化的医疗应用。而改良凝胶剂在保证脂溶性(疏水性)药物的体外释放和皮肤渗透效率不受显著影响的同时,还能有效促进中药复方中水溶性成分的经皮转运,增强局部递送效果,是一种有效传统中药创新策略。在本研究中,针对舒活灵酊剂的多类型活性成分和多重治疗功能,对舒活灵酊剂在剂型上进行的水凝胶制剂的创新性改良策略,为促进中药复方中不同理化特性的活性成分的共同递送提供了剂型改良的可靠方案,对基于多组分、多靶点的中药复方更好地发挥治疗作用提供了科学经验,为促进中药传承创新提供了新的发展思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 崔龙, 卢鹏, 曹丽华, 等. 麝香舒活灵的渗漉提取工艺优选 [J]. 中国实验方剂学杂志, 2015, 21(20): 41-43.
[2] 黄珍珍, 崔龙, 尚强, 等. 麝香舒活灵质量标准提高 [J]. 中南药学, 2017, 15(12): 1761-1764.
[3] Ao H, Feng W W, Peng C. Hydroxysafflor yellow A: A promising therapeutic agent for a broad spectrum of diseases [J]., 2018, 2018: 8259280.
[4] Xie F, Chai J K, Hu Q,. Transdermal permeation of drugs with differing lipophilicity: Effect of penetration enhancer camphor [J]., 2016, 507(1/2): 90-101.
[5] Kathe K, Kathpalia H. Film forming systems for topical and transdermal drug delivery [J]., 2017, 12(6): 487-497.
[6] Benson H A E, Grice J E, Mohammed Y,. Topical and transdermal drug delivery: From simple potions to smart technologies [J]., 2019, 16(5): 444-460.
[7] 郭德生. 外用制剂在皮肤科临床治疗中存在的问题和应对措施 [J]. 临床医药文献电子杂志, 2017, 4(35): 6927-6928.
[8] 马林纳, 白明, 苗明三. 中药酊剂临床外用现状与分析 [J]. 中华中医药杂志, 2021, 36(1): 532-535.
[9] Pergolizzi J V, Taylor R, LeQuang J A,. The role and mechanism of action of menthol in topical analgesic products [J]., 2018, 43(3): 313-319.
[10] Wang S, Zhang D, Hu J S,. A clinical and mechanistic study of topical borneol-induced analgesia [J]., 2017, 9(6): 802-815.
[11] Hoare T R, Kohane D S. Hydrogels in drug delivery: Progress and challenges [J]., 2008, 49(8): 1993-2007.
[12] Peng L H, Xu S Y, Shan Y H,. Sequential release of salidroside and paeonol from a nanosphere-hydrogel system inhibits ultraviolet B-induced melanogenesis in guinea pig skin [J]., 2014, 9(1): 1897-1908.
[13] 侯萍, 李铭, 马军, 等. 天然高分子材料水凝胶的制备及其应用进展 [J]. 高分子通报, 2022(8): 29-36.
[14] Xu X H, Yuan T J, Ye P W,. Construction of a biomimetic chemokine reservoir stimulates rapidwound repair and regeneration [J]., 2019, 570: 118648.
[15] Zhang C Z, Niu J, Chong Y S,. Porous microspheres as promising vehicles for the topical delivery of poorly soluble asiaticoside accelerate wound healing and inhibit scar formation&[J]., 2016, 109: 1-13.
[16] 杨露, 张永萍, 彭丽华. 中药及其外用制剂调控细胞因子促创面愈合的研究进展 [J]. 中国中药杂志, 2021, 46(20): 5173-5184.
[17] 辛义周, 唐文照, 张迎, 等. 马黄酊的抗炎活性物质基础研究与凝胶剂型的研发[Z]. 山东中医药大学附属医院, 2021.
[18] Chen X, Peng L H, Shan Y H,. Astragaloside IV-loaded nanoparticle-enriched hydrogel induces wound healing and anti-scar activity through topical delivery [J]., 2013, 447(1/2): 171-181.
[19] Bousmina M, Aouina M, Chaudhry B,. Rheology of polymer blends: Non-linear model for viscoelastic emulsions undergoing high deformation flows [J]., 2001, 40(6): 538-551.
[20] Bonacucina G, Martelli S, Palmieri G F. Rheological, mucoadhesive and release properties of Carbopol gels in hydrophilic cosolvents [J]., 2004, 282(1/2): 115-130.
[21] Tanner T, Marks R. Delivering drugs by the transdermal route: Review and comment [J]., 2008, 14(3): 249-260.
[22] Reading S A, Yeomans M. Oxygen absorption by skin exposed to oxygen supersaturated water [J]., 2012, 90(5): 515-524.
[23] Eisen A Z. Human skin collagenase: Localization and distribution in normal human skin [J]., 1969, 52(5): 442-448.
[24] Peng L H, Xu S Y, Shan Y H,. Sequential release of salidroside and paeonol from a nanosphere-hydrogel system inhibits ultraviolet B-induced melanogenesis in guinea pig skin [J]., 2014, 9: 1897-1908.
[25] Chen Y, Cun D M, Quan P,. Saturated long-chain esters of isopulegol as novel permeation enhancers for transdermal drug delivery [J]., 2014, 31(8): 1907-1918.
[26] Chen X, Peng L H, Chee S S,. Nanoscaled pearl powder accelerates wound repair and regenerationand[J]., 2019, 45: 1009-1016.
[27] Bauer E A, Stricklin G P, Jeffrey J J, et al. Collagenase production by human skin fibroblasts [J]., 1975, 64(1): 232-240.
Preparation andevaluation of Shexiang Shuhuoling Hydrogel
PENG Li-hua1, 2, YUAN Tie-jun1, GAO Jin3, LI Dong4, 5, SHI Mu-yang1, SHANG Qiang4, 5
1. College of Pharmaceutical Sciences, Zhejiang University, Hangzhou 310058, China 2. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078, China 3. Guangdong Engineering Research Center for Aerosol Inhalation Preparation, Zhuhai 528447, China 4. Livzon Pharmaceutical Group Inc., Zhuhai 519090, China 5. Engineering Research Center for Anti-Viral Traditional Chinese Medicine of Sichuan Province, Chengdu 611930, China
To Solve the problems of irritation of original Shexiang Shuhuoling Tincture (SS-T) and poor delivery of hydrophilic active ingredients by improving its formulation based on hydrogels.The optimum preparation conditions of hydrogels were selected by single factor experiment, and the rheological properties, equilibrium water content and oxygen permeability of hydrogels were investigated.biodegradation was investigated in a simulated body surface environment with collagenase, andrelease, skin permeability and biocompatibility of the gel were compared with crude extracts and original tinctures.The optimal prescription of Shexiang Shuohuoling Hydrogel (麝香舒活灵水凝胶剂, SS-H) was 2% carbomer, 5% glycerol, 1.6% triethanolamine, and no penetration enhancer was required. SS-H had considerable smear ability and physical strength, and also showed certain moisture retention, oxygen permeability, and good degradation performance. While therelease and skin permeability of lipophilic drugs were not significantly affected, the cumulative release and skin permeability of hydrophilic drug hydroxysafflor yellow A in SS-H were increased by 20% and 40% compared with those in SHL-T, respectively. In addition, SS-H increased the viability of skin cells by 20%—60% compared with crude extract, showing good biocompatibility, while SS-T had no obvious promoting effect on cell viability.The improvement of the gel preparation of SS-T is an effective formulation improvement strategy. The prepared SS-H has good physical and chemical properties, which can alleviate the irritation of the original tincture to human body and enhance the local delivery effect of hydrophilic active ingredients. This study provides a new formulation improvement strategy for optimizing the traditional topical preparation based on traditional Chinese medicine compound.
Shexiang Shuhuoling; tincture; hydrogel; topical preparation; drug delivery; percutaneous absorption
R283.6
A
0253 - 2670(2023)01 - 0092 - 08
10.7501/j.issn.0253-2670.2023.01.012
2022-06-22
科技部重点研发计划项目(2022YFC3501904);科技部重点研发计划项目(2021YFC1712805);浙江省基础公益计划项目(LGF22H280001);中央本级项目名贵中药资源可持续利用能力建设(2060302);中国澳门特别行政区澳门科技发展基金
彭丽华,女,副教授,从事经皮与外用制剂、生物大分子与天然药物递释技术研究。Tel/Fax: (0571)88981231 E-mail: lhpeng@zju.edu.cn
通信作者:尚 强,男,高级工程师,从事中药新产品的研究与开发。Tel/Fax: (028)83871721 E-mail: sq8032004@sina.com
[责任编辑 郑礼胜]
