粉防己根中1个新的阿朴啡型生物碱及其细胞毒活性
2023-01-10陈建国杨中铎杨立军杨淑红
陈建国,杨中铎, 2*,杨立军,杨淑红
粉防己根中1个新的阿朴啡型生物碱及其细胞毒活性
陈建国1,杨中铎1, 2*,杨立军1,杨淑红1
1. 兰州理工大学生命科学与工程学院甘肃 兰州 730050 2. 兰州理工大学温州泵阀工程研究院浙江 温州 325100
研究粉防己根的化学成分及其生物活性。采用各种柱色谱方法分离纯化化学成分,应用红外、高分辨质谱、核磁共振谱学技术鉴定化合物的结构;采用MTT法测定化合物对人肝癌HepG2细胞的抑制活性。从粉防己根的生物碱提取物中分离得到1个新的阿朴啡型生物碱,鉴定为7-甲基-7-(氯甲基)-9-羟基-6,7二氢-5苯并[]-1,3-苯并二氧杂环戊基[6,5,4-]喹啉-7-铵(1);化合物1对HepG2细胞显示出较强的增殖抑制活性,其半数抑制浓度(half maximal inhibitory concentration,IC50)为(6.61±3.67)μg/mL。化合物1为新化合物,命名为粉防己碱E(stephtetrandrine E),具有作为抗肿瘤药物开发的潜在价值。
粉防己;阿朴啡型生物碱;结构鉴定;粉防己碱E;细胞活力;磷酸二酯酶1
粉防己为防己科(Menispermaceae)千金藤属Lour.植物粉防己S. Moore的干燥根,广泛分布于浙江、安徽、福建等省,主要用于自身免疫性疾病和风湿病的治疗[1],具有解热、利尿、消炎、抗糖尿病和抗肝纤维化的活性[2]。阿朴啡型生物碱具有联苯的四环结构,伴有多种氧化态型和多种取代基。1991年,司端运等[3]首次从粉防己的地上部分分离鉴定了6个阿朴啡类生物碱:防己醌碱、堇醌碱、氧化南天竹啡碱、无根藤米里丁、南天竹啡碱(nantenine)和无根藤新碱。2016年,Dong等[4]从香青藤的块茎中分离并鉴定了1种新的阿朴啡类生物碱香青藤宁碱(illigeranine),该化合物显示出对丁酰胆碱酯酶和乙酰胆碱酯酶中等强度的抑制活性,半数抑制浓度(half maximal inhibitory concentration,IC50)值分别为(31.62±1.15)和(81.69±2.07)μmol/L。2009年,Chen等[5]从铁线莲中分离并鉴定了1种新的阿朴啡生物碱β-木果酚碱(β-magnoflorine),其对青霉UC-4376显示出较强的抗真菌活性。到目前为止,已从20个科的100多个属植物中分离出500多个阿朴啡生物碱[6-7]。为了进一步寻找新的具有生物活性的阿朴啡生物碱,本研究应用酸提碱沉法提取生物碱,综合应用大孔树脂、硅胶、LH-20等多种色谱学方法对粉防己的化学成分进行研究,应用红外、高分辨质谱、核磁共振等谱学技术鉴定,得到了1个新生物碱,结构为7-甲基-7-(氯甲基)-9-羟基-6,7二氢-5苯并[]-1,3-苯并二氧杂环戊基[6,5,4-]喹啉-7-铵(7-(chloromethyl)-9-hydroxy-7-methyl-6,7- dihydro-5-benzo[]-1,3-benzodioxolo[6,5,4-]- quinolin-7-ium,1),命名为粉防己碱E,结构见图1;并采用MTT法测定了化合物1对人肝癌HepG2细胞的抑制活性。
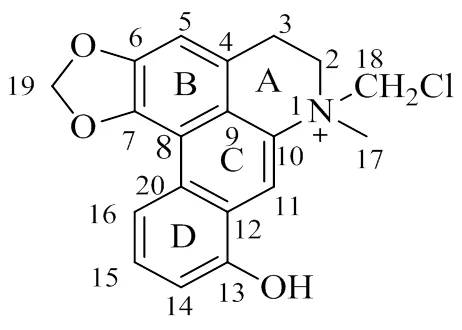
图1 化合物1的化学结构
1 仪器与材料
Bruker Avance III型核磁共振谱仪(600 MHz,瑞士Bruker公司);Delta Plus型高分辨质谱仪(美国Thermo Finnigan公司);JASCO P-1030型旋光仪(日本JASCO公司);Perkin Elmer 1600型傅里叶变换红外色谱仪(KBr压片,美国Perkin-Elmer公司);柱色谱硅胶(200~300目,青岛海洋化工厂);Sephadex LH-20型葡聚糖凝胶柱色谱(瑞典Amersham Pharmacia公司);HPD-100大孔吸附树脂(郑州勤实科技有限公司);制霉菌素(批号N141226)购自阿拉丁试剂(上海)有限公司。-半胱氨酸(批号C108237,质量分数99%)购自阿拉丁试剂(上海)有限公司;表柔比星(批号MB1094)购自大连美仑生物技术有限公司。磷酸二酯酶1(phosphodiesterase 1,PDE1,批号P3243)购自Sigma公司。尖孢镰刀菌购自北京北纳创联生物技术研究院(批号BNCC336354)。HepG2细胞由四川大学时间生物学重点实验室赠送。
粉防己根购自甘肃兰州黄河药材市场,经兰州理工大学杨林副教授鉴定为粉防己S. Moore的干燥根。标本(2018-ylj-1)保存于兰州理工大学生命科学与工程学院天然药物实验室。
2 方法
2.1 提取与分离
干燥的粉防己根(20.0 kg)粉碎后用95%乙醇水提取3次,合并提取液,旋转蒸发仪浓缩至干,得到乙醇提取物。乙醇提取物加3 L热水悬浮,用稀盐酸(5%)调节pH至2.0,静置过夜后,抽滤除去不溶物。滤液用氨水(25%)调节pH至10.0,用CHCl3(1.5 L×4)萃取得到总生物碱(500 g)。总生物碱溶解于10%的乙醇中,进行大孔树脂柱色谱,乙醇-水溶液(10%、30%、50%、70%、90%、100%)梯度洗脱,得到6个组分(Fr. 1~6)。
对Fr. 2(60 g)进行硅胶柱色谱,用三氯甲烷-甲醇(20∶1→1∶1)梯度洗脱,薄层色谱(TLC)检测合并得到4个组分(Fr. 2.1~2.4)。组分Fr. 2.4进行硅胶柱色谱分离纯化,三氯甲烷-丙酮(30∶1→2∶1)梯度洗脱,TLC检测合并得到5个组分(Fr. 2.4.1~2.4.5)。组分Fr. 2.4.2用LH-20柱色谱分离纯化,甲醇洗脱得到化合物1(5.5 mg)。
2.2 生物活性测定
2.2.1 细胞活力测定 采用MTT法检测HepG2细胞的体外细胞活力。首先,收集对数生长期的细胞,用培养基将细胞重新悬浮成浓度为1×104~3×104个细胞/mL的细胞悬浮液,然后将细胞悬浮液按每孔100 μL接种到96孔板中。将96孔板置于5% CO2细胞培养箱中在37 ℃培养过夜。实验分为3组,对照组、实验组和阳性药(表柔比星)组。第2天,实验组各孔中加入100 μL各浓度梯度的药物,每个药物浓度设置3个平行孔。对照组各孔中加入100 μL含0.1%二甲基亚砜(DMSO)的培养基。阳性药组各孔中加入100 μL各浓度梯度的表柔比星。上述处理组,继续在细胞培养箱中孵育72 h。向96孔板的每个孔中加入5 mg/mL的MTT溶液20 μL,在37 ℃下孵育2~4 h形成甲瓒晶体,去除上清液。向每个孔中加入150 μL DMSO溶解甲瓒晶体。完全溶解后,用酶标仪在波长570 nm下测定吸光度()值。根据公式计算药物对肿瘤细胞的生长抑制率,再使用Graphpad Prism软件计算IC50值[8]。
生长抑制率=(对照-实验)/对照
2.2.2 PDE1活性测定 测定方法参照文献方法[9]。在96孔板中,加入160 μL含0.11 mol/L氯化钠和15 mmol/L氯化镁的0.11 mol/L tris-HCl缓冲液(pH 8.9)、PDE1终浓度为0.000 18 U/孔、20 μL的样品(化合物1)或20 μL的阳性药-半胱氨酸。在45 ℃下孵育20 min,加入20 μL的0.65 mmol/L底物(对硝基苯基胸腺嘧啶-5-磷酸),继续孵育15 min后,在酶标仪上405 nm处测定值。实验分4组,样品组加20 μL样品,空白组用20 μL tris-HCl缓冲液,样品本底组加20 μL样品并用20 μL tris-HCl缓冲液代替底物,完全抑制组用20 μL 200 μg/mL的阳性药-半胱氨酸。每组平行测定3次,用酶标仪在波长405 nm下测定值,根据值的变化计算抑制率。
抑制率=[(空白-完全抑制)-(样品-样品本底)]/(空白-完全抑制)
2.2.3 抗尖孢镰刀菌生长活性测定 测定方法参照文献报道[10]。将接种至PDA固体培养基中培养5~6 d,然后用10 mL双倍浓度的PDA液体培养基冲洗得悬浮液,使用4层灭菌纱布过滤菌丝体,得到分生孢子液。并用分光光度计测定分生孢子液在625 nm处的值,并用2倍浓度的PDA原液稀释分生孢子液,使值处于0.09~0.12。在此稀释浓度上再稀释100倍即得实验用孢子悬浮液。在96孔板的各孔中加入50 μL孢子悬浮液,加入50 μL阳性药(制霉菌素)或待测样品。将96孔板放置在28 ℃恒温培养箱培养24 h,每孔加入20 μL的碘硝基四唑紫(iodonitrotetrazolium chloride,INT)染色剂,继续培养24 h,观察颜色变化,加入INT后颜色不变红的孔所对应的样品可认定为有抗尖孢镰刀菌活性。使用50 μL无菌水代替样品作为阴性对照组。
3 结果
3.1 结构鉴定
化合物1:白色粉末,[α]20 D+90.0° (10, CH3OH)。HRESIMS给出分子式C19H17NO3Cl(/342.088 9 [M]+(计算值342.089 2)。红外光谱在3419 cm−1处显示有羟基。化合物1的1H-和13C-NMR波谱数据(表1)显示有1个甲基、4个亚甲基、5个次甲基和9个季碳信号。同时NMR数据还表明化合物1具有1个-甲基 [H3.41 (3H, s, H-17),C50.4 (C-17)]、1个氯甲基[H5.49 (2H, s, H-18),C69.7 (C-18)]、1个二氧亚甲基[H6.26 (2H, s, H-19),C102.9 (C-19)] 和5个芳环质子 [H7.34 (1H, s, H-5), 7.86 (1H, s, H-11), 7.88 (1H, dd,= 9.3, 2.6 Hz, H-14), 7.61 (1H, t,= 9.3 Hz, H-15), 9.06 (1H, dd,= 9.3, 2.6 Hz, H-16)]。化合物1的1H-和13C-NMR数据与已知的去氢阿朴啡生物碱相似[11-13],这表明化合物1是去氢阿朴啡生物碱的类似物。H-19/C-6、H-19/C-7、H-5/C-6、H-5/C-7之间的HMBC相关峰(图2)表明二氧亚甲基与B-环并合形成1,3二氧五环。H-18/C-2、H-2/C-18、H-18/C-17、H-17/C-18、H-2/C-17之间的HMBC相关峰(图2)表明,甲基和氯甲基连接到氮原子上形成季胺。H-11/C-10、H-11/C-12、H-11/C-20、H-11/C-9之间的HMBC相关峰表明C环形成了芳环。由于D环中的3个质子分别显示H9.06 (dd,= 9.3, 2.6 Hz), 7.61 (t,= 9.3 Hz), 7.88 (dd,= 9.3, 2.6 Hz) 峰,因此D环中的羟基只能被取代在C-13或C-16位。通过查阅文献报道[11,14-15],发现当去氢阿朴啡生物碱的C-16位没有羟基取代时,H-16的化学位移通常较大,H为8.5~9.1,而当在C-16位有羟基取代时,D环上质子的化学位移通常不超过H8.0。化合物1的H-16的化学位移达到H9.06,这表明羟基应该连接到C-13,而不是C-16。
综合NMR图谱信息,对化合物1的碳氢信号进行归属,见表1。鉴定化合物1的结构为7-甲基- 7-(氯甲基)-9-羟基-6,7二氢-5苯并[]-1,3-苯并二氧杂环戊基[6,5,4-]喹啉-7-铵;经SciFinder Scholar检索,化合物1为1个新的阿朴啡型生物碱,命名为粉防己碱E,结构见图1。

表1 化合物1的1H-NMR 和13C-NMR数据(600/150 MHz, CD3OD)

图2 化合物1的1H-1H COSY和HMBC相关
3.2 生物活性测定结果
通过MTT法、高通量抗真菌活性测定法、紫外分光光度法(酶标仪上利用96孔板测定)分别测定了化合物1对HepG2细胞的增殖、尖孢镰刀菌的生长和PDE1的抑制活性。结果表明,化合物1对HepG2细胞增殖有较强的抑制活性,其IC50值为(6.61±3.67)μg/mL,阳性药表柔比星的IC50值为(4.01±1.15)μg/mL。化合物1在10 mg/mL时对尖孢镰刀菌生长无明显抑制活性(加入INT后颜色变红),化合物1对PDE1无明显抑制活性。
4 讨论
本研究从粉防己根的生物碱提取物中分离得到1个新的阿朴啡型生物碱,粉防己碱E,其表现出良好的抗HepG2细胞增殖的活性。另外,本研究同时发现了4个双苄基异喹啉类生物碱,粉防己碱A~D,其中粉防己碱C也表现出良好的抑制HepG2细胞增殖的活性[16]。这些研究结果将为粉防己根开发成抗肿瘤产品提供了理论支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] Ogino T, Sato T, Sasaki H,. Four new bisbenzylisoquinoline alkaloids from the root of(Fen-Fang ji) [J]., 1988, 27(5): 1149.
[2] Sun Y F, Wink M. Tetrandrine and fangchinoline, bisbenzylisoquinoline alkaloids fromcan reverse multidrug resistance by inhibiting P-glycoprotein activity in multidrug resistant human cancer cells [J]., 2014, 21(8/9): 1110-1119.
[3] 司端运, 赵守训. 粉防己地上部分的阿朴啡类生物碱成分 [J]. 济宁医学院学报, 1991, 14(2): 1-6.
[4] Dong J W, Cai L, Li X J,. Monoterpene esters and aporphine alkaloids fromwith inhibitory effects against cholinesterase and NO production in LPS-stimulated RAW264.7 macrophages [J]., 2017, 40(12): 1394-1402.
[5] Chen J H, du Z Z, Shen Y M,. Aporphine alkaloids fromand their antifungal activity [J]., 2009, 32(1): 3-5.
[6] 刘言娟, 柳军玺, 邸多隆. 阿朴菲类生物碱抗癌活性研究进展 [J]. 中草药, 2012, 43(4): 806-814.
[7] Chen J X, Gao K, Liu T G,. Aporphine alkaloids: A kind of alkaloids’ extract source, chemical constitution and pharmacological actions in different botany [J]., 2013, 25(18): 10015-10027.
[8] Liu Z H, Lei Q, Wei W,. Synthesis and biological evaluation of ()-4-(3-arylvinyl-1-indazol-6-yl) pyrimidin- 2-amine derivatives as PLK4 inhibitors for the treatment of breast cancer [J]., 2017, 7(44): 27737-27746.
[9] Fozing C D, Ali Z, Ngadjui B T,. Phosphodiesterase I-inhibiting Diels-Alder adducts from the leaves of[J]., 2012, 78(2): 154-159.
[10] Zhang Y, Kao P L, Rampal A,. High-throughput screening assays to identify plant natural products with antifungal properties against[J]., 2022, 2391: 171-184.
[11] Wang H, Cheng X, Kong S J,. Synthesis and structure-activity relationships of a series of aporphine derivatives with antiarrhythmic activities and acute toxicity [J]., 2016, 21(12): 1555.
[12] 吴彤彬, 刘国卿, 闵知大, 等. 一去氢阿朴啡生物碱的结构测定 [J]. 中国药科大学学报, 1989, 20(4): 235-236.
[13] Chen C Y, Kao C L, Li W J,. Secondary metabolites from the stems of[J]., 2018, 54(3): 617-618.
[14] Atanes N,. Synthesis of 7-substituted dehydronoraporphines, with some biogenetic considerations [J]., 1994, 50(38): 11257-11266.
[15] Greecke M, Borer R, Brossi A. Conversion of natural ()-bulbocapnine into two (ring A)-substituted derivatives of ()-apomorphine [J]., 1979, 62(5): 1543-1548.
[16] Yang L J, Yang Z D, Li Z J,. Stephtetrandrine A-D, bisbenzylisoquinoline alkaloids from[J]., 2022, doi: 10.1080/14786419. 2021.1961135.
A new aporphine alkaloid fromroots ofand its cytotoxicity
CHEN Jian-guo1, YANG Zhong-duo1, 2, YANG Li-jun1, YANG Shu-hong1
1. School of Life Science and Engineering, Lanzhou University of Technology, Lanzhou 730050, China 2. Wenzhou Engineering Institute of Pump & Valve, Lanzhou University of Technology, Wenzhou 325105, China
To study the chemical constituents ofthe roots ofand its biological activities.The chemical constituents were isolated by various column chromatography methods, the structures of the isolated compounds were identified by IR, HRESIMS, 1D, 2D NMR spectra and the human hepatoma cell HepG2 inhibitory activity was tested by MTT method.A new aporphine alkaloid (1) was isolated from the alkaloid extract of the roots of, which was identified as 7-(chloromethyl)-9-hydroxy-7-methyl-6,7-dihydro-5-benzo[]-1,3-benzodioxolo[6,5,4-]quinolin-7-ium; Compound 1 showed potent inhibition against HepG2 cells with its half maximal inhibitory concentration of (6.61±3.67) μg/mL.Compound 1 is a new compound, named stephtetrandrine E, which has potential value as an anti-tumor agent.
S. Moore; aporphine alkaloid; structure elucidation; stephtetrandrine E; cell viability; phosphodiesterase 1
R284.1
A
0253 - 2670(2023)01 - 0041 - 04
10.7501/j.issn.0253-2670.2023.01.006
2022-10-27
国家自然科学基金资助项目(22267011);甘肃省高等学校产业支撑计划项目(2022CYZC-29);温州市科技局项目(2022Y0872);甘肃省自然科学基金资助项目(20JR5RA458)
陈建国(1997—),男,硕士研究生,研究方向为天然药物化学。E-mail: 392085702@qq.com
通信作者:杨中铎,男,教授,硕导,研究方向为天然药物化学。Tel: (0931)2973727 E-mail: yangzhongduo@126.com
[责任编辑 王文倩]
