噬菌体在动物源性食品致病菌控制中的应用
2023-01-10聂长丽张明董浩宋钢张国清郭晓华申照华张德福励建荣
聂长丽,张明,董浩,宋钢,张国清,郭晓华,申照华,张德福*,励建荣
(1. 渤海大学食品科学与工程学院,渤海大学海洋研究院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013;2. 山东美佳集团有限公司,山东 日照,276806;3. 凌海市达莲海珍品养殖有限责任公司,辽宁 锦州,121211;4. 锦州市龙海馨港科技有限公司, 辽宁 锦州 121211;5. 锦州市农业农村综合服务中心水产技术推广总站,辽宁 锦州,121000)
动物性食品是人类摄取优质蛋白的重要来源,但是动物集约化养殖导致其机体免疫力下降,易被细菌感染,从而导致食源性疾病的发生,严重危及消费者健康与食品安全。目前,养殖业者主要使用药物治疗或者通过在饲料中添加抗菌药物预防食用动物的细菌性疾病,达到防控动物性食品细菌污染的目的。然而,长期使用抗菌药物会产生副作用,如药物残留、耐药性等,给养殖业造成极大的经济损失,因此迫切需要寻找绿色环保安全的方法控制食用动物的细菌性疾病,从而为人们提供安全优质的蛋白。
上个世纪中叶,青霉素等抗生素的发现及使用使噬菌体受到冷落。近年来,噬菌体作为一种新型抗菌剂重新受到人们的关注[1]。噬菌体是生态系统中最丰富的生物之一,其可感染宿主菌并进行复制、增殖,最终裂解宿主菌释放子代噬菌体,从而达到抗菌的效果,并且噬菌体对动物、人类无害,可作为一种有潜力的生物防治剂,用于防控细菌感染[2]。目前,荷兰、德国、美国等国家已有针对单增李斯特菌、大肠杆菌、沙门氏菌、志贺氏菌等主要食源性致病菌的噬菌体制剂实现商业化应用,如ListShieldTM,EcoShieldTM等[3]。
本研究综述了噬菌体在控制动物性食品中致病菌方面的研究进展,分析噬菌体治疗的优势与面临的挑战,为噬菌体制剂在防控食用动物细菌性疾病、提高食品原料安全性方面的研究与应用提供参考。
1 噬菌体概述
1.1 噬菌体的发现
1896年,英国细菌学家Hankin首次发现在印度的恒河和亚穆那河水中含有抗菌活性的物质,可杀灭霍乱弧菌,抑制霍乱病的流行[4]。1915年,英国微生物学家Frederick Twort在研究牛痘病毒时,发现存在一种物质能通过微孔过滤器并破坏培养的细菌,他公布了这一发现,但没有引起人们的重视[5]。1917年,加拿大微生物学家Félix d’Hérelle发现了痢疾杆菌噬菌体,并进行了命名。Félix d’Hérelle对噬菌体进行了大量的研究,并尝试了利用噬菌体治疗人体细菌的感染,从此开始了将噬菌体应用于临床的研究[6]。
1.2 噬菌体的分类
噬菌体是能感染细菌、真菌、放线菌或螺旋体等微生物的病毒的总称[7]。其存在于多种生态环境中,种类繁多,数量可达1031,约为细菌数量的10倍[8-9]。噬菌体分类有多种不同的标准。根据遗传物质不同,可将其分为DNA噬菌体和RNA噬菌体;按照宿主来源的不同可分为植物噬菌体、细菌噬菌体、动物噬菌体等;根据是否有尾可将其分为有尾噬菌体和无尾噬菌体,据文献报道96%的噬菌体属于有尾噬菌体目[10]。其中,有尾噬菌体目可分为肌尾噬菌体科(Myoviridae)、短尾噬菌体科(Podoviridae)和长尾噬菌体科(Siphoviridae)。根据形态可分为瓶状、球状、杆状、丝状、链状、多面体等[11]。
根据噬菌体的生活周期不同可以分为烈性噬菌体(Lytic phage)和温和噬菌体(Temperate phage)[12]。烈性噬菌体是指在短时间内能连续完成裂解周期而实现繁殖的噬菌体,其侵染宿主细胞后短时间内可完成吸附、侵入、增殖、装配和裂解5个阶段,最终导致宿主细胞死亡(图1)[13-15]。温和噬菌体吸附并且侵入宿主细胞后将基因组整合到宿主菌的染色体中,并随宿主基因组的复制而进行同步复制,一般不进行增殖和引起宿主细胞裂解[16]。因此,目前具有实用价值的噬菌体主要是烈性噬菌体。
1.3 噬菌体的杀菌机制
噬菌体的杀菌作用是通过裂解酶实现的。裂解酶(Endolysin或Lysin)是双链DNA噬菌体在自身复制晚期合成的一类细胞壁水解酶,又称作内溶素、溶胞壁酶[17-18]。
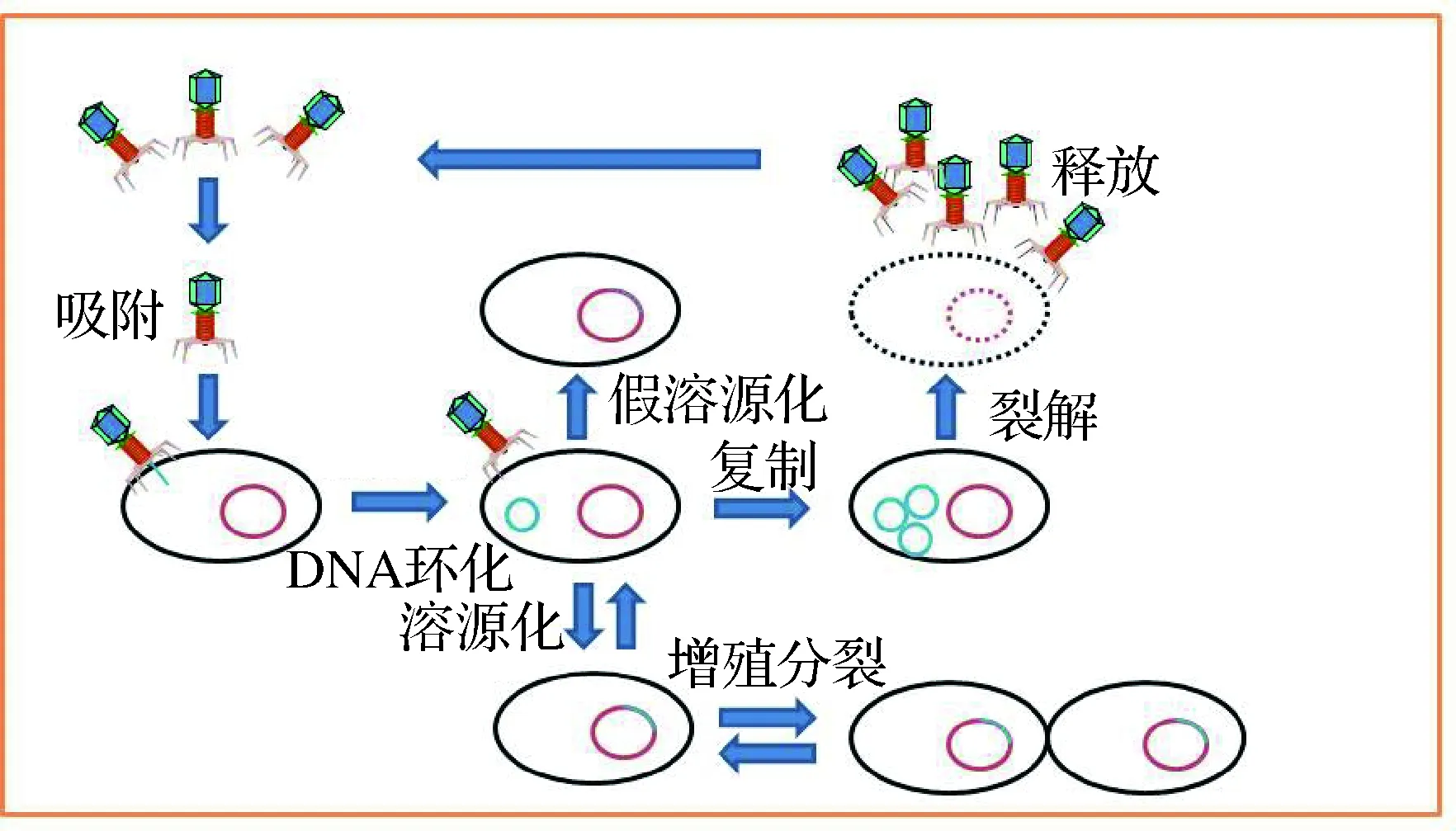
图1 噬菌体的生命周期Fig.1 Life cycle of bacteriophages
大多数的噬菌体能够吸附在细菌表面的受体上,受体大部分是蛋白质(多糖)。噬菌体感染后期,内溶素破坏细菌细胞壁上各种分子的共价键,达到裂解细胞壁的作用[19-20]。在裂解细胞壁时,多数内溶素因缺少信号肽需要与孔蛋白(Holin)协同作用。孔蛋白是一种疏水性的跨膜蛋白,他可以在细胞膜上形成同源低聚物而损害膜或形成非特异性孔洞,促使细胞壁水解酶接近肽聚糖上的作用靶点;孔蛋白也可控制酶的释放量,从而控制内溶素在体内裂解时间,达到水解宿主细胞壁的目的,同时起到杀菌作用[20-21]。少数有信号肽序列的内溶素参与宿主细胞的分泌机制,不与孔蛋白协同作用。噬菌体的杀菌机制见图2[20]。
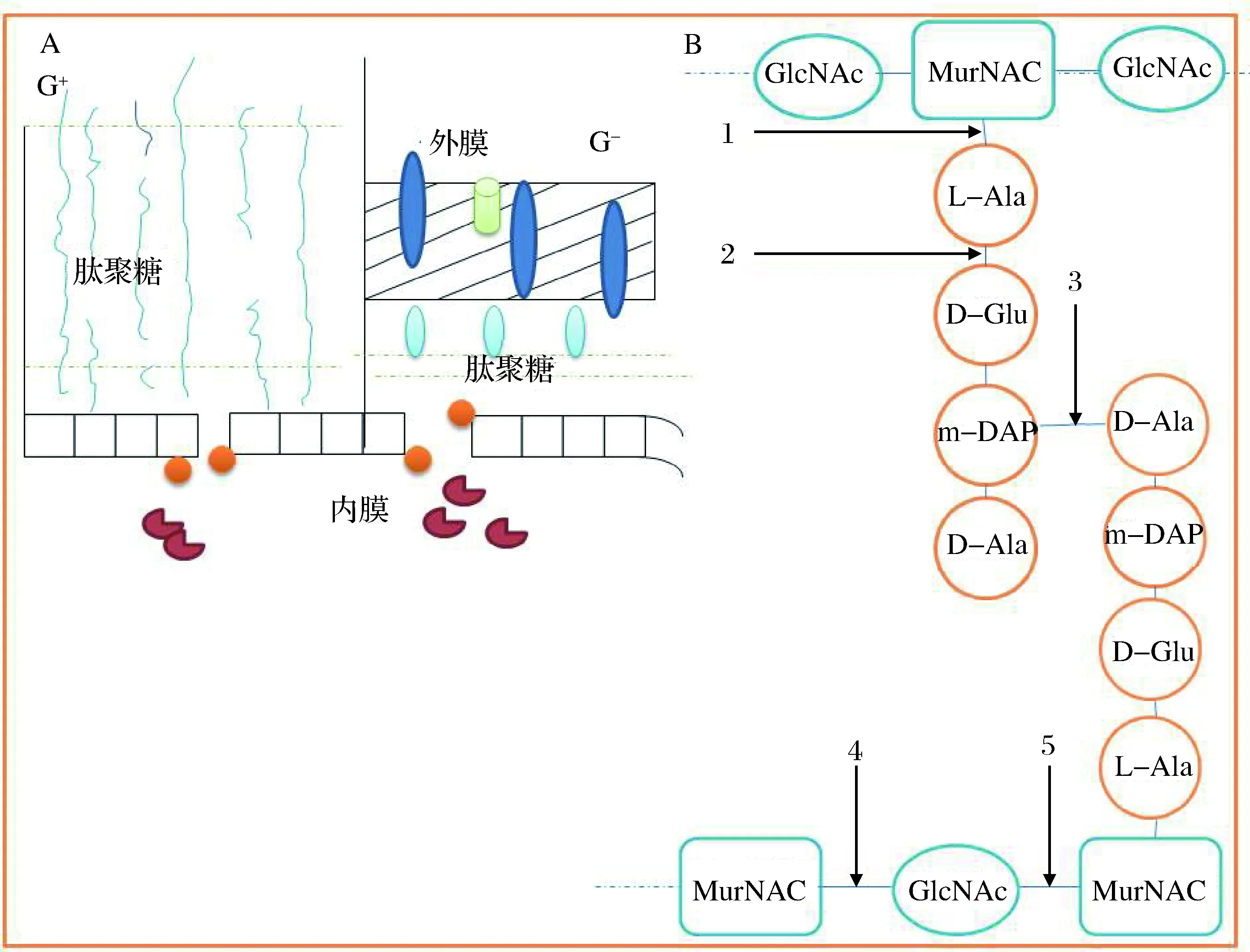
图2 细菌细胞壁的结构、内溶素的结构位点及噬菌体的杀菌机制Fig.2 Structure of bacterial cell wall, structure site of endolysin and bactericidal mechanism of bacteriophage(A)细菌细胞壁及内溶素作用示意图。孔蛋白();内溶素();(B)肽聚糖结构及内溶素的攻击位点。数字是内溶素的攻击位点:1:酰胺酶(Amidase);2、3:肽链内切酶(Endopeptidase);4:N-乙酰胞壁酸(N-acetylmuramidase);5:N-乙酰氨基葡萄糖苷酶和转糖基酶(N-acetylglucosaminidases, Transglycosylase)
2 噬菌体在动物性食品原料安全控制中的应用
2.1 噬菌体控制水生动物的细菌
水产养殖业是世界上发展最快的行业之一,在国民经济中发挥着非常重要的作用[22]。随着大规模高密度集约化养殖模式的发展,许多与水产动物疾病相关的问题逐渐暴露出来,制约了水产养殖业的稳定发展。目前,控制细菌性疾病主要依赖抗菌药物,但原农业部批准生产和使用的水产养殖用抗菌药物种类较少,而且抗菌药物的不合理使用不仅会导致细菌的耐药性增强,还会带来环境污染与药物残留等问题,因此寻找绿色环保的方法控制水产养殖中的细菌性病害成为当务之急,噬菌体治疗因此成为人们采用的方法之一[23-24]。同时相关研究表明,噬菌体对水生动物中的弧菌、假单胞菌、爱德华氏菌、链球菌、柱状黄杆菌等多种致病菌有较好的防治效果。表1总结了噬菌体疗法在水产品的部分代表性致病菌防治中的应用。
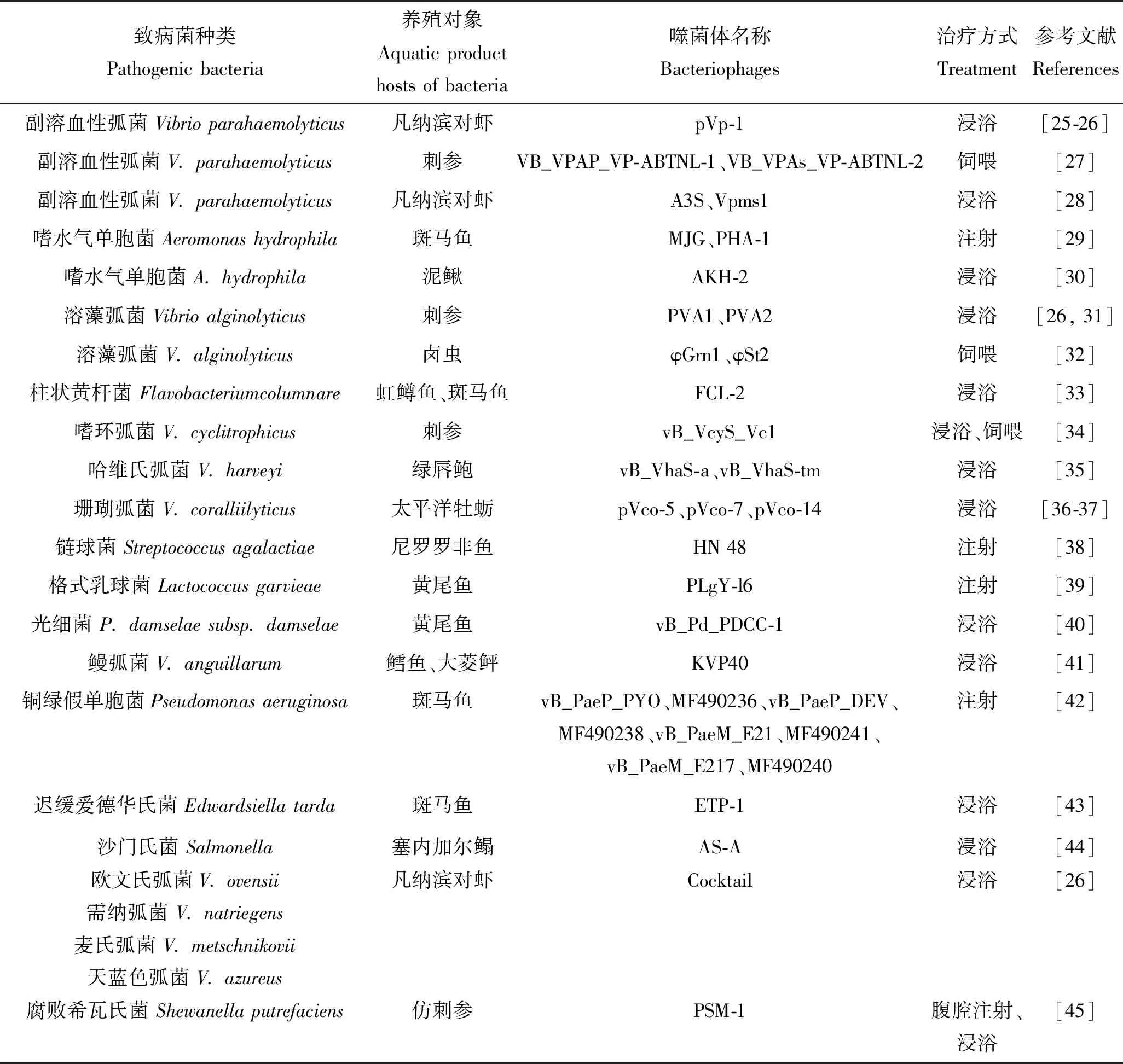
表1 噬菌体在水产品养殖领域的应用Tab.1 The application of bacteriophage in aquaculture
2.1.1 噬菌体控制溶藻弧菌
溶藻弧菌是海洋环境中常见的一种嗜盐性的致病性弧菌,可引起虾、鱼、牡蛎(Ostreidae)、海参等感染发病,导致发病动物死亡。Zhang等[31]利用浸浴的方式研究混合噬菌体对刺参(Apostichopusjaponicus)的治疗效果,结果显示,感染复数分别为10.0、1.0和0.1的混合噬菌体浸浴过的刺参存活率分别为73%、50%和47%(n=30),高于没有噬菌体的对照组(3%,n=30),与强霉素和卡那霉素处理组的存活率(80%和47%)没有显著差异。毕晓泽[46]用浸浴的方式评价溶藻弧菌噬菌体制剂(4.32×107CFU/mL 噬菌体、0.125 mg/mL大蒜素、2.5 mmol/mL NaCl、5.0 mmol/mL MgCl2)对大菱鲆(Scophthalmusmaximus)弧菌病的治疗效果。结果表明,噬菌体制剂处理的大菱鲆的存活率(70.00%,n=10)高于单一噬菌体处理组(53.33%,n=10)和大蒜素处理组(40.00%,n=10)。说明噬菌体制剂比单一噬菌体或大蒜素对感染溶藻弧菌的大菱鲆治疗效果更显著。
2.1.2 噬菌体控制副溶血性弧菌
副溶血性弧菌是一种对人和海洋动物均有致病性的革兰氏阴性菌,能够导致鱼、虾、牡蛎等水生动物患病,给水产养殖业造成巨大经济损失,如由副溶血性弧菌引起的对虾急性肝胰腺坏死病(AHPND)一直是东南亚和拉丁美洲对虾(PenaeusOrientalis)养殖中最棘手的疾病之一[25]。食用了该菌污染的食品还可能引起腹泻、呕吐等症状,给食品安全和消费者身体健康带来隐患。Zhang等[47]研究了噬菌体OMN对牡蛎(Crassostreahongkongensis)中副溶血性弧菌的防控效果表明,应用噬菌体OMN处理48 h、72 h后,牡蛎表面的副溶血性弧菌分别减少90%和99%。胡蝶等[48]将质量分数为1.0 g/kg 的噬菌体微胶囊混于方斑东风螺(Babyloniaareolata)的饵料中,经饲喂后,东风螺肠道宿主菌平均减少96%,水体中宿主菌平均减少72%;将质量分数为1.5 g/kg的噬菌体微胶囊加入凡纳滨对虾(Penaeusvannamei)饵料中,经饲喂后,对虾肠道宿主菌平均减少86%,水体中宿主菌平均减少68%。Mateus等[22]评估了3株噬菌体混合物(VP-1、VP-2和VP-3)及单一噬菌体防控副溶血性弧菌的效果。结果表明,单一噬菌体VP-1、VP-2和VP-3及噬菌体“鸡尾酒模式”都可以降低副溶血性弧菌的数量,且与单独使用VP-3和噬菌体“鸡尾酒”的效果相似,说明单一噬菌体及其“鸡尾酒模式”对副溶血性弧菌均具有较好的防控效果。
2.1.3 噬菌体控制哈维氏弧菌
哈维氏弧菌也是一种水生动物致病菌,其可以引起对虾的发光弧菌病等。Vinod等[49]采用浸浴的方式研究哈维氏弧菌噬菌体治疗斑节对虾(Penaeusmonodon)中的发光弧菌病。结果显示,噬菌体治疗组中斑节对虾的存活率(70%、80%)高于对照组(25%);田间试验表明,对于自然爆发的发光弧菌病,噬菌体处理可提高幼虾的存活率,减少孵化池中哈维氏弧菌的数量。Wang等[35]研究噬菌体治疗澳大利亚绿边鲍(Haliotislaevigata)感染哈维氏弧菌的效果,结果表明噬菌体处理组鲍的存活率高于对照组。Karunasagar等[50]用噬菌体(Viha10、Viha8)和抗菌药物治疗幼虾,噬菌体治疗组的存活率(86%、88%)高于抗菌药物治疗组(65%、68%)。
2.1.4 噬菌体控制腐败希瓦氏菌
噬菌体也可用来防控水生动物中的腐败菌。腐败希瓦氏菌是水产品中的特定腐败菌,抑制腐败菌的生长可以防止水产品腐败。吕孙建等[51]采用滴注法观察宽谱噬菌体NTHP01噬菌效果,结果显示,NTHP01能够有效抑制水产养殖中的大多数致病菌,如副溶血弧菌、嗜水气单胞菌、温和气单胞菌、变形假单胞菌、溶藻弧菌、迟缓爱德华氏菌等,尤其对温和气单胞菌、腐败希瓦氏菌的裂解能力最强。宋亚雄[45]研究了噬菌体PSM-1防治仿刺参中希瓦氏菌的能力。结果显示,噬菌体PSM-1腹腔注射组可将仿刺参的存活率从0%提升至80%以上,浸浴组可将仿刺参的存活率从0%提升到60%以上。两组实验在最佳给药时间和最高给药浓度时,对仿刺参保护率均高于90%。
2.2 噬菌体治疗陆生动物的致病菌
噬菌体治疗也可作为控制陆生动物细菌感染的一种方式。早在1919年,噬菌体即被用来控制沙门氏菌的感染。利用噬菌体控制陆生动物细菌性疾病的研究主要集中在噬菌体的治疗方式上,通过优化抗菌策略,防止或减少陆生动物疾病或病原体的传播。大肠杆菌、沙门氏菌、弯曲杆菌、金黄色葡萄球菌是陆生动物4种主要的致病菌[52]。表2总结了噬菌体在预防上述4种细菌引起的陆生动物疾病方面的相关研究。
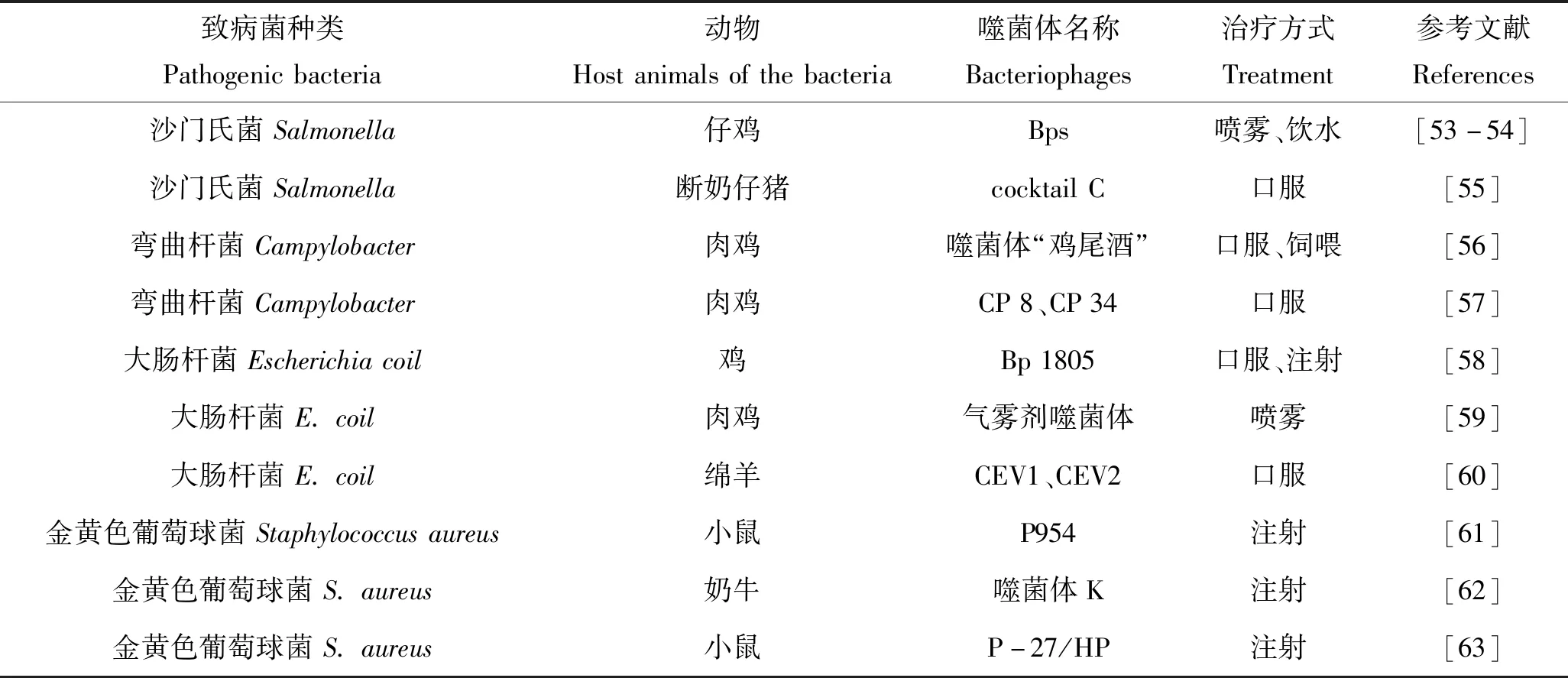
表2 噬菌体在陆生动物致病菌防治中的应用Tab.2 The application of bacteriophage in pathogens control of land animals
2.2.1 噬菌体控制大肠杆菌
大肠杆菌是养殖业常见的条件致病菌之一,可以导致家禽死亡,给畜牧业造成严重的经济损失[64]。李敏等[65]以1日龄罗曼鸡为实验对象探索噬菌体BP16的防治效果。结果显示,雏鸡感染大肠杆菌前6 h使用噬菌体能有效预防大肠杆菌病,在感染时至感染后6 h内使用噬菌体,能有效治疗大肠杆菌病,且噬菌体治疗效果优于氟苯尼考。Guo等[66]也证实了噬菌体能有效治疗大肠杆菌病,连续3天向感染后的奶牛乳房内分别注入噬菌体混合物或抗生素,结果表明,噬菌体混合物可显著减少细菌和体细胞中炎症因子的数量,缓解奶牛乳房炎的症状,达到与抗生素相同的治疗效果。在实验的第6天,抗生素组和噬菌体组几乎检测不到细菌。反刍动物肠道中的大肠杆菌O157∶H7在屠宰期间可能会污染肉类。虽然噬菌体可以通过直接给药、口服治疗的方式对反刍动物进行治疗,但研究发现口服治疗可能会降低噬菌体的数量[1]。主要原因可能有:噬菌体可能与胃肠道或瘤胃中的物质发生非特异性结合,接触胃酸时失去活性,口服的噬菌体到达胃肠道中数量减少。Stanford等[67]研究将噬菌体包裹在甲基丙烯酸酯聚合物中制成胶囊丸剂,可在低pH时保护噬菌体,并且口服这种胶囊丸剂后排出的粪便中含有的大肠杆菌数量显著减少。
2.2.2 噬菌体控制沙门氏菌
沙门氏菌是普遍公认的食源性致病菌,人感染沙门氏菌主要是食用了该菌污染的动物性食品(鸡蛋、禽肉等)所致。据疾病预防控制中心(Centers for Disease Control and Prevention, CDC)统计,2002—2017年,韩国报道的4 265例食源性疾病事件中约9.3%是由沙门氏菌引起的[52]。王曦等[68]用粪便移植和噬菌体混合物联合的方法对被沙门氏菌感染的SPF雏鸡进行治疗,雏鸡的死亡率降低、肠道炎症损伤症状得到缓解。Kumar等[69]研究噬菌体NINP13076对小鼠体内沙门氏菌的作用效果及对肠道菌群的影响。结果表明,小鼠连续5 d口服沙门氏菌噬菌体NINP13076后,肺、肾、心、肝、肠等重要脏器未见明显病理变化,并且典型的益生菌菌群的生长即使在与沙门氏菌噬菌体孵育至24 h后仍然不受影响。Hong等[70]利用噬菌体PA13076在小鼠模型中进行测试,与对照组相比,经过噬菌体治疗的小鼠体内多个组织和器官中的沙门氏菌浓度显著降低,小鼠的存活率与噬菌体浓度呈正相关。
2.2.3 噬菌体控制弯曲杆菌
弯曲杆菌是革兰氏阴性菌,其存在于家禽和牛的肠道中,是最常见的人畜共患病原菌。人感染弯曲杆菌主要是摄入受污染的食物如牛奶、生肉和饮用水等。弯曲杆菌每年给农业、食品工业等造成巨大经济损失,但噬菌体疗法可防控家禽感染弯曲杆菌。D′Angelantonio等[71]研究了噬菌体(Φ16-izsam和Φ7-izsam)对肉鸡肠道中弯曲杆菌的抑制作用,在屠宰前24 h,将最佳感染复数(Optimal Multiplicity of Infection, MOI)为0.1和1.0的噬菌体(Φ16-izsam和Φ7-izsam)使用两步噬菌体给药的方式对空肠中的弯曲杆菌进行控制,感染的肉鸡中细菌减少了1~2个数量级,这说明噬菌体可以控制肉鸡中感染的弯曲杆菌。Carla等[56]通过口服和饲喂两种方式评估了噬菌体对弯曲杆菌的控制效果,结果显示,口服灌胃和将混合噬菌体添加至雏鸡的食物中进行饲喂这两种方式都能够降低雏鸡的弯曲杆菌数量。然而,当饲喂噬菌体“鸡尾酒”时,弯曲杆菌的数量比口服灌胃的方式显著降低。说明噬菌体可能受到胃酸的影响,导致噬菌体的活性下降。
2.2.4 噬菌体控制金黄色葡萄球菌
金黄色葡萄球菌是引起奶牛乳房炎的致病菌,制约着乳业的发展。严亚贤等[72]模拟环境观察抑制金黄色葡萄球菌的能力。结果显示,事先经过噬菌体喷雾处理后的平板上,金黄色葡萄球菌的数量减少,甚至没有生长。说明噬菌体可以作为环境消毒剂抑制环境中的金黄色葡萄球菌。Shetru等[73]研究了噬菌体ΦDMSA-2对金黄色葡萄球菌的抑制作用。结果表明,用噬菌体ΦDMSA-2处理的小鼠表现出更快的上皮再形成和更快的组织重塑。在所有噬菌体处理组中,感染组织中的细菌数量都减少了,并使小鼠100%存活。涂尊方等[74]的动物实验证实,噬菌体PhMASA-WJ对小鼠无毒副作用,败血症小鼠经噬菌体PhMASA-WJ治疗后存活率为60%,对照组全部死亡,噬菌体PhMASA-WJ治疗显著提高了小鼠的存活率。
2.3 噬菌体在食品中的应用
由食源性致病菌引起的食品安全问题越来越受消费者关注。热杀菌这种传统的杀菌方式并不适合于所有食品,并且对食品的感官和营养价值有影响;防腐剂的使用虽然能有效延长食品保质期,但滥用的问题层出不穷。为了满足消费者对含更少化学防腐剂、更高质量食品的需求,噬菌体这种高效、无残留、发展前景良好的生物灭菌剂成为了研究热点。噬菌体能降低致病菌污染风险、延长食品保质期,在保障食品的质量与安全方面具有较好潜力。

表3 噬菌体在食品中的应用Tab.3 The application of bacteriophage in food
2.3.1 噬菌体对食品原料中病原菌的控制
肉类食品在生产过程中极易受到多种致病菌的污染。Sun等[88]研究了冷藏羊肉中噬菌体PSDA-2对沙门氏菌的控制效果。结果表明,与无噬菌体的对照相比,在感染复数分别为100和10 000时,噬菌体PSDA-2可将4 ℃下的羊肉中的沙门氏菌分别减少1.7 lg CFU/mL和2.1 lg CFU/mL。Dewanggana等[89]探索了噬菌体在控制各种食品中产肠毒素大肠杆菌(ETEC)中的应用,不同孵化时间(1 d和6 d)的噬菌体DW-EC显著降低了鸡肉(80.93%、87.29%)、鱼肉(63.78%、87.89%)两种不同食品样品中的ETEC种群数量。郑小双等[90]用副溶血性弧菌模拟污染黄鱼(Pseudosciaenacrocea)片来研究噬菌体VppMIX的抑菌效果,结果显示在25 ℃恒温保藏12 h后,不同剂量噬菌体VppMIX处理的黄鱼样品中副溶血性弧菌数量比对照组降低了1.41~4.98 lg CFU/g。杨振泉[91]用噬菌体SPMIX3-156来控制鲶鱼(Ictaluruspunctatus)中的腐败希瓦氏菌的生长,结果显示噬菌体SPMIX3-156可防控冷冻鱼片中的腐败希瓦氏菌的数量。同时,他筛选的噬菌体SppYZU05可作为食品添加成分或生物保鲜剂抑制食品生产过程和贮藏中的腐败希瓦氏菌[92]。
2.3.2 噬菌体对乳及乳制品中病原菌的控制
经巴氏杀菌的乳及乳制品中仍然存在病原菌。Bao等[93]用沙门氏菌噬菌体PA13076和PC2184的混合物探索其对沙门氏菌的控制效果。结果显示,4 ℃处理5 h后,巴氏杀菌奶中沙门氏菌数减少了1.5~4.0 lg CFU/mL。李虹娇等[94]用噬菌体TBC-1对牛乳和乳粉中的阪崎肠杆菌ATCCBAA894和ATCC25944进行控制。结果显示,室温25 ℃培育3 h,在MOI为106时,能将牛乳中102CFU/mL的阪崎肠杆菌抑制到检出限以下;在25 ℃与37 ℃温度下分别培育3 h,乳粉中的阪崎肠杆菌ATCCBAA894菌量都减少到检出限以下,在25 ℃培育3~12 h,乳粉中阪崎肠杆菌ATCC25944菌量均在检出限以下。可见,噬菌体TBC-1对牛乳与乳粉中两种阪崎肠杆菌均有良好的抑制作用。蔡天舒等[95]研究噬菌体qdsa001在牛奶中的抑菌作用。结果显示,4 ℃和37 ℃牛奶中的金黄色葡萄球菌的数量均降低。说明噬菌体可应用于抑制乳品中金黄色葡萄球菌的生长,对乳制品生产过程中控制金黄色葡萄球菌具有重大意义。
2.3.3 噬菌体对即食食品中病原菌的控制
即食(Ready to Eat, RTE)食品是指无需第二次加热可立即食用的食品。RTE食品在加工、包装、配送过程中极易受病原菌污染,储存条件不当导致细菌增殖,会引发食源性疾病。Guenther等[96]使用宽宿主谱沙门氏菌噬菌体FO1-E2防控多种RTE食品中鼠伤寒沙门氏菌的污染,如热狗、炸鸡、海鲜、巧克力牛奶及蛋黄等,8 ℃时,噬菌体处理6 h,可将沙门氏菌数量降低到检测限以下,其中15 ℃时巧克力牛奶和炸鸡中沙门氏菌数量降低得最多,其次是热狗和海鲜。You等[97]研究了噬菌体VPT02对即食生鱼片中副溶血性弧菌的抑制效果,当噬菌体VPT02感染复数为10时,与对照相比,噬菌体VPT02使副溶血性弧菌减少3.9个数量级,表明噬菌体VPT02有抑菌的潜力。袁琳等[98]研究了噬菌体SHOU24对即食对虾中副溶血性弧菌的抑制效果。结果表明,经噬菌体处理的副溶血性弧菌的生长延滞期增长了4.04 h,噬菌体在常温条件下能使即食虾中副溶血性弧菌的浓度下降1个数量级。噬菌体SHOU24可显著降低即食对虾中的副溶血性弧菌数量。
3 噬菌体治疗的优势及面临的挑战
抗菌药物是一种可以针对细胞壁合成或蛋白质合成等生理过程进行选择性破坏的化学物质,而裂解性噬菌体则是对病原菌进行特异性结合而将其杀灭。噬菌体治疗就是利用裂解性噬菌体的特性治疗细菌性疾病。噬菌体与抗菌药物相比有许多优势:一是噬菌体分离相对快速、简单、廉价,但若考虑噬菌体的裂解性能、广谱范围和非转导性就比较耗时。二是噬菌体产生抗性的速度慢。三是特异性高。噬菌体以宿主菌的细胞壁受体为靶标,不影响其他的微生物群,而抗菌药物可能会损害或干扰正常微生物群。四是固有毒性低。噬菌体是由核酸和蛋白质组成,毒性低。五是宿主菌密度极低时,噬菌体仍能够继续复制增殖。六是噬菌体能够适应不断变化的环境条件。七是可以破坏细菌的生物膜。八是噬菌体一般能够承受食品加工环境的条件。
噬菌体治疗可以防治细菌引起的感染,但在实际的应用过程中也面临着许多问题,例如噬菌体治疗细胞内病原体作用有限;噬菌体中含有一些大分子蛋白,给病人用高浓度的噬菌体或反复使用同一种噬菌体时,可能会引起极端反应,如过敏反应等[99];烈性噬菌体和温和噬菌体都可能会携带毒力基因或耐药性编码基因,可能会通过一般或特殊的转导机制增加宿主菌毒性或产生新型致病菌株,如CTXΦ噬菌体通过转移产生毒素的毒力因子,增强了霍乱弧菌的毒力等[100];宿主菌在噬菌体存在的生存压力下会发生突变,有可能产生抗噬菌体菌株。噬菌体治疗在养殖业的应用需更深入的研究,以提高噬菌体治疗的效率。噬菌体的特异性通常被认为是噬菌体的优势特征,但在治疗时可能会成为弊端;再者噬菌体治疗可能会受到治疗方式、动物健康状况等条件的影响;在动物模型中饲喂噬菌体不足或过量,动物可能不会产生任何反应等。因此,噬菌体在食用动物致病菌控制中的广泛应用仍然需要深入的研究。
4 结语与展望
本研究总结了噬菌体在动物源性食品中致病菌控制方面的研究进展,同时分析了噬菌体治疗的优势与存在的问题。可以看出,噬菌体完全取代抗菌药物治疗食用动物中致病菌引起的感染还需要更多的研究以解决目前存在的问题,比如还未形成噬菌体作为生物防治剂的标准化方法、缺乏相应的法律法规、噬菌体应用的可操作性和实用性仍有待提高以及噬菌体在临床的应用需要获得监管部门的批准等。另外,由于噬菌体的病毒属性,并没有被广大民众完全接受。“在食品上喷洒病毒”的想法可能会引起消费者的抵制,因此,目前中国还未批准任何噬菌体成为食品添加剂。需要加大对公众和食品加工者关于噬菌体的安全性、有效性和广泛性等方面的宣传。细菌对噬菌体产生抗性的问题可以通过研发多种噬菌体混合而成的“鸡尾酒”模式减缓产生抗性的速度,噬菌体宿主谱窄的问题可通过基因编辑噬菌体,拓宽噬菌体的宿主谱,赋予噬菌体多种特性。在噬菌体安全方面,可研发噬菌体的蛋白产品如酶制剂进行解决。
任何抗菌策略都存在利与弊,噬菌体具有特异性高、自我增殖快、分离周期短、绿色环保等抗菌药物无法比拟的优点,可作为一种有潜力的生物防治剂。随着分子生物学、基因工程技术、合成生物技术的发展与成熟及对噬菌体研究的深入,噬菌体治疗的效率将会提高;研究噬菌体与宿主菌相互进化的机制,观察细菌是如何进化对噬菌体产生抗性的,从而进一步保证噬菌体的安全性,相信今后随着噬菌体控制致病菌技术的不断完善,噬菌体的商业化应用终将实现,最终可以替代抗菌药物来控制食用动物中的致病菌,成为保障人类健康和食品安全的手段之一。
