糖尿病对心肌细胞钠离子流的影响
2023-01-09李烽钱玲玲王如兴
李烽 钱玲玲 王如兴
研究发现糖尿病(diabetes mellitus,DM)可致多种心律失常,包括房性心律失常、室性心律失常甚至猝死等恶性心律失常[1-2]。DM 致心律失常的相关机制复杂多样,主要涉及心肌电重构、心肌结构重构、心脏自主神经功能紊乱及炎症氧化应激等[3-4]。其中,心肌电重构是以心肌细胞跨膜离子流紊乱为主要特征的心律失常病理改变,探究DM 致心肌细胞离子流改变对阐明DM 致心律失常的发生及发展具有重大意义。近年来,越来越多研究发现DM 在致钠离子流异常的过程中扮演着重要角色,可显著促进DM 相关心律失常的发生及发展。笔者主要综述DM 与心室肌细胞、心房肌细胞及转基因细胞系钠离子流的相关研究,探讨控制血糖及心肌细胞钠离子流异常对预防和减少心律失常发生的临床意义,并做相关展望。
1 心肌细胞钠离子流简介
钠离子流是心肌快反应细胞的特征电流。当心肌细胞兴奋达到阈电位后,由SCN5A编码的钠通道迅速开放,从静息态进入激活态,大量钠离子内流形成动作电位的0期,此时形成的钠离子流又称峰钠电流;此后钠通道迅速关闭转为失活态(图1A)[5]。研究发现,部分钠离子通通道在失活后仍可进入开放或重新开放状态,从而在动作电位平台期,可以出现少量(0.5%~1%峰钠电流)钠离子内流,即晚钠电流,它可以在动作电位复极过程中持续数百毫秒(图1B、C)[6]。此外,钠通道激活曲线和失活曲线重叠部分的区域称为钠窗电流,其在晚钠电流的形成中发挥着重要作用(图1D)[7]。
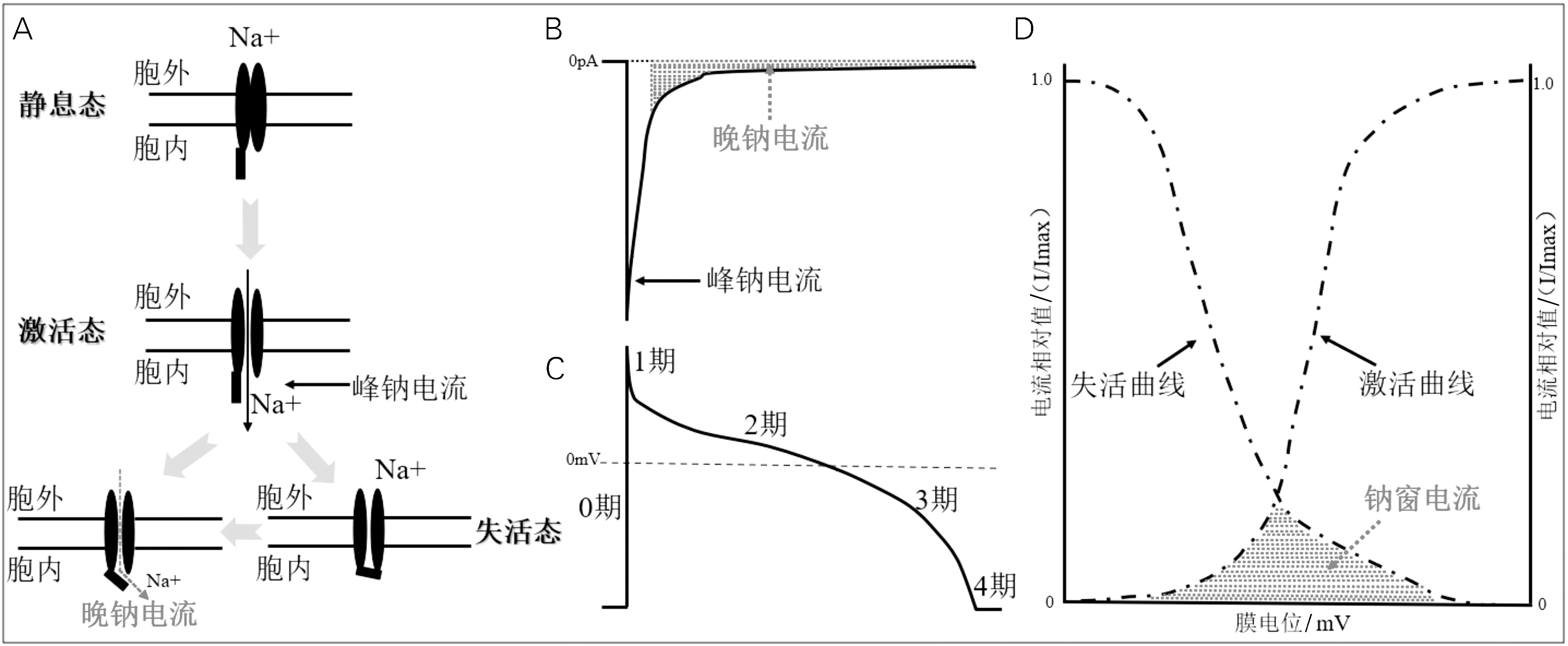
图1 心肌快反应细胞钠通道电生理相关示意图
2 DM 与心室肌细胞钠离子流
大量研究发现,DM 可致心室肌细胞峰钠电流密度降低。Bilginoglu等[8]采用链脲佐菌素(streptozotocin,STZ)(50 mg/kg,静脉注射)构建DM 大鼠模型,7~8周后行心室乳头肌组织块的动作电位研究,发现与正常组相比,DM大鼠心室乳头肌静息电位、超射和半最大去极化速度均降低[(-74.8±1.6)m V vs(-80.2±1.2)m V;(5.1±1.5)m V vs(8.4±1.2)m V;(28.8±0.8)V/s vs(53.8±1.9)V/s,P<0.05]。全细胞膜片钳记录钠离子流发现,DM 大鼠心室肌细胞峰钠电流的密度虽轻度降低,但差异具有统计学意义[(-35.3±0.9)p A/p F vs(-40.9±0.9)p A/p F,P<0.05;刺激电压-45 m V,电极外液含40 mmol/L Na+];同时,DM大鼠心室肌细胞钠通道的稳态激活和失活曲线均向去极化方向右移(平均右移幅度分别为6.2 m V 和6.4 m V)。研究提示峰钠电流密度及动作电位相关参数降低可能与心室肌细胞钠通道的激活和失活的同时抑制有关。此后,Stables等[9]构建四氧嘧啶(140~160 mg/kg,静脉注射)诱导的DM兔模型,21周后,应用光学标测发现,与正常组相比,DM 兔心肌细胞动作电位复极70%的时程(action potential duration at repolarization of 70%,APD70)未发生明显改变[(150.8±2.4)ms vs(150.0±2.4)ms,P>0.05],而 传 导 速度显著降低[(0.385±0.006)m/s vs(0.464±0.016)m/s,P<0.05]。心肌细胞膜片钳实验显示,DM 兔心室肌细胞峰钠电流密度显著下降[(-15.42±1.17)p A/p F vs(-22.59±1.83)p A/p F,P<0.05;刺激电压-40 m V,电极外液含5 mmol/L Na+],下降幅度高达32%。与Bilginoglu等[8]研究不同的是,钠电流的门控动力学参数(包括稳态激活、稳态失活以及失活后恢复)未发生明显改变。此外研究者对钠通道进行分子生物学研究发现,DM 兔心肌细胞钠通道的基因表达及蛋白表达均未发生明显改变(P>0.05)。最终研究者借助Luo-Rudy离子模型进行计算机模拟研究提示峰钠电流密度显著下降是DM 兔心室传导受损的关键因素。然而,研究者强调,由于光学标测仅反映心脏浅表组织的电生理特性以及多种因素影响心肌传导速度(包括钠离子流、缝隙连接电导性、内向整流钾离子流及心肌纤维化等),因此上述结论尚需开展深入研究进一步证实。近期,Li等[10]对白介素-17A(interleukin-17A,IL-17A)基因敲除小鼠及野生型小鼠采用STZ(50 mg/kg)腹腔注射的方式诱导DM 小鼠模型,12周后,行心室肌组织光学标测及心室肌细胞膜片钳研究发现,与IL-17A基因敲除的DM 小鼠相比,野生型DM 小鼠心肌细胞APD显著延长(P<0.05);同时,野生型DM 小鼠心室肌细胞峰钠电流密度下降,SCN5A基因表达及钠通道蛋白(NaV1.5)表达显著下调(P<0.05),提示IL-17A 表达上调可能是显著增加DM 小鼠心肌细胞电生理紊乱的重要原因。此外,野生型DM 小鼠心室肌细胞钠通道稳态激活、稳态失活以及失活后恢复等门控动力学并未发生明显改变(P>0.05)。
然而,部分研究提示DM 对心室肌细胞峰钠电流无影响。Chattou等[11]采用STZ(40 mg/kg)静脉注射的方式诱导DM 大鼠模型,3~4周后,给予心室肌细胞刺激频率0.2 Hz、钳制电压-100 m V、刺激电压维持2 s或3 s的方案激发钠电流,结果发现,与膜电容大小相似的正常组心肌细胞相比,DM 大鼠心肌细胞钠离子快衰减的电流幅度大小未发生改变[(-3.4±0.3)n A vs(-3.1±0.2)n A,P>0.05],研究者推测DM 大鼠心室肌峰钠电流无变化可能与造模时间较短有关。此后,Axelsen 等[12]建立高脂高糖诱导的2 型DM 前期大鼠模型,延长造模时间至6周,发现大鼠体表心电图QRS波增宽[(16.1±0.51)ms vs(14.7±0.32)ms,P<0.05],且心室肌光学标测提示DM 大鼠心肌传导速度显著降低[(0.62±0.02)m/s vs(0.79±0.06)m/s,P<0.05],而细胞电生理研究提示DM 大鼠钠通道电流密度未发生明显改变(P>0.05)。因此研究者推测2型DM 前期可无钠通道功能改变。
此外研究提示,DM 可改变心室肌细胞晚钠电流的大小。由于晚钠电流幅度过小,直接比较误差较大,Chattou等[11]采用藜芦碱(100 mg/m L,一种减慢钠电流衰减的生物碱)诱导后比较晚钠电流的大小,结果发现,与正常组相比,DM 大鼠心室肌细胞藜芦碱诱导的晚钠电流显著降低。同时开展通道动力学研究发现,藜芦碱诱导的晚钠电流衰减特征呈双指数分布,且DM 大鼠心室肌细胞的晚钠电流快失活常数显著减小(P<0.05,刺激电压范围为-60~-20 m V)。研究者认为,与正常组相比,DM 致晚钠电流降低可能与DM 大鼠心室肌细胞对藜芦碱具有较低的敏感性有关,并强调仍需重复上述研究或更换评估晚钠电流的方案进一步证实该研究结论。此后,Lee等[13]构建STZ(65 mg/kg,腹腔注射)诱导的DM 大鼠模型,应用电压钳Step/Ramp 方案(室温下,钳制电压设定-100 m V,刺激电压为+20 m V 维持100 ms,而后在大于100 ms的过程中,刺激电压逐渐回到-100 m V),并测量河豚毒素(TTX)30μmol/L 处理前后电流下降幅度来衡量晚钠电流的大小,结果提示,DM 大鼠心室肌细胞晚钠电流密度显著增大[(-0.67±0.07)p A/p F vs(-0.49±0.04)p A/p F,P<0.05],研究者认为,联合使用多种晚钠电流刺激方案可有利于提高判断DM 致心室肌晚钠电流改变的准确性。
综上所述,DM 可致心室肌钠离子流异常。然而由于研究模型、时间及方案尚不统一,因此关于DM 致心室肌钠离子流改变仍存在争议。
3 DM 与心房肌细胞钠离子流
DM 致心房肌钠离子流异常,可引起心电图P 波增宽,促进心房颤动(简称房颤)的发生。多数研究提示,DM 可致心房肌峰钠电流降低。Liu等[14]构建四氧嘧啶(150 mg/kg,静脉注射)诱导的DM 兔模型,8周后,发现心房肌细胞峰钠电流显著降低(P<0.05)。Jin等[15]构建STZ(55 mg/kg,腹腔注射)诱导DM 小鼠模型,12周后发现,与对照组相比,DM 小鼠房颤的诱发率显著增加(100%vs 0%,P<0.05)。Langendorff灌流法分离心房肌细胞行膜片钳研究发现,DM小鼠心房肌细胞APD90显著延长(平均值可超过300 ms)且伴有超射幅度的显著降低(P<0.05)。进一步研究发现,心房肌细胞的峰钠电流显著降低(P<0.05),这与测得动作电位超射幅度降低相一致。然而研究者并未对心房肌细胞钠通道的门控动力学参数进行测定,因此尚需开展相关研究深入探讨DM 模型造模12周后小鼠心肌细胞钠通道的功能改变以及其在房性心律失常中的作用。此外,Polina等[16]急性分离16~22周龄1型DM 秋田鼠心房肌细胞,并行全细胞膜片钳研究发现,与野生型小鼠相比,1型DM 秋田鼠左心房心肌细胞的动作电位延长[APD90,(55.5±4.5)ms vs(36.4±2.6)ms,P=0.001],伴有最大除极速度的降低[(141.2±5.8)V/s vs(168.1±6.6)V/s,P=0.036]、钠 通 道电流密度的下降(P<0.05)。采用分子生物学深入研究发现,上述细胞电生理改变与编码钠通道的基因SCN5A下调及NaV1.5表达降低相关。此外,研究者给予DM 秋田鼠胰岛素慢性处理(对12周龄1型DM 秋田鼠胰岛素泵皮下植入,每天缓慢释放0.2U 胰岛素,连续4周)和急性处理(对16周龄1型DM 秋田鼠皮下注射胰岛素5~10U/kg)后,可上调心房肌细胞SCN5A基因及NaV1.5的表达从而逆转心房肌动作电位延长等电生理改变。研究者推测胰岛素信号通路改变在1型DM 秋田鼠致房颤中可能发挥着重要作用。
但部分研究提示DM 对心房肌峰钠电流无影响。Li等[17]联合高糖高脂饮食与STZ腹腔注射建立2型DM 大鼠模型,造模8周后,行电压钳记录显示,钠通道电流密度未发生明显改变[(-50.37±1.53)p A/p F vs(-52.08±4.04)p A/p F,P>0.05;电 极 外 液 含140 mmol/L Na+]。近 期Bohne等[18]利用16~20周龄的db/db小鼠(一种经典的2型DM 小鼠模型)研究发现,与野生型小鼠相较,db/db小鼠心房肌细胞钠通道电流-电压曲线无变化,提示db/db小鼠峰钠电流未发生改变,同时分子生物实验研究证实db/db小鼠心房肌细胞SCN5A基因及NaV1.5表达均未发生改变,这与Li等[17]研究结果相似。
目前研究发现,DM 可显著增大心房肌细胞晚钠电流。Jin等[15]构建STZ诱导DM 小鼠模型,12周后采用电压钳Step方案(钳制电压设定-100 m V,刺激电压为-20 m V 分别维持850 ms、400 ms和115 ms)记录晚钠电流,发现DM小鼠心房肌细胞晚钠电流均显著增加(P<0.05)。有趣的是,不管是急性还是慢性给予DM 小鼠晚钠电流选择性抑制剂处理(急性处理为0.2μmol/L GS967孵育急性分离的DM小鼠心房肌细胞,慢性处理为给予DM 小鼠连续6天0.069 mg/kg GS967腹腔注射),均可显著抑制DM 小鼠心房肌细胞晚钠电流的增加,同时可显著降低房颤的诱发率(14.3%vs 100.0%,P<0.05)。研究者强调DM 致小鼠心房肌细胞晚钠电流的增加在易化房颤的发生中发挥着关键的作用,同时该结果也为实现控制心肌细胞钠离子流异常而减少心律失常的发生提供重要理论基础。Bohne等[18]发现16~20周龄的db/db小鼠,其心房肌细胞钠电流的激活曲线无变化,而失活曲线显著右移,致激活曲线和失活曲线重叠部分增宽,提示db/db小鼠心房肌细胞钠通道失活发生减缓,致钠窗电流增大、晚钠电流增大可能。
4 糖尿病与转染基因细胞系的钠离子流
转染基因的细胞系因具有易于培养、保存时间长、便于机制探索等优势而广泛应用于心脏细胞电生理研究[19],常用的细胞系包括人胚肾(HEK293)细胞、中国仓鼠卵巢(CHO)细胞及诱导多能干细胞分化的心肌细胞(iPSC-CMs)等。目前研究发现,高糖可降低转染钠通道基因细胞系的钠离子流。
Yu等[20]对转染NaV1.5基因的HEK-293T 细胞进行膜片钳研究发现,与正常糖组(5.5 mmol/L)相比,高糖(25 mmol/L)处理的HEK-293T 细胞峰钠电流密度显著降低[(-198.74±20.44)p A/p F vs(-238.58±37.26)p A/p F,P<0.05],而晚钠电流密度未发生明显改变[(-4.68±0.45)p A/p F vs(-3.85±0.66)p A/p F,P>0.05]。Khazraei等[21]对转染SCN5A基因的HEK293 细胞行高糖(25 mmol/L)和正常糖培养18~20 h,行全细胞膜片钳探究钠电流的门控动力学参数,结果发现,与正常糖培养相比,高糖培养的HEK293的半激活电压未发生明显改变[(-38.4±0.6)m V vs(-37.7±0.8)m V,P>0.05],而半失活电压显著降 低[(-102.9±0.7)m V vs(-91.6±1.0)m V,P<0.05]。研究提示高糖环境可在不改变钠通道激活功能的情况下,显著增加其失活功能,从而导致峰钠电流降低。
Fouda等[22]对转染编码NaV1.5蛋白cDNA 的CHO 细胞及iPSC-CMs行24 h炎性介质或100 mmol/L 葡萄糖孵育,全细胞膜片钳记录发现,与未行炎性介质或葡萄糖孵育的对照组相比,孵育24 h炎性介质或100 mmol/L 葡萄糖CHO 细胞及iPSC-CMs的钠通道激活曲线及失活曲线均向右移[半激活电压:炎性介质孵育后为(-22.3±2.4)m V 和100 mmol/L葡萄糖孵育后为(-16.6±2.8)m V;对照组为(-36.2±1.6)m V,P<0.05。半失活电压:炎性介质孵育后为(-77.1±1.7)m V 和100 mmol/L 葡 萄 糖 孵 育 后 为(-61.7±2.6)m V;对照组为(-90.9±1.8)m V,P<0.05],而峰钠电流密度未发生明显变化改变[炎性介质孵育后为(-761.8±36.1)p A/p F 和100 mmol/L 葡 萄 糖 孵 育 后 为(-899.9±115.7)p A/pF;对照组为(-836.2±83.1)p A/pF,P>0.05]。同时研究者采用电压钳Step方案(钳制电压设定-130 m V,刺激电压为0 m V 分别维持200 ms或50 ms)记录晚钠电流,结果发现,经炎性介质或100 mmol/L 葡萄糖孵育后,晚钠电流显著增大[晚钠电流占峰钠电流百分比:炎性介质孵育后为(3.64±0.23)%和100 mmol/L 葡萄糖孵育后为(6.86±0.17)%;对照组为(0.80±0.05)%,P<0.05]。此外研究者采用蛋白激酶A 和C 的激动剂[CPT-c AMP(1μmol/L孵育20 min)和PMA(10 nmol/L 孵育20 min)]孵育CHO 细胞模拟激活炎症反应的过程可促进上述细胞电生理的异常,而采用蛋白激酶A 和C 的抑制剂[H-89(2 μmol/L孵育20 min)和Gö6983(1μmol/L孵育20 min)]孵育CHO 细胞模拟抑制炎症反应的过程可缓解上述细胞电生理的异常,因此提示炎症在高糖诱导的钠通道功能紊乱中可能发挥着重要作用。
5 总结和展望
尽管大量研究表明DM 可致心肌细胞钠离子流异常,但其内在机制仍不完全清楚。DM 状态下心肌细胞钠通道基因和蛋白表达改变及钠通道门控动力学异常等诸多问题仍有待进一步研究。但已得到公认的是通过控制DM 及心肌细胞钠离子流紊乱能显著预防和减少心律失常发生,对改善DM 患者的预后具有重大意义。
近年来表观遗传学修饰(包括DNA 甲基化、组蛋白修饰及非编码RNA 等)在心血管疾病领域的机制研究中发挥着至关重要的作用[23]。研究发现,疾病状态下表观遗传学修饰可显著影响心肌细胞相关离子通道基因的表达,从而诱发和促进心律失常的发生及发展[24]。然而,目前鲜有DM 状态下表观遗传学修饰对心肌细胞钠离子流影响的相关研究,因此有望借助生物信息学、分子生物学理论及转染基因的细胞系等,探究表观遗传学修饰在DM 致心肌细胞钠离子流紊乱中的作用机制,为后续精准治疗提供坚实的理论基础。
血糖波动是指血糖水平在其高峰和低谷之间变化的不稳定状态。近年来越来越多的研究证实血糖波动比持续性高血糖更加促进DM 患者心血管并发症的发生和发展,控制血糖波动对减少心血管相关并发症的发生具有重要的临床意义[25-26]。然而目前尚无血糖波动状态下心肌细胞钠离子流异常的相关报道,因此仍需从分子、细胞、组织和动物整体等多个水平进行深入研究。
