白蛋白对老年大鼠全脑缺血再灌注后G 蛋白偶联受体124 表达和血脑屏障的影响
2023-01-09唐跃东谢启亮汪兰曌杨斐宇张峰周小勇申捷
唐跃东,谢启亮,汪兰曌,杨斐宇,张峰,周小勇,申捷
1. 复旦大学附属金山医院急危重病中心,上海 201508; 2. 上海市卫生健康委员会化学伤害急危重病医学重点实验室,上海 201508;3. 复旦大学化学伤害与急危重病研究中心,上海 201508
心脏骤停(cardiac arrest, CA)是较为常见的危及生命的临床急症,也是一项重要的全球公共卫生挑战。 尽管近年来心肺复苏技术逐步普及发展, CA 患者总体出院存活率仍然较低。 2020年美国院外心脏骤停(out-of-hospital cardiac arrest, OHCA)患者出院存活率仅为 10.4%[1],而我国每年近55 万例的 CA 患者的出院存活率更是不足1%[2]。 造成这一现状的根本原因是CA 后延迟复苏所导致的顽固性的神经功能障碍。 这种复苏后脑血流快速恢复,但神经功能障碍不能恢复,甚至恶化的现象被称为全脑缺血再灌注损伤 (global cerebral ischemia/reperfusion injury, GCI/RI)。 同时,高龄CA 患者比例也逐年增加,而年龄本身可能会增加老年CA 患者的死亡率[3]。
CA 后的脑水肿通常被认为是神经功能恶化的前兆,同时也是其早期干预治疗重要的参考靶点[4]。 自主循环恢复后早期的脑水肿可能反映了大脑的自我调节能力丧失以及血脑屏障完整性广泛破坏。 这种水肿常表现为一系列需要及早干预的临床症候,如颅内压升高、脑缺血、癫痫发作和弥漫性去极化所致的昏迷[5]。 其临床转归多为轻重程度不等的可逆性脑损伤甚至是不可逆转的脑死亡。 然而,迄今为止却缺乏有效的针对性治疗药物。 人血白蛋白(human serum albumin, HSA)是一种公认的神经保护剂,可以减少局灶缺血大鼠脑梗死灶面积,同时能够减轻脑水肿,从而改善脑缺血再灌注后的神经功能。 在局灶脑缺血模型中, HSA 的这种保护性一般认为与其降低血脑屏障(blood-brain barrier, BBB)通透性有关,但近来也有研究认为白蛋白会增加BBB 通透性而加重脑水肿[6-7]。 此外,年龄因素对 BBB 的通透性也存在着独立的影响。 在老年大鼠的全脑缺血再灌注损伤模型中, HSA 是否存在这种保护作用及对BBB 的作用尚未见报道。 而近年研究表明, G 蛋白偶联受体 124(G-protein-coupled receptor 124, GPR124)是脑缺血时维持血脑屏障完整性的关键分子[8-9]。 因此,通过对HSA 如何缓解老年大鼠全脑缺血再灌注引起的脑损伤及其对GPR124 表达影响的研究,从而为临床上老年CA 患者开展相关治疗研究提供参考。
1 资料与方法
1.1 材料、仪器和试剂
1.1.1 实验动物 20 周龄清洁级健康成年雄性Wistar 大鼠108 只,体质量260~300 g,购自中科院上海实验动物中心(SLAC)。 大鼠饲养条件及手术操作严格遵守复旦大学动物实验伦理学原则。
1.1. 2 主要实验仪器 荧光定量 PCR 仪(美国Roche 公司);荧光酶标仪(赛默飞世尔科技);激光共聚焦显微镜(德国徕卡公司);荧光化学发光成像系统(赛默飞世尔科技)。
1.1.3 主要试剂 伊文思蓝(生工生物工程股份有限公司); Anti-GPCR GPR124 抗体(美国 Abcam 公司); Trizol (Ambion 公司);反转录试剂盒(日本TaKaRa 公司)。
1.2方法
1.2.1 大鼠全脑缺血再灌注模型的制作 参考本实验室方法及采用改良的Pulsinelli 四血管阻断法(4-VO)构建大鼠的全脑缺血再灌注 (GCI/RI) 模型[10]。 模型构建成功的判断标准:大鼠意识丧失;角膜反射消失、双瞳孔散大固定;四肢上举,翻正反射消失;剔除癫痫样发作的大鼠。
1.2.2 动物分组及给药 (1)动物分组:取 Wistar 大鼠共计108 只按照随机数字表法分成3 组(36 只/组):1)假手术组(Sham 组);2)全脑缺血/再灌注模型组(GCI/R 组);3)HSA 治疗组(GCI/R + HSA 组)。其中Sham 组:完成切口,分离但不结扎和凝闭血管。实验组又分为缺血15 min 再灌注6、 24、 48 h 3 个时间点亚组(每亚组各6 只)。 (2)各组给药方法:假手术组(Sham 组):只做手术,不行缺血再灌注也不给予人血白蛋白治疗。 全脑缺血再灌注模型组(GCI/R组):缺血再灌注后2 h 后,立即由颈外静脉注射生理盐水(normal saline)(0.9% NaCl, 5 mL/kg); HSA 治疗组(GCI/R + HSA 组):再灌注2 h 后,立即经颈外静脉注入人血白蛋白(Grifols Biologicals, Los Angeles,USA; 25% solution; 2.5 g/kg)。
1.2.3 伊文思蓝染色法定性评价大鼠血脑屏障通透性 取脑组织前2 h 尾静脉注射伊文思蓝(evans blue,EB),每100 g 体质量大鼠注射 2% EB 溶液 0.4 mL。经血液循环1 h 后可见大鼠的口周、眼角、肢体和睾丸等浅表皮肤呈现蓝色。 将大鼠断头取脑后,进行大体观察。 经蓝色激发光照射后, EB 在荧光显微镜下呈现红色斑点,根据这些斑点的大小和数目,可定性反映 BBB 的通透性。
1.2.4 实时荧光定量 PCR (qRT-PCR)检测GPR124 mRNA 的表达 取各组大鼠海马组织,参照Trizol 试剂盒说明书提取总RNA。 每个样本取1 μg RNA 作为逆转录模板合成cDNA。 所用引物(表1)。 PCR 反应条件: 95 ℃ 2 min; 95 ℃ 20 s、 60 ℃ 30 s、 72 ℃ 30 s,共40 个循环;产物经溶解曲线单峰验证,记录每个反应管中的荧光信号达到所设定值时所需的循环数(Ct值), △△Ct = (Ct 目的基因-Ct β-actin)治疗组 - (Ct目的基因-Ctβ-actin)对照组,数据采用2-△△Ct 法分析,计算目的基因与内参β-actin 比值作为目的基因的相对表达量。

表1 引物信息
1.2.5 免疫印迹法(WB)检测海马区 GPR124 蛋白表达 取出海马组织后-80 ℃保存备用。 RIPA 裂解液提取各组样本总蛋白,用BSA 法测定总蛋白浓度,将各组蛋白终浓度调整一致。 采用SDS-PAGE 垂直板全湿法电泳,制备分离胶和浓缩胶,上样,电泳,将凝胶中的蛋白转移至PVDF 膜,将膜放入含5%脱脂牛奶的TBST 封闭缓冲液中封闭2 h 后加入稀释的一抗(GPR124 单克隆抗体 1∶1 000)。 一抗 4 ℃摇床孵育过夜,室温下复温2 h,充分洗膜后加入相应二抗室温孵育1 h,洗膜后发光液化学发光,曝光显色。
1.2.6 免疫荧光法(IF)检测海马区 GPR124 蛋白表达 将大鼠海马冰冻组织切片用4 ℃的丙酮溶液固定大约10 min。 其后进行如下操作:用组化笔在玻片上圈起组织;用PBS 浸润组织;4%多聚甲醛处理(室温)10 min;PBS 漂洗, 5 min × 3 遍; 0.5% Txiton X-100处理(室温) 5 min; TBST 漂洗, 5 min × 3 遍;封闭(室温) 1 h;孵育 GPR124 一抗(用 0.1%BSA/TBST配) 4 ℃ 孵育过夜;0.1% BSA/TBST 漂洗,5 min ×3遍;孵育荧光二抗(用含 0.1 BSA 的 TBST 配)RT 孵育1 ~2 h; 0.1% BSA/TBST 漂洗, 5 min ×3 遍; DAPI, 5 min; PBS 漂洗, 5 min × 3 遍;用封片剂进行封片,因荧光不断淬灭,应尽早在荧光显微镜下拍照;ImageJ 用于量化核和/或细胞质荧光信号。
1.3 统计学分析采用GraphPad Prism 6 进行统计作图及数据分析。 所有数值以均值±标准差(Mean ±SD)描述,正态分布且方差齐性的多组计量资料用One-way-ANOVA(单因素方差分析),组间比较采用SNK 分析,方差不齐者采用 Kruskal-Wallis H 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 伊文思蓝(EB)评价血脑屏障结果大体观察可见假手术组(Sham 组)大鼠脑大体标本呈棕白色,全脑缺血再灌注模型组(GCI/R 组)大鼠脑大体标本呈蓝色,人血白蛋白组(GCI/R + HSA 组)与 GCI/R组比较脑组织蓝色程度明显减轻。 见图1。
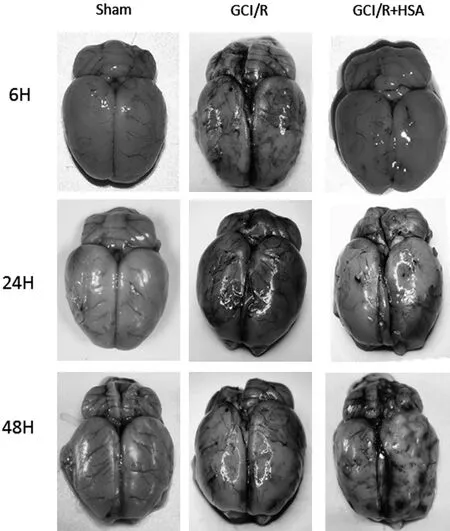
图1 全脑缺血-再灌注后各组大鼠EB 染色后脑部直视图
由于EB 不能透过正常的BBB,因此在荧光显微镜下, Sham 组的大鼠脑组织中几乎没有红斑;而在GCI/R 组的大鼠脑组织中在镜下可以观察到红斑明显增多,提示 EB 大量渗漏;在 GCI/R + HSA 组的镜下红斑较GCI/R 组明显减少,但仍明显多于 Sham 组(图 2)。 同时,免疫荧光也显示, GCI/R 组再灌注 6 h 后, EB 外渗明显增加,24、48 h 渗漏进一步增多,而 GCI/R +HSA组, EB 渗漏24 h 达高峰,48 h 时较前明显减少。

图2 全脑缺血-再灌注后各组大鼠EB 染色荧光拍照图
2.2 实时荧光定量PCR 结果随着缺血损伤时间的延长,GPR124 mRNA 在 GCI/R 组和 GCI/R + HSA组均呈现逐步上调的趋势。 在再灌注后6 h,大鼠海马区组织GPR124 mRNA 的表达上调,其后的缺血再灌后24、48 h 2 个时间点GPR124 mRNA 的表达随时间进一步上调,而应用人血白蛋白后各时间点的GPR124 mRNA 表达较 GCI/R 组进一步上调。 在缺血再灌注后第24 h,与Sham 组相比较,GCI/R 组的海马区GPR124 (Sham: 1.05 ± 0.13, GCI/R: 2.04 ± 0.25,P<0.01)的 mRNA 表达上调;与 GCI/R 组相比较,GCI/R + HSA 组的海马区GPR124 (GCI/R: 2.04 ±0.25, GCI/R + HSA: 2.66 ± 0.42,P< 0.05)的 mRNA 表达进一步上调(图 3:A-C)。

图3 qRT-PCR 检测GPR124 mRNA 的表达
2.3免疫印迹法(WB)结果WB 结果显示,各组GPR124 蛋白表达的时间变化趋势与GPR124 mRNA结果趋于一致。 再灌注后 6 h,大鼠海马区组织GPR124 蛋白的表达增加,其后的缺血再灌后24、 48 h 2 个时间点GPR124 蛋白的表达随时间进一步增加。此外, GCI/R +HSA 组的大鼠海马组织 3 个时间点的GPR124 蛋白表达均较 GCI/R 组表达相应增加(图4A)。 在全脑缺血再灌注后第24 h,与Sham 组相比, GCI/R 组的海马组织 GPR124 蛋白表达增加(P<0.01);与 GCI/R 组相比, GCI/R + HSA 组的海马组织 GPR124 蛋白表达明显增加(P< 0.01),灰度值统计结果见图4B。

图4 不同时间点(6、24、48 h)大鼠海马组织中GPR124 蛋白表达
2.4 免疫荧光法(IF)结果IF 结果进一步证实了各组大鼠GPR124 蛋白表达的时间变化趋势。 此外,在再灌注后第 24 h,与 Sham 组比较, GCI/R 组大鼠GPR124 的平均荧光强度显著增加(P<0.01),提示缺血再灌注后GPR124 在海马CA1 区GPR124 蛋白表达增加,与 GCI/R 组比较, GCI/R + HSA 组 GPR124 平均荧光强度进一步显著增加(P<0. 05),提示应用HSA 可促进GPR124 蛋白表达的增加,差异有统计学意义。 见图 5~7。

图5 免疫荧光检测 CA1 区 GPR124 蛋白的表达(6 h)(Bar =20 μm, ×400 倍)

图6 免疫荧光检测 CA1 区 GPR124 蛋白的表达(24 h)(Bar =20 μm, ×400 倍)

图7 免疫荧光检测 CA1 区 GPR124 蛋白的表达(48 h)(Bar =20 μm, ×400 倍)
3 讨论
本研究通过改良的Pulsinelli 四血管阻断法构建了老年大鼠GCI/RI 模型,模拟了CA 后全脑缺血的临床场景,并在此基础上应用大剂量(2.5 g/kg)人血白蛋白(HSA)加以干预,结果发现人血HSA 可以改善老年大鼠GCI/RI 模型的血脑屏障(BBB)的通透性并影响BBB 相关蛋白GPR124 的表达。
BBB 是指血液循环和中枢神经系统之间形成的一种机械和功能屏障,它发挥着维持脑血管稳态作用。 BBB 的破坏或功能障碍与包括缺血性卒中在内的多种中枢神经系统疾病相关。年龄等衰老相关因素可以促进或加重BBB 的破坏和功能障碍。 脑脊液/血浆白蛋白比值增加和脑成像研究表明,正常人类衰老过程中, BBB 破裂较为常见[11]。 BBB 损害是脑缺血再灌注损伤后脑水肿的核心病因,因而控制BBB 功能的内皮受体蛋白对老年CA 患者的神经保护显得犹为重要。 而控制BBB 功能的内皮受体蛋白并不唯一并且功能较为复杂。 本课题组既往研究发现,全脑缺血再灌注大鼠的海马区,与BBB 结构相关的Caveolin-1 蛋白的表达下调[12]。
HSA 是近年发现的能对抗多种脑缺血再灌注损伤机制的神经保护剂,对局灶性脑缺血、外伤性脑缺血等均有明显治疗作用。 HSA 能够维持BBB 的稳定性, 改善脑水肿, 减少脑梗死体积; 另还能有效地清除脑创伤后形成的脑水肿,抑制内源性过氧化物酶;通过与血液中游离脂肪酸结合,阻断病理性脂质过氧化反应;扩张血管容量,减少红细胞聚集,降低血液黏度等作用[13]。 此外也有研究发现HSA 具有明显的抑制血管内皮细胞凋亡并且促进血管内皮细胞生长因子表达,进一步促进缺血部位血管新生等作用[14]。 临床应用中,大剂量HSA 治疗缺血性脑卒中患者,可减轻脑水肿,预防延迟的局部缺血损伤,最终改善患者的长期预后。 HSA 的脑保护作用存在着明显的时间和剂量效应优势。 Belayev 等[6]研究发现,即使是延迟至缺血后 4 h 再应用中等剂量的 HSA(1.25 g/kg)治疗,也可以明显减小局脑缺血模型的脑梗死灶的体积,减轻脑组织水肿的严重程度,并最终改善神经功能的评分[15]。 HSA 对 BBB 的作用仍存在一定的争议。 有研究报道,新生小鼠脑出血后给予HSA 治疗,可减少血脑屏障的渗透性,维持 BBB 的稳定等作用[16]。 局脑缺血模型研究表明,应用rt-PA 和HSA 联合治疗时可以能显著降低rt-PA 治疗产生的缺血再灌注损伤,其作用与 HSA 降低 BBB 通透性有关[17]。 而另外一些研究却认为, HSA 通过增加BBB 通透性来加重局脑缺血模型大鼠的脑水肿[18]。 而 HSA 对老年大鼠的GCI/R 后的BBB 通透性的作用及可能机制,较少有研究涉及。 本研究表明,在老年大鼠的GCI/RI 模型中,再灌注后各个时间点BBB 通透性均增加,而HSA 的应用可以阻断这种增加趋势而发挥脑保护作用。
HSA 诱导脑组织中GPR124 的表达增加可能是其引起全脑缺血再灌注大鼠BBB 通透性降低的原因之一。 G 蛋白偶联受体124(GPR124)是一种膜表面受体,血管生成过程中在胚胎内皮细胞和周细胞中表达,同时在脑内血管内皮细胞和血管生成周细胞中也有特异性表达[19]。 体内研究表明, GPR124 缺陷小鼠在胚胎15.5 d 内因前脑和脊髓血管发育缺陷死亡,因而GPR124 在正常胚胎小鼠的前脑血管生成和维持BBB 功能中发挥着不可或缺的作用[20]。 在正常成年小鼠内皮细胞中,条件敲除GPR124 并不影响BBB 的稳态完整性,但在缺血性卒中小鼠模型中,可导致BBB 破坏、微血管出血和脑水肿[9]。 GPR124 具有显著的功能趋向性,可能是脑缺血再灌注损伤过程中BBB 完整性的必要因素之一,因此可作为GCI/RI 所致BBB 相关疾病的治疗靶点。本研究表明在老年大鼠GCI/RI 后, BBB 结构和功能破坏,同时伴随着 GPR124 蛋白的表达增加,推测GCI/RI 早期 GPR124 表达可能是 BBB 的保护因素。给予 HSA 治疗后,与模型组(GCI/R 组)相比较,其表达进一步增加,推测 GCI/RI 后应用 HSA 能增加GPR124 蛋白的表达可能参与了对抗GCI/RI 的病理生理过程,亦即 HSA 治疗能有效地促进GPR124 蛋白表达增加而发挥BBB 保护作用。
本研究存在一定的局限性。例如仅应用了EB 荧光法来定性评估血脑屏障的通透性。 此外,有关HSA对全脑缺血再灌注后的BBB 的保护作用的未进行剂量效应关系的实验。 这些不足有待在今后的研究中进一步完善。
综上所述, HSA 在老年大鼠全脑缺血再灌注损伤(GCI/RI)早期应用具有改善 BBB 通透性的作用,其作用可能与诱导脑组织中GPR124 的表达增加有关,其机制有待进一步研究。
