NLRP3炎症小体通过T细胞亚群参与IgA肾病发病机制的研究进展
2023-01-09樊晓敏王彩丽
樊晓敏 米 焱 王彩丽
免疫球蛋白(immunoglobulin,Ig)A肾病是原发性肾小球疾病的一种常见类型,其临床表现不一,可有血尿,伴或伴不同程度的蛋白尿、高血压及肾功能受损,预后也不尽相同。IgA肾病发病机制目前仍不明确,机体免疫功能障碍、细胞因子和炎症介质异常分泌都可能参与IgA肾病的发展。在人体血液循环中,IgA主要以单体IgA1的形式存在,是体内产生最多的Ig。循环中的IgA主要由骨髓中的记忆性浆细胞产生,另有少量由外周淋巴器官(如脾和淋巴结)的浆细胞产生。研究[1]结果表明,免疫功能障碍会导致IgA1发生异常糖基化,形成半乳糖缺乏型IgA1(galactose deficient IgA1,Gd-IgA1),从而参与IgA肾病的发病,IgA肾病患者血清中Gd-IgA1显著增多。IgA肾病属于自身免疫性疾病,机体黏膜免疫过程中可产生IgA1,异常糖基化的IgA1与N-乙酰半乳糖氨基-O-丝氨酸/苏氨酸Tn抗原结合形成免疫复合物并沉积在肾小球系膜区和毛细血管区,引起系膜细胞增殖和系膜基质增生,导致肾损伤,大部分会进展为终末期肾病[2]。由此可以认为,循环免疫复合物形成可诱发IgA肾病,通过调控循环免疫复合物在肾小球的沉积或能有效地延缓IgA肾病的进展。
大量蛋白尿和肾功能损害是肾病预后不良的临床指标,肾小球硬化和间质纤维化是预后不良的病理学指标,NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体及T细胞亚群的分化可以引起IgA肾病出现蛋白尿、肾功能损害及肾脏病理性改变。寻求NLRP3炎症小体及T细胞亚群的特异性干预靶点或可为IgA肾病提供新的治疗手段。IgA肾病的发病机制及治疗一直是临床面临的巨大挑战,也是国内外学者研究的热点。本文通过对NLRP3炎症小体及T细胞亚群分化在IgA肾病中的致病性进行综述,以期为寻求IgA肾病新的治疗靶点提供思路。
1 T细胞亚群在IgA肾病患者外周血中的表达
T细胞亚群在维持机体正常免疫功能中发挥着重要的作用,是反映机体免疫状态的常用临床指标之一,监测T细胞亚群的变化有利于疾病的诊断并观察疾病的进展。T细胞在功能上分为辅助性T细胞(helper T cell,Th)、细胞毒性T细胞(cytotoxic T cell,Tc)和调节性T细胞(regulatory T cell,Treg)[3]。CD4分子见于Th,参与机体的细胞免疫和体液免疫;CD8分子见于Tc,可特异性杀伤靶细胞;Treg主要通过细胞接触机制及分泌抗炎症因子IL-10、TNF-β等维持免疫稳态和免疫耐受[4]。CD4+T细胞可协调B细胞分化产生抗体,CD8+T细胞可抑制抗体的合成及T细胞增殖,两者的稳态与平衡共同维持着机体的正常免疫应答。外周血CD4+T细胞和CD8+T细胞的绝对值、CD4+/CD8+T细胞比值异常都会引起T细胞亚群失衡,导致机体免疫功能紊乱而引发疾病。
CD4+T细胞可引起肾小球肾炎,在IgA肾病患者肾组织中可见炎症细胞浸润于肾小球和肾小管间质,CD4+T细胞通过招募巨噬细胞和淋巴细胞,激活细胞免疫,引起炎症细胞的浸润、迁移,从而导致系膜细胞增殖并抑制细胞凋亡[5]。初始的CD4+T细胞可分化为Th1、Th2和Th17[6]。Th1分泌促炎症细胞因子IL-2、INF-γ、TNF-α、TNF-β,参与细胞免疫介导的细胞内病原体清除;Th2分泌细胞因子IL-4、IL-5、IL-6、IL-10,参与体液免疫介导的细胞外病原体清除[7]。此外,Th1细胞因子具有抑制感染发生的作用,Th2细胞因子具有促进纤维细胞分化的作用。IgA肾病中Th2、Th17占比较高,但Th1和Treg占比较低,而Th2、Th17可促进Gd-IgA1表达的增高[8]。Th1/Th2比值降低可引起IgA肾病患者出现蛋白尿和肾脏病理改变。Th2产生的IL-4和IL-6通过调控合成IgA1的细胞中关键糖基转移酶水平,从而加重IgA1半乳糖缺乏症,参与肾脏纤维化的发生,提示抑制CD4+T细胞向Th2分化可能是预防肾脏纤维化的潜在治疗手段[9]。Th17分泌的IL-21可刺激抗Gd-IgA1的产生[10]。有肾功能减退、蛋白尿和肾小管间质损害的患者细胞因子IL-17A表达量显著增加[11]。由此可见,Th1/Th2和Treg/Th17失衡均可参与IgA肾病的发展。Kurtulus等[12]报道CD4+T细胞通过识别主要组织相容性复合物Ⅱ(major histocompatibility complex Ⅱ,MHCⅡ)类抗原释放细胞因子IL-3、IFN-γ、TNF-β、TGF-β,引起肾间质纤维化,导致IgA肾病进展。叶寒青等[13]分析了82例有肾间质纤维化和肾小管萎缩改变的IgA肾病患者资料,发现CD4+/CD8+T细胞比值显著高于健康对照组。唐余燕等[14]的研究发现,IgA肾病患者T细胞中Th2、Th17占比显著高于健康对照组,提示IgA肾病患者存在T细胞亚群紊乱。IgA肾病患者T细胞计数与病情严重程度有关,在不同程度的肾间质纤维化或肾小管萎缩中呈现动态变化,故检测外周血T细胞亚群的计数对于IgA肾病患者的免疫状态、病理学类型、临床表现、治疗指导、预后评估有重要价值。当前,对症支持和应用免疫抑制剂是治疗IgA肾病的主要手段,但目前免疫抑制剂靶向所有的T细胞亚群。寻求T细胞亚群新的干预靶点以调节和干预IgA抗体的产生,改善患者的临床症状及病理学改变,对指导IgA肾病临床用药有重要意义。
2 NLRP3炎症小体在IgA肾病患者肾组织中的表达
NLRP3炎症小体是固有免疫的重要组成部分,不仅抵御外源性微生物的入侵,还与适应性免疫有关。NLRP3炎症小体作为重要炎症复合体,由NLRP3分子、衔接蛋白凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ACS)和胱天蛋白酶-1(caspase-1)前体组成。NLRP3分子受到刺激(主要为内源性损伤相关分子模式和晶体)后通过溶酶体破裂模型、半通道模型和活性氧模型等机制被激活,招募caspase-1形成NLRP3炎症复合体,而活化的caspase-1利用其酶活性剪切IL-1β前体和IL-18前体产生效应因子IL-1β和IL-18发挥生物学作用[15]。研究[16]结果表明,肾纤维化模型小鼠的肾脏炎症反应与NLRP3炎症小体的激活及IL-1β和IL-18的过度产生有关。NLRP3表达量与肾间质炎症、肾小管萎缩和肾间质纤维化水平呈正相关。IgA肾病患者肾组织中NLRP3 mRNA和蛋白质表达量均增加,且与患者血肌酐水平及肾功能减退呈正相关,也与患者预后相关[17]。He等[18]研究证实,IgA肾病大鼠血清和肾组织中IL-1β和IL-18含量明显增加,其表达水平在临床中可用于判断肾病患者的预后。Tsai等[19]研究发现,IgA免疫复合物可以通过激活T细胞和促进线粒体活性氧产生和释放以激活NLRP3炎症小体,从而引起IL-1β、IL-18、TNF-α、IFN-γ等释放。敲除IgA肾病小鼠的NLRP3或予靶向肾NLRP3的短发夹RNA干预可减少蛋白尿,改善肾功能,减少肾小球单核细胞浸润,减轻肾损伤。以上研究结果表明,NLRP3炎症小体在IgA肾病发病中发挥着重要作用,NLRP3肾靶向抑制剂是治疗IgA肾病的新策略。
3 IgA肾病患者中NLRP3炎症小体与T细胞亚群的相关性
NLRP3炎症小体可在T细胞、B细胞等免疫细胞中表达,主要存在于肝、肺和肾等组织中,在肿瘤、感染及自身免疫性疾病发生中扮演重要角色。NLRP3炎症小体活化后产生的IL-1β和IL-18可导致T细胞亚群紊乱。IL-1β细胞因子可通过诱导T细胞释放IL-2维持原始T细胞的存活,也可通过抵抗Treg的免疫抑制作用促进T细胞增殖,亦可促进原始T细胞分泌IL-17A细胞因子并向Th17亚群分化[20],表明NLRP3炎症小体对T细胞存活和增殖有重要意义(图1)。T细胞增殖可促进获得性免疫反应的发生,而尿酸盐晶体通过激活NLRP3炎症小体直接刺激T细胞中表达IL-1β,进一步增强炎症反应[21]。CD4+T细胞可影响小鼠NLRP3炎症小体的激活,其含量与NLRP3炎症小体的表达量呈正相关。CD8+T细胞反馈以抗原依赖方式激活抗原呈递细胞中的NLRP3炎症小体,从而促进IL-1β成熟[22]。Rauen等[23]的研究结果表明,炎症小体可能通过病原体侵袭黏膜诱导免疫应答,影响T细胞的调节功能,激活补体系统,刺激机体产生自身免疫性抗体,最终导致IgA肾病。NLRP3炎症小体产生的细胞因子在IgA肾病患者外周血中表达升高,因此推测NLRP3炎症小体异常活化可能参与IgA肾病患者T细胞亚群失衡,T细胞亚群的失衡也会影响NLRP3炎症小体的表达。临床上可以通过调控T细胞亚群的稳态及机体内NLRP3炎症小体的表达来治疗IgA肾病。
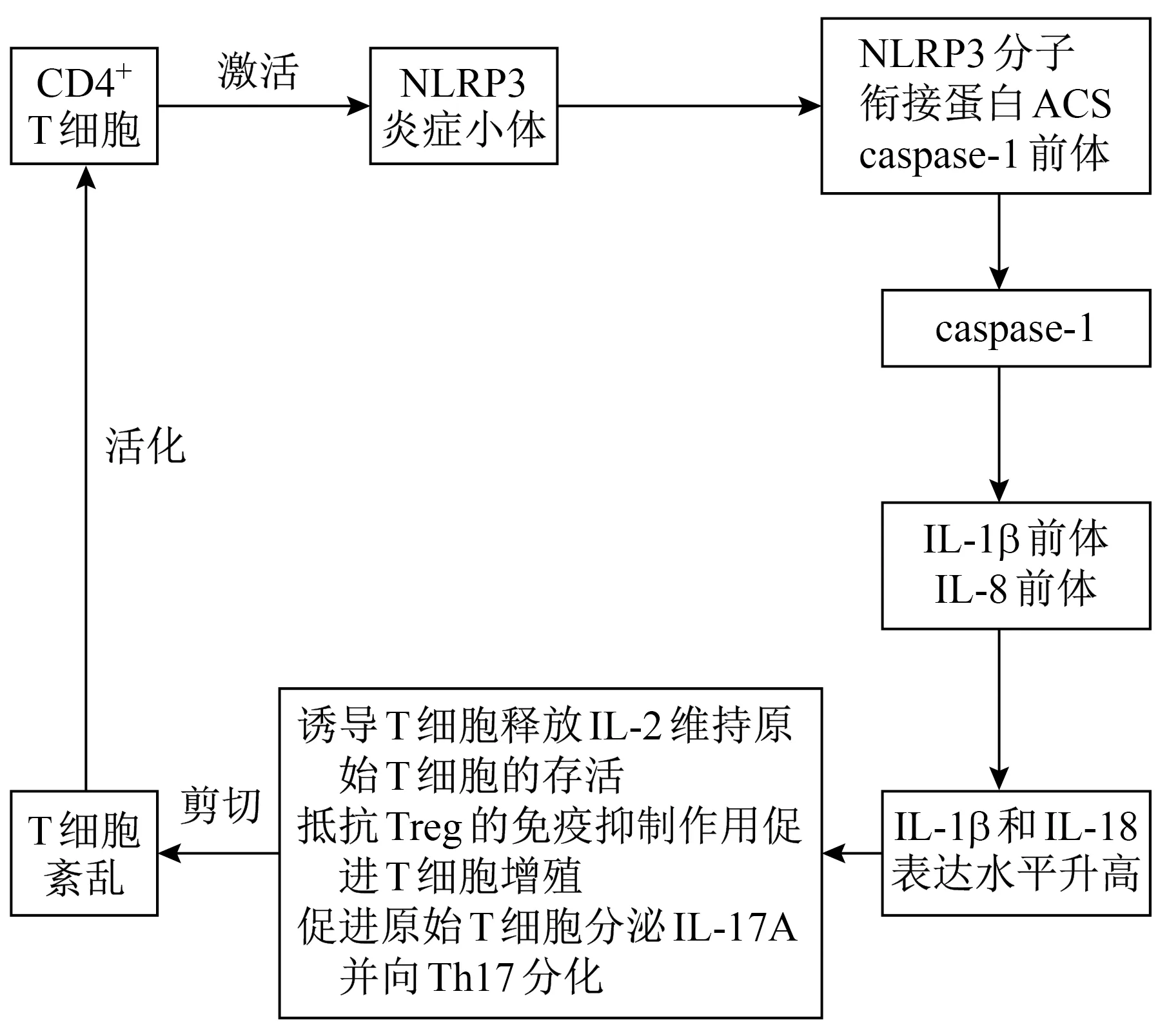
图1 T细胞亚群及NLRP3炎症小体参与IgA肾病发病的机制
4 小 结
NLRP3炎症小体和T细胞亚群分化参与IgA肾病发病的机制受到越来越多的关注与研究。IgA肾病患者的蛋白尿、肾功能受损及病理性改变与NLRP3炎症小体和T细胞亚群异常密切相关,NLRP3炎症小体激活后产生的IL-1β和IL-18可调控T细胞亚群的分化,导致T细胞亚群紊乱,而T细胞亚群失衡也可影响IgA肾病患者NLRP3炎症小体的表达水平。调控NLRP3炎症小体和T细胞亚群可能是治疗IgA肾病的新靶点,但仍需要更多的研究者付诸行动,最终为IgA肾病患者的临床治疗提供指导。
