缩宫素受体脱敏后非甾体抗炎药对子宫平滑肌收缩的影响
2023-01-09廖丽美王婷婷胡建英李菁如黄绍强
廖丽美 焦 静 王婷婷 胡建英 李菁如 黄绍强
NSAID包括非选择性环氧合酶(cyclooxygenase,COX)抑制剂和选择性环氧合酶2(cyclooxygenase-2,COX-2)抑制剂,其通过抑制COX减少前列腺素的合成而发挥抗炎、解热和镇痛的作用,逐渐成为剖宫产术后多模式镇痛的基础药物[1-2]。研究[3]显示,前列腺素可内源性促进子宫收缩,故临床上NSAID也常被用于预防早产[4],因此,剖宫产术后镇痛时应用NSAID有抑制子宫平滑肌收缩的潜在风险。部分临产后转行剖宫产的产妇术前可经历长时间的缩宫素诱导或产程促进。长时间输注缩宫素(超过4 h)会导致乳酸堆积,并使缩宫素受体(oxytocin receptor, OTR)脱敏[5-6],从而降低子宫平滑肌对缩宫素的敏感性;然而,目前鲜见这类产妇应用NSAID进行术后镇痛是否会进一步抑制子宫收缩的报道。对于没有OTR脱敏的子宫平滑肌,早期的体外研究[7]结果表明,选择性COX-2抑制剂尼美舒利和非选择性COX抑制剂吲哚美辛只能在1×10-4mol/L的浓度下抑制收缩。随后的研究[8-9]显示,选择性COX-2抑制剂尼美舒利、美洛昔康和塞来昔布在体外以浓度依赖的方式抑制人子宫肌层收缩,其中塞来昔布具有更显著的松弛作用。
本研究聚焦OTR脱敏,探索NSAID,即酮咯酸(COX抑制剂)和帕瑞昔布(COX-2抑制剂)对妊娠晚期大鼠子宫平滑肌收缩活性的影响,为NSAID在剖宫产术后镇痛中的应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 12周龄、体重280~360 g的妊娠16 d(中期妊娠)的9只Sprague-Dawley(SD)大鼠购自上海杰斯杰实验动物有限公司。在动物设施中圈养大鼠4 d,光暗交替周期为12 h,无限量提供标准食物和饮用水。本实验经复旦大学上海医学院动物伦理委员会审核、批准(批准号为201901007Z),实验动物生产许可证号为SCXK(沪)2018-0004。

1.2 方法
1.2.1 子宫平滑肌分离 经大鼠右腹股沟向腹腔内注射过量(1 mL/100 g)水合氯醛。将大鼠的子宫及宫腔内容物置于4 ℃预冷的生理盐溶液[溶液配制:120 mmol/L氯化钠、5.9 mmol/L氯化钾(KCl)、25 mmol/L碳酸氢钠、1.2 mmol/L磷酸二氢钠、11.5 mmol/L葡萄糖、2.5 mmol/L氯化钙、1.2 mmol/L氯化镁]中。暴露子宫腔并分离内容物后,在显微镜下剔除子宫组织周围的脂肪和血管组织,并将子宫组织沿肌肉纵轴切成7 mm×3 mm大小的肌条,用于收缩实验。分离过程中注意勿损伤子宫内膜。将纵形肌条垂直悬浮于装有35 mL、pH为7.4的生理盐溶液的37 ℃恒温水浴槽中。将体积分数为0.95的O2和0.05的CO2混合气体连续泵入生理盐溶液,并确保液位的波动不影响肌条收缩[10]。
1.2.2 诱导子宫平滑肌肌条中OTR脱敏 在该实验中,将来源于同一只妊娠晚期大鼠的子宫平滑肌分为基础组、对照组和OTR脱敏组。基础组未进行任何处理。对照组和OTR脱敏组分别进行不同的预收缩处理。使用1×10-7mol/L缩宫素预处理对照组和OTR脱敏组子宫平滑肌15 min后(即预收缩),将OTR脱敏组暴露于1×10-6mol/L缩宫素2 h以诱导OTR脱敏,而对照组则使用0.5×10-9mol/L缩宫素。完成诱导OTR脱敏后,将子宫平滑肌肌条在生理盐溶液中静置10 min,随后再以浓度为1×10-7mol/L的缩宫素处理。计算并比较对照组和OTR脱敏组在分别以对照脱敏和脱敏处理前后予1×10-7mol/L缩宫素处理后的收缩活性。收缩活性=平均张力(g)×频率(次/15 min)。收集完成收缩实验的子宫平滑肌,进行Western blotting和实时荧光定量(qRT-PCR)用于比较基础组、对照组和OTR脱敏组中OTR的mRNA和蛋白质的表达差异。
1.2.3 检测各组子宫平滑肌肌条收缩活性 在该组实验中,将来源于同一只妊娠晚期大鼠的子宫平滑肌分为对照收缩组和OTR脱敏收缩组。将每条子宫平滑肌在1 g张力下于生理盐溶液中平衡60 min,以实现规则收缩并适应环境。当子宫平滑肌达到规则的收缩模式时,使用96 mmol/LKCl刺激肌条,以充分激活肌条并测量其最大收缩力(定义为K1)。完成1.2.2所述的诱导OTR脱敏后,计算子宫平滑肌在1×10-7mol/L缩宫素下的基础收缩活性。后使用浓度递增(1×10-7或10-8mol/L~1×10-3mol/L)的NSAID(酮咯酸、帕瑞昔布)或固定浓度的生理盐溶液(同方法1.2.1中的溶液配置)分别处理两组子宫平滑肌,每个药物浓度下或生理盐溶液中分别作用15 min,计算其收缩活性和收缩活性比值,以及酮咯酸和帕瑞昔布的半抑制浓度(IC50)。收缩活性比值为每个药物浓度下的收缩活性与基础收缩活性之比。
在完成最高浓度(1×10-3mol/L)的NSAID或生理盐溶液暴露后,使用96 mmol/L KCl持续刺激对照收缩组和OTR脱敏收缩组的子宫平滑肌10 min,测量其最大收缩力(定义为K2),以评估其活性状态,并比较K1和K2,评估NSAID是否影响子宫平滑肌对KCl的反应性。排除在生理盐溶液中平衡20 min仍未能产生自发收缩,以及实验前、实验后对高钾刺激无反应的子宫平滑肌肌条。

1.2.5 Western blotting 使用放射免疫沉淀法RIPA裂解液(P0013B)提取组织中的所有蛋白质,并行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。将分离的蛋白质转移到聚偏二氟乙烯(PVDF)膜上。在室温下用溶于磷酸盐吐温缓冲液的5%脱脂牛奶封闭膜2 h,以减少非特异性背景。在4 ℃下分别用抗OTR(1∶5 000)和抗GAPDH(1∶10 000)一抗处理PVDF膜,并分别与二抗(1∶5 000)在室温下共同孵育2 h。最后,采用增强的化学发光法(Bio-Rad)处理膜并使用Western blotting可视化仪进行观察。重复实验4次,得到蛋白质相对表达量。

2 结 果
2.1 诱导子宫平滑肌OTR脱敏 在预收缩后,将OTR脱敏组暴露于1×10-6mmol缩宫素2 h以诱导OTR脱敏时,OTR脱敏组的子宫平滑肌收缩幅度和频率逐渐降低,而对照组则无明显变化,见图1。对照组预收缩时的肌条收缩活性为(52.69±5.15) g·次/15 min,与对照脱敏处理后以1×10-7mol/L缩宫素处理下的(54.22±5.57) g·次/15 min的差异无统计学意义(P>0.05)。OTR脱敏组中预收缩时的收缩活性为(50.96±6.40) g·次/15 min,显著高于脱敏处理后以1×10-7mol/L缩宫素处理下的(20.44±2.24) g·次/15 min(P=0.005)。OTR脱敏组的OTR mRNA相对表达量为0.04±0.01,显著低于对照组的1.13±0.11(P<0.01), OTR蛋白质相对表达量为0.04±0.02,亦显著低于对照组的0.12±0.01(P<0.05)。基础组、对照组和OTR脱敏组的OTR蛋白质表达情况见图2。

A 对照组 B OTR脱敏组图1 子宫平滑肌收缩曲线示意图
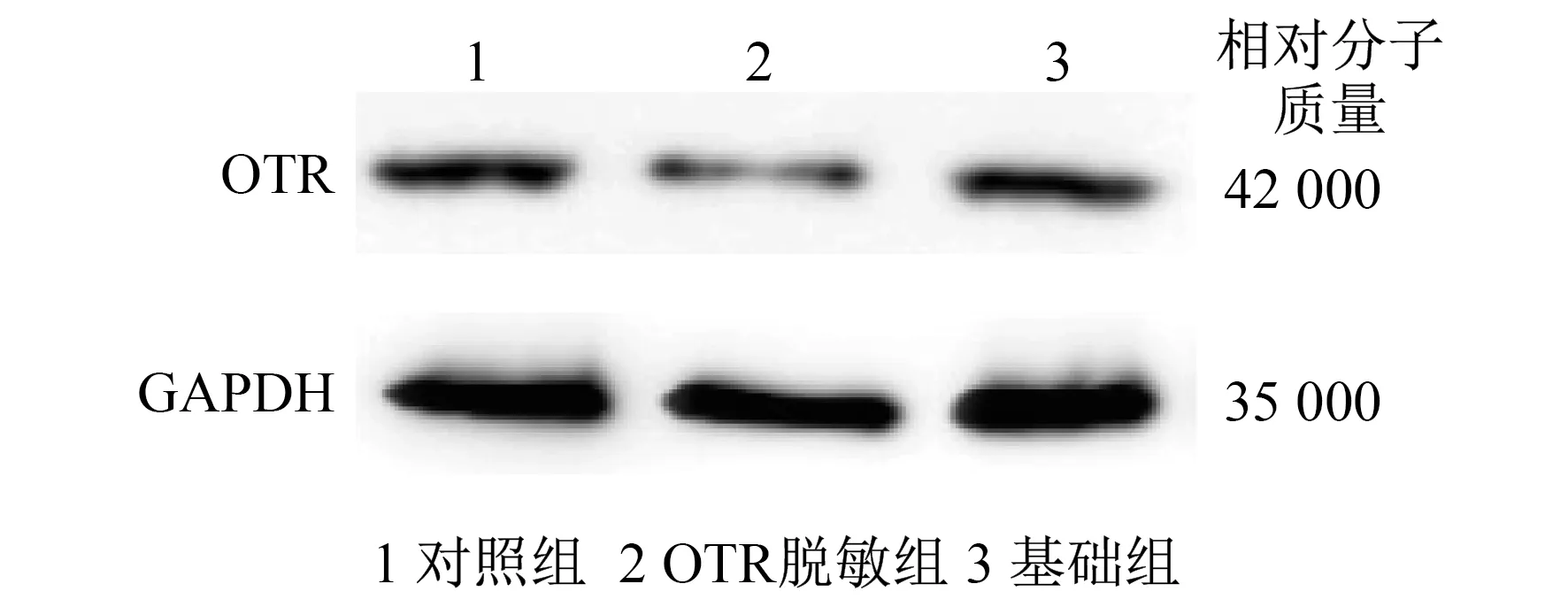
图2 基础组、对照组和OTR脱敏组的OTR蛋白质表达情况
2.2 NSAID对OTR脱敏后子宫平滑肌收缩活性的影响 使用1×10-7mol/L酮咯酸和帕瑞昔布分别处理子宫平滑肌肌条时,对照收缩组的收缩活性比值分别为0.81±0.03、0.78±0.06;OTR脱敏收缩组的收缩活性比值分别为0.68±0.10、0.96±0.13;此时两组中使用生理盐溶液处理的收缩活性比值分别为0.86±0.03、0.97±0.07。使用1×10-6mol/L酮咯酸和帕瑞昔布分别处理子宫平滑肌肌条时,对照收缩组的收缩活性比值分别为0.66±0.04、0.68±0.06,OTR脱敏收缩组的收缩活性比值分别为0.85±0.08、0.91±0.13;此时两组中使用生理盐溶液处理的收缩活性比值分别为0.82±0.07、0.95±0.11。使用1×10-5mol/L酮咯酸和帕瑞昔布分别处理子宫平滑肌肌条时,对照收缩组的收缩活性比值分别为0.66±0.04、0.58±0.06,OTR脱敏收缩组的收缩活性比值分别为0.61±0.11、0.68±0.09;此时两组中使用生理盐溶液处理的收缩活性比值分别为0.68±0.02、0.90±0.07。使用1×10-4mol/L酮咯酸和帕瑞昔布分别处理子宫平滑肌肌条时,对照收缩组的收缩活性比值分别为0.48±0.06、0.29±0.05,OTR脱敏收缩组的收缩活性比值分别为0.43±0.10、0.25±0.07;此时两组中使用生理盐溶液处理的收缩活性比值分别为0.76±0.08、0.89±0.12。使用1×10-3mol/L酮咯酸和帕瑞昔布分别处理子宫平滑肌肌条时,对照收缩组的收缩活性比值分别为0.03±0.01、0,OTR脱敏收缩组的收缩活性比值分别为0.07±0.02、0;此时两组中使用生理盐溶液处理的收缩活性比值分别为0.62±0.07、0.79±0.08。
当对照收缩组和OTR脱敏收缩组的NSAID处理浓度均≤1×10-5mol/L时,3种处理间的收缩活性比值的差异均无统计学意义(P值均>0.05)。当处理浓度>1×10-5mol/L时,两组经NSAID药物处理后的收缩活性比值均显著低于生理盐溶液处理后(P值均<0.05),且在处理浓度为1×10-3mol/L时,两组的NSAID处理后的肌条收缩活性比值几乎为0;而两组任一处理浓度时的同一药物处理后的收缩活性比值的差异均无统计学意义(P值均>0.05)。
2.3 两组不同NSAID的IC50及不同NSAID处理前后的收缩力的比较 对照收缩组中,帕瑞昔布的IC50显著低于酮咯酸(P=0.04);OTR脱敏收缩组中,2种药物的IC50的差异无统计学意义(P>0.05)。同时,两组间同种药物IC50的差异均无统计学差异(P值均>0.05)。对照收缩组和OTR脱敏收缩组间3种处理的K1的差异均无统计学意义(P值均>0.05)。对照收缩组和OTR脱敏收缩组使用帕瑞昔布处理的K2均显著低于K1(P值均<0.05),而酮咯酸处理的K1与K2的差异均无统计学意义(P值均>0.05)。见表1。

表1 两组不同NSAID的IC50及不同NSAID处理前后的收缩力的比较
3 讨 论
本研究结果表明,OTR脱敏与否不会改变NSAID药物处理对子宫平滑肌收缩活性的影响,同时,当酮咯酸和帕瑞昔布的处理浓度>1×10-5mol/L的浓度时,子宫平滑肌的收缩活性受到显著抑制。
一项研究[12]结果显示,当COX抑制剂的浓度为1×10-8mol/L时,其处理可显著抑制人子宫平滑肌细胞产生前列腺素,而在1×10-4mol/L的处理浓度时,仅轻度抑制子宫平滑肌的收缩活性,提示分娩后子宫平滑肌的收缩与其前列腺素的合成量可能不存在显著相关性。多项临床和基础研究[13-15]结果表明,NSAID因具有明显的子宫收缩抑制作用,被广泛应用于预防早产的治疗。羊膜是怀孕期间子宫中合成前列腺素的主要组织,而这些组织在分娩后排出子宫,因此,NSAID对子宫收缩的作用在两种不同的生理状态下可能有所不同。
早期研究[7,16]结果显示,非选择性COX抑制剂和选择性COX-2抑制剂在处理浓度>1×10-5mol/L时均可显著抑制子宫平滑肌收缩,NSAID可通过一种独立于COX抑制机制的途径抑制子宫收缩,而钙通道阻滞可能参与其中。基于本研究结果,笔者推测即使组织缩宫素浓度较高,NSAID也可有效抑制子宫平滑肌的收缩,其机制可能与抑制了子宫平滑肌收缩的共同通路相关,即细胞外钙和细胞内储存钙流入细胞质。此外,当酮咯酸和帕瑞昔布的血浆峰浓度处于1×10-6~1×10-5mol/L,这类NSAID药物的血浆蛋白结合率几乎均>90%[17-19],提示血浆游离药物浓度<1×10-5mol/L。
部分研究[8,20]结果显示,当NSAID的处理浓度为1×10-9~1×10-5mol/L时,其呈浓度依赖性地抑制子宫平滑肌收缩。与本研究结果似乎相矛盾,笔者分析该研究可能未考虑不同时间段子宫平滑肌之间的收缩活性差异;因为,子宫平滑肌的收缩活性随着收缩时间的延长而逐渐下降,若未考虑这一因素则会夸大药物的抑制作用。Magalhaes等[11]的研究结果显示,使用1×10-8mol/L缩宫素预处理孕晚期大鼠子宫平滑肌1 h可引起平滑肌中的OTR脱敏,继而导致子宫平滑肌收缩乏力。这与本研究结果亦有所不同。在该研究中,用于诱导乏力的缩宫素预处理后,子宫平滑肌仅用生理盐溶液清洗1次,而不同于本研究应用生理盐溶液平衡10 min,这可使子宫平滑肌得到充分“休息”[21]。没有充分平衡的子宫平滑肌不能完全响应随后的较低浓度的缩宫素。本研究通过蛋白质和mRNA水平验证OTR的脱敏作用,蛋白质和mRNA表达量均显著降低,这与Phaneuf等[22]研究发现的人子宫平滑肌中OTR脱敏后,OTR mRNA表达量下调50倍的结果相似。
使用高钾溶液刺激子宫平滑肌时,细胞内钾离子的流出减少,引起膜去极化,电压门控钙通道开放,外部钙内流的急剧增加可增强子宫平滑肌的收缩。经浓度递增的(1×10-7或10-8mol/L至1×10-3mol/L)帕瑞昔布处理后,对照收缩组和OTR脱敏收缩组的子宫平滑肌肌条对96 mmol/L KCl刺激的反应性均显著降低,笔者推测其可能与高浓度(>1×10-5mol/L)帕瑞昔布具有钙通道阻滞特性相关。早期研究[7]结果显示,在>1×10-5mol/L的药物浓度下,可观察到尼美舒利和吲哚美欣以浓度依赖的方式抑制钙通道电流。酮咯酸则没有表现出显著降低子宫平滑肌对96 mmol/L KCl刺激的反应性,其原因可能与其阻滞钙通道的能力较弱有关,或两种药物影响子宫平滑肌收缩的机制可能存在差异。
综上所述,本研究发现,无论子宫平滑肌中是否存在OTR脱敏,非选择性COX抑制剂酮咯酸和选择性COX-2抑制剂帕瑞昔布对子宫平滑肌收缩的抑制作用没有显著差异。这从侧面提示,对于临产后转行剖宫产的产妇,应用NSAID进行术后镇痛可能不存在进一步增加子宫收缩乏力的风险,相关结论有待进一步验证。
