注射用帕瑞昔布钠在不同输液器具中的稳定性及 配伍考察
2019-06-04李世浩赵彦昌林伟彬黄均初陈燕鹏
李世浩 赵彦昌 林伟彬 黄均初 陈燕鹏
帕瑞昔布钠,化学名为N-[[4-(5-甲基-3-苯基-4-异恶唑基)苯基]磺酰基]丙酰胺钠盐,属于一种新型的非甾体抗炎药[1]。帕瑞昔布钠对环氧酶(COX)-2的抑制强度是对COX-1的2.8万倍[2],因为这种高选择性,其能在不影响胃黏膜、肾脏及血小板功能的同时发挥镇痛及抗炎作用。目前,国内对帕瑞昔布钠的研究主要集中于其药理作用、临床应用与联合用药、定量分析等方面[3-7],但未见其在输液器具中稳定性研究报告,本实验设计在室温(25℃)下模拟临床使用对注射用帕瑞昔布钠与0.9%氯化钠注射液在不同输药容器配伍稳定性进行考察,现报告如下。
1 仪器与试剂
1.1 仪器 仪器:WATERS高效液相色谱仪(型号515)、数显酸度计(型号PHS-3C)、半微量分析天平(型号MS205DU)。
1.2 药品与试剂 注射用帕瑞昔布钠(湖南科伦制药有限公司,规格:40 mg)、帕瑞昔布钠对照品(纯度99%)、0.9%氯化钠注射液、磷酸氢二钠、乙腈、甲醇、聚丙烯塑料瓶、非PVC输液袋、玻璃输液瓶、50 ml一次性使用注射器。
2 方法与结果
2.1 色谱条件与系统适用性试验 色谱柱选用Ultimate®LP-C18(4.6×250 mm,5 μm)柱,流动相为乙腈-0.01 mol/L磷酸氢二钠水溶液(用磷酸调节pH=3.0)(体积比48∶52),柱温为30℃,检测波长为215 nm,流速为1.0 ml/min,进样量为 10 μl。分别配制帕瑞昔布钠对照品、样品以及空白对照液,分别将以上三种溶液按上述色谱条件进样10 μl,同时记录色谱图。参照进口注册标准[8],在上述色谱条件下,帕瑞昔布峰的系统适用性标准应为理论板数>5000,拖尾因子<1.05。
2.2 线性相关性试验 精密称取帕瑞昔布钠对照品适量,用稀释剂乙腈-水(体积比48∶52)配制成浓度为 204.732 μg/ml的对照品贮备液,分别精密吸取贮备液0.025、0.25、0.5、1.0、2.0、5.0 ml于10 ml的量瓶中。用稀释剂乙腈-水(体积比48∶52)定容、混匀,各取10 μl进样测定。以帕瑞昔布钠溶液的质量浓度(ρ,μg/ml)为横坐标,峰面积(A)为纵坐标,进行线性回归,得出帕瑞昔布钠回归方程为y=27790x-25606(r=0.9998),结果表明,帕瑞昔布钠质量浓度在 0.51183~102.366 μg/ml内与峰面积线性相关性良好。
2.3 精密度试验 精密吸取“2.2”项下贮备液2 ml于 10 ml量瓶定容帕瑞昔布钠溶液(浓度为40.9464 μg/ml)10 μl。重复进样6次,同时计算峰面积相对标准偏差,结果得到相对标准偏差(RSD)为0.2%,这表明仪器精密度良好。
2.4 溶液稳定性试验 配制浓度约为40 μg/ml帕瑞昔布钠样品溶液,置于阳光不直射的室温条件下放置,分别于0、2、4、6、8、10、12、24、36、48 h在上述色谱条件进样10 μl,计算帕瑞昔布峰面积RSD。结果得到10次测定峰面积RSD为1.0%,这说明样品溶液在48 h内稳定。
2.5 回收率试验 精密量取已知含量的配伍液3份,分别加入帕瑞昔布钠对照品适量,用稀释剂乙腈-水(体积比48∶52)稀释成高、中、低3种浓度溶液,按上述色谱条件进样10 μl,测定峰面积,代入回归方程计算浓度,并计算各浓度水平的回收率,结果分别为103.4%、98.5%、92.6%,RSD分别为0.4%、0.9%、0.6%,结果平均回收率为98.2%,均在90%~110%内,符合测定要求。
3 配伍稳定性试验
3.1 配伍液的制备 根据临床用药给药途径的不同,分别配制5种帕瑞昔布钠静脉镇痛液,药物浓度模拟临床用药 浓度。
配伍液A:取注射用帕瑞昔布钠80 mg,抽取4 ml 0.9%氯化钠注射液溶解帕瑞昔布钠后,用0.9%氯化钠注射液稀释至500 ml,置于聚丙烯塑料瓶中,在室温条件下不避光 保存。
配伍液B:取注射用帕瑞昔布钠80 mg,抽取4 ml 0.9%氯化钠注射液溶解帕瑞昔布钠后,用0.9%氯化钠注射液稀释至500ml,置于非PVC输液袋中,在室温条件下不避光 保存。
配伍液C:取注射用帕瑞昔布钠80mg,抽取4 ml 0.9%氯化钠注射液溶解帕瑞昔布钠后,用0.9%氯化钠注射液稀释至500 ml,置于玻璃输液瓶,在室温条件下不避光保存。
配伍液D:取注射用帕瑞昔布钠80 mg,抽取2 ml 0.9%氯化钠注射液溶解帕瑞昔布钠后,用0.9%氯化钠注射液稀释至100 ml,置于50 ml一次性使用注射器中,在室温条件下避光保存。
配伍液E:取注射用帕瑞昔布钠80 mg,抽取4 ml 0.9%氯化钠注射液溶解后,用0.9%氯化钠注射液稀释至500 ml,置于一次性使用流量设定微调式输液器中,在室温条件下不避光保存。
3.2 外观、pH值变化 配伍液A、B、C分别在0、2、4、6、8、10、12、24、36、48 h观察外观变化并测定对应的pH值;配伍液D、E分别在0、2、4、8、12、24、36、48 h观察外观变化并测定对应的pH值。
3.3 相对百分含量变化 精密吸取各组配伍液1.0 ml,置于10 ml的量瓶中,用稀释剂乙腈-水(体积比48∶52)稀释至刻度,摇匀,按上述色谱条件进样10 μl。测定峰面积,将不同时间(配伍液A、B、C、D、E)测得的峰面积代入线性同归方程。以0 h含量为100.0%,计算各时间点的帕瑞昔布钠相对百分含量。见表1,表2,表3,表4,表5。
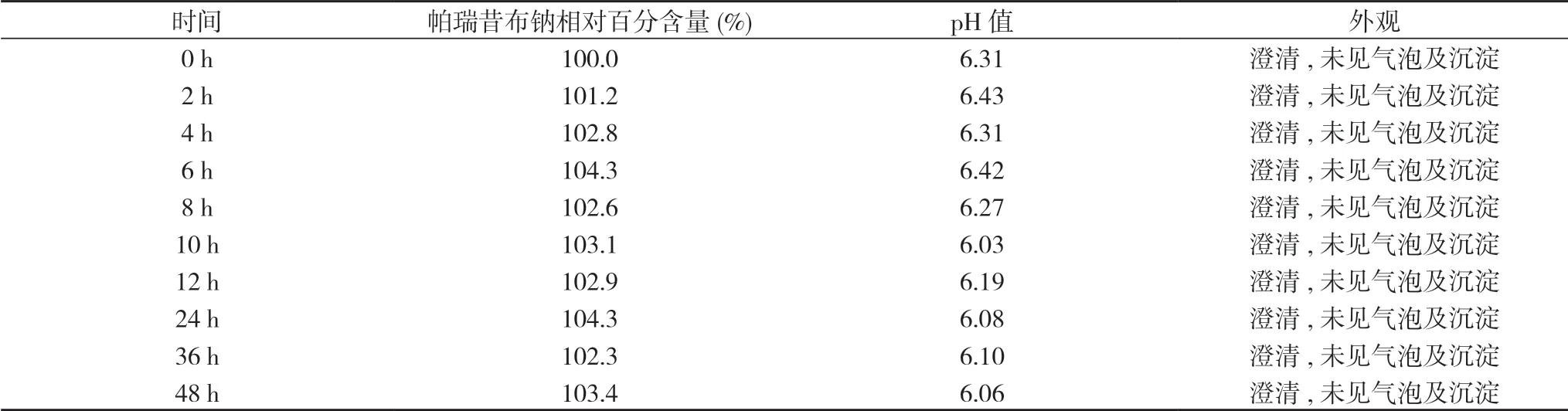
表1 帕瑞昔布钠配伍液在聚丙烯塑料瓶中外观、pH值与含量改变情况

表2 帕瑞昔布钠配伍液在非PVC输液袋中外观、pH值与含量改变情况

表3 帕瑞昔布钠配伍液在玻璃输液瓶中外观、pH值与含量改变情况

表4 帕瑞昔布钠配伍液在50 ml一次性使用注射器中外观、pH值与含量改变情况

表5 帕瑞昔布钠配伍液在一次性使用流量设定微调式输液器中外观、pH值与含量改变情况
4 讨论
在临床用药过程中,发现注射用帕瑞昔布钠与几十种药物配伍时出现乳白色混浊伴沉淀物形成,这些是否也与输液器具有关?因此进行了本试验与观察。结果注射用帕瑞昔布钠与0.9%氯化钠注射液在聚丙烯塑料瓶、非PVC输液袋、玻璃输液瓶、50 ml一次性使用注射器、一次性使用流量设定微调式输液器中配伍后,其pH值在48 h内未发生明显改变,其外观在48 h内保持澄清,外观性状未发生改变,帕瑞昔布钠相对百分含量在48 h内未发生明显变化,而且据相关的文献加速试验中[9]表明发现有关物质的明显增长主要是由于原料药中伐地昔布的降解产生,与输液器具无关。结果表明注射用帕瑞昔布钠与0.9%氯化钠注射液在这5类常用输液器中48 h接触,具有良好的化学稳定性、未产生生理毒副作用等显著特性。
综上所述,注射用帕瑞昔布钠与聚丙烯塑料瓶、非PVC输液袋、玻璃输液瓶、50 ml一次性使用注射器、一次性使用流量设定微调式输液器配伍是安全稳定的。
