微生物合成己酸的基本原理:能量代谢及影响因素
2023-01-07马鸿志武文宇于子强赵继华汪群慧
马鸿志,武文宇,于子强,赵继华,高 明,汪群慧
1) 北京科技大学能源与环境工程学院环境科学与工程系,北京 100083 2) 工业典型污染物资源化处理北京市重点实验室,北京 100083
随着有机废物处理压力的日益增大,开发合适的有机废物资源化技术迫在眉睫[1].微生物合成己酸是一种基于羧酸平台的技术,将短链的醇、酸通过厌氧发酵中的β 氧化逆循环进行碳链延长,合成高价值的己酸[2].β 氧化逆循环是一种在乙酰辅酶A 辅助下,通过逆β 氧化将羧酸的碳链每次延长两个碳的厌氧代谢途径.每次逆β 氧化为一个循环,其中代谢模式与相关酶基本一致.以乙酸为例,乙酸在第一次逆β 氧化中被乙酰辅酶A 延长碳链为丁酸,之后丁酸在第二次逆β 氧化中被乙酰辅酶A 延长为己酸.
在己酸合成过程中,合适的微生物十分重要,以纯菌(如以乙醇为底物的克氏梭菌(Clostridium kluyveri)和以乳酸为底物的埃氏巨型球菌(Megasphaera elsdeniiin))为接种物,以乙醇、乳酸以及乙酸为底物的微生物合成己酸技术已较为成熟[3].近年来,以低成本混菌为接种物,以实际有机废物为底物的微生物合成己酸技术在资源化领域取得了一定的成就.Wu 等[4]将富含乳酸、乙醇的中国酿酒废水作为底物,以酿酒厂窖泥与污水处理厂剩余污泥作为混合接种物,进行了序批式实验,产物中己酸质量分数达到了59.23%,产量为5.55 g·L-1,实现了酿酒废水与剩余污泥的资源化.Zhu 等[5]将富含乳酸的黄水为底物,以酿酒厂窖泥为接种物,在序批式反应器中三次增添底物,己酸产量达到23 g·L-1,产物中己酸质量分数达到了84.74%.刘春梅[6]以果蔬垃圾发酵液为底物,以污泥为接种物,在乙醇与果蔬垃圾发酵液质量比为4∶1,pH值为7.5 的条件下,己酸产量达到了14.9 g·L-1.
尽管微生物合成己酸在有机废物资源化领域得到了一定的成果,但仍存在着影响因素过多、产量较低等问题[7].目前的研究多介绍微生物合成己酸过程中的功能微生物、底物种类以及产物产率[8-9].同时,在机理描述时往往忽略各反应步骤之间的能量代谢与还原酶的供给关系[10].β 氧化逆循环过程中涉及多个与能量代谢相关的步骤,以及与热力学相关的还原酶供给关系,对能量代谢与还原酶供给关系的明确有助于明晰反应机理,提高产物产率.本研究将介绍碳链延长的基本原理,并开展对碳链延长过程中的能量、还原酶供给关系的分析,结合研究现状介绍微生物合成己酸过程中的两种典型影响因素:pH 与顶空气体,并分析其作用机理.综述生物电化学强化己酸合成的研究进展,探讨该技术目前的局限性以及未来的发展方向,以期提供将己酸产率提高的策略.
1 微生物合成己酸途径与能量、还原酶的供给关系
微生物合成己酸是通过β 氧化逆循环实现的,在这个过程中发生了电子供体的氧化与电子受体的还原.一般常用乙醇与乳酸作为电子供体,乙酸作为电子受体.由于乙醇与乳酸的代谢途径不同,将分别进行讨论,并探讨其中的竞争途径.此外,将对电子受体的还原以及整个β 氧化逆循环过程中的能量代谢与还原酶的供给关系进行分析.
1.1 乳酸作为电子供体的氧化过程
图1 为乳酸作为电子供体参与β 氧化逆循环的代谢途径,乳酸首先被乳酸脱氢酶氧化为丙酮酸,之后与发酵液中的辅酶A 结合生成乙酰辅酶A(Acetyl-CoA).值得注意的是,在乳酸厌氧发酵过程中,存在着竞争途径.当乳酸浓度过高时,乳酸会被转化为丙烯酰辅酶A,从而进行奇数碳的碳链延长(丙酸、戊酸),无法生成偶数碳的己酸.一旦乳酸-丙烯酸酯途径开始占主导,偶数碳的己酸合成将很难开展[11].然而,由于不同研究中发酵系统的微生物多样性与设备复杂性,很难确定乳酸-丙烯酸酯途径的乳酸浓度阈值.在Prabhu等[12]接种纯菌(Megasphaera elsdeniiin)乳酸碳链延长研究中,乳酸质量浓度达到3.15 g·L-1时乳酸-丙烯酸酯途径已经占主导地位;在Kucek 等[11]的升流式厌氧连续流反应器中,乳酸质量浓度负荷为8.50 g·L-1·d-1时,偶数碳的己酸合成占主导地位,当乳酸质量浓度负荷提升到15.14 g·L-1·d-1时,乳酸-丙烯酸酯途径占主导地位;在Zhu 等[5]的厌氧反应器中,尽管乳酸投加量高达30 g·L-1,偶数碳的己酸合成仍占主导地位.因此,在以乳酸作为电子供体时,为避免乳酸-丙烯酸酯途径的竞争,乳酸浓度不宜过高,决定主导途径的乳酸浓度阈值需要结合实际情况确定.
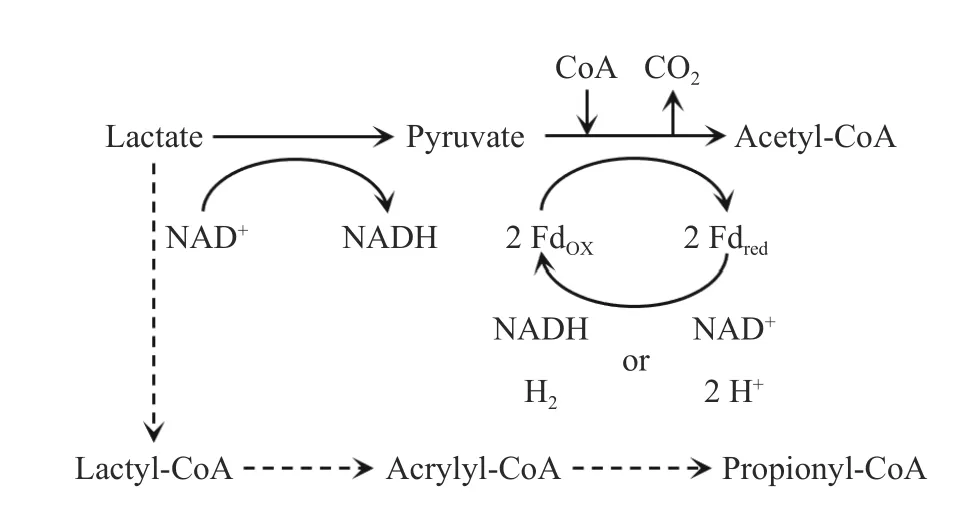
图1 乳酸的乙酰辅酶A 氧化途径和其竞争途径Fig.1 Acetyl-CoA oxidation pathway and competitive pathway of lactic acid
除竞争途径外,乳酸代谢过程还存在着不同的电子选择路径.丙酮酸向乙酰辅酶A 的转化过程中存在着Rnf(一种以NAD+(还原性辅酶Ⅰ的氧化形式)为电子受体的酶复合物,命名来源于Rhodobacter capsulatusnitrogen fixation,即荚膜红杆菌的固氮行为)电子传递链与Ech(Energy-converting ferredoxin-dependent hydrogenase complexoll,以质子为电子受体的酶复合物)电子传递链这两种选择路径,前者会消耗NAD+,后者则消耗质子[13].尽管两种电子传递链的转化目标都为乙酰辅酶A,但Ech 电子传递链会显著升高厌氧系统的pH,导致发酵体系pH 失衡,从而使β 氧化逆循环受到不良的影响[14].因此,Rnf 电子传递链是乳酸代谢过程中更佳的选择路径,在确定Ech 电子传递链存在时应及时调控发酵液的pH,避免发酵体系pH失衡.
图中,CoA 表示酶,NADH 为还原性辅酶Ⅰ,NAD+为还原性辅酶Ⅰ的氧化形式,Fdred为还原态铁氧还蛋白,FdOX氧化态铁氧还蛋白.
1.2 乙醇作为电子供体的氧化过程
乙醇作为电子供体参与β 氧化逆循环,其代谢途径如图2 所示:乙醇首先被乙醇脱氢酶氧化为乙醛,乙醛被乙醛脱氢酶氧化为乙酰辅酶A.此时,部分乙酰辅酶A 可能会被氧化为乙酸,乙酸作为电子受体参与后续反应.需要注意的是,乙酸作为乙酸营养型产甲烷菌的底物,可能被消耗进行甲烷的合成,导致电子受体的流失,通常采用pH调节与添加产甲烷抑制剂对产甲烷菌进行抑制[9,15].另外一种对乙醇转化己酸的抑制途径是乙醇的过度氧化(Excessive ethanol oxidation,EEO)[16].EEO 主要由于CO2分压过高导致,该竞争途径会使得更多的乙酰辅酶A 转化为乙酸,导致后续步骤中乙酰辅酶A 的缺失,从而使己酸的合成受到抑制.因此,在己酸合成中应时刻监测发酵液的乙酸浓度与顶空气体组成,当乙酸浓度升高时调整反应器的相关参数,从而避免EEO 的发生.
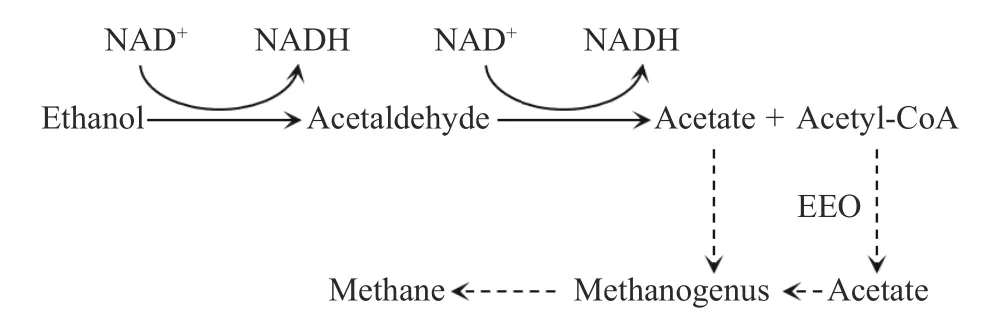
图2 乙醇的乙酰辅酶A 氧化途径和其竞争途径Fig.2 Acetyl-CoA oxidation pathway and competitive pathway of ethanol
1.3 电子受体的还原
β 氧化逆循环也需要电子受体的还原,一般是指乙酸还原为丁酸,丁酸还原为己酸.其还原途径如图3 所示:乙酰辅酶A 自我缩合,生成乙酰乙酰辅酶A,之后在还原型辅酶Ⅱ(NAD(P)H)的作用下还原并脱水,转化为丁烯酰辅酶A.丁烯酰辅酶A 被丁酰辅酶A 脱氢酶还原为丁酰辅酶A 后,与乙酸结合生成丁酸与乙酰辅酶A.丁酰辅酶A 也可以与乙酰辅酶A 结合,在经过还原脱水后被己酰辅酶A 脱氢酶还原为己酰辅酶A,之后结合丁酸生成己酸与丁酰辅酶A,完成一次乙酸向己酸的转化[13].综上,乙酸的碳链被乙酰辅酶A 延长两个碳生成丁酸,丁酸的碳链再被丁酰辅酶A 与乙酰辅酶A 延长两个碳生成己酸.在微生物合成己酸过程中,丁酸作为中间产物会被首先合成,之后再进行己酸的合成,两者的时间间隔范围可从短约2 h 至长达144 h 不等[4,17].
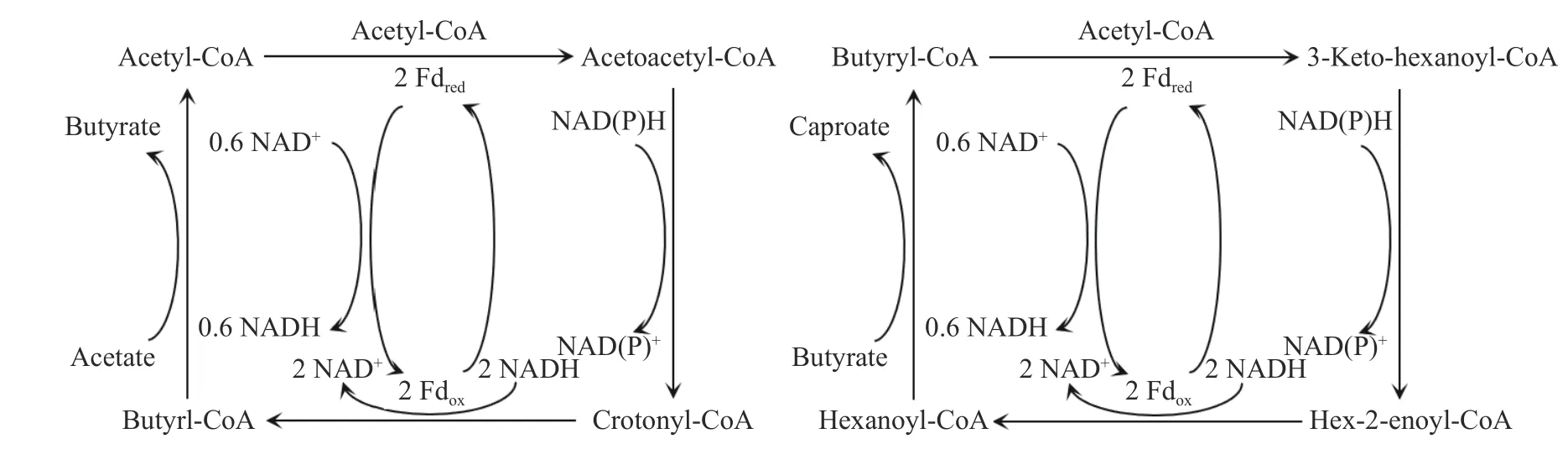
图3 丁酸与己酸的生成机理Fig.3 Diagrams illustrating the mechanism of formation of butyric and caproic acids
1.4 还原酶的供给与能量代谢
β 氧化逆循环过程中存在许多还原型辅酶Ⅰ(Nicotinamide adenine dinucleotide,NADH)参与的氧化还原反应,同时会有反应能量的变化,本节将重点介绍β 氧化逆循环过程中的还原酶供给关系与能量代谢.
1.4.1 还原酶的供给
乙醇和乳酸向乙酰辅酶A 的转化都是在NAD+的作用下实现的.在氧化过程中,NAD+会从中间产物得到H+,并从电子供体处得到电子,完成向NADH 的转化.1 mol 乙醇转化为1 mol 乙酰辅酶A 时会转化2 mol NAD+为NADH.1 mol 乳酸转化为1 mol 乙酰辅酶A 时,通过Rnf 电子传递链会转化2 mol NAD+为NADH,通过Ech 电子传递链时会转化1 mol NAD+为NADH.丁酸与己酸的生成需要NADH 的参与.每1 mol 乙酰辅酶A 生成1 mol 丁酸(己酸),丁酰辅酶A 脱氢酶(己酰辅酶A 脱氢酶)需消耗1.4 mol NADH(消耗2 mol NADH,但同时铁氧化还原蛋白的转化会生成0.6 mol NADH)[18].综上,如图4 所示,电子供体氧化生产NADH,而电子受体还原消耗NADH.因此,1 mol电子供体向1 mol 乙酰辅酶A 转化生成的1~2 mol NADH,可以提供到1 mol 乙酰辅酶A 向1 mol丁酸或己酸的转化过程中.
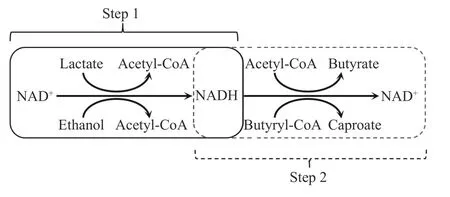
图4 β 氧化逆循环中还原酶的供给Fig.4 Reductase supply in reverse β oxidation
1.4.2 能量的供给与电子分岔
厌氧发酵过程中微生物需要足够的能量维持自身的生长代谢.不同于好氧过程,厌氧发酵过程中由于缺乏氧气作为电子受体,部分能量伴随电子供体中电子的转移而进入到其他电子受体中,如β 氧化逆循环中的己酸.因此,在合成己酸过程中,微生物往往会选择最佳途径来保证足够的能量供给,明确β 氧化逆循环过程中的能量代谢至关重要.本部分内容将总结细化前文的己酸合成途径,并标注关键的能量代谢位点,从酶与电子传递的角度进一步明确微生物合成己酸过程中ATP的合成与厌氧微生物对不同电子氧化还原电位的利用.
β 氧化逆循环过程中伴随着底物水平磷酸化(Substrate level phosphorylation,SLP)与电子传递磷酸化(Electron transport phosphorylation,ETP)两种ATP 合成方式[19].前者来源于磷酸基团向二磷酸腺苷(Adenosine diphosphate,ADP)的转移,后者来源于电化学离子梯度作用下还原态铁氧还蛋白(Fdred)向氧化态铁氧还蛋白(FdOX)的氧化.图5与图6 分别展示了电子供体氧化与电子受体还原过程中的ATP 合成.如图5 所示,SLP 发生在乙酰辅酶A 被氧化为乙酸的过程中,乙酰辅酶A 先转化为磷酸乙酰酐,之后磷酸乙酰酐的磷酸基脱落,发酵液中游离的ADP 会与磷酸基结合,进而生成三磷酸腺苷(Adenosine triphosphate,ATP),即能量.同理,丁酰辅酶与己酰辅酶A 被氧化为丁酸和己酸时也会产生ATP[20].然而,如图6 所示,在β 氧化逆循环中,该过程有乙酸或丁酸的参与,则不会产生ATP.β 氧化逆循环中丁酰辅酶A(己酰辅酶A)到丁酸(己酸)的步骤类似于基团的交换,而SLP 则是由氧化过程中磷酸基脱落造成的,这是两种本质不同但产物相同的反应类型.若微生物将丁酰辅酶A(己酰辅酶A)通过SLP 转化为丁酸(己酸),尽管ATP 产量增加,但将导致乙酰辅酶A 缺失,从而导致β 氧化逆循环受阻,使碳链延长过程停滞在丁酸.从能量代谢的角度来说,若β 氧化逆循环中碳链延长被停滞在丁酸,则可能是因为微生物需要通过SLP 供给的能量维持自身生长代谢,而非通过β 氧化逆循环将能量转移到己酸中导致的.ETP 发生在丙酮酸的氧化(图5)与丁烯酰辅酶A、2-己烯酰辅酶A 的还原过程(图6)中,这些过程都涉及Fdred的氧化.如图5 所示,这种氧化是在Rnf 或Ech 上发生的,Na+或H+向胞外移动,形成离子电化学梯度,此时ATP 合成酶会结合胞外的离子电化学梯度进行ATP 的生产[14].这两种来源不同的ATP 都可以在电子受体还原时为碳链的延长提供能量.

图5 电子供体氧化过程中的能量代谢Fig.5 Energy metabolism during electron donor oxidation
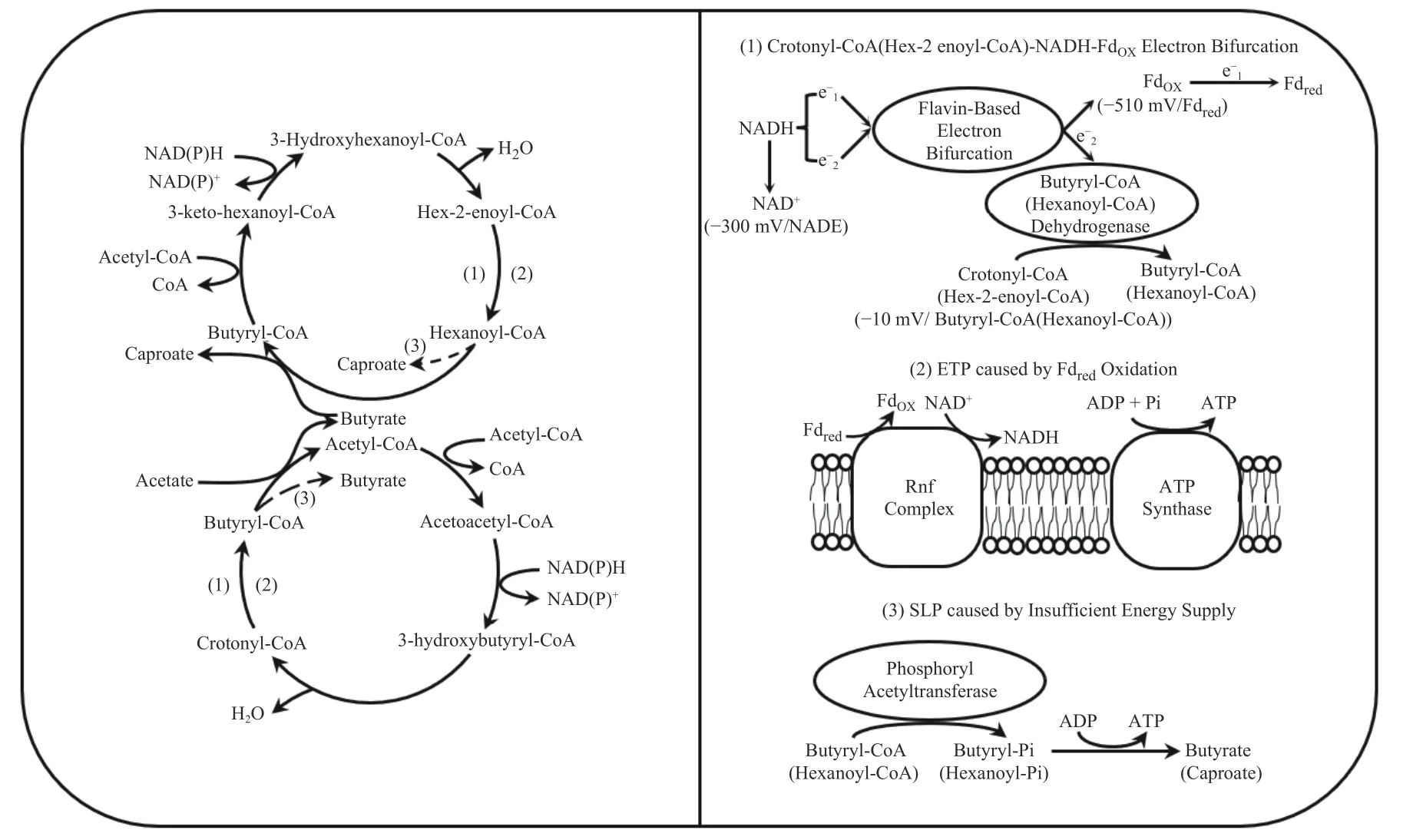
图6 电子受体还原过程中的能量代谢Fig.6 Energy metabolism during electron acceptor reduction
在ETP 过程中Fdred被氧化为FdOX,之后FdOX需要被还原为Fdred继续参与电子的传递,维持微生物的基础代谢.然而,FdOX向Fdred的转化是热力学困难的过程,因为此电对的氧化还原电势E(FdOX/Fdred)=-510 mV,在厌氧发酵中基本不存在可以还原FdOX的电对(E(H+/H2)=-414 mV,E(NAD+/NADH)=-300 mV)[21].为解释FdOX还原的热力学不利,在早期的研究中,Thauer 等[22]认为乙酰辅酶A 是这一过程的高度特异性激活剂,然而这种假设并不能从热力学上得到支持.Kaplan和Kennedy[23]则认为厌氧微生物会避免通过ETP获取能量,因当时的研究并未明确NADH 可以还原FdOX.
近些年来,电子分岔的发现给出了答案.Seedorf 等[24]提出了一种Clostridium kluyveri通过耦合放能反应来驱动耗能反应进行的假设.Herrmann 等[19]细化了这种代谢方式,并提出了厌氧微生物的电子分岔理论.从热力学的角度来讲,电子分岔是指一个热力学无法自发进行的反应(ΔG>0)被另一个热力学自发进行的反应(ΔG<0)所激活了,这与Seedorf 等[24]的观点相同.从电子传递的角度来讲,电子分岔是指来源于相同分子的一对电子(该对电子不一定都存在于同一个分子中,但必须是同一种分子)被一种黄素基电子传递蛋白所分开,分别置于高电位与低电位.以Clostridium kluyveri引导的碳链延长过程为例,NADH 在电子分岔的作用下将FdOX还原.图6 介绍了该过程中的电子传递,将来自NADH 的两个电子分别命名为e-1与e-2.在丁烯酰辅酶A 还原的过程中,Clostridium kluyveri的黄素基电子传递蛋白与丁酰辅酶A 脱氢酶紧密结合形成复合物,一分子的NADH 的e-1与e-2被该复合物分开,e-2进入丁酰辅酶A 脱氢酶参与丁烯酰辅酶A 的还原(E(丁烯酰辅酶A/丁酰辅酶A)=-10 mV);e-1进入到FdOX中,之后下一个分子的NADH 将一个电子提供到FdOX中,实现FdOX向Fdred的还原(式(1)).从氧化还原电位的角度来说,各具有-300 mV 还原力的NADH 中的一对电子,其中一个电子仅发挥了-10 mV 的还原力去还原丁烯酰辅酶A,理论上这多余的还原力无法继续参与该对电子的反应,然而电子分岔使得该还原力转移到了另一个电子上,使得其能发挥至少-510 mV 的还原力,将FdOX还原.

除此之外,H2也可以通过电子分岔将FdOX还原,且不需要借助脱氢酶.如图5 所示,氢气的e-1与e-2被分开,其中e-2电子进入电势更高的状态,将NAD+还原为NADH,e-1进入FdOX,下一对氢气的电子重复此过程,则能实现FdOX的还原(式(2))[25].
如图5 所示,在乳酸的氧化中同样存在电子分岔现象.这种分岔表现于乳酸向丙酮酸的转化可以通过电子分岔进行逆向反应,NADH 中的e-1与e-2分别将丙酮酸(E(丙酮酸/乳酸)=-190 mV)与FdOX还原(式(3))[26].

电子分岔被认为是厌氧微生物中能量代谢的重要过程.厌氧发酵过程的热力学不利在于微生物代谢缺乏足够的能量供给.在这种情况下,微生物需要减少能量的损耗.电子分岔可以将厌氧环境中还原型物质的还原电位进一步的转化为ATP.从能量的角度来说,在β 氧化逆循环中,电子分岔可以从SLP 和ETP 两个方面为微生物提供能量.以乙酰辅酶A 的代谢的为例,1 mol 乙酰辅酶A 氧化为1 mol 乙酸提供1 mol ATP,还原为丁酸提供0.5 mol ATP(此处假设不再进行β 氧化逆循环).当电子分岔不发生时,1 mol 丁烯酰辅酶A 转化为丁酸需要1 mol NADH,而当NADH 的电子被电子分岔分开至FdOX与丁酰辅酶A 脱氢酶时,1 mol 丁烯酰辅酶A 转化为丁酸则需要2 mol NADH[19].因此,更大的NADH 需求量导致乙酰辅酶A 更少的转化为丁酸,而是转化为乙酸,从而加强了SLP 的能量供给.因该过程中电子分岔的发生导致更多Fdred的生成,由Fdred驱动的ETP 更加剧烈,ETP 的能量供给也被加强.从还原力的角度来说,电子分岔避免了还原力的浪费,例如前文中描述的,分别具有-300 mV 氧化还原电位的NADH 的一对电子,其中一个发挥了-10 mV 的还原力将丁烯酰辅酶A 还原后,该氧化还原电位差值并没有被浪费,而是被转移到了另一个电子中,使其能发挥-510 mV 的还原力.
在碳链延长过程中,电子分岔可以分为三种,第一种是导致乙酰辅酶A 氧化的丁酰辅酶A 脱氢酶-NADH-FdOX电子分岔,第二种是NAD+-H2-FdOX电子分岔,第三种是可逆的丙酮酸-NADHFdOX电子分岔.在β 氧化逆循环中对第一种电子分岔的抑制可以提高碳链延长效率,对第二种电子分岔的促进可能会向厌氧系统提供更强的还原力,第三种电子分岔导致的乳酸氧化受阻暂未见报道.值得关注的是,当第一种电子分岔发生时,乙酰辅酶A 被更多的转化为乙酸,这是EEO 的一个表现.因此有理由怀疑,丁酰辅酶A 脱氢酶-NADH-FdOX电子分岔与EEO 有关,或者能调控EEO.随着电子分岔研究的深入,寻找合适的手段去调控电子分岔的发生甚至电子的流向,可能将进一步提高己酸甚至更长链酸的产量.
2 影响因素
2.1 PH
pH 是微生物合成己酸过程中的重要影响因素,合理地调控会大幅度提高己酸的产量.pH 会从功能微生物的偏好范围、产物累积以及竞争途径三方面影响己酸的生成.下面分别就pH 对乳酸和乙醇为电子供体开展碳链延长的影响进行讨论.
2.1.1 pH 对以乙醇为电子供体的碳链延长的影响
Clostridium kluyveri是一种研究最多,应用最广的以乙醇为底物的己酸功能菌.研究表明,Clostridium kluyveri可以在pH 为5.2~8.0 的范围内生长[27].在β 氧化逆循环过程中,Clostridium kluyver在pH 为6.8 时获得最高的己酸产率,pH 从7.0 到5.5 的降低会导致己酸功能菌的生长率降低约40%[28-29].San-Valero 等[30]以Clostridium kluyveri为接种物,在pH 为6.8 时获得了高达21.4 g·L-1的己酸产量.Zhang 等[31]研究了初始pH 对Clostridium kluyveri己酸生产的影响,发现当初始pH 为7.4 时己酸产量最高,当pH 下降至约6.6~7.0 时己酸开始迅速累积,最终获得了16.5 g·L-1的己酸产量.低的pH 会导致羧酸以未解离的方式存在,累积的羧酸会造成产物抑制[32].在Yu 等[33]的研究中,以最佳醇酸比的条件进行了不同pH 下的己酸生产.结果表明,在pH 为5.5 时,己酸生产受到抑制,丁酸成为了主要的产物.Yu 等[33]认为,更多的丁酸积累是由于微生物将底物更多代谢为丁酸,而不是未解离毒性更大的己酸.在Ge 等[34]的连续流己酸生产厌氧反应器中发现,当pH 为5.5,未离解的己酸在浓度高于0.0075 mol·L-1时会对己酸功能菌造成生物毒性,当厌氧反应器中己酸质量浓度积累到5.48 g·L-1时,微生物会更多的积累丁酸,这可能也源于微生物为避免生物毒性的一种反应.从功能微生物的最适pH 范围与产物抑制的角度来说,偏向于中性的pH 是更适合乙醇为底物的碳链延长的.然而,中性的pH 也有利于产甲烷菌的代谢,产甲烷竞争途径导致了碳源的流失[35].酸性条件可以降低产甲烷菌的活性,且产甲烷菌对于未解离羧酸的耐受能力弱于己酸功能菌[36].Wu 等[15]的研究表明,大于0.005 mol·L-1的未解离的羧酸足以完全抑制产甲烷菌,此时的pH 约为5.4,甲烷产量为0,且在不添加产甲烷抑制剂的情况下仍具有一定的己酸产率(此时己酸质量浓度约为1.91 g·L-1,相比初始pH 为6.5 时产量提高约10.76%).因此,为避免产甲烷竞争途径的影响,许多研究在pH<6 的条件下进行了以乙醇为底物的碳链延长.Vasudevan 等[37]在pH 为5.44 时获得了1 g·L-1的己酸产率.Crognale 等[38]以餐厨垃圾提取物中的乙醇为主要电子供体进行己酸生产,当有机负荷(以化学需氧量为标准)为15 g·L-1·d-1时,pH 大部分时间保持在6 以下,最终获得了4.8 g ·L-1的己酸产量.Wang等[39]以污泥为接种物的产己酸研究表明,pH 为6 时,产甲烷菌已经被抑制.这些在较低pH 进行的研究在不投加产甲烷抑制剂的条件下,实现了对甲烷菌的抑制,减少了对己酸功能菌的竞争并节约成本,但相应己酸产量较低.综上所述,pH 为5.5~6 应该是一个更合适的范围(图7).然而,该pH 范围内随着己酸产量的提高,未解离的己酸对己酸功能菌产生抑制的可能性也极高,需要开展在线提取己酸等方式从而避免产物毒性累积,但该方法会提高生产成本.在现阶段添加产甲烷菌抑制剂,采用接近中性的pH 可能是提高己酸产率更好的选择,研发经济的产物分离技术也应是微生物合成己酸的研究方向.
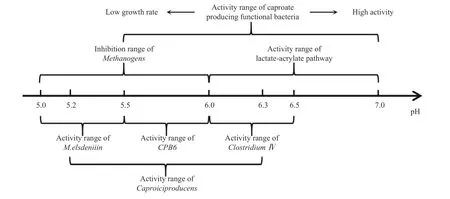
图7 几种典型己酸功能菌的pH 工作范围Fig.7 pH range of several typical caproic acid functional bacteria
2.1.2 pH 对以乳酸为电子供体的碳链延长的影响
以乳酸为底物的碳链延长过程中主要采用混菌为接种物,大部分己酸功能菌可适应偏酸性的pH 条件.Zhu 等[40]利用CPB6,一种新分离的瘤胃科菌种进行了己酸生产,发现其在pH 值为5.5~6 时表现最好.Kucek 等[11]以Megasphaera elsdeniiin为主要功能微生物菌群的驯化混菌为接种物,通过在线提取进行了以乳酸为电子供体的己酸连续生产.在这个连续生产过程中pH 值<5.5,这是因为Megasphaera elsdeniiin是一种能耐受低pH 的菌种,同时在线提取也避免了未解离己酸带来的产物抑制.偏酸性的条件同样可以抑制乳酸-丙烯酸酯途径[41].丙酸杆菌已被证明能在pH 值为6.5~7 时从乳酸中产生乙酸和丙酸,在pH值<6 时丙酸杆菌的生长速率迅速下降[42].在Xie等[43]以乳酸为电子供体,丁酸为电子受体的研究中,采用低浓度乳酸与低pH(pH 值为5.0)的调控策略,有效抑制了乳酸-丙烯酸酯途径.Candry等[41]配置了与实际废水相同构成,把糖类物质替换成乳酸的模拟废水,并接种了驯化的混菌.结果表明,pH 值>6 时乳酸-丙烯酸酯途径为主导途径,导致己酸产量极低;pH 值<6 时中虽然无法完全抑制乳酸-丙烯酸酯途径,但己酸产量明显提升.Candry 等[41]从热力学角度解释了pH 对乳酸-丙烯酸酯途径的影响,接近中性的pH 会使微生物通过乳酸-丙烯酸酯途径获得更高的能量,随着pH的降低,微生物生成己酸将获得更多的能量.在Nzeteo 等[44]以餐厨垃圾渗滤液中的乳酸为主要电子供体,Clostridiumsp.为主要己酸功能菌的己酸生产研究中,pH 降至5.5 时己酸生成速率下降,pH 降至5.0 时己酸生成被完全抑制.因此,以乳酸为底物进行碳链延长时,控制pH 在5.0~6.0 的范围既可保证己酸的生产,又可以抑制乳酸-丙烯酸酯途径的竞争.然而,由于混菌体系的复杂性,也存在例外.Zhu 等[5]利用实际废水中的乳酸生产己酸,接种物为驯化的酒窖窖泥,其中Clostridium IV是驯化混菌中的主要己酸功能菌.在pH 值为6.0~6.5 的条件下,且不进行在线提取时,最高己酸生产速率达到2.97 g·L-1·d-1.与Kucek 等[11]的研究不同的是,在pH 值>6 的情况下,Zhu 等[5]的反应器中未出现乳酸-丙烯酸酯途径的痕迹,原因可能是氧化乳酸的菌群与进行β 氧化逆循环的菌群不同,即Clostridium IV负责碳链延长,而其他菌群负责乳酸的氧化,不同菌群的相互协作使乳酸-丙烯酸酯途径受到抑制.在Gao 等[45]的酿酒废水产己酸的研究中,接种物同样为驯化的窖泥,但并未实时调控pH,pH 从6.3 降至5.2,期间每克挥发性固体获得了0.20 g 的己酸,且无乳酸-丙烯酸酯途径的干扰,主要功能菌为Caproiciproducens,这个过程中也可能存在不同菌群的相互协作.综上,以乳酸为电子供体,进行在线提取己酸时,应尽量控制pH 在5.0~6.0 的范围内,这样可避免乳酸-丙烯酸酯途径的竞争(图7).除此之外,以混菌为接种物,调控不同菌群的相互协作,可能同样会抑制乳酸-丙烯酸酯途径,同时强化己酸生产.
2.2 顶空气体
CO2与H2作为微生物合成己酸过程中的两种典型顶空气体,可以参与到β 氧化逆循环中从而提高己酸的产量,明确CO2与H2的作用机理至关重要.
在碳中和、碳达峰的背景下,CO2作为一种合适的资源化底物,其在微生物合成己酸中的应用成为了研究的热点.CO2从三个方面影响己酸的生产.第一个方面,Clostridium kluyveri可通过化能自养代谢将CO2用于合成自身的蛋白质[46].Tomlinson 和Barker[47]以乙酸盐和CO2为底物培养Clostridium kluyveri,利用同位素示踪法确认Clostridium kluyveri细胞内部25%的碳来自CO2,11%的碳来自于乙酸盐.第二个方面,CO2可以通过还原乙酰辅酶A 途径转化为乙酰辅酶A,或进一步被氧化为乙酸,从而参与β 氧化逆循环.Roghair 等[16]研究了CO2浓度负荷对碳链延长过程中乙醇消耗的影响,结果表明高CO2浓度负荷(每升底物每天通入CO22.5 L)下己酸产量为10.8 g ·L-1·d-1,低CO2浓度负荷(每升底物每天通入CO20.5 L)下己酸产量为2.9 g ·L-1·d-1.San-Valero 等[30]通过碳 酸氢钠调节pH,向发酵液中补充了CO2,己酸产量从18.3 g·L-1提升到21.4 g·L-1.第三个方面,高CO2浓度负荷会造成EEO 的发生,导致乙酰辅酶A 更多的转化为乙酸,而不是参与己酸的合成.在Roghair等[16]的研究中,高CO2浓度负荷使EEO 的影响从16%提升到了29%.Grootscholten 等[35]将每升底物的CO2的浓度负荷从2.4 L·d-1提高到4.8 L·d-1,未观察到碳链的延长,且EEO 现象更加严重.因此,提供适量的CO2有助于微生物合成己酸,但浓度负荷不宜过高,较低的浓度负荷会更高效地利用碳源转化为己酸.
H2作为还原性物质,可以降低发酵体系的氧化还原电位,同时可以被厌氧微生物利用,作为电子供体与CO2通过还原乙酰辅酶A 途径生成乙酰辅酶A 和乙酸,参与β 氧化逆循环.在pH 值为7,温度为25 ℃时,该反应ΔG=-94.96 kJ·mol-1,反应易于进行[48].除此之外,H2分压也从多个方面影响着己酸的合成.首先,H2可以通过与CO2的反应,或者本身的分压来降低CO2的分压,从而避免EEO[49].但是过高的H2分压将会导致β 氧化逆循环的能量供给不足[18].这来源于:(1)过高的H2分压使得乙酰辅酶A 向乙酸的转化受阻,进而影响SLP 提供ATP 的过程;(2)过高的H2分压抑制了Ech 上发生的H+还原,导致ETP 提供ATP 的过程受影响.尽管该情况下,微生物仍可通过前文所提及的电子分岔(如NAD+-H2-FdOX电子分岔,通过H2将FdOX还原,继而进行ETP)将H2的还原力转化为ATP,从而进行碳链的延长[24].但这种转化的完成将延长发酵时间,造成己酸合成效率的降低.Stams[50]通过热力学计算,得出H2分压<10 kPa 时可避免高分压的负面影响.过低的H2分压同样会抑制己酸的合成[13].当H2分压<10-2kPa 时,H+通过ETP 合成一个ATP 所需要的能量大于一个ATP释放的能量,造成净能量损失,使β 氧化逆循环的能量供给受到抑制[51].这种情况下微生物可能会通过脂肪酸β 氧化获取能量,导致碳链缩短[35].低H2分压主要由氢营养型产甲烷菌对H2的消耗导致.González-Tenorio 等[52]利用有机废物为底物,CO2与H2作为顶空气体进行了己酸的生产,在H2被快速代谢时检测到了甲烷的生成,其分压最高可达顶空气体的约25%.通过调整pH 或添加产甲烷抑制剂可以抑制产甲烷菌的活性,解决H2分压过低导致的己酸合成受到抑制的问题[50].Grootscholten 等[35]认为,微生物合成己酸过程中应保持H2分压>3 kPa,以此来保证对EEO 的抑制.综上所述,β 氧化逆循环中H2分压应保持在3 kPa到10 kPa 之间.
上述关于H2分压的讨论主要基于以乙醇为电子供体的己酸合成过程.当电子供体为乳酸时,过高的H2分压(H2分压>10 kPa)可能将不再造成上述不良影响.在Wu 等[32]以乳酸为电子供体的产己酸研究中,相比不添加H2,H2分压为150 kPa 时乳酸-丙烯酸酯途径被抑制,中链脂肪酸产率提高约1.65 倍.尽管高H2分压可能抑制ETP 过程从而造成能量供给障碍,但Wu 等[32]的研究中长达30 d 的发酵时间足够使微生物将H2的氧化还原电位转化为能量以供给自身生长代谢,这可能是尽管ETP 被抑制,但己酸产率仍然提高的原因.因此,在以乳酸为电子供体进行碳链延长时,提高H2分压并适当延长发酵时间,可抑制乳酸-丙烯酸酯途径并提高己酸产量.
2.3 生物电化学系统强化己酸合成
生物电化学系统(Bioelectrochemical system,BES)可以通过外加阴极增强发酵过程的还原驱动力,在微生物合成己酸中的应用成为了近年来研究的热点[53].2013 年,Eerten-Jansen 等[54]仅以乙酸为底物,在BES 中将乙酸还原为己酸,己酸产量接近0.8 g·L-1.该研究中并没有传统的电子供体(如乙醇和乳酸),表明生物阴极可以作为电子供体参与β 氧化逆循环.该研究提出了两种外加阴极电子的去向,其一是电子通过电解水转移到氢气中,然后还原乙酸为乙醇;其二是电活性微生物在阴极上直接将电子转移入细胞内,同时结合游离的H+将乙酸还原为乙醇.这两种电子流动皆表明该研究中的己酸仍来源于乙醇与乙酸驱动的β 氧化逆循环,而非构建了新的己酸合成途径.但该项研究提供了一种利用BES 生产己酸的技术,使人们意识到BES 强化己酸合成的可能性.Andersen等[55]发现对发酵液通电可以促进乳酸的碳链延长,己酸产量提高了3%,这项研究说明BES 强化了以乳酸为电子供体的己酸生产.Jiang 等[56]以乙醇与乙酸为底物,研究了生物阴极对碳链延长过程的影响.结果表明,与开路控制相比,BES 中产物的己酸电子选择性提高了约28%,这项研究说明BES 强化了以乙醇为电子供体的己酸生产.Cheng等[57]对乙醇与乙酸驱动的碳链延长进行了深入研究,评估了不同乙醇乙酸比例下BES 对己酸产量的提升,并证明己酸产量随着醇酸比的升高而升高.在醇酸比为3∶1 时,相比开路系统,BES 提高了26.1%的己酸浓度.
对CO2的固定是近些年来BES 强化己酸合成研究的重点.早期的研究发现BES 能将CO2通过厌氧发酵固定为甲烷和乙酸,这来源于生物阴极对还原乙酰辅酶A 途径的强化[58-59].Raes 等[60]以CO2与乙酸为底物进行BES 混合微生物培养,发现高电流密度会显著增加丁酸盐的累积,并生产微量的己酸.这表明生物阴极促进了CO2的还原乙酰辅酶A 途径,并且CO2通过生物阴极参与了碳链延长.近些年来,在BES 中以CO2为底物进行己酸生产受到了重视[61].Igor 等[62]以CO2为唯一碳源,在 BES 中进行了碳链的延伸,中链脂肪酸产量达到1.2 g·L-1.然而,CO2作为唯一碳源,其既要通过还原乙酰辅酶A 途径转化为乙酰辅酶A 作为电子供体,又要进一步被氧化为乙酸作为电子受体,这可能会造成底物供给的不足.因此,应该考虑将CO2与其他物质协同发酵进行己酸生产.Jiang 等[63]使用CO2和乙醇为底物进行了己酸的生产,外加阴极使产物中的己酸电子回收效率从32.22%提高到91.47%.乙醇的添加弥补了电子供体的不足,克服了以CO2为唯一碳源时存在的电子供体或电子受体缺少的问题,且BES 同时促进了CO2的还原乙酰辅酶A 途径与乙醇为电子供体的碳链延长.
综上,BES 强化己酸合成技术具有十足的潜力,与自然发酵相同的是,BES 也面临着产甲烷抑制、热力学瓶颈以及底物的供给等问题[61].不同的是,BES 对β 氧化逆循环过程的促进机理尚不清晰,且缺乏BES 对乳酸为电子供体的碳链延长的影响的研究[64].结合近些年来在厌氧微生物体内,尤其是Clostridium kluyveri内发现的电子分岔现象,可能会将外加电势与胞内的铁氧化还原蛋白的氧化还原电势结合起来,这值得深入的研究.从结构优化的角度出发,未来的研究可以通过调整电解池的参数、修饰电极以及优化产物的在线提取来提升己酸产率[65].同时,可以将基因工程、代谢工程与BES 强化己酸合成结合,提高微生物的工作效率[66].从应用的角度出发,以实际废水、废气为底物的BES 强化己酸合成也应是重点研究方向[46].
3 结论与展望
本文介绍了碳链延长过程中还原酶与能量的供给关系,分析了pH、顶空气体对碳链延长的影响机理并提供了相应策略.在β 氧化逆循环过程中,电子供体的氧化为电子受体的还原提供了还原酶,并存在三种能量合成途径:SLP、ETP,以及将氧化还原电位转化为能量的第三种能量代谢方式——电子分岔.调控电子分岔的发生以及电子的流向,可能将进一步提高己酸的产量.对以pH与顶空气体为代表的影响因素分析表明:(1)pH值<6 时可以同时实现对产甲烷途径与乳酸-丙烯酸酯途径的抑制,需要研究低成本的底物分离技术,避免己酸的毒性抑制并提高产率.现阶段添加产甲烷菌抑制剂,采用接近中性的pH 可能是提高己酸产率更好的选择;(2)CO2作为底物参与微生物合成己酸有助于碳固定,但应避免过高CO2分压引起的EEO;(3)合适的H2分压应保持在3 kPa到10 kPa 之间,以抑制乙醇过度氧化的发生,同时避免电子供体氧化的热力学不利;(4)生物电化学强化己酸合成技术具有巨大的潜力,未来应深入研究其对β 氧化逆循环过程的影响机理,并以实际废水废气为底物的开展己酸生产.
