化学反应原理图像类试题的分析
2023-01-07王海霞
王海霞
(山东省平度经济开发区高级中学)
翻开2022年湖南省和广东省普通高中学业水平选择性考试的化学卷,笔者对化学反应原理图像试题进行了如下归类.
1 催化剂对反应的影响
该类图像题的命题特点是:在其他条件相同时,以多种催化剂对同一反应的影响,考查有无催化剂时浓度的变化特征、c-t图像中曲线的确认以及反应速率的计算等.
例1 (2022年广东卷第15 题)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y 的影响,各物质浓度c随反应时间t的部分变化曲线如图1所示,则( ).

图1
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X 的浓度随t的变化
D.使用催化剂Ⅰ时,0~2min内,
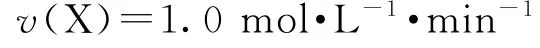
分析 催化剂能够加快反应速率,没有催化剂,反应可以进行,只是反应速率较慢,选项A 错误.由图可知,相同时间,催化剂Ⅰ比催化剂Ⅱ效果好,说明催化剂Ⅰ使反应活化能更低,选项B 错误.由反应式可知,X 的浓度减少量是Y 的浓度生成量的一半,a线与催化剂Ⅱ不满足此比例,选项C错误.a线与催化剂Ⅰ满足反应变化比例,故
选项D 正确.答案为D.
知识点拨 1)其他条件相同时,催化剂能够加快反应速率,但不改变反应的限度.
2)因为X→2Y,曲线a表示c(X)的变化,存在v(X)∶v(Y)=1∶2,即Δc(X)∶Δc(Y)=1∶2.
2 能量与反应进程的关系图像
对反应历程的探究是近年来出现的热点,主要涉及在一个反应中出现过渡态和中间产物,发生多元化反应,通过其能量变化,可以找出总反应的能量变化、决定反应速率的一步反应等.
例2 (2022年湖南卷第12题)反应物(S)转化为产物(P或P·Z)的能量与反应进程的关系如图2所示.下列有关不同反应进程的说法正确的是( ).
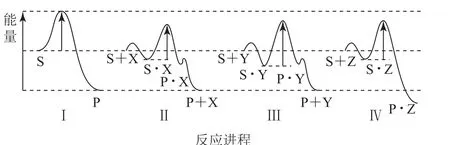
图2
A.进程Ⅰ是放热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
分析 从Ⅰ可知反应物S的总能量高于生成物P的总能量,故进程Ⅰ是放热反应,选项A 正确.进程Ⅱ中相当于在进程Ⅰ中加入了催化剂X,催化剂X 降低了反应的活化能,加快了反应速率,缩短了平衡时间,但不改变平衡时生成物P 的产率,选项B 错误.从图可知,进程Ⅲ的活化能高于进程Ⅱ的活化能,故进程Ⅲ生成P的速率比Ⅱ的小,选项C错误.进程Ⅳ中,最终的产物是P·Z,故Z没有催化作用,选项D 正确.答案为A、D.
知识点拨 1)催化剂在参与反应的历程中,改变了原来的反应进程,最终又“游离”出来.
2)催化剂降低了反应的活化能,加快了反应速率,缩短了达到平衡的时间,但不改变平衡时生成物的产率.
3 不同温度下平衡体系中不同组分的物质的量变化图像
这类问题多以某一特定的可逆反应为载体.一定条件(恒压或恒容)下,试题给出一种反应物或生成物的变化曲线,判断其他曲线代表的“物质”,推理反应的热效应特征,分析加入某一物质后平衡移动的方向或反应物平衡转化率的变化等.
例3 (2022年广东卷第13题)恒容密闭容器中,BaSO4(s)+4H2(g)⇌BaS(s)+4H2O(g).在不同温度下达平衡时,各组分的物质的量(n)如图3所示.下列说法正确的是( ).
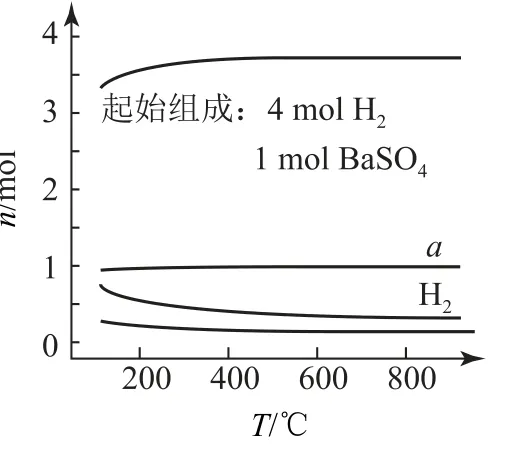
图3
A.该反应的ΔH<0
B.a为n(H2O)随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入BaSO4,H2的平衡转化率增大
分析 由图像可知,平衡时升高温度,H2的物质的量减少,H2O(g)的物质的量增加,即平衡正向移动,说明该反应的正反应是吸热反应,即ΔH>0,选项A、B错误.容器体积不变,加入与反应无关的气体,H2与H2O的浓度不变,故平衡不移动,选项C正确.加入的BaSO4为固体,不影响平衡,选项D错误.答案为C.
知识点拨 1)分析同一物质在不同温度下平衡时的物质的量:若是反应物,温度越高其量越少,说明该反应是吸热反应;若是生成物,温度越高其量越少,说明该反应是放热反应.
2)可逆反应中有固体或液体参与反应,增大其量,不影响该反应体系中的气体平衡转化率.
4 外界条件不同时,同一反应的气体压强变化的比较
在外界条件不同的反应容器中,以相同的投料进行同一反应,分析反应的热效应特征,判断反应物或生成物的物质的量变化、计算反应平衡常数、比较反应速率大小等.
例4 (2022年湖南卷第14题)向体积均为1L的两恒容容器中分别充入2molX 和1molY 发生反应:2X(g)+Y(g)⇌Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图4 所示.下列说法正确的是( ).
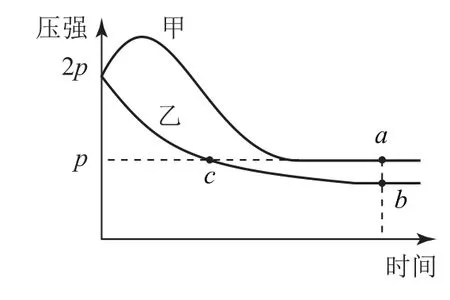
图4
A.ΔH>0
B.气体的总物质的量:na<nc
C.a点 平 衡 常数:K>12
D.反应速率:va正<vb正
分析 2X(g)+Y(g)⇌Z(g)是气体体积减小的反应,甲为绝热过程,从图像可以看出,甲曲线开始时压强增大,原因是容器温度升高,说明该反应过程放热,即ΔH<0,选项A 错误.a、c两点的压强相同,甲是绝热容器的曲线,因放出热量使容器内气体的温度高于乙,由气体状态方程可知气体的总物质的量:na<nc,选项B正确.若甲容器为恒温容器,假设生成Z的物质的量为x,结合三段式计算.

但甲是绝热容器,而反应使体系温度升高,由pV=nRT可知,气体总物质的量减少,说明反应正向进行的程度更大,故K>12,选项C正确.因为a、b两点都达到平衡,甲的温度高于乙,反应速率大于乙,选项D 错误.答案为B、C.
知识点拨 1)绝热恒容容器中反应达到平衡时反应物的转化率一定小于恒温恒容容器中的.因为绝热恒容容器中发生的反应,无论是放热还是吸热,体系温度的变化,都会减小反应正向进行的程度.
2)若在容器中发生的是正向放热的可逆反应,则绝热恒容容器中比恒温恒容容器中的反应先达到平衡,且绝热恒容容器平衡时的速率也较大.
通过对几道高考题的解读不难发现,这类问题都是“以纲扣本”的,因此,平时要认真研析“变化观念与平衡思想”,提高图像类问题的解题效率.
