人乳头状瘤病毒阳性的头颈鳞状细胞癌特异性基因生物信息学研究
2023-01-06郭丹丹杨梅龙丹徐丽张阳春张春林
郭丹丹,杨梅,龙丹,徐丽,张阳春,张春林
(遵义医科大学附属医院 耳鼻咽喉科,贵州 遵义 563000)
头颈鳞状细胞癌(鳞癌)是一种常见的恶性肿瘤,全球发病率排第六[1]。吸烟以及饮酒是公认的头颈鳞癌的致癌危险因素[2]。近些年证实人乳头状瘤病毒(human papilloma virus,HPV)感染是头颈鳞癌的独立危险因素,流行病学研究发现HPV相关的头颈鳞癌的发病率逐年升高[3]。与HPV(-)头颈鳞癌相比,HPV(+)头颈鳞癌具有淋巴结转移早,分期较晚,但对放化疗敏感,临床预后良好的特点,其机制目前尚未完全明确,可能与HPV(+)头颈鳞癌具有独特的致癌及调控机制有关[4]。此外,临床上尚无针对HPV(+)头颈鳞癌特有的基因靶点治疗。因此,本研究通过对HPV(+)及HPV(-)的头颈鳞癌基因芯片组织进行差异分析,筛选出HPV相关头颈鳞癌的特异性基因及相关通路,使用Cbioportal和癌症基因组图谱(the cancer genome atlas,TCGA)检验特异基因表达趋势以及头颈鳞癌生存预后的相关性为进一步的机制研究提供参考。
1 研究方法
1.1 基因表达谱芯片筛选
从GEO高通量基因芯片数据库中下载芯片数据集,进行芯片筛选,目标芯片入选标准:①患者头颈鳞癌标本,排除细胞株及动物;②入选芯片具有HPV检测信息;③需为基因表达芯片,各探针具有归一化的表达值;④需复核芯片质量。本研究使用的芯片数据集,编号是GSE39366,GSE52088。
1.2 信号通路富集分析和基因本体分析
京都基因和基因组(kyoto encyclopedia of genes and genomes, KEGG)数据库是一个可系统分析基因产物在细胞中的代谢途径以及产物功能的数据库,可用于系统分析基因组、生物通路、疾病、化学物质等,通过DAVID 生物信息资源数据库对差异基因进行信号通路分析和基因本体分析,并从生物学功能、细胞中的定位对基因产物进行标准化描述,对差异表达基因的生物学进程、细胞组成及分子功能进行基因本体分析,并对富集的信号通路(P<0.01)进行分析。
1.3 差异基因筛选
对两个数据集的芯片分别进行数据下载以及差异基因筛选,利用在线工具GEO高通量基因芯片数据库中2R分析各个芯片。以结合差异倍数进行综合筛选,以矫正后的P<0.01且|log差异倍数|≥ 2为标准筛选差异表达基因,并将探针标准化为基因名称,筛选出共同差异基因。
1.4 蛋白相互作用网络分析和筛选特异基因
通过在线分析工具STRING 11.0,以及Cytoscape3.8.0软件筛选关键基因。以蛋白节点存在关联作用的蛋白个数为度值,通过网络结构,根据关联积分值,获得整个网络中可能形成的蛋白质簇和关键节点蛋白,并在Cytoscape中进行可视化分析。最终筛选特异基因并对其进行分析。
1.5 数据库验证表达趋势
TCGA数据库以及表达趋势验证:通过UALCAN检索头颈鳞癌相关数据,获得来源于TCGA的正常组织44例,癌组织318例。进一步验证特异基因在TCGA数据库中HPV(+)头颈鳞癌(n=80)和HPV(-)头颈鳞癌(n=434)两个亚组瘤体组织与正常组织间的表达差异。
2 结果
2.1 患者基本临床病例信息
GEO高通量基因芯片数据库中筛选及芯片质量分析,选定GSE39366、GSE52088两个符合入选标准的芯片系列,对其Matrix文件所提供的患者相关信息进行分析,共纳入390例患者,GSE39366共保留了138例样本。基本信息见表1。检索并获得来源于TCGA的正常组织44例,癌组织318例。患者基本信息见表2。
2.2 信号通路富集分析和基因本体分析
通过DAVID 6.8生物信息资源数据库对差异基因(表1)以及特异基因(表2)在KEGG数据库中富集的信号通路进行分析,通路富集与基因本体分析的结果详见图1、2。细胞成分分析主要富集在细胞外区域,分子变化功能显示与生长因子活性相关。

图1 通过DAVID 生物信息资源数据库对差异基因进行KEGG通路富集以及GO分析生物学进程、细胞组成及分子功能

表1 患者基本信息(GSE39366) (例)

表2 患者基本信息(TCGA-头颈鳞癌) (例)
2.3 共同差异基因筛选
556个差异基因,从数据集GSE52088中筛选出305个差异基因,GSE39366中筛选出251个差异基因。进一步从中筛选出42个差异基因,数据集的重叠部分包含42个基因(图3A),其中17个下调的基因和25个上调基因。
2.4 蛋白相互作用网络分析
使用 STRING 11.0 对差异表达基因构建了蛋白互作用网络图(图3B),从中共获得17个关键基因。其中上调基因12个,下调基因5个。
2.5 Cytoscape 3.8.0软件筛选特异基因
通过 Cytoscape 软件进行关键基因可视化分析(图3C,P<0.01),从关键基因中筛选特异基因,共有4个基因被鉴定为度≥4的特异基因。该可视化分析图具有29个节点和20个边缘,可反映与节点相关联的边的条数关联度(平均节点度:1.38,平均聚类系数:0.383;P<0.01)各基因状态如表3所示。

表3 筛选出的特异基因度值

图2 通过DAVID生物信息资源数据库对特异基因进行KEGG通路富集以及GO分析生物学进程、细胞组成及分子功能

图3 使用STRING 11.0对差异表达基因构建了蛋白互作用网络图
2.6 数据库验证特异基因在头颈鳞癌样本中的表达
通过UCSC癌症浏览器构建特异基因的分层聚类,层次聚类显示它们在头颈部鳞癌样本与非癌样品中的表达差异(图4、5)。根据cBioPortal的整体生存数据绘制Kaplan-Meier曲线。结果显示IL-6、MMP1、CD44、CXCL1高表达组患者的总体生存率(overall survival rate,OS)、无病生存率(disease-free survival,DFS)较低(图6)。其中,IL-6、CD44高表达组患者的OS、DFS与低表达组患者比较,差异具有统计学意义(P<0.01);MMP1以及CXCL1高表达组患者的OS、DFS与低表达组患者比较,差异无统计学意义(P>0.01)。

图4 使用UCSC癌症浏览器构建特异基因的分层聚类

图5 IL-6
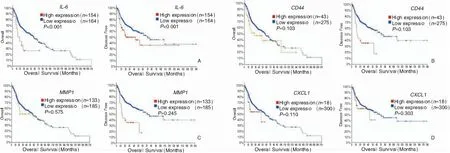
图6 头颈部鳞癌患者(n=318)中特异基因IL-6
3 讨论
近年来HPV相关的头颈鳞癌的发病率升高,且呈年轻化趋势[5],既往研究表明感染HPV是HPV(+)头颈鳞癌致病的独立危险因素[6],然而HPV(+)头颈鳞癌的致癌及调控机制目前尚未完全明确。有学者认为[7]E6、E7蛋白在HPV增殖过程中起关键作用。E6能与细胞内相关蛋白形成复合物,特异性结合P53使其降解,引起细胞无限增值。E7蛋白可结合视网膜母细胞瘤蛋白(Rb),导致细胞周期失控,因此检测HPV-DNA是诊断HPV相关头颈鳞癌的重要途径。现有多种方法可用来诊断HPV(+)头颈鳞癌,包括聚合酶链反应检测HPV-DNA或RNA,原位杂交检测HPV-DNA,免疫组化法检测HPV的癌基因E6/E7或P16蛋白等,HPV检测方法多种多样,目前尚无统一、公认的方法。Hashmi Atif等研究表明[8]P16可作为HPV相关头颈鳞癌诊断以及预后标记物。但P16蛋白的检测大多采用免疫组化法,所需样本量大,其灵敏度根据染色方法的选择而异,仅能进行半定量分析。李雅冬等[9]采用基因芯片技术检测头颈部鳞癌中的HPV-DNA序列,进而定性定量分析基因序列及表达谱,筛选基因标记进而诊断头颈鳞癌。然而国内对于HPV(+)头颈鳞癌基因标记物报道较少,HPV(+)头颈鳞癌基因靶向药物未见报道,因此本研究筛选出HPV(+)头颈鳞癌特异基因具有重要的临床以及社会价值。
既往研究已有利用生物信息学方法筛选HPV相关头颈鳞癌关键基因[10],张轶雯等[11]学者通过生物信息学方法筛选出HPV(+)口咽癌特征基因以及这些基因参与的Wnt、PI3K-Akt信号通路,但并未阐述HPV相关头颈鳞癌特征基因的研究方法,本研究通过筛选HPV(+)头颈鳞癌特征基因以及这些基因参与的生物学过程和关键通路并筛选出HPV(+)头颈鳞癌的特异性基因IL-6、CXCL1、MMP1、CD44。这些基因主要位于核周区域,主要参与细胞周期调控、NOD样受体信号通路、TNF信号通路。已有研究表明NOD介导的信号通路可促进头颈鳞癌的发展[12],肿瘤坏死因子(tumor necrosis factor, TNF)通路可诱导头颈鳞癌细胞凋亡和细胞存活[13],本研究中基因本体分析表明IL-6主要参与细胞增殖的调节[14](G1/S期、G2/M有丝分裂周期),CD44主要参与基因表达的调控[15],MMP1主要参与蛋白磷酸化的负调控[16],提示这些基因可能参与调控HPV(+)头颈鳞癌的发生发展过程。而特异基因富集于TNF信号通路途径,NOD样受体信号通路等,NOD1、NOD2通过激活核转录因子-κB(nuclear transcription factor-κB, NF-κB)信号通路诱导细胞产生促炎性因子和细胞因子,包括IL-6、IL-8、CXCL1、CXCL2等,TNF-α可通过激活NF-κB诱导MMPs基因的表达,调控细胞凋亡过程,因此,NOD样受体信号通路、TNF信号通路作为此次研究的关键通路,可能与特异基因IL-6、CXCL1共同调控HPV相关头颈鳞癌发生发展以及肿瘤侵袭过程。
Kumar等[17]研究表明头颈鳞癌中IL-6的调节与HPV感染有关,但未阐明IL-6在HPV(+) 头颈鳞癌发展及侵袭中的作用。Jian 等[18]研究发现头颈鳞癌中IL-6高表达者预后不良,然而IL-6与HPV相关的头颈鳞癌机制尚不明确。IL-6于口腔鳞状细胞癌中的报道较多,IL-6家族成员中的OSM (oncostatin M,OSM)可促进HPV(+)口腔鳞状细胞癌发生发展[18],本研究中IL-6在特异基因里度值与差异性表达程度均最高,提示IL-6可能对HPV(+)头颈鳞癌的肿瘤进展起促进作用,然而其在不同亚组瘤体组织中的作用机制仍未确定。
此外,HPV(+)头颈鳞癌患者对放化疗敏感性性比HPV(-)头颈鳞癌患者高,且本课题组前期研究已证实HPV(+)头颈细胞株对放化疗敏感性高于HPV(-)细胞株[19],但是导致这种敏感性增加的机制尚不清楚,可能与IL-6产生有关。HPV可促进肿瘤细胞分泌IL-6,从而增加敏感性[20]。已有证据表明IL-6介导的 JAK / STAT3途径可促进细胞增殖及血管生成,淋巴结转移,可能成为治疗头颈部鳞癌的潜在有用靶点[21],故IL-6有望成为HPV(+)头颈鳞癌的靶点药物。
既往研究表明MMP1与头颈鳞癌的DFS显著相关[22],且高表达组的预后显著差于低表达组。但MMP1与HPV(+)头颈鳞癌致病机制尚不清楚[23],已有研究报道MMPs作为乳腺癌[24]等恶性肿瘤靶向治疗的合适靶点,MMP1是MMPs基因家族成员,提示MMP1可能成为治疗HPV(+)头颈鳞癌的潜在药物靶点。同时,本研究结果表明CD44的表达与头颈鳞癌的DFS呈负相关,但MMP1及CXCL1与肿瘤的预后无显著相关性,这种差异可能与患者年龄、性别、职业暴露因素以及肿瘤的分期、分型、淋巴结转移程度、肿瘤浸润深度有关[25],已有学者揭示CD44可以作为头颈鳞癌潜在分子标记物[26],其在喉癌浸润转移中有重要作用,CD44介导的信号通路可能为抑制HPV(+)头颈鳞癌细胞中的顺铂耐药性提供新的药物靶点[27]。已有文献报道CXCL1在口腔鳞癌基质细胞中高表且与口腔鳞癌不良预后有关[28],故有望作为头颈鳞癌诊断预后的标志,但与头颈鳞癌发生发展相关机制尚不明确[29]。
综上,本研究筛选的特异基因中,虽然IL-6、CXCL1、MMP1、CD44在头颈鳞癌中已有报道,但在HPV相关头颈鳞癌中的研究较少,IL-6、CD44有望成为治疗HPV(+)头颈鳞癌的关键靶点,而MMP1及CXCL1可能作为诊断及预后的标志物。本研究在GEO数据库中筛选了与HPV状态相关的两个数据集,由于芯片系统检测的局限性,cDNA间可能存在相同或相似序列,可出现交叉杂交影响分析结果,往往需要Northen印迹、RT-PCR等实验在临床样本中验证。然而,IL-6、CXCL1、MMP1、CD44与头颈鳞癌及HPV的关系未见明确报道,但可作为潜在的生物学标志物进一步挖掘研究。
