我国血浆综合利用研究概述*
2023-01-06裴仁俊费章城潘波曹海军李长清
裴仁俊 费章城 潘波 曹海军 李长清
血浆是血液经离心或自然沉降,使有形成分分离后得到的淡黄色半透明液体,其中92%为水分,6%~8%为血浆蛋白质,其他为多种无机盐等物质。目前在我国,血浆来源有两种[1],一种是来源无偿献血,采集后的全血通过离心分离后获得,供临床使用;另一种来源于单采血浆,单采血浆是将人体的血液利用单采血浆机将血浆分离出来,供血液制品公司生产使用。血浆是宝贵的资源,其是血浆蛋白制品生产的必需原料,也是临床疾病治疗不可取代的药物。通常所说的血浆综合利用是指以单采血浆为原料,分离纯化出临床所需的血浆蛋白制品的过程。
我国已进入老龄化社会,根据第七次全国人口普查数据,中国60岁及以上人口占比为18.7%[2]。目前在我国,无论是献血还是单采血浆,其年龄均不能超过60岁[3]。随着老龄化程度未来几十年的不断加剧,一方面献血及献浆人数在减少;另一方面,血浆蛋白制品的使用量将逐渐增加,如何提升对血浆的综合利用水平是行业亟待解决的问题。本文对我国原料血浆的采集、血浆蛋白制品种类及制备工艺、血浆蛋白制品研究现状、促进血浆利用的相关法规等进行了较全面的综述。同时对我国血浆综合利用的发展进行了展望,以期为我国血浆综合利用水平的提升提供参考。
1 原料血浆
1.1 采集:血浆是血浆蛋白制品重要生产原料,其安全性直接关系到制品的安全。我国制品企业严格按照《单采血浆站管理办法》[4]、《血液制品管理条例》[5]、《生物制品批签发管理办法》[6]、《药品生产质量管理规范》[7]等法规对原料血浆采集、检测等环节进行管理。其中原料血浆设有检疫期,采集及检测合格的原料血浆放置90天,对献浆者血浆样本再次进行检测并合格后,方可将之前采集的血浆投入生产[8]。若企业增加病毒核酸扩增法检测(Virus nucleic acid testing, NAT)血浆样本,检疫期可缩短至60天[9]。
在我国,原料血浆通常在浆站采用单份酶联免疫法检测。合格后,生产企业再采用酶联免疫法联合NAT单份复检。检疫期结束后,再次对献浆者血浆样本进行检测,合格后方可生产使用;若献浆者后续信息缺失,按不合格血浆处理。投料生产时,再次对合并血浆采用酶联免疫法检测。欧美单采血浆站不进行血浆检测,而是在血浆检测中心采用酶联法联合NAT进行集中检测。合格后,运输到生产企业不再进行单人份检测,检疫期(60天)结束后未收到献浆者的不合格信息即可投料生产。在投料生产时,对混合血浆采用NAT进行检测,同时混合血浆样品送达药监部门批签发检验[10]。
我国原料血浆的病毒安全性检验以酶联免疫为主,欧美国家核酸检测已作为法定血液检测项目普遍开展。酶联免疫与NAT相比,窗口期较长、灵敏度低。所以,加快原料血浆NAT检测的普及,能够缩短检疫期的同时,也有利于提高血浆蛋白制品的安全性。
1.2 采集量:与欧美血浆采集量相比,我国制品公司血浆采集量相对较少,年投浆量低。2021年,据不完全统计,我国单采血浆站近300家,血浆实际采集量在1 000吨左右的制品公司有2家;800吨~900吨的有1家,500吨~800吨的有3家,400吨~500吨的有4家,200吨~400吨的有7家,有8家制品企业低于100吨。美国是世界上原料血浆采集量最多的国家,美国有2 000多个单采血浆站,年采血浆1.5~2万吨,约占全球总量的2/3[10],其不仅能够满足国内对血浆蛋白制品的需求,还有超一半的血浆以原料血浆或制品形式出口到国外。国际上认为投浆量在1 000~1 500吨最具规模效应。就投浆生产能力而言,我国有10多家公司年投浆量生产能力可达1 000吨以上,但实际投浆量远不够。特贝林(GSL behring)、基立福(Grifols)、奥克特珐玛(Octapharma)、百特(Baxalta)几家大型血液制品企业的血浆采集量占据全球市场约80%份额,血浆投浆量均在2 000吨以上,有的甚至达到6 000吨。
2 我国血浆综合利用的现状 血浆作为血浆蛋白制品的生产原料,其是整个血浆蛋白制品行业发展的根本。如何更多更好地从血浆中分离出血浆蛋白,从而制备出临床上治病救人的血浆蛋白制品,这是整个行业持续发展的关键。
2.1 血浆蛋白制品种类:已鉴定的具有生理功能的血浆蛋白种类有200多种,已明确分子结构的蛋白质有100多种,其中已上市应用于临床的有20多种[11]。目前我国血浆蛋白制品主要由人白蛋白、免疫球蛋白及凝血因子三大类组成。与国内外产品对比详见表1。在消费结构上,国外免疫球蛋白类产品占主导地位,而我国以白蛋白为主[12]。
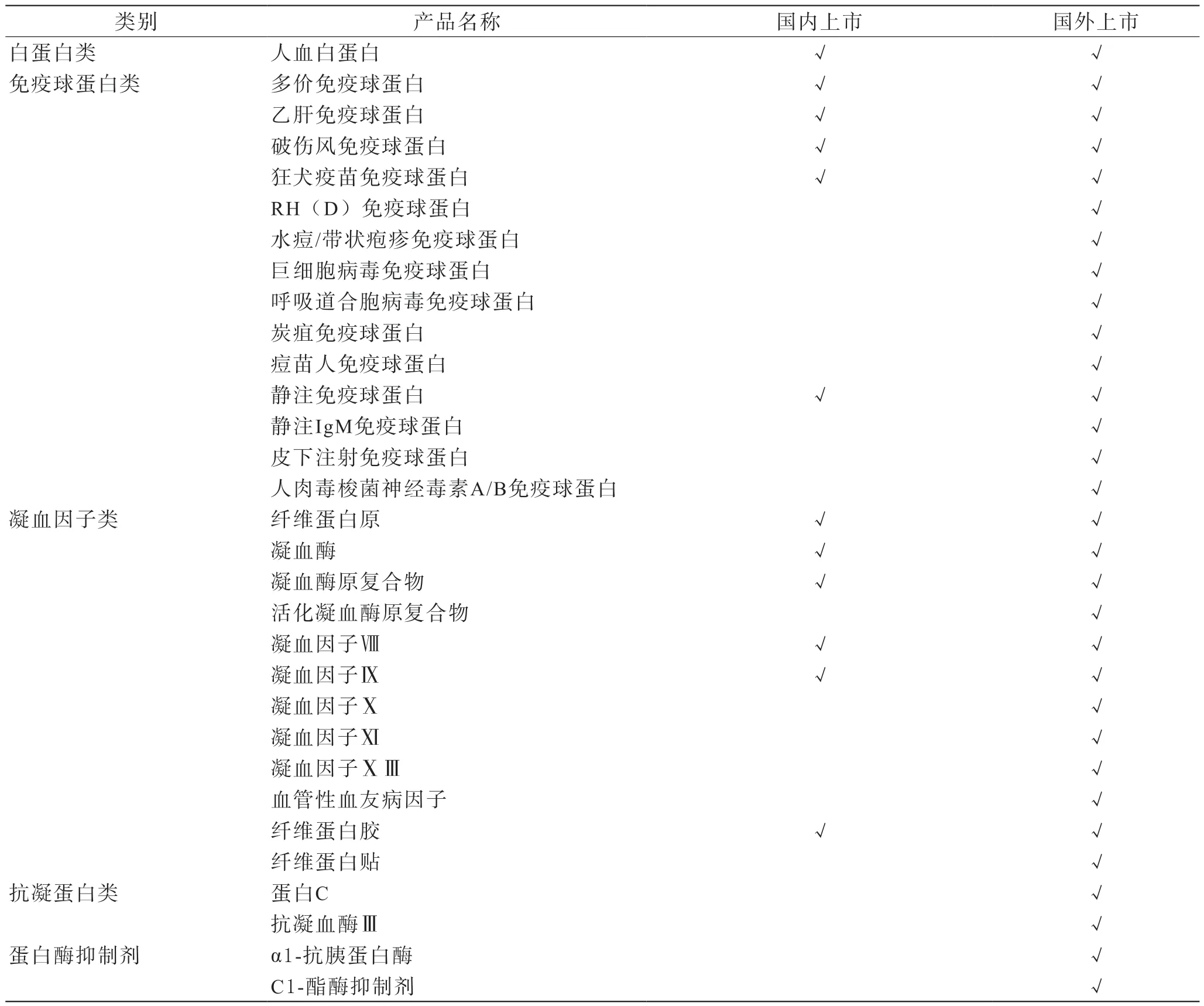
表1 国内外血浆蛋白制品种类对比
2.2 血浆蛋白制品制备工艺:血浆蛋白制品制备工艺主要包括分离纯化和病毒灭活/去除两个主要过程,前者主要保障了制品的纯度,后者保障安全性。血浆蛋白制备技术的发展得益于Cohn教授及其同事,创建的低温乙醇法分离白蛋白工艺,称为Cohn6法。1949年又创建了Cohn9法分离制备免疫球蛋白。两种方法形成了血浆蛋白分离的完整体系,即低温乙醇分离系统。Kistler-Nitschman法(K-N法)[13]是Cohn法的经典改良方法,主要通过提高乙醇的原始浓度,缩小了反应体积、提高了蛋白回收率,代表制品是白蛋白和免疫球蛋白[14]。20世纪70年代起,柱层析法逐步应用到血浆蛋白的分离提纯工艺,获得高纯度的血液制品,且回收率和自动化程度提高。20世纪90年代后期起,血液制品的生产以低温乙醇法为主,同时结合柱层析法来规模化生产多种血液制品。两者相辅相成应用于血液制品的生产中。
在制品安全性方面,病毒灭活/去除技术发挥着关键作用。其中灭活方法包括有机溶剂/去污剂法(S/D法)、巴氏灭活法、干热灭活法、低pH孵放等;去除方法有沉淀法、深层过滤、层析和纳米膜过滤法(纳滤)等。尽管辛酸盐处理、沉淀分离、深层过滤、层析等对病毒有一定的灭活或去除作用,但其与工艺中分离纯化更为密切,通常不作为独立的病毒灭活/去除方法。在我国,通常所说的病毒灭活/去除方法,其作用与缺点见表2[15]。

表2 血浆制品病毒灭活/去除方法处理的作用与缺点
2.2.1 人白蛋白:国内的人白蛋白(human serum albumin,HSA)生产工艺主要在Cohn6法基础上发展而来,采用全程压滤的方式分离组分Ⅴ沉淀[16]。该法相比于K-N法,HSA回收率提高了约10%,由于压滤过程需助滤剂和滤板,会导致Al3+含量增加[17]。杨汇川等[18]发现约20%经压滤法生产的产品白蛋白Al3+含量高于离心法生产的产品。但低温乙醇法制品收率高,且低温、乙醇及分级分馏条件能灭活及去除病毒[19]。因此,其依旧是我国白蛋白制备的主流工艺。
低温乙醇法制备的产品纯度不够高[20],为了提高白蛋白的回收率和纯度,国内外在其基础上进行优化,如结合层析法[21]。CSL公司将层析法与低温乙醇法相结合,纯度提高至99.5%,并且实现完全自动化控制[22]。层析法改变了低温乙醇法分离时间长、产品种类少、自动化程度低等缺点,同时增加了回收率,提高了血浆利用率[20]。
对于HAS,使用最普遍及成熟的病毒灭活/去除方法是巴氏消毒法。60℃、10 h是目前主要用于HSA病毒灭活的方法[23],脂包膜病毒和非脂包膜病毒均可被有效灭活,不需病毒灭活验证,只需对该法所用设施进行验证即可。然而长时间高温会对制品造成一定影响[21],常需加耐热稳定剂。欧洲药典和美国药典要求对灌装好的HAS采用巴氏消毒法进行终端病毒灭活[24-25]。CSL公司在巴氏消毒法基础上,增加了低pH孵放法。
2.2.2 免疫球蛋白类制品:国内外对静注人免疫球蛋白(intravenous immunoglobulin, IVIG)多数以改良Cohn法或者K-N法为起始步骤。国内生产IVIG均采用低温乙醇法或结合DEAE-Sepharose FF层析的方法[26]。在工艺改进方面,张学成等[27]引入阴离子交换层析(AEX),可提高IVIG的质量指标;邹炜等[28]采用MAbsortents A2P亲和层析、DEAE离子交换层析,分离出IgG纯度>98.0%,回收率>70.0%,比传统低温乙醇法回收率提高了10.0%~15.0%。
国外生产IVIG常用方法与国内相似,主要在层析工艺上存在差异。BRESOLIN等[29]采用载有ω-aminodecyl的琼脂糖层析柱,在中性pH条件下一步纯化得到免疫球蛋白;Bayer公司采用两步离子交换层析替代传统的低温乙醇法生产IVIG,生产时间由100 h缩短到30 h,回收率从48%提高到75%,成为近十年来最成功的血液综合利用的例子[30]。
IVIG病毒灭活/去除方法有:低pH值孵放、巴氏消毒、S/D灭活及纳米过滤[31-34]。低pH孵放因工艺简单、易于控制,被绝大多数血液制品公司作为IVIG制备过程中常规病毒灭活方法之一[35]。同时,低pH孵放有助于去除潜在的血栓形成因子,且能有效灭活脂包膜病毒[36-37]。此外,国内部分厂家采用巴氏消毒的病毒灭活方法。国外IVIG病毒灭活/去除常规方法为纳米过滤联合低pH孵放。我国采用20 nm级纳米过滤联合低pH孵放,已投入生产[38]。纳米过滤的应用可减少对IVIG损伤,并且可提高产品回收率。
2.2.3 人凝血因子类制品:人凝血因子的稳定性较差,需采用较温和的纯化方法。目前,凝血因子分离纯化主要采用低温乙醇法和层析法的结合,利用S/D法、干热灭活法、纳米过滤等两种及以上的病毒灭活/去除方法。最早研发的凝血因子类制品是人纤维蛋白原,因存在病毒安全性问题曾被中止上市,直到病毒灭活工艺的发展和完善才又在国内外重新获批。除此之外,我国还有凝血因子Ⅷ、凝血酶原复合物、凝血酶、凝血因子Ⅸ等产品。
2.2.3.1 人纤维蛋白原:我国制备人纤维蛋白原(Fibrinogenic,Fg)的原料包括:新鲜冰冻血浆、冷沉淀、人凝血因子Ⅷ生产废弃液。制备方法有硫酸钡沉淀法、低温乙醇沉淀法、离子交换层析法[39]。为提高Fg的回收率与纯度,赵东生等[40]利用Fractgel EMD TMAE(M)等凝胶,一步层析即可除去纤溶酶原、纤维结合蛋白和灭活剂,得到的Fg制品杂质少,纯度≥95%;刘敏亮等[41]利用组分Ⅰ为原料,分离过程中采用低温乙醇沉淀、甘氨酸沉淀两步沉淀,两步阴离子层析法,有效去除杂蛋白,Fg纯度可达95.2%。
沉淀法和层析法存在步骤繁琐、成本高等缺点。GILBERT等[42]利用冰冻血浆为原料,根据Fg的大小和电荷利用电泳技术,2 h即可完成Fg分离,所得Fg纯度>90%、回收率超过85%,并且在制备过程中可以去除细小病毒B19。该技术尚未投入生产,其与传统的分离技术截然不同,为纤维蛋白原分离供了一种新的方法。
我国Fg病毒灭活/去除通常采用S/D法和干热灭活法[43],与Fibrogen公司的Fibrogen-I®产品一致[44],而Octapharma公司的Fibryga®产品采用S/D法联合20 nm纳米过滤技术保证其安全性[45]。
2.2.3.2 人凝血因子Ⅷ:国内外主要采用化学沉淀结合离子交换层析法制备人凝血因子Ⅷ(human coagulation factor Ⅷ,FⅧ)[46]。血浆质量对FⅧ制备有很大影响,常使用Cohn法组分Ⅰ的冷沉淀物作为初始原料。在技术改进方面,菅长永[47]引入了DEAESephadex A50凝胶层析柱,可以吸附去除酸沉淀后上清液中的人凝血因子Ⅱ、Ⅶ、Ⅸ、Ⅹ、部分纤维蛋白原和大部分纤维结合蛋白,与经典的氢氧化铝吸附法相比,避免了Al3+的引入,增强了制品安全性。康丽梅等[48]用择超大孔阴离子介质POROs 50HQ进行色谱法进行纯化,工艺步骤简单,易于放大生产,回收率高达85.0%。
BURNOUF等[49]开创了DEAE-Fracto Gel TSK 650M离子交换层析方法制备高纯度的FⅧ制品。其以冷沉淀为原料,用氢氧化铝去除依赖维生素K的凝血因子,后离心获上清,上清用DEAE-Fractogel TSK 650M柱吸附,吸附后洗脱获得FⅧ。此法将传统FⅧ制品的纯度提高了200倍,而且产品的稳定性较高,国内的几家生产企业多采用此生产工艺,或在此方法的基础上进一步优化和改进。
国内外FⅧ主要采用S/D联合干热(100℃,30 min或80℃,72 h)保证产品安全性。国外在FⅧ制备中还利用纳米过滤的病毒去除技术,可以去除较小的和无包膜的病毒[50-51]。
2.2.3.3 人凝血酶原复合物:国内外生产人凝血酶原复合物(prothrombin complex concentrates,PCC)以层析技术为主,主要采用DEAE-Sephadex A-50吸附进行大规模制备。曹海军等[52]对DEAE-Sephadex A-50批式吸附过程中吸附、洗涤、洗脱条件进行了全面的探讨[53-55],经1次批式吸附,产品纯度可达2.1 IU/mg~3.3IU/mg,收率可达74.4%±10.8%。刘欣宴等[56]采用两步DEAE-Sephadex A-50凝胶吸附制备PCC,最终产品回收率在70.0%~80.0%之间,各项指标均符合中国药典要求。
国内外制备PCC除了利用层析法外,还使用了扩张床(expanded bed adsorption,EBA)技术,EBA具有流化床和固定床的优点,还能处理含有悬浮颗粒的液体且分离效率高。MCCANN等[57]采用EBA从组分Ⅰ上清中分离出PCC, 与DEAE凝胶相比,EBA在高流速下更有效,整个过程只需2.5 h,大大缩短了分离时间。国内黄亮等[58]在EBA中使用CG-6阴离子交换树脂,优化保护剂甘露醇+肝素条件下,FⅨ一次性洗脱回收率为90.7%±7.8%,回收率提高41.0%,但EBA在大规模生产中的应用尚有待进一步尝试。
S/D法和干热法联合处理能有效灭活PCC中的病毒,是目前国内外常用的病毒灭活/去除方式。
2.2.3.4 凝血酶:凝血酶制备原料通常为去冷沉淀血浆或Cohn组分Ⅲ,我国常用层析法纯化。其中离子交换层析具有快速、选择性好及大规模生产等优点被广泛应用。庾昌文[59]等以去冷沉淀为原料,通过DEAE Sephadex A-50凝胶吸附、超滤后以氯化钙激活、离子交换层析等步骤,制得的产品与国内其他工艺相比,凝血酶回收率高出约50.0%,比活可达2 600 IU/mg以上。美国AMAL等[60]以凝血酶原激活的富含凝血酶的血浆上清为原料,用DEAE-Sephalose阴离子交换剂初步纯化,再用CM-Sepharose阳离子交换分离,制备出超高纯的凝血酶,其凝血酶的比活性为9 200 IU/mg~12 650 IU/mg。
我国采用S/D病毒灭活联合纳米过滤病毒去除方式,保证制品的安全性。PETER等[61]用S/D法、纳米过滤及热处理联合对人凝血酶进行病毒灭活及去除,人凝血酶活性和稳定性不受影响。三种病毒灭活/去除方式已得到有效验证,我国可根据实际情况应用到生产中。
2.2.3.5 凝血因子Ⅸ:凝血因子Ⅸ(coagulation factor Ⅸ, FⅨ)常以去冷沉淀或新鲜冰冻血浆为原料。国内主要以离子交换联合肝素亲和层析法纯化FIX[62-63],但肝素亲和层析对FIX吸附特异性不强,比活性较低。朱光祖等[64]采用高吸附特异性的新型非Ca2+依赖型FIX免疫亲和层析替代肝素亲和层析简化了生产步骤,成品杂质少,比活性高达196.5 IU/mg。离子交换层析分离过程中交换树脂长期浸泡在高盐溶液中,但离子交换树脂耐盐性低。国外BEGIĆ[65]将三种具有代表性的离子交换树脂对比,得到硫酸盐型树脂耐盐性最强,并且硫酸盐型树脂是将凝血因子Ⅸ从维生素K依赖性凝血因子中分离的唯一方法。FⅨ制备过程,离子交换树脂、洗涤缓冲液等对FⅨ制剂的纯度及其活性回收率均产生影响。优化选择生产需求的各项工艺参数,是高纯度FⅨ制备研究的重中之重。
国内外病毒灭活方式无明显区别,使用S/D灭活联合纳米过滤去除病毒,冻干后制品经100℃、30 min干热病毒灭活。
2.2.3 血浆综合利用研究动态:近来,我们统计了国内2017年~2022年有关血浆综合利用发表的文章,约500篇,其中2020~2022年约240篇、2017~2019年约260篇。文章研究主要集中在血浆制品制备及临床治疗两大方面。血浆制品制备以血液制品公司研究为主,主要包括:工艺优化、产品质量检测、病毒灭活,针对新产品制造的工艺探索很少。此外,国内大学、科研院所、药监机构主要开展质量检测、病毒灭活、新工艺制备等方面的研究。临床治疗类文章以医院研究为主,主要研究不同制品用于常见适应证的治疗效果,极少有适应证拓展方面的研究。
对血浆的开发利用,制备出血浆蛋白制品最早起源于美国,并逐步拓展到欧洲。欧美有关血浆蛋白制品的制备研究主要集中在20世纪80、90年代,常见适应证临床研究主要在2010年前。2001年10月,国际人类蛋白质组组织在美国成立,并计划启动人类蛋白质组计划,该计划最终目标是鉴定人类全部的血浆蛋白质及其功能[66],其对血浆蛋白制品行业的发展具有一定推动作用。
我国血浆蛋白制品研发和生产起步于20世纪50年代,但直至1982年,在全国推广单采血浆技术以后才迅速发展起来。与欧美相比,我国血浆蛋白制品的相关技术研究相对滞后,基础研究薄弱。以静注人免疫球蛋白研究为例,IVIG是从数以千计健康献浆者的混合血浆中纯化而来由多克隆IgG(>95%)组成的人血浆蛋白制品,不仅含有几乎完整的人类抗体谱[67],还具有较强的抗炎[68]和免疫调节[69]等功能。2002年,DODEL等人首次在IVIg中发现了其含有Aβ的抗体[70]。之后,tau抗体、糖基化终末产物受体抗体等多种与阿尔茨海默病(alzheimer's disease,AD)病程有关的重要抗体相继在IVIG中被发现。基于此,围绕IVIG干预AD的临床试验在欧美国家不同制品公司陆续开展。自2012年,欧美制品公司已开展了5个IVIG干预AD的随机对照试验。然而,我国仅中国医学科学院、中国科学院开展相关研究[71-72]。
对于血浆蛋白制品,国内制品公司的相关研究多局限于工艺优化、质量分析,对于基础性、开拓性、前瞻性的研究几乎没有涉及。因此,我国血浆蛋白制品行业应加强制品公司、高校、科研院所间的合作,真正形成产学研一体化,提高血浆综合利用水平及推动行业的长期良性发展。
2.2.4 目前正在开发的血浆蛋白制品:我国血浆蛋白制品种类虽与欧美相比存在一定差距,但目前处于临床试验的有:炭疽免疫球蛋白、静注人免疫球蛋白(10%)、皮下注射免疫球蛋白(20%)、巨细胞病毒免疫球蛋白、抗凝血酶Ⅲ、纤维蛋白人凝血因子Ⅷ/血管性血友病因子复合物[73]、人血管性血友病因子[74]、纤溶酶原[75];处于临床前开发的有:转铁蛋白、纤维蛋白止血贴、水痘-带状疱疹免疫球蛋白、C1-酯酶抑制剂[73]、抗RhD免疫球蛋白[76]、手足口免疫球蛋白等。
由此也可以看出,我国对血浆开发技术层面已有了充分的积累,但相关的质量控制技术及方法需跟进。
2.3 我国促进血浆综合利用的相关法规及规章:1984年,我国发现使用美国进口的血源性凝血因子Ⅷ制品,有4名血友病患者感染艾滋病毒,血浆蛋白制品的安全问题第一次引起全社会的警觉。1985年卫生部颁布《关于禁止进口Ⅷ因子制剂等血液制品的通告》,要求以国内自主生产代替[77]。鉴于血液制品的特殊性和极高安全性要求,随后我国对进口血液制品采取了严格的管制措施,仅允许人血白蛋白制品的进口[78]。血浆采集及制品的制备过程,如没有严格的监管,极易导致经输血传播病原体人际感染。1996年《血液制品管理条例》明确规定要求用于血液制品的血浆必须通过单采血浆站进行,同时单采血浆站需获得省级政府卫生行政部门核发的单采血浆许可证才能进行采浆。且在一个采血区域内只能设置一个单采血浆站[5]。1998年,血浆蛋白制品生产单位实施强制性GMP认证,2001年起,我国不再批准新的制品生产企业[79]。
为了提高血浆的综合利用率,2008年出台《单采血浆站管理办法》中规定,新增单采血浆站的公司注册的血液制品不得少于6个品种,承担国家计划免疫任务的企业不少于5个品种[4]。2012年,在此基础上又要求6个品种同时包含人血白蛋白、人免疫球蛋白和人凝血因子类制品,并确定生产企业在注册血液制品品种时,同种成分不同剂型和规格的血液制品应按一个品种计算[80]。2016年,国家卫生及计划生育委员会颁布《关于促进单采血浆站健康发展的意见》,要求审批新增的单采血浆站向研发能力强、血浆综合利用率高、管理规范的血液制品生产公司倾斜[81]。这些法规及建议在一定程度上促进了国内企业对血浆的综合利用。
血浆来源方面,国际上用于血浆蛋白制品生产原料血浆包含有偿采集的单采血浆和回收血浆(来源于无偿献血体系)。美国、加拿大、澳大利亚等不少国家将血站回收血浆用于血浆蛋白制品生产。欧洲用于血浆蛋白制品生产的回收血浆比例占其血浆采集总量的80%,美国占其血浆采集总量的20%[10]。我国《献血法》《血站管理办法》《中国药典》都规定:无偿献血者的血液必须用于临床,不得买卖、不得用于血液产品生产单位的生产。《实施原料血浆检疫期管理技术指导原则》规定:用于血液产品生产的原料血浆必须进行检疫期管理。因此,受我国现行法律法规的影响,血站系统回收血浆不能用于血浆蛋白制品生产。我国每年约300吨的回收血浆[1],为了提高此部分血浆的利用率,我国行政管理部门已参照国际有关回收血浆的管理规范和技术标准,拟定回收血浆用于血浆蛋白制品生产的相关规定和技术标准。2019年,国家卫健委等5部委联合下发的《关于开展儿童血液病、恶性肿瘤医疗救治及保障管理工作的通知》中已明确指出:探索利用血站富余血浆生产血浆蛋白制品,用于血液病、恶性肿瘤患儿救治[82]。这开启了我国血站回收血浆用于血浆蛋白制品生产的大门。
在我国,政策整体框架已基本建立且日趋合理,但法律法规在鼓励浆站建设和血站富余血浆利用等方面仍需进一步完善。随着血浆蛋白制品行业不断发展,采浆能力、产能不断提高,血浆需求量也不断增多。鼓励各地政府加快浆站建设,科学规划合理布局,适当扩大采浆区域,并授权当地卫生部门,实现有效监管。血站富余血浆利用方面,国外利用其生产血液制品历时已久,可借鉴国外再利用的经验与做法,同时根据我国国情,多部门协商制定出合理的方案。
3 展望 经60多年的发展,我国血浆综合利用能力得到了长足的进步和发展,目前开发已上市的制品有3大类13种,正在研发约10余种。随着我国血浆蛋白制品种类不断丰富,我国血浆综合利用水平与欧美差距将不断缩小。此外,与欧美相比,从开发种类而言,我国差距最大的是特异性免疫球蛋白制品,但1批血浆仅能生产免疫球蛋白中的一种,从血浆实际利用能力上,我国与欧美相比,并没有想象中的差异那么大。但是,在保障制品种类满足疾病防治需求方面,须进一步提升。
血浆蛋白制品的质量分为制备质量和内在质量,制备质量满足《中国药典》最新要求即可;内在质量高于制备质量,是对药典之外制品其他内在成分及活性物质的深入评价及分析。目前,我国行业对制品内在质量重视程度不够。内在质量的把控及分析,可适当减轻各厂家同质化的恶性竞争,扩大制品的临床适应证。如人FⅧ制品,国内厂家并未对血管性血友病因子(von Willebrand Factor,vWF)活性含量进行评价及标识,富含vWF活性的人FⅧ制品适应证可扩展到对血管性血友病患者的防治。再如PCC制品,国内也未对其活化凝血因子尤其是aFⅦ的分析,含aFⅦ活性的PCC对抗体产生的甲型血友病出血具有一定的干预作用。此外,对其中蛋白C、蛋白S、蛋白Z抗凝成分的分析,在保障制品临床使用安全的同时,也为此类蛋白缺乏症患者的临床干预提供支持。
中国食品药品监督管理局批准的IVIG适应证仅有4种[83]。但FDA批准的IVIG适应证有8种,超适应证约100种[84],正因如此,全球血浆蛋白制品(不含重组凝血因子)消费结构中免疫球蛋白类市场占比51%,位居第一[85]。由于免疫球蛋白具有丰富的抗体谱且功能复杂[86],不同献浆员及制备工艺差异都会影响IVIG的内在质量[87],进而影响临床疗效。深入挖掘IVIG的内在质量,拓展其临床适应证,进一步保障国民的用药需求,这也是提升血浆综合利用水平的一种间接路径。
我国血浆蛋白制品公司具有小而分散的特点,国际竞争能力有限。为提高企业规模化,公司间的兼并或重组是有效途径。2017年,我国共签发人血白蛋白2 877批计4 082.910 2万瓶,国产人血白蛋白与进口人血白蛋白比例分别为43.13%和56.87%。人血白蛋白签发批数比上年增加8.81%,进口人血白蛋白签发批数增加9.47%[88]。由此,反映出了我国血浆蛋白制品供不应求,提升血浆采集总量及综合利用水平十分紧迫及必要。因在国内市场,血浆蛋白制品长期处于供不应求的状态,导致部分企业科研动力不足。此外,专业人才缺乏,研发资金投入少[89],也是致使部分企业品种单一,血浆综合利用水平不高的重要原因。血浆是宝贵的资源,随着我国未来几十年老龄化程度的不断加剧,对血浆采集将带来巨大冲击,如何全面提升我国血浆综合利用水平,无论是生产企业还是监管部门都应提前谋划,共同努力。其中企业间的兼并重组,加强与科研院所、高校间的合作,共享技术是一种有效的方式。
利益冲突所有作者均声明不存在利益冲突
