3株枫香优株组培快繁体系的建立
2023-01-05裴云霞汪长江胡兴宜倪天虹管兰华杜克兵
裴云霞,曹 健,汪长江,胡兴宜,倪天虹,管兰华,杜克兵*
(1.华中农业大学 园艺林学学院,武汉 430070;2.湖北省林业局林木种苗管理总站,武汉 430079;3.湖北省林业科学研究院,武汉 430075)
枫香(LiquidambarformosanaHance)为金缕梅科(Hamamelidaceae)枫香属(Liquidambar)的高大落叶乔木,广泛分布于长江流域以南地区,是我国重要的经济用材和秋色叶观赏树种.由于扦插繁殖生根率较低,生产中枫香主要以播种和嫁接繁殖为主.但播种繁殖的苗木遗传分化大,质量参差不齐;嫁接繁殖又受季节限制,需要繁殖砧木,生产成本较高[1-3].组织培养具有繁殖系数高、不受季节限制、生产成本低等特点,成为了枫香优株无性繁殖和利用的重要途径之一.当前,已有少量关于枫香组培快繁技术的研究.许林[4]以枫香的带芽茎段为外植体开展组培快繁研究,最大增殖系数达到5.3.王泽伟等[5]以北美枫香(L.styraciflua)为母本,中国枫香为父本进行杂交,选用杂种子代的子叶、子叶节和下胚轴作为外植体,建立了离体快繁体系.李颖楠[2]用枫香种子为外植体进行了组织培养研究.李亮[6]以茎段为外植体,建立了枫香、枫香“变异体”、细柄阿丁枫(Altingiagracilipes)以及半枫荷(Semiliquidambarcathayensis)的离体快繁体系,最大增殖系数达到7.0.总体来看,目前报道的文献中以枫香优株的茎段作为外植体,开展优株无性繁殖的研究还不多,且增殖系数多数不高,还有很大的发展空间.在湖北省枫香种质资源调查的基础上,筛选出了2个速生优株和1个红叶优株.为加快这3个优株的繁殖和应用,本研究以其带芽茎段为试验材料,进行了组培快繁研究,以期建立起高效的组培快繁体系,并探索不同优株对培养基成分响应的差异.
1 材料与方法
1.1 试验材料
试验材料为湖北省红安县野外选优获得的枫香优良单株1#(HA-1)、2#(HA-2)和3#(HA-3).其中,HA-1为观赏用优良单株,其特点是秋季叶色红艳美观且持续时间长,树高18.9 m、胸径41.6 cm;HA-2和HA-3为采用五株优势木法筛选的材用优良单株,特点是速生且树干通直;其中HA-2树高31.1 m、胸径44.6 cm,HA-3树高33 m、胸径60.4 cm.选取来自3株优株树干中部的当年生半木质化带芽茎段作为外植体材料.
1.2 培养条件
所有培养基均以WPM+3.0%蔗糖+0.7%琼脂为基本培养基,培养基pH值为5.8,于121 ℃、110 kPa下灭菌20 min.之后所有材料均置于(25±2)℃的组培室内培养,随机排列,光照条件为1 500~2 000 lx,光照时间为16 h/d.
1.3 初代培养
将3种试材取长2~3 cm的带芽茎段,采用张烨然等[7]的方法进行消毒(采用0.1%氯化汞,消毒时间调整为10 min),随后接种于添加不同植物生长调节剂的初代培养基中,生长调节剂组合的比例在参考路佳[8]、雷莎[9]、龚峥等[10]的基础上设定,包括6-苄氨基腺嘌呤(6-BA)、激动素(KT)、萘乙酸(NAA)和吲哚丁酸(IBA).每种培养基接种30个外植体,3次重复,每次重复接种10瓶,每瓶接种1个外植体,随机排列,激素组合编号为初代培养(initial culture)(简称IC).接种30 d后统计腋芽萌发率,筛选3种试材的最适初代培养基.
1.4 增殖培养
待腋芽生长至1~2 cm时,将幼芽切下接种到添加不同植物生长调节剂的增殖培养基中,生长调节剂组合的比例在参考李颖楠[2]、路佳[8]、吴丽君[11]、张富荣等[12]的基础上设定,包括6-BA、NAA、赤霉素(GA3)、玉米素(ZT)和油菜素内酯(BR).每种培养基接种30个外植体,5次重复,每次重复接种6瓶,每瓶接种1个外植体,随机排列,激素组合编号为增殖培养(proliferation culture,PC).接种40 d后统计增殖系数,并观测无菌苗的叶色、芽丛平均高度、愈伤组织大小和颜色等情况,筛选3种试材的最适增殖培养基.增殖系数的计算公式为:A=B/C;其中A为增殖系数,B为接种40 d时的有效芽数(个),C为接种芽总数(个),以高度达1 cm的芽记为有效芽[7].
1.5 生根培养
取高于2 cm的丛生芽为试材,接入含不同植物生长调节剂(NAA、IBA)的生根培养基中,生长调节剂组合的比例在参考李颖楠[2]、龚峥等[10]的基础上设定.每种培养基接种30个外植体,5次重复,每次重复接种6瓶,每瓶接种1个外植体,随机排列.生根率的计算公式为:D=E/F×100;其中D为接种40 d后统计的生根率,E为生根苗数(个),F为总苗数(个).通过统计生根率、根数、根长和侧根生长状况等,筛选3种试材的最佳生根培养基.
1.6 试管苗移栽
生根苗培养40 d后,打开瓶盖置于自然条件下炼苗.7 d后取出生根苗,洗净根部的培养基,移栽于营养土∶沙(1∶1)的方形营养钵中(11 cm×11 cm),覆塑料杯保湿.每个营养钵1株,15 d后移去塑料杯.40 d后统计成活率,并记录生长状况.
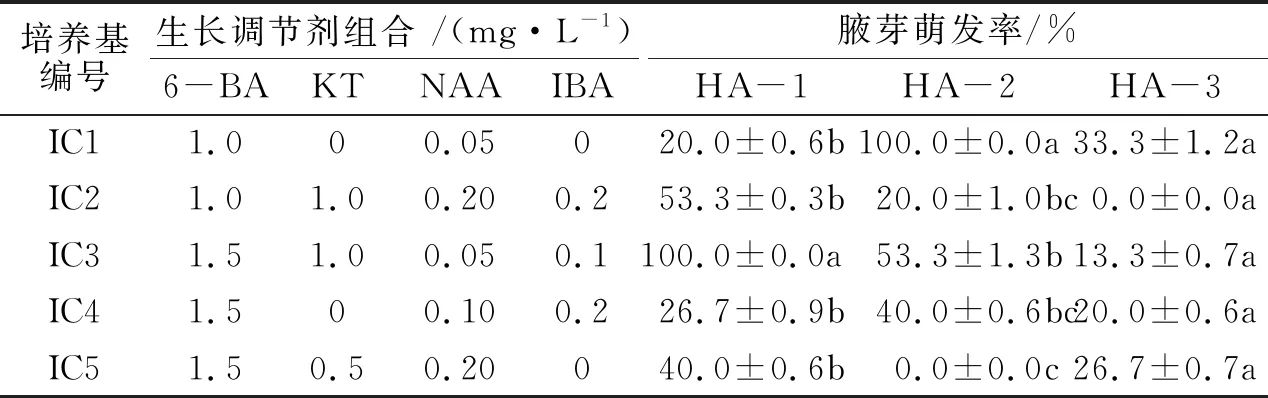
表1 不同培养基对枫香腋芽萌发的影响Tab.1 Effects of different media on axillary bud germination of L.formosana

(a) HA-1 (b) HA-2 (c) HA-3图1 接种30 d时的腋芽萌发情况Fig.1 Axillary bud germination after 30 days inoculation
2 数据处理
图表中的数据均为平均值±标准误(n=3).采用SAS8.1软件进行方差分析与多重比较(Duncan′s),百分数经过反正弦转换后再进行方差分析.
3 结果与分析
3.1 初代培养分析
植物激素6-BA、KT、NAA和IBA均对腋芽萌发有促进作用,3种试材的适宜培养基有所不同(见表1).HA-1在组成包括1.5 mg/L 6-BA+1.0 mg/L KT+0.05 mg/L NAA+0.1 mg/L IBA(IC3)的培养基中腋芽萌发率最高,达到100%;HA-2和HA-3均在组成包括1.0 mg/L 6-BA+0.05 mg/L NAA(IC1)的培养基中腋芽萌发率最高,分别为100%和33.3%(表1和图1).
3.2 增殖培养分析
3种试材在不同培养基中的增殖系数和芽丛平均高度存在显著差异(见表2).相比于对照组(PC1),添加6-BA、NAA和GA3能显著增加3种试材的增殖系数和芽丛高度.就增殖系数而言,HA-1在PC9中效果最好,增殖系数为4.6;HA-2在PC3中效果最好,增殖系数达9.0;HA-3则在PC14中效果最好,增殖系数为4.4.就芽丛高度而言,HA-1在PC15中最高,约为2.5 cm;HA-2和HA-3则在PC16中最高,分别为2.3 cm和3.5 cm.对比图2和图3,可知添加GA3可有效促进幼芽的高度增长.综合而言,HA-1在组成包括2.0 mg/L6-BA+0.05 mg/L NAA的培养基中增殖效果较好,增殖系数为4.6,芽丛平均高度为1.6 cm,幼芽生长正常;HA-2的最适增殖培养基组成包括1.0 mg/L 6-BA+0.01 mg/L NAA,增殖系数为9.0,芽丛平均高度为1.9 cm,幼苗生长健壮.HA-3的最适增殖培养基组成包括1.0 mg/L 6-BA+0.03 mg/L NAA+1.0 mg/L GA3,增殖系数为4.4,芽丛平均高度为1.8 cm.
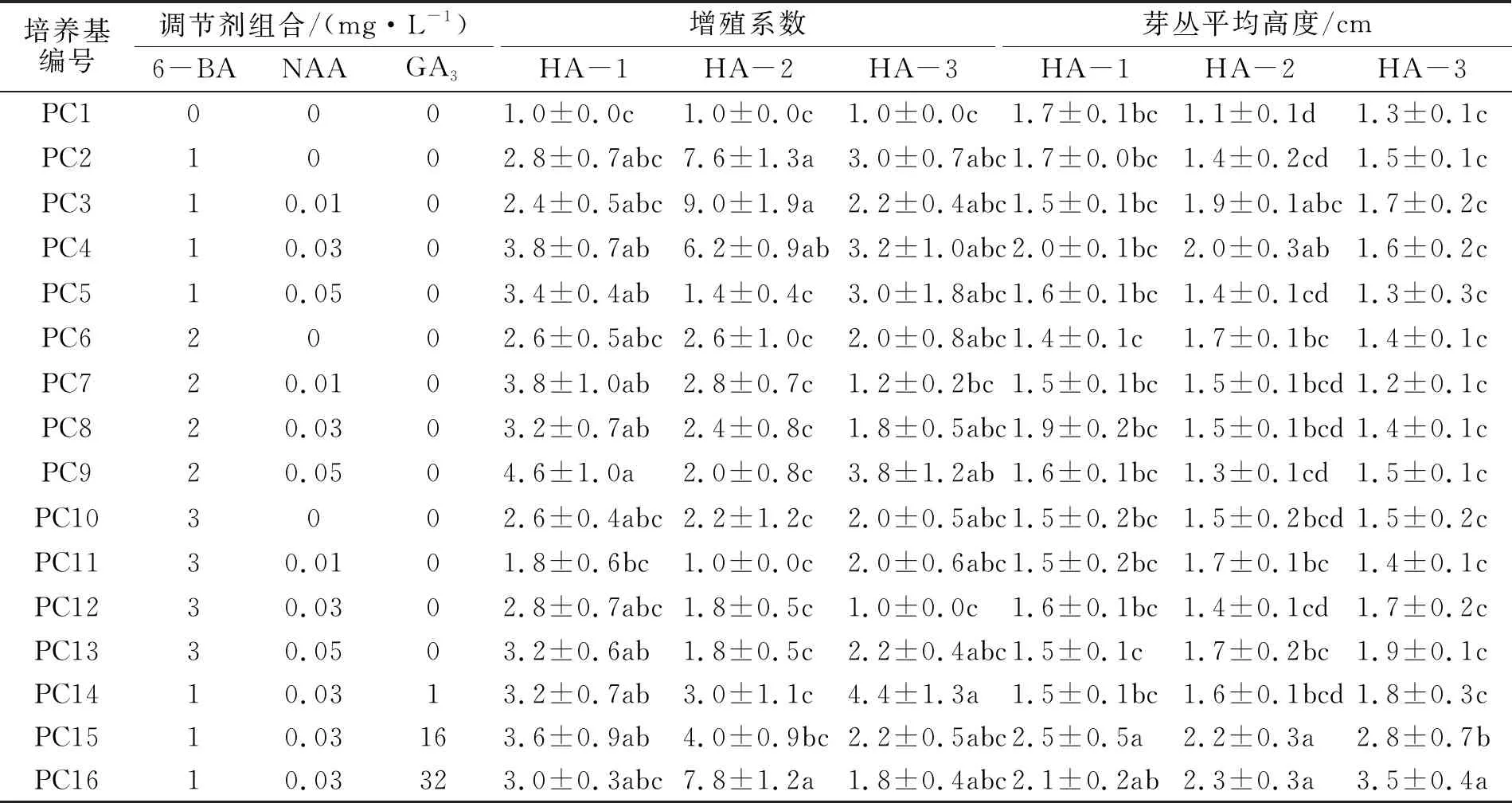
表2 不同培养基对枫香试管苗增殖的影响Tab.2 Effects of different culture media on shoot proliferation of L.formosana

(a) HA-1 (b) HA-2 (c) HA-3图2 未添加GA3的培养基中生长40 d的情况Fig.2 Growth for 40 days in medium without GA3

(a) HA-1 (b) HA-2 (c) HA-3图3 添加32 mg/L GA3的培养基中生长40 d的情况Fig.3 Growth for 40 days in medium with 32 mg/L GA3
ZT和BR被认为是新型植物生长调节剂.本研究以HA-3为试材,设置了16种含不同浓度ZT和BR的增殖培养基,探究2种激素对枫香组培苗生长的影响(见表3).结果表明,HA-3在16种培养基中的增殖系数均较低,最大增殖系数仅为1.5(PC11),芽丛平均高度最大为2.8 cm(PC12),愈伤组织直径大小不一,介于0.2~1.1 cm之间.同时发现,BR对幼苗的叶色和叶片大小产生了明显影响.当BR浓度为0.03 mg/L和0.06 mg/L时,叶片变小、颜色偏红;BR浓度升高至0.2 mg/L时,无菌苗的叶色为深绿色,叶片较大(见图4).

表3 ZT和BR对HA-3试管苗增殖的影响Tab.3 Effects of ZT and BR on shoot proliferation of HA-3
3.3 生根培养与移栽
3种试材在不添加激素的培养基中均未生根,添加一定浓度的NAA和IBA可显著促进生根,但不同试材之间的生根率和根系形态明显不同(见表4).HA-1在含1.0 mg/L IBA的培养基中生根率最高为30%,平均根数为1.4条,平均根长为0.36 cm,无愈伤组织形成,根系细长,且有二级侧根形成.HA-2在添加1.0 mg/L IBA的培养基中生根率达到80%,平均根数与根长达到最大值,分别为2.6条与1.43 cm,无愈伤组织形成,根系细长,二级侧根数量较少;在添加0.3 mg/L NAA、0.2 mg/L NAA+1.0 mg/L IBA的培养基中生根率均达到60%.HA-3在含0.1 mg/L NAA培养基中的生根率为20%,平均根数最多为0.8条,平均根长为0.21 cm,有愈伤组织形成,直径约为0.6 cm,根系呈短粗型,无二级侧根形成.HA-3在含1.0 mg/L IBA培养基中的生根率同样为20%,但根系性状明显不同,其平均根数为0.4条,平均根长为0.28 cm,无愈伤组织形成,根系为细长型,且二级侧根数量较多.

(a) PC13 (b) PC11 (c) PC15图4 HA-3生长40 d的增殖情况Fig.4 Proliferation of HA-3 growth for 40 days
可见,HA-1、HA-2和HA-3对不同激素组合的响应有所不同,不仅生根率有差异,根系形态也明显不同(见图5).综合而言,可选择组成包括WPM +3.0%蔗糖+0.7%琼脂+1.0 mg/L IBA的培养基作为三者的生根培养基.生根苗移栽40 d后,3种试材的成活率均可达到100%,且幼苗生长健壮(见图6).
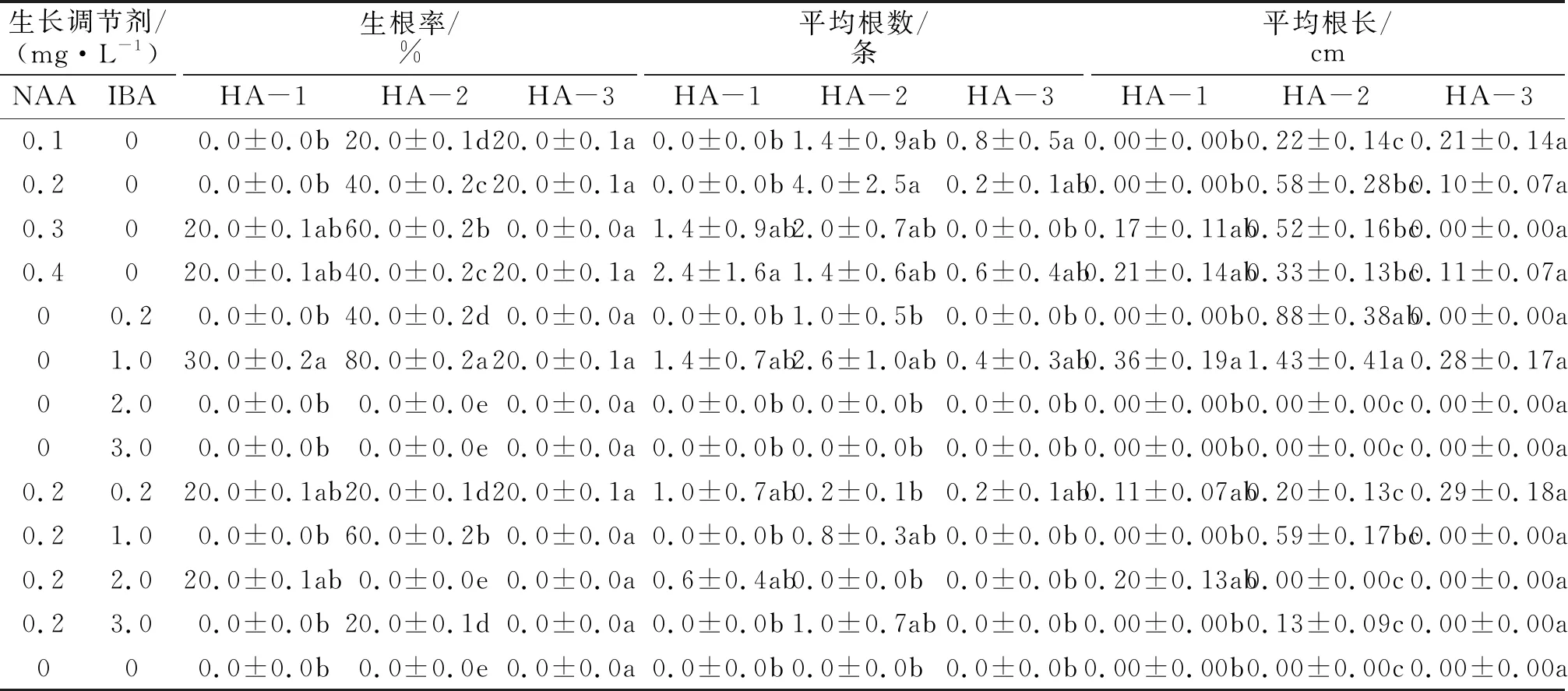
表4 生长调节剂对枫香试管苗生根的影响 Tab.4 Effects of hormones on rooting of L. formosana

(a) HA-1 (b) HA-2 (c) HA-3图5 生长40 d的生根情况Fig.5 Rooting culture for 40 days
4 讨论
生长素和细胞分裂素是组织培养中诱导细胞分裂、分化和器官形成最重要的两类植物激素[13].在已有文献中,6-BA、NAA、IBA、KT、ZT是组织培养使用较多的激素种类,其中NAA和IBA属于生长素类,具有促进茎伸长、细胞分裂和分化的作用;6-BA、KT、ZT作为细胞分裂素类物质,能够加速细胞分裂,促使细胞分化和形态的形成.由于组织培养当中植物激素之间存在互相促进和抑制作用,故在组织培养中多采用不同激素配合使用的方法.通常,较高的生长素和细胞分裂素比例能促进愈伤组织的诱导和增殖,但激素的类别和浓度的选择是组织培养中的难点.

(a) HA-1 (b) HA-2 (c) HA-3图6 组培苗移栽后的生长情况Fig.6 Transplanted tissue culture seedlings
枫香的组织培养过程中,也需要添加各种激素以保证植物的正常生理活动.许林[4]发现在添加0.75 mg/L 6-BA 和0.1 mg/L NAA的培养基中,枫香的腋芽萌发率可达到100%.美国枫香(L.styraclflua)在含有1.0 mg/L 6-BA、0.1 mg/L NAA 和0.1 mg/L KT的培养基中腋芽萌发率可达96%[9].本研究以枫香带芽茎段为外植体进行培养,通过选择6-BA、NAA、IBA和KT作为促进腋芽萌发的激素,通过观察腋芽萌发率和生长状态,最终表明1.5 mg/L 6-BA、0.05 mg/L NAA、0.1 mg/L IBA和1.0 mg/L KT为HA-1腋芽萌发的最佳激素组合.而HA-2和HA-3均在含有1.0 mg/L 6-BA、0.05 mg/L NAA的培养基中腋芽萌发率最高,分别为100%和33.3%.
枫香增殖培养阶段,为了试验出生长状态正常的继代苗和较高的增殖系数,本研究分析了6-BA 、NAA和GA3对3株优株增殖的影响.选择0~3 mg/L 6-BA、0~0.05 mg/L NAA和1~32 mg/L GA3作为增殖培养的激素配比.结果显示,与初代培养相似,3种试材的增殖培养效果亦显著不同.就6-BA而言,HA-1在含有2.0 mg/L 6-BA的培养基中的增殖效果最好,增殖系数为4.6;而HA-2和HA-3则更适合在6-BA质量浓度较低的培养基中增殖,这一结果与李颖楠[2]、路佳[8]等的研究结果相似.就NAA而言,适宜3株优株生长的浓度亦有所不同;HA-1适宜较高质量浓度,即0.05 mg/L的NAA,而HA-2和HA-3则在添加较低质量浓度NAA的培养基中的增殖效果最佳,分别为0.01 mg/L和0.03 mg/L.综合分析可知,3种试材对相同激素组合的增殖响应显著不同:激素浓度较高更有利于HA-1的不定芽萌发,HA-2和HA-3则更适宜较低激素浓度的培养基.造成这种差异的原因可能与试验材料的基因型、年龄或取材部位有关.
植物组织培养中,GA3、ZT和BR也有大量应用.GA3属于四环二萜类激素,是常用的赤霉素,能够调控茎伸长、叶片扩大和开花等过程,但不能增加丛生芽的数量[11,14-15].本研究中,在6-BA和NAA质量浓度相同的条件下,GA3的质量浓度较高和较低均会抑制HA-1的生长,而在添加中等质量浓度(16 mg/L) GA3的培养基中芽丛平均高度明显增加.HA-2和HA-3则在高质量浓度(32 mg/L) GA3培养基中平均高度明显更高,这与枫香[4]、葡萄(Vitisvinifera)[16]、红叶石楠(Photiniafraseri)[11]等的研究结果一致.ZT作为一种细胞分裂素,可调节植物组织器官的生长发育;BR则参与植株光形态建成、细胞分化、开花结实以及衰老等过程[13].本研究中,当ZT和BR的质量浓度低于0.2 mg/L时,3种试材的增殖系数和芽丛高度均无显著变化,这与廉家盛等[17]和宁志怨等[18]对蓝莓(Vacciniummyrtillus)的研究结果一致.但邰志娟等[19]认为添加0.2 mg/L BR能促进仙人掌(Opuntiastricta)芽的增殖.本研究虽然没有通过添加ZT和BR提高枫香的增殖系数,但从侧面说明这两种激素对枫香的增殖培养效果并不明显,这在前人对枫香的组培研究中是没有报道过的.同时,本研究还发现BR质量浓度为0.03 mg/L和0.06 mg/L时,幼苗的叶片变小,颜色偏红;BR质量浓度升高至0.2 mg/L时,幼苗的叶片较大,叶色深绿.这说明低质量浓度BR可能影响叶片生长和色素合成,这对于枫香这一秋色叶树种的遗传改良具有一定启示,但其作用机理还需要进一步的研究.
IBA和NAA能够调节植物营养生长,促进生根,被广泛应用于植物的生根培养中[20-22].李亮[6]的研究表明,添加0.75 mg/L的 IBA能够显著提高枫香的生根率.同时李颖楠[2]和路佳[8]发现在添加0.1 mg/L IBA+0.3 mg/L NAA的培养基中,枫香的生根率可达87%,平均根长为3.91 cm;在添加0.2 mg/L IBA的培养基中,北美枫香的生根率为79%,平均根数为7条,平均根长为4.61 cm.因此,本研究选择0~0.4 mg/L的NAA和0~3.0 mg/L的IBA作为生根培养的激素配比,通过观察3株枫香优株的生根率、平均根数和平均根长,以确定适宜不同枫香优株的最佳生根培养基.结果显示,添加NAA不利于3株枫香优株的生根培养,而1.0 mg/L的IBA更有利于生根,且3株枫香优株中生根率最高的材料为HA-2,生根率达到80%.但这一结果与李颖楠[2]、路佳[8]等的结果有所差异,造成这一结果的原因,一方面与培养基成分不同有关,另一方面也可能与试验材料的基因型、年龄或取材部位不同有关.
总而言之,本研究中HA-2的培养效果最好,更适合通过组培方式进行繁殖,以扩大苗木生产速度和规模;HA-1、HA-3的增殖和生根培养条件还需要在后续的试验中进一步优化.
