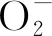尖叶四照花叶片多糖含量测定及抗氧化活性分析
2023-01-05覃红菊吴心雨
覃红菊,吴心雨,肖 强*
(1.湖北民族大学 林学园艺学院,湖北 恩施 445000;2.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000)
尖叶四照花(Cornuselliptica)是山茱萸科(Cornaceae)四照花属(Cornus)常绿乔木,又称为山荔枝、野荔枝、石枣等.当前,学者对尖叶四照花植物的开发利用大多聚焦于观赏价值、果实食用性、药用价值等方面.对尖叶四照花化学成分的研究,主要围绕多酚类、环烯醚萜苷、三萜、甾醇及有机酸类化合物进行[1-2];但对于尖叶四照花叶片中具有重要生物活性的多糖物质的研究则未见报道.
多糖即多聚糖(polysaccharide),广泛分布在动、植物细胞中,由聚合度超过10个单糖以上的聚糖组成.多糖来源广泛,是高等植物和动物细胞膜、微生物细胞壁中的重要组成物质[3].研究表明,多糖具有免疫调节[4]、抗氧化[5]、抗肿瘤[6]及其他多种生物活性[7].目前香菇多糖、灵芝多糖、云芝多糖已在国内外临床上广泛应用,其他多糖也正在深入研究与开发中[8].在多糖研究中,快速测定样品的多糖含量,对于高效优化多糖提取、纯化工艺具有重要应用价值;目前常用苯酚-浓硫酸法测定多糖含量,但该法存在耗时长、试剂腐蚀性高等缺陷.
近年来荧光光谱法作为一种新的光谱分析方法[9-10],在生物大分子以及离子缔合物的分析中应用越来越广泛,可以用于多糖[11]、核酸[12]、蛋白质[13]、无机离子[14]等的测定.荧光光谱法能检测出许多分光光度法无法检测的物质,并且所需试剂易得、操作简单易行、灵敏度高、选择性强、用样量少,有利于对微量样品的测定[15].因此本实验采用荧光光谱法测定尖叶四照花叶片多糖含量,为后续对该多糖的分离纯化提供高效的多糖检测手段;并在此基础上,开展该多糖的体外抗氧化测定,为实现尖叶四照花叶片多糖的有效开发提供初步依据.
1 材料与仪器
1.1 实验材料与试剂
尖叶四照花叶片采自湖北省恩施市湖北民族大学,叶片鲜绿成熟无病害.清洗后,烘干、粉碎、过80目筛后贮存在干燥器中密封备用.
试剂包括石油醚、无水乙醇、葡萄糖标准品、浓硫酸、氢氧化钠(NaOH)、葡聚糖凝胶G-100、十二烷基苯磺酸钠(SDBS)、氯化十六烷基吡啶(CPC)、十六烷基三甲基溴化铵(CTAB)、1,1-二苯基-2-三硝基苯肼(DPPH)、抗坏血酸(Vc).
1.2 实验仪器
仪器包括荧光分光光度计(日本日立公司,F-4600)、紫外-可见光分光光度计(北京普析通用仪器有限责任公司,TU-1901)、低速台式离心机(湖南湘仪实验室仪器开发有限公司,H2050R)、冷冻干燥机(德国Christ公司,ALPHA1-2LD)、数显恒温水浴锅(上海力辰邦西仪器科技有限公司,HH-2).
2 实验方法
2.1 尖叶四照花叶片多糖的制备
称取10 g经脱脂、脱单糖的尖叶四照花叶片粉末,按1∶20(g/mL)的料液比加入超纯水,提取温度为70 ℃,提取时间为3 h,冷却后离心,离心温度为4 ℃,转速为10 000 r/min,时间为20 min.取上清液,加入4倍体积的无水乙醇,醇沉过夜,离心后取沉淀,加10 mL蒸馏水溶解得到尖叶四照花叶片粗多糖,然后使用木瓜蛋白酶[10]和TCA溶液[16-17]进行脱蛋白处理得所需样品液.使用葡聚糖凝胶柱纯化样品液,得到纯化后的多糖用于后续实验.
2.2 荧光光谱法测定叶片多糖
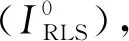
2.2.2 标准曲线的绘制 将尖叶四照花叶片纯化多糖按梯度配置成不同质量浓度的标准品溶液.按照“2.2.1测定方法”,做3次平行实验,横轴为多糖标准品浓度(c,μg/mL),纵轴为共振光散射强度(ΔIRLS),得出多糖的线性方程:ΔIRLS=84.472c+23.24,R2=0.997 1,线性范围为3~18 μg/mL.
2.2.3 波长与表面活性剂的选择 本实验将从CPC、CTAB、SDBS 3种表面活性剂中比较选择.比较200~800 nm波长范围内,不同表面活性剂与多糖结合后在NaOH溶液中的共振光散射强度及其单独在NaOH溶液中的共振光散射强度,选用共振光散射强度差值最大的物质作为最佳表面活性剂,选用最佳表面活性剂下的最大散射波长作为测定波长.
2.3 单因素实验
2.3.1 NaOH溶液浓度对ΔIRLS的影响 按照“2.2.1测定方法”,分别选取0.3、0.6、0.9、1.2、1.5、1.8 mol/L不同浓度梯度的NaOH溶液,其他条件均相同,进行单因素实验.当NaOH溶液浓度为0.9 mol/L时,ΔIRLS最大,故NaOH溶液最佳浓度为0.9 mol/L.
2.3.2 CTAB溶液浓度对ΔIRLS的影响 按照“2.2.1测定方法”,分别选取1.0、1.5、2.0、2.5、3.0、3.5 mmol/L不同浓度梯度的CTAB溶液,其他条件均相同,进行单因素实验.当CTAB溶液浓度为3.0 mmol/L时,ΔIRLS最大,故CTAB溶液最佳浓度为3.0 mmol/L.
2.3.3 反应时间对ΔIRLS的影响 按照“2.2.1测定方法”,分别选取10、20、30、40、50、60 min的反应时间,其他条件均相同,进行单因素实验.当反应时间为30 min时,ΔIRLS最大.故最优反应时间为30 min.

表1 正交实验水平Tab.1 Orthogonal experiment level
2.4 正交实验
基于最佳波长及表面活性剂的选择,在单因素实验的基础上,以 NaOH溶液浓度(A)、CTAB溶液浓度(B)和反应时间(C)为自变量,以ΔIRLS为因变量.确定荧光光谱法测定尖叶四照花叶片多糖含量的最优反应条件,如表1所示.
2.5 苯酚-浓硫酸法测定多糖含量
将葡萄糖标准品分别配制成质量浓度为0、0.2、0.4、0.6、0.8、1.0 g/mL的标准葡萄糖溶液,分别取1 mL置于具塞试管中,再分别加入1 mL 6% 苯酚溶液,摇匀后再加浓硫酸5.0 mL,混合均匀后置于90 ℃恒温水浴锅中水浴加热15 min,冷却至室温,在490 nm波长处测吸光度[18].得到标准曲线为y=0.008 3x+0.015 7,R2=0.998 7.
2.6 抗氧化活性分析
2.6.1 DPPH自由基清除实验 分别取2 mL多糖溶液、2 mL DPPH溶液,混合均匀,室温放置30 min 后,5 000 r/min 离心10 min,测定其上清液在517 nm波长处的吸光度A1,同时测定样品溶液在517 nm处的吸光度Ax及DPPH溶液在517 nm处的吸光度A2[19];以同等浓度Vc作为阳性对照组,平行测定3次.清除率计算公式为:ADPPH•=[1-(A1-Ax)/A2]×100%.式中:ADPPH•表示DPPH自由基清除率.
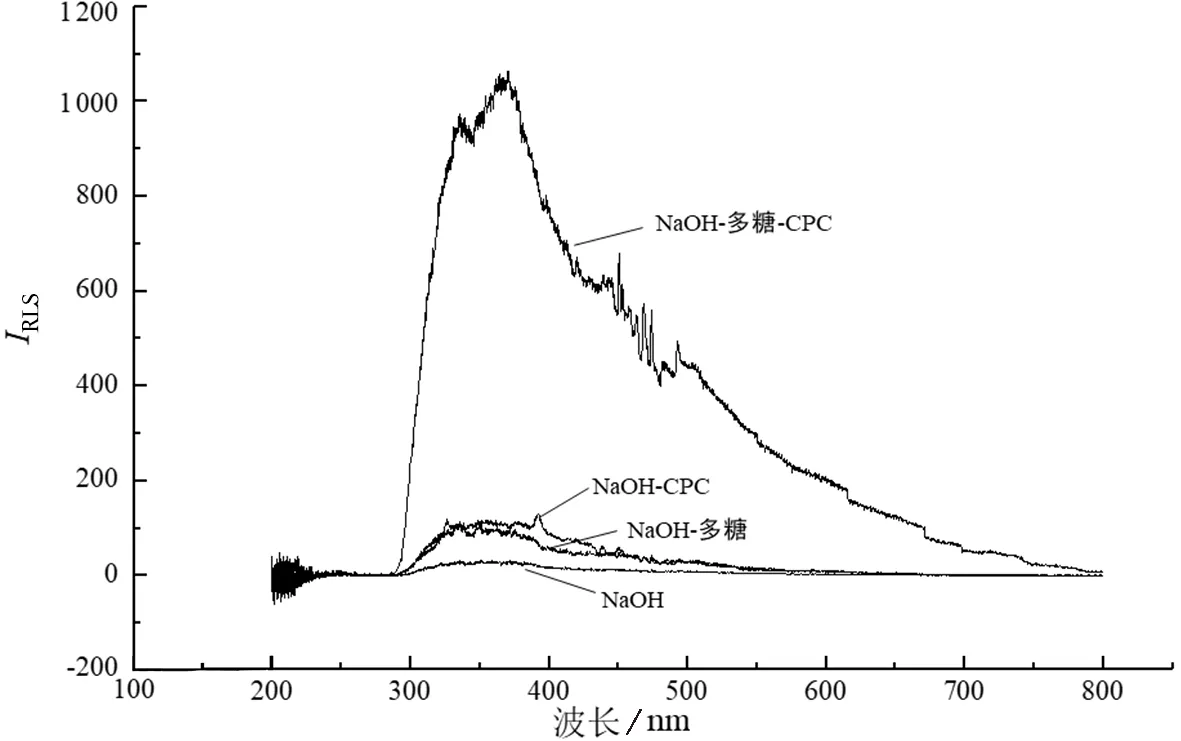
图1 CPC体系IRLS光谱Fig.1 CPC system IRLS spectroscopy
3 结果与分析
3.1 波长及表面活性剂的选择
本研究对CPC、CTAB、SDBS 3种表面活性剂进行比较,如图1~3所示.由于尖叶四照花叶片多糖为酸性多糖,带有阴离子,CTAB和CPC表面活性剂为阳离子,在静电作用下他们会互相结合形成体积较大的粒子,而SDBS为阴离子表面活性剂,尖叶四照花叶片多糖与其结合较难或无法结合.由瑞利散射公式[21]可知,粒子体积越大,共振光散射越强.所以CTAB体系下的共振光散射强度大于CPC体系且远大于SDBS体系.因此选择CTAB为表面活性剂,选用CTAB体系下的最大散射波长370 nm作为荧光光谱法的测定波长.
3.2 单因素实验
1) NaOH溶液浓度对ΔIRLS的影响如图4所示.当NaOH溶液浓度逐渐升高时,ΔIRLS先升后降,最适浓度为0.9 mol/L.这是由于适当的碱性条件可以诱导尖叶四照花叶片多糖产生更多的负电荷,增强其与CTAB表面活性剂之间的静电作用.当NaOH浓度大于最适浓度后,碱性强度超过尖叶四照花叶片多糖可承受范围就会使尖叶四照花叶片多糖降解,导致ΔIRLS下降.此结果与成芳等[22]得出的荧光光谱法测红豆杉叶片的最佳NaOH溶液浓度为1 mol/L相近,证明这一实验结果具有可行性.
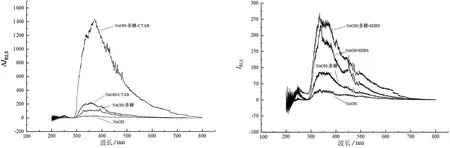
图2 CTAB体系IRLS光谱图3 SDBS体系IRLS光谱 Fig.2 CTAB system IRLS spectroscopy Fig.3 SDBS system IRLS spectroscopy
2) CTAB溶液浓度对ΔIRLS的影响如图5所示.CTAB最适浓度为3.0 mmol/L,当CTAB溶液浓度升高时,ΔIRLS先升高后下降.这是由于随着CTAB浓度的升高,其与尖叶四照花叶片多糖结合形成的粒子缔合物也就越多,而CTAB溶液浓度超过最适浓度时分子可能发生自聚合作用,与多糖的缔合作用减弱,就会导致共振光散射强度差值(ΔIRLS)下降.此结果与郭宗宁等[23]通过共振光散射法测定核酸的实验中CTAB溶液浓度的最佳条件0.1 mmol/L有较大差距,可能是由于多糖、核酸与CTAB结合程度不同导致的.
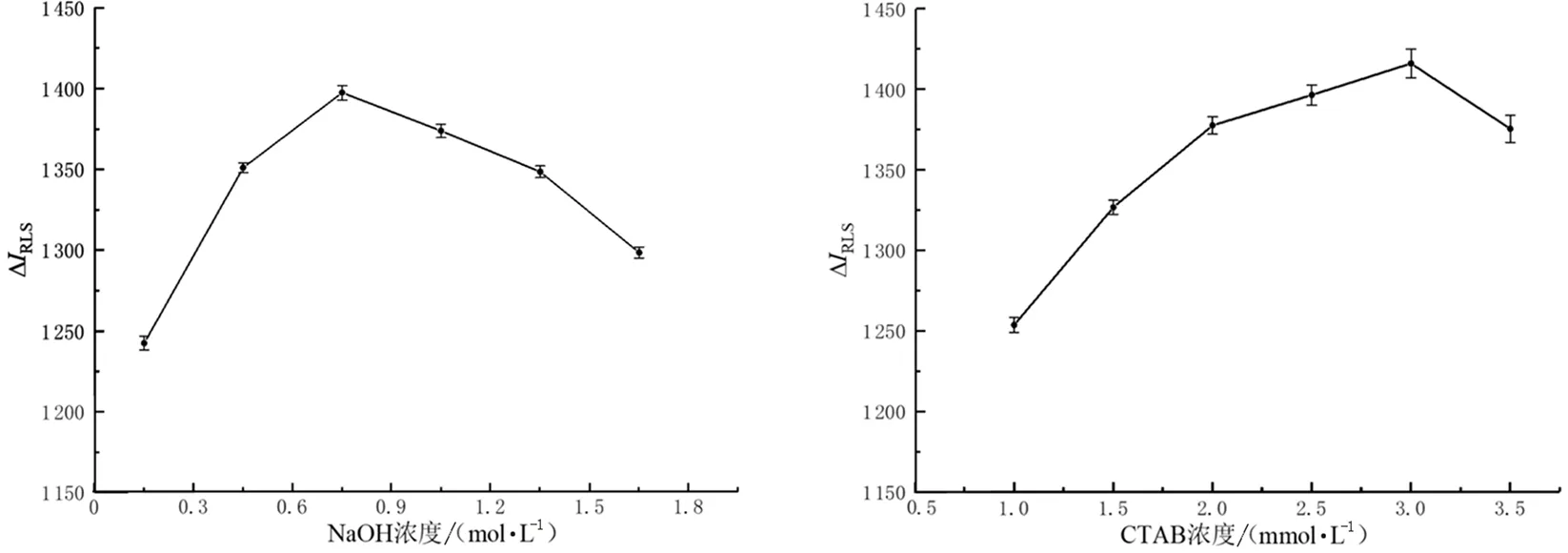
图4 NaOH溶液浓度对共振光散射强度的影响图5 CTAB溶液浓度对共振光散射强度的影响
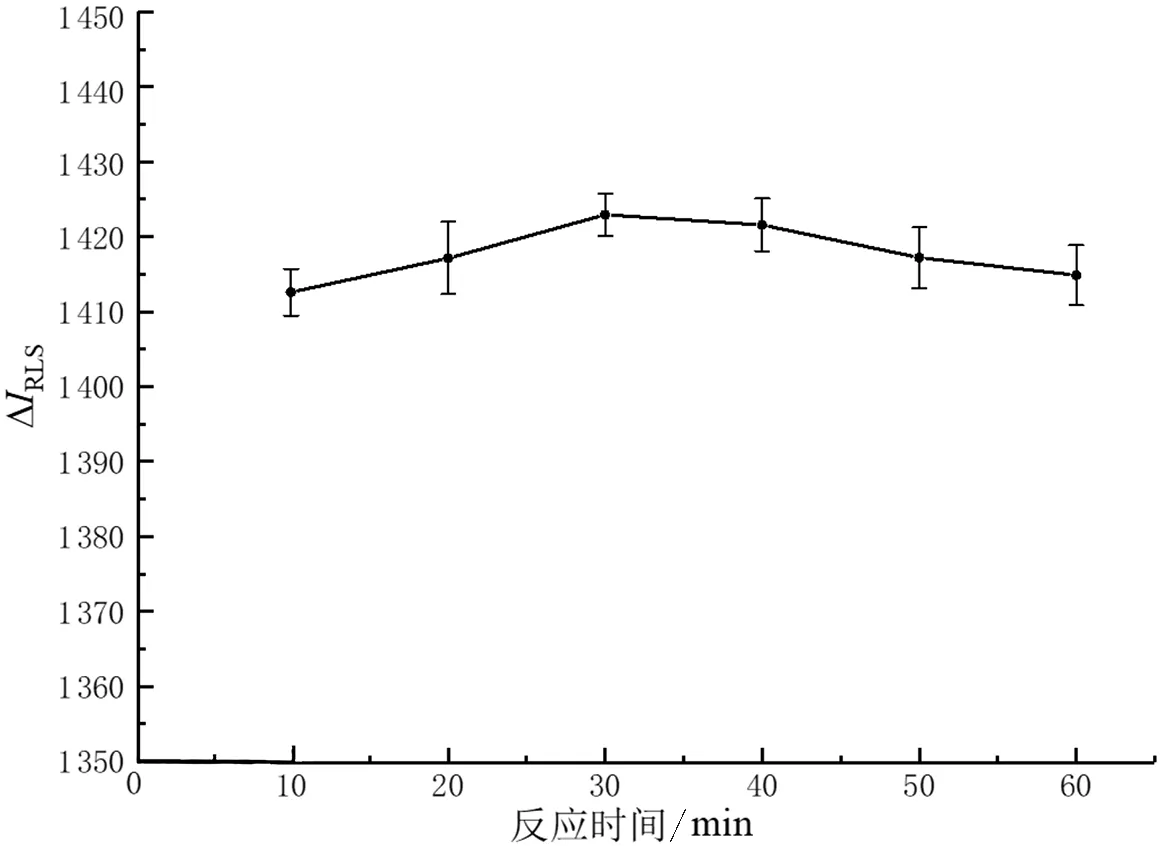
图6 反应时间对共振光散射强度的影响Fig.6 Effect of reaction time on the intensity of resonance light scattering
3) 反应时间对ΔIRLS的影响如图6所示.当反应时间逐渐增加时,ΔIRLS先升高后下降,但在10~60 min的反应时间里,共振光散射强度基本稳定,最适反应时间为30 min.朱梦等[24]通过荧光光谱法测异烟肼多糖的实验中最佳反应时间为25 min,与本实验基本相同.当反应时间超过30 min时,ΔIRLS有所下降可能是由于空气中的氧气长时间接触尖叶四照花叶片多糖发生氧化.
3.3 正交实验
基于单因素实验结果,进行正交实验(3因素3水平)(L33),如表2所示.由表2可知,对ΔIRLS的影响主次顺序为:NaOH溶液浓度>CTAB溶液浓度>反应时间,对ΔIRLS的各影响因素3个水平间优势为:A2>A3>A1,B2>B1>B3,C2>C1>C3.所以最优反应条件为:0.9 mol/L NaOH溶液,3.0 mmol/L CTAB溶液,30 min反应时间.以上述条件进行3组平行实验.测得ΔIRLS分别为1 396.3、1 413.7、1 409.5,平均值为1 406.5,相对标准偏差为0.53%,小于5.0%,说明正交实验结果具有科学性.
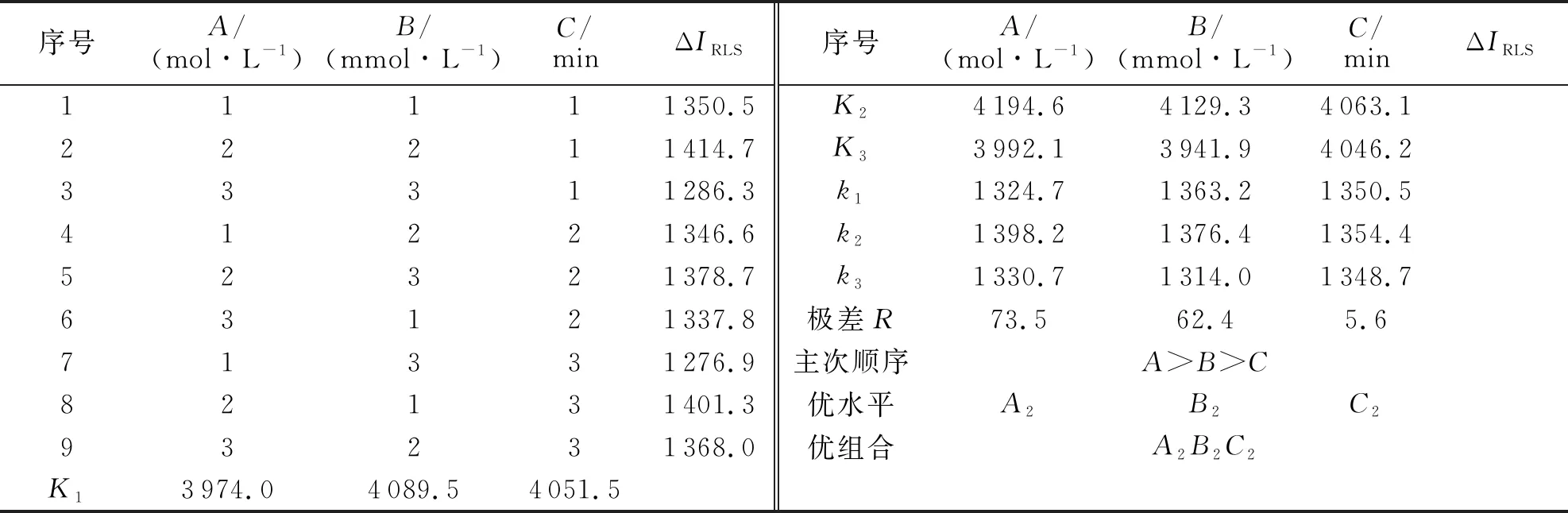
表2 L33正交实验结果Tab.2 L33 orthogonal test results
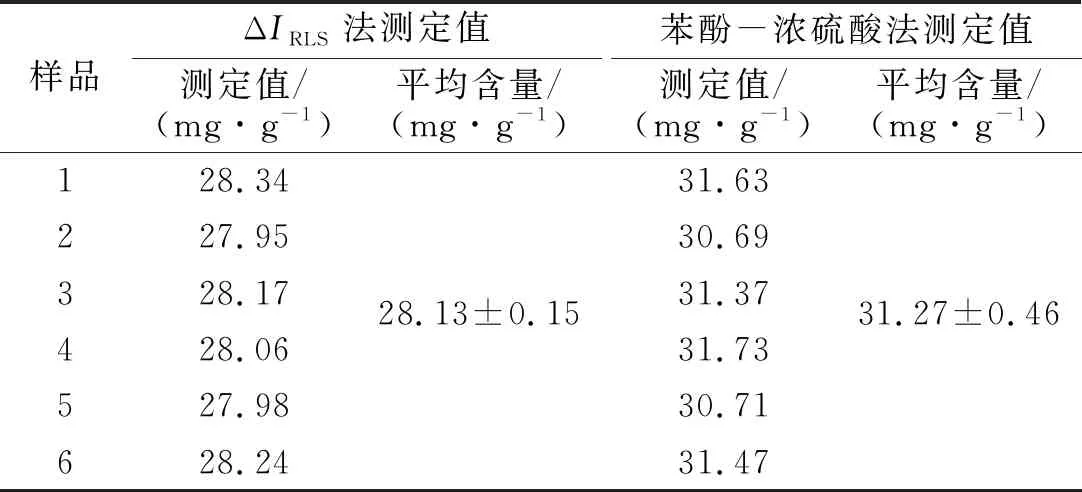
表3 ΔIRLS法与苯酚-浓硫酸法测定结果比较Tab.3 Comparison of ΔIRLS method and phenol sulfuric acid method
3.4 不同测定方法结果比较
ΔIRLS法与苯酚-浓硫酸法含量测定结果比较如表3所示.由表3可知,采用荧光光谱法测定尖叶四照花叶片多糖平均含量为28.13±0.15 mg/g,苯酚-硫酸法测定尖叶四照花叶片多糖平均含量为31.27±0.46 mg/g,结果差距不大,证明荧光光谱法测定尖叶四照花叶片多糖含量的方法具有可行性.
3.5 多糖抗氧化活性
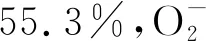

图7 尖叶四照花叶片多糖对DPPH自由基的清除作用 图8 尖叶四照花叶片多糖对自由基的清除作用
4 结论