HA-SA复合微凝胶的制备与评价
2023-01-05胡婕李红卫付艳平余丽文治杰胡燕
胡婕,李红卫,付艳平,余丽,文治杰,胡燕
(中南民族大学 药学院&民族药学国家示范中心,武汉 430074)
水凝胶是一种亲水、稳定但不溶于水的三维网状结构[1],因其良好的生物组织相容性,在生物医学领域中应用非常广泛.微凝胶更是由于粒径小、载药量高、生物相容性好、且环境响应性灵敏,在药物缓控释系统中的应用具有独特的优势[2-3].
海藻酸钠(sodium hyaluronate,SA)是从褐藻类海带或者马尾藻中提取出来的高分子多糖,具有制剂辅料所需要的稳定性、溶解性、粘性和安全性,常被用作药用辅料[2-3].但是纯SA-Ca2+制备的水凝胶存在药物突释和稳定性差的缺点,这是SA水凝胶在缓控释制剂领域上应用受到限制的主要原因[4].透明质酸(hyaluronic acid,HA)是广泛存在于皮肤组织、结缔组织和神经组织中的一种糖胺聚糖,具有优异的生物相容性和生物降解性能,经过化学交联后形成的HA水凝胶稳定性良好[5-6],但HA具有对酸碱环境不敏感的缺点,导致药物在胃肠道中不容易释放[7-9].本研究将具有生物相容性和生物降解性的天然高分子材料SA和HA结合[10],通过乳化法制备得到一种对pH敏感的具有互穿网络结构的复合微凝胶,该微凝胶不仅解决了材料自身存在的缺陷,而且制备出的HA-SA复合微凝胶有明显的pH敏感性,可控制药物缓慢持久释放,在药物递送和治疗肠道疾病中具有潜在价值[11-13].
1 实验部分
1.1 材料与仪器
海藻酸钠(SA)、透明质酸(HA,食品级)、姜黄素、二甲双胍、吲哚美辛(上海阿拉丁);液体石蜡、司盘、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、己二酸二酰肼(ADH)、无水氯化钙、氢氧化钠、磷酸二氢钠、无水乙醇均为分析级(国药集团).
1.2 复合微凝胶的制备
1.2.1 复合微凝胶的交联原理
HA-SA复合水凝胶的制备原理主要分为两部分.首先为HA分子中的羧酸根与交联剂己二酸二酰肼(ADH)分子中的氨基在碳二亚胺(EDC)/N-羟基丁二酰亚胺(NHS)催化条件下反应,脱水缩合形成了酰胺键,得到HA-ADH网络结构;SA在Ca2+溶液中发生非共价键的物理交联,形成了SA-Ca2+网络结构,两者混合,形成了一种有互穿网络结构的复合微凝胶,交联原理见图1.

图1 HA-SA复合微凝胶交联原理图Fig.1 Cross-linkingmechanismof HA-SA compositemicrogels
1.2.2 复合微凝胶的制备过程
称取0.4 g SA和0.2 g HA于烧杯中,加入20 mL蒸馏水,磁力搅拌溶解后往烧杯中加入ADH和催化剂EDC/NHS,继续搅拌至所有原料完全溶解后分为两部分.一部分样品加入液体石蜡和司盘,继续机械搅拌20 min乳化,将乳化后的乳液滴加到新鲜配制的2.5%CaCl2溶液中,搅拌40 min后,放置几分钟,待所制备的微凝胶沉积于烧杯底部,弃上层液体,再将微凝胶清洗风干即得空白的HA-SA复合微凝胶.而另一部分采用直接滴制法加入到2.5%CaCl2溶液制备HA-SA宏观水凝胶,后续处理方法相同.制备流程见图2.
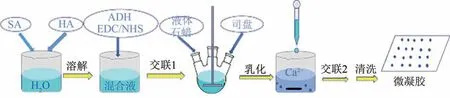
图2 HA-SA复合微凝胶制备流程图Fig.2 Flow chart of the preparation process of HA-SA composite microgels
1.3 复合微凝胶的表征
将新鲜制备及自然风干后的水凝胶、复合微凝胶分别平铺于白色的背景上,观察并拍照;取少量冷冻干燥后的微凝胶样品,以1∶99的比例将待测样品与溴化钾充分混合,研磨后制片进行红外分析(IR);经X射线衍射仪(XRD)来测定冷冻干燥后的HA-SA微凝胶样品的晶型结构.管压:40 kV,扫描速度:1°/min,2θ范围:4°~40°.
1.4 HA-SA复合水凝胶的溶胀测试
称取风干后的复合水凝胶(质量W0)后,放入37℃中pH 1.2的模拟胃液(SGF)中,每隔0.5 h取出,擦干,记录质量(Wt).2 h后更换到pH 7.4的模拟肠液(SIF)中,记录质量(Wt)的变化.最后使用公式(1)计算HA-SA复合水凝胶的溶胀率:

式中,SR为溶胀率,Wt为溶胀后的复合水凝胶质量,W0为复合水凝胶的初质量.
1.5 复合微凝胶的释药行为研究
取0.05 g的HA-SA微凝胶,加入SGF 50 mL,于37℃,100 r/min恒温振荡,每隔0.5 h取样4 mL,同时补充同体积新鲜释放介质;2 h后将SGF更换为SIF,同样的方法继续进行测试.将模型药物姜黄素[14]、吲哚美辛[15]及二甲双胍经紫外分光光度计分别于430、320、233 nm波长处测定吸光度得标准曲线,计算药物浓度后由公式(2)得到累积释药率,以时间与累积释药率制作各药物的释药曲线.累积释药率按以下公式进行计算:

Qn为累积的释药率(%);Cn为n次取样时样液中所含的药物浓度(μg/mL);V为取样体积(4 mL);V0为锥形瓶内溶液的总体积(50 mL),其中W是载药量.
以交联时间、CaCl2浓度以及不同模型药物等对微凝胶释药性能进行进一步考察.
2.内容:借助互联网吸纳电工作业的新方法、新技术、新工艺、新标准,充实培训内容;并通过信息技术增强培训的直观性和吸引力。
1.5.1 交联时间
按照1.2制备方法称取4组SA和HA于烧杯中,加入蒸馏水,搅拌溶解后往烧杯中加入ADH、EDC/NHS和0.1 g姜黄素,然后继续搅拌,控制交联时间为6、9、10和12 h.而后制备方法同1.2,最终得到不同交联时间的HA-SA复合载药微凝胶.由释药结果,得最佳交联时间.
1.5.2 CaCl2浓度
其他条件不变,CaCl2的浓度分别为2%、2.5%、3%、3.5%、4%、5%,上述同法制备5组微凝胶,然后进行释药实验.由释药结果,得出最佳交联CaCl2浓度.
1.5.3 不同载药复合微凝胶
称取3份0.4 g SA和0.2 g HA,其他条件不变,分别称取0.1 g的姜黄素、吲哚美辛和二甲双胍,制备3组不同的载药微凝胶,然后自然风干.制得的微凝胶进行释药,由释药结果得出微凝胶对不同药物的缓释效果.
2 结果与讨论
2.1 复合微凝胶的表征分析
2.1.1 复合水凝胶与复合微凝胶的形貌表征
由图3可知,新制的HA-SA复合水凝胶是白色的球状体,球体直径约为0.3 cm,风干后体积明显变小,直径约0.1 cm;而溶胀后的水凝胶变成了近透明的球体,体积比新制的水凝胶大.而制备的HA-SA复合微凝胶呈白色小球状,风干后偏粉末,体积明显变小;载姜黄素药物的HA-SA微凝胶呈现黄色,直径约为0.05 cm.

图3 HA-SA复合水凝胶及HA-SA复合微凝胶的形貌比较Fig.3 Comparison of morphology of HA-SA compositehydrogel and HA-SA compositemicrogel
2.1.2 复合微凝胶的FT-IR及XRD分析
由图4可知,HA-SA复合微凝胶的图谱保留了纯HA及SA的特征吸收峰,且HA-SA红外光谱中1680 cm-1处新增了酰胺键的吸收峰,由此可知,HA的-COOH与交联剂ADH的-NH2成功的进行了脱水缩合反应形成了酰胺键.
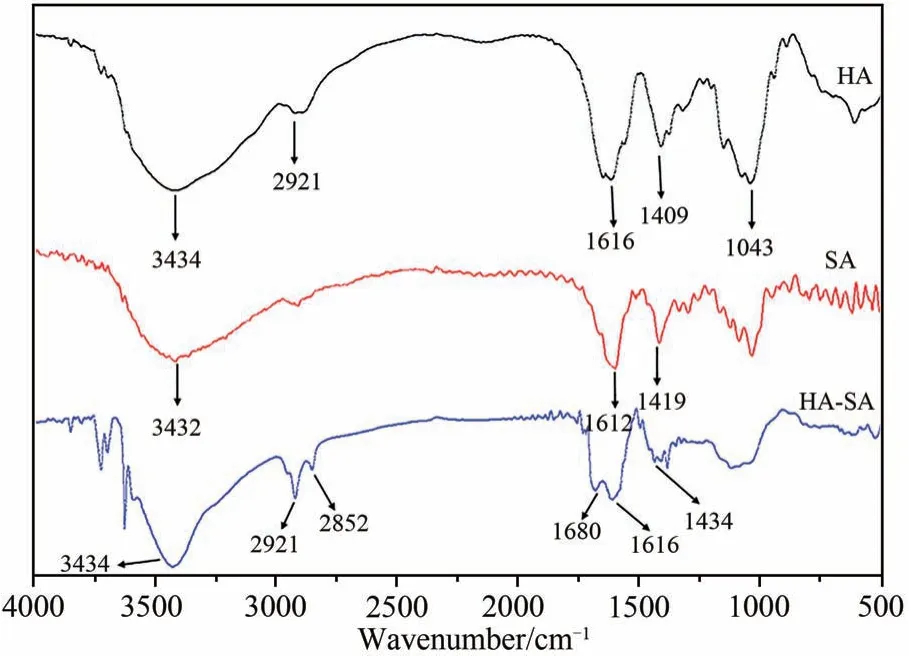
图4 HA-SA复合微凝胶红外光谱分析Fig.4 Infrared spectrum analysis of HA-SA compositemicrogel
从图5中可看出SA的衍射图在衍射角(2θ)约为14°左右处有尖锐的衍射峰,而HA的衍射图没有尖锐峰,该结果表示材料SA具有晶形结构,HA没有晶形结构.而以SA、HA为原料制备的HA-SA复合微凝胶也没有出现衍射峰,由此可知SA在经物理交联后结构变为不定型结构.

图5 HA-SA复合微凝胶X射线衍射图谱分析Fig.5 X-ray diffraction pattern analysisof HA-SA compositemicrogel
2.2 复合水凝胶溶胀性能分析
水凝胶的溶胀性能是影响是药物释放的重要因素.为此,首先考察了HA-SA宏观水凝胶的溶胀性能,以期进一步考察其微凝胶的释药行为.由图6可知,该复合水凝胶有明显的pH敏感性,前2 h于SGF中HA-SA复合水凝胶基本不溶胀,溶胀率在5以内,而当2 h后更换SIF,此后水凝胶网络结构逐渐打开,体积变大不断溶胀,约33.5 h后达到最大溶胀率44.故此水凝胶由pH=1.2的SGF转至pH=7.4的SIF中后,溶胀率发生明显变化,由SGF中几乎不溶胀到SIF中逐渐溶胀并最终达44的溶胀率,充分说明该凝胶体系具显著pH敏感性,可控制药物在肠道缓慢持续释放.

图6 HA-SA复合水凝胶的溶胀曲线Fig.6 Swellingcurveof HA-SA compositehydrogel
2.3 复合微凝胶释药性能分析
通过对复合微凝胶进行单因素考察,得到交联时间、CaCl2浓度以及不同模型药物等因素对该微凝胶释药性能的影响,结果见图7.

图7 制备条件对HA-SA复合微凝胶释药性能的影响Fig.7 Theinfluenceof preparation conditions on thedrugreleaseperformance of HA-SA compositemicrogels
2.3.1 交联时间
由图7(a)可知交联12 h所得微凝胶对pH变化最敏感,可更好地控制药物在肠道缓慢持久的释放,此时微凝胶具有较好的pH响应性.且交联12 h时,可达更好的交联度,使整个凝胶体系更加稳定.
2.3.2 CaCl2浓度
SA浓度不变(图7(b)),不同浓度的CaCl2溶液制备的微凝胶累积释药率大致相同,都可达包载量的90%以上,表明Ca2+不是影响微凝胶释药性能的关键因素,但比较而言2.5%CaCl2的缓释效果较好.
2.3.3 不同载药复合微凝胶
微凝胶对姜黄素有良好的缓释作用效果(图7(c));而吲哚美辛微凝胶在前2 h就发生药物突释且平衡时只有约60%的释药量,药物释放不完全;二甲双胍微凝胶突释严重.相同的凝胶体系,由于二甲双胍极易溶于水,而溶解度大的药物释药较快[16],且吲哚美辛较姜黄素也有较好的溶解性.因此,该微凝胶体系对姜黄素具有最好的缓释作用,可控制药物在肠道缓慢持久释放发挥治疗作用.
3 结语
以HA和SA为原料,制备了一种具有互穿网络结构的pH敏感型微凝胶,该体系反应条件温和,原料经济易得且制备简便.当溶胀时间为33.5 h时复合微凝胶溶胀率达44;当Ca2+浓度为2.5%,交联时间为12 h时,复合微凝胶有最佳释药性能;且该微凝胶对姜黄素的缓释效果要优于吲哚美辛和二甲双胍.HA-SA复合微凝胶不仅具有pH敏感性控制药物在肠道中的作用而且可以控制药物的缓慢持久释放,在药物递送和治疗肠道疾病领域上具有潜在价值.
