洛伐他汀调控转化生长因子-β诱导的卵巢癌细胞增殖、侵袭和迁移的机制研究
2023-01-05弓翠屏王英
弓翠屏,王英
卵巢癌是一种常见女性生殖系统恶性肿瘤。研究表明,由于缺少特异性症状和临床早期诊断方法,导致大多数卵巢癌病人确诊时已近晚期或发生转移[1-2]。对于已转移的卵巢癌病人,不能采用手术治疗,因此探究新型的化疗药物成为临床的研究热点。转化生长因子-β(TGF-β)是TGF家族的重要成员,在细胞生长、分化中发挥重要的作用[3-4]。研究发现,TGF-β对细胞转移中上皮细胞间充质化(EMT)过程具有关键调控作用[5]。近年来研究发现,他汀类药物如辛伐他汀、洛伐他汀不仅具有降血脂的作用,还可抑制肿瘤细胞的生长[6-7]。据报道,辛伐他汀可阻碍TGF-β诱导的卵巢癌细胞恶性生物学特性及EMT过程[8]。因此本研究于2019年8月至2020年5月,以卵巢癌SKOV3细胞为研究对象,探究洛伐他汀对TGF-β诱导的SKOV3细胞增殖、侵袭、迁移的影响以及作用机制。
1 资料与方法
1.1 一般资料人卵巢癌SKOV3细胞购自美国生物标准品收藏中心公司,胎牛血清、RPMI-1640购自美国Gibco公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所,Mataigel胶购自美国BD公司,Transwell小室购自美国Corning公司,兔抗神经钙黏素(N-cadherin)抗体(1∶300)、鼠抗波形蛋白(Vimentin)抗体(1∶200)、兔抗上皮钙黏素(E-cadherin)抗体(1∶100)、兔抗p38丝裂原活化蛋白 激 酶(p38 mitogen-activated protein kinases,p38MAPK)抗体(1∶1 000)购自英国Abcam公司,鼠抗Phosphorylation p38 MAPK(p-p38)抗体(1∶2 000)购自美国Santa Cruz公司。电泳转膜仪购自美国BIO-RAD公司,酶标仪购自美国Sigma公司。
1.2 SKOV3细胞的培养SKOV3细胞在RPMI-1640培养基中培养,加入10%灭活胎牛血清,5%二氧化碳、37℃培养箱中,每1~2天换液,细胞密度达到80%,胰酶消化传代。
1.3 CCK-8实验检测SKOV3细胞增殖洛伐他汀与二甲基亚砜混合,浓度调整为0、5、10、20、40、60 μmol∕L;TGF-β溶于去离子水,浓度为10 μg∕L;采用不同浓度(0、5、10、20、40、60 μmol∕L)洛伐他汀培养SKOV3细胞;以每孔1×104个细胞接种至96孔板,37℃分别培养24 h、48 h、72 h,每孔加入10 μL CCK-8,继续培养1 h,酶标仪检测450 nm下SKOV3细胞吸光值,吸光值越大,表示SKOV3细胞增殖活性越强。
1.4 划痕实验检测SKOV3细胞迁移率将SKOV3细胞分为对照组、TGF-β(10 μg∕L)组、洛伐他汀(10 μmol∕L)组、洛伐他汀+TGF-β组;对照组细胞常规培养,TGF-β(10 μg∕L)组、洛伐他汀(10 μmol∕L)组细胞中分别加入10 μg∕L TGF-β和10 μmol∕L洛伐他汀处理,洛伐他汀+TGF-β组细胞中同时加入10 μg∕L TGF-β和10 μmol∕L洛伐他汀处理;收集3×105个SKOV3细胞,接种至6孔板,37℃培养至细胞密度约为80%~90%,采用无菌枪头在培养板中划线,通过显微镜观察0 h、24 h划痕面积,计算迁移率。迁移率=(0 h划痕面积-24 h划痕面积)∕0 h划痕面积×100%。
1.5 Transwell法检测SKOV3细胞侵袭、迁移将Mataigel胶与无血清培养基置于冰上按1∶8混合,取50 μL Mataigel胶稀释液覆盖Transwell上室,37℃孵育2 h,凝固后备用。收集各组培养24 h的SKOV3细胞,加入200 μL无血清培养基,吸取含1×105个SKOV3细胞悬浮液加入Transwell上室中,下室加入500 μL含10%胎牛血清的培养基,37℃孵育24 h,棉签擦掉残留SKOV3细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,显微镜(×200)下检测侵袭细胞数;迁移实验过程中Transwell上室无须添加Mataigel胶,其与同侵袭。
1.6 蛋白质印迹法检测蛋白水平收集各组SKOV3细胞,每孔加入RIPA裂解液,冰上裂解30 min,提取总蛋白;将蛋白样品适量稀释,100℃加热5 min;吸取40 μg蛋白样品上样,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜上,5%脱脂奶粉封闭1 h,TBST清洗3次,加入一抗(按照说明书进行稀释),4℃过夜,TBST清洗3次,加入二抗,37℃孵育1.5 h,显影、拍照,Quantity One软件测定蛋白灰度,分析蛋白灰度值∕GAPDH蛋白灰度值的比值。
1.7 统计学方法SPSS 22.0统计学软件分析实验结果,计量资料表示为±s,多组间比较采用单因素方差分析,组间多重比较使用SNK-q检验,不同浓度、不同时间作用下细胞增殖活性采用重复测量方差法分析,P<0.05认为差异有统计学意义。
2 结果
2.1 不同浓度洛伐他汀对TGF-β诱导SKOV3细胞增殖的影响结果见表1,与对照组相比,TGF-β(10 μg∕L)组提高SKOV3细胞24 h、48 h和72 h的增殖活性,均差异有统计学意义(P<0.05)。与TGF-β(10 μg∕L)组相比,随着洛伐他汀浓度的不断增加,5、10、20、40、60 μmol∕L TGF-β诱导的SKOV3细胞24 h、48 h和72 h增殖活性逐渐降低;随着洛伐他汀作用时间的不断增加,TGF-β诱导的SKOV3细胞增殖活性逐渐升高;差异有统计学意义(P<0.05)。其中,10 μmol∕L洛伐他汀在24 h即对TGF-β诱导的SKOV3细胞增殖具有明显抑制作用。
表1 不同浓度洛伐他汀对转化生长因子-β(TGF-β)诱导SKOV3细胞增殖的影响
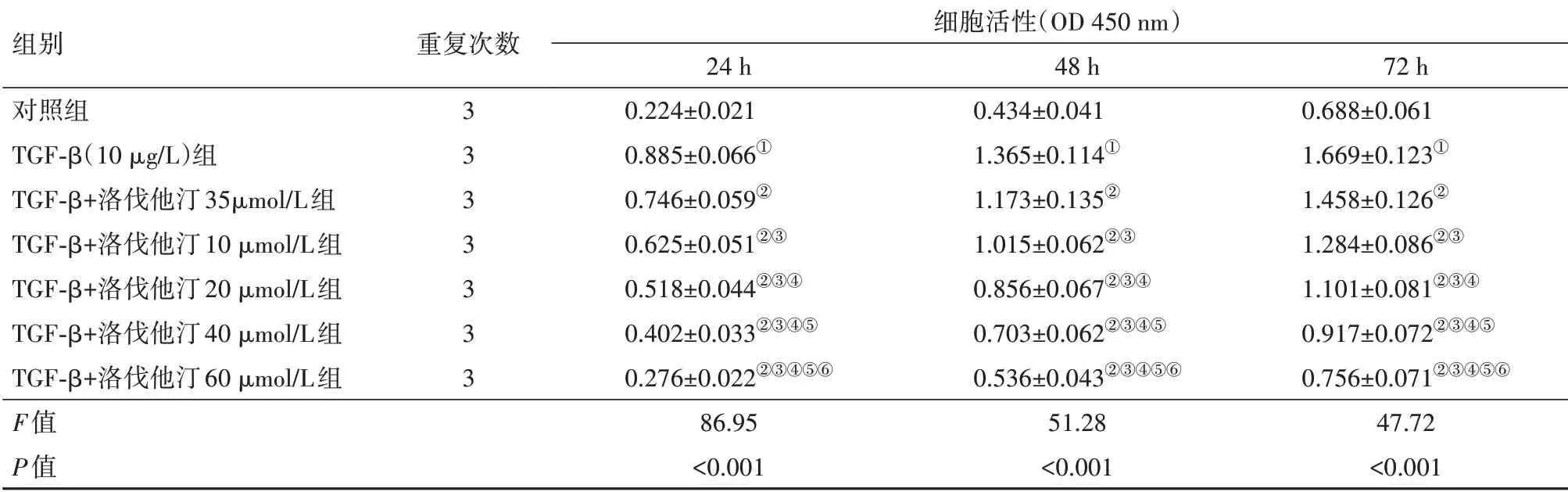
表1 不同浓度洛伐他汀对转化生长因子-β(TGF-β)诱导SKOV3细胞增殖的影响
注:①与对照组相比,P<0.05。②与对照组TGF-β(10 μg∕L)组相比,P<0.05。③与对照组TGF-β+洛伐他汀5μmol∕L组相比,P<0.05。④与对照组TGF-β+洛伐他汀10 μmol∕L组相比,P<0.05。⑤与对照组TGF-β+洛伐他汀20 μmol∕L组相比,P<0.05。⑥与对照组TGF-β+洛伐他汀40 μmol∕L组相比,P<0.05。
组别对照组TGF-β(10 μg∕L)组TGF-β+洛伐他汀35μmol∕L组TGF-β+洛伐他汀10 μmol∕L组TGF-β+洛伐他汀20 μmol∕L组TGF-β+洛伐他汀40 μmol∕L组TGF-β+洛伐他汀60 μmol∕L组F值P值重复次数3 3 3 3 3 3 3细胞活性(OD 450 nm)24 h 0.224±0.021 0.885±0.066①0.746±0.059②0.625±0.051②③0.518±0.044②③④0.402±0.033②③④⑤0.276±0.022②③④⑤⑥86.95<0.001 48 h 0.434±0.041 1.365±0.114①1.173±0.135②1.015±0.062②③0.856±0.067②③④0.703±0.062②③④⑤0.536±0.043②③④⑤⑥51.28<0.001 72 h 0.688±0.061 1.669±0.123①1.458±0.126②1.284±0.086②③1.101±0.081②③④0.917±0.072②③④⑤0.756±0.071②③④⑤⑥47.72<0.001
2.2 洛伐他汀对TGF-β诱导SKOV3细胞迁移的影响与对照组相比,TGF-β(10 μg∕L)组提高SKOV3细胞迁移率和迁移细胞数,但洛伐他汀(10 μmol∕L)组降低SKOV3细胞迁移率和迁移细胞数;与TGF-β(10 μg∕L)组相比,洛伐他汀降低TGF-β(10 μg∕L)诱导的SKOV3细胞迁移率和迁移细胞数。见表2。
表2 洛伐他汀对TGF-β诱导SKOV3细胞迁移的影响∕

表2 洛伐他汀对TGF-β诱导SKOV3细胞迁移的影响∕
注:TGF-β为转化生长因子-β。①与对照组相比,P<0.05。②与TGF-β(10 μg∕L)组或洛伐他汀(10 μmol∕L)组相比,P<0.05。
组别对照组TGF-β(10 μg∕L)组洛伐他汀(10 μmol∕L)组洛伐他汀+TGF-β组F值P值重复次数3 3 3 3迁移率0.423±0.045 0.786±0.074①0.258±0.026①0.485±0.051②54.16<0.001迁移细胞数163.895±15.473 357.962±32.632①65.241±6.487①212.341±20.523①②100.86<0.001
2.3 洛伐他汀对TGF-β诱导SKOV3细胞侵袭的影响对照组、TGF-β(10 μg∕L)组、洛伐他汀(10 μmol∕L)组、洛伐他汀+TGF-β组的细胞侵袭数分别为89.658±8.746、179.635±15.432、32.163±3.054、114.362±10.963,四组之间比较差异有统计学意义(F=100.81,P<0.001)。与对照组相比,TGF-β(10μg∕L)组提高SKOV3细胞侵袭数,但洛伐他汀(10 μmol∕L)组降低SKOV3细胞侵袭数;与TGF-β(10 μg∕L)组相比,洛伐他汀降低TGF-β(10 μg∕L)诱导的SKOV3细胞侵袭数。
2.4 洛伐他汀对TGF-β诱导SKOV3细胞EMT的影响与对照组相比,TGF-β(10 μg∕L)组提高SKOV3细胞中N-cadherin、Vimentin蛋白水平,降低E-cadherin蛋白水平,但洛伐他汀(10 μmol∕L)组降低SKOV3细胞中N-cadherin、Vimentin蛋白水平,升高E-cadherin蛋白水平;与TGF-β(10 μg∕L)组相比,洛伐他汀降低TGF-β(10 μg∕L)诱导的SKOV3细胞中N-cadherin、Vimentin蛋白水平的增加和E-cadherin蛋白水平的降低。见表3,图1。
表3 洛伐他汀对TGF-β诱导SKOV3细胞EMT的影响
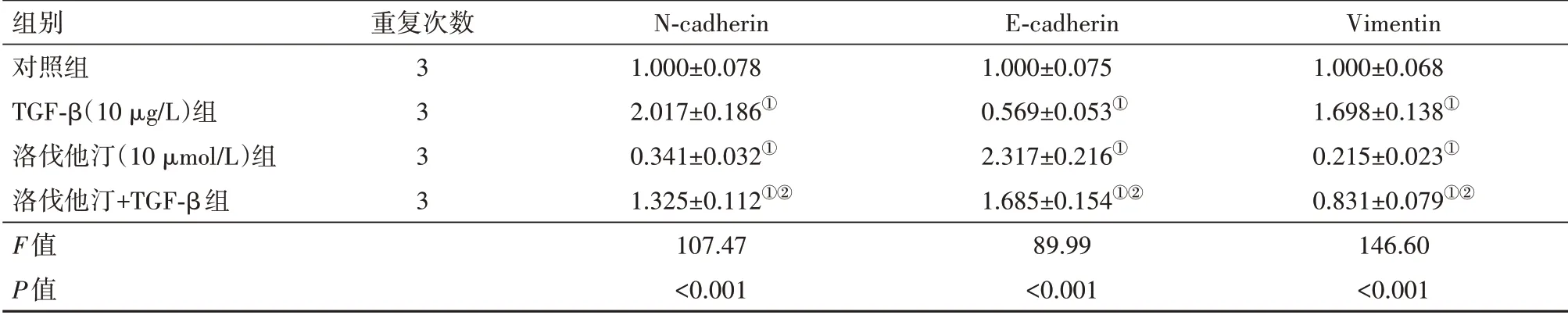
表3 洛伐他汀对TGF-β诱导SKOV3细胞EMT的影响
注:TGF-β为转化生长因子-β,N-cadherin为神经钙黏素,E-cadherin为上皮钙黏素,Vimentin为波形蛋白。①与对照组相比,P<0.05。②与TGF-β(10 μg∕L)组或洛伐他汀(10 μmol∕L)组相比,P<0.05。
组别对照组TGF-β(10 μg∕L)组洛伐他汀(10 μmol∕L)组洛伐他汀+TGF-β组F值P值重复次数3 3 3 3 N-cadherin 1.000±0.078 2.017±0.186①0.341±0.032①1.325±0.112①②107.47<0.001 E-cadherin 1.000±0.075 0.569±0.053①2.317±0.216①1.685±0.154①②89.99<0.001 Vimentin 1.000±0.068 1.698±0.138①0.215±0.023①0.831±0.079①②146.60<0.001
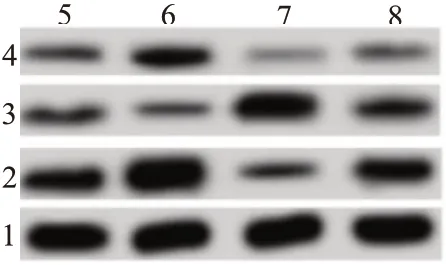
图1 洛伐他汀对TGF-β诱导SKOV3细胞EMT的影响
2.5 洛 伐 他 汀 对TGF-β诱 导SKOV3细 胞p38MAPK信号通路的影响各组p38蛋白水平无明显差异;与对照组相比,TGF-β(10 μg∕L)组提高SKOV3细胞中p-p38蛋白水平,但洛伐他汀(10 μmol∕L)组降低SKOV3细胞中p-p38蛋白水平;与TGF-β(10 μg∕L)组相比,洛伐他汀降低TGF-β(10 μg∕L)诱导的SKOV3细胞中p-p38蛋白水平的增加。见表4,图2。

图2 洛伐他汀对TGF-β诱导SKOV3细胞p38MAPK信号通路的影响
表4 洛伐他汀对TGF-β诱导SKOV3细胞p38MAPK信号通路的影响

表4 洛伐他汀对TGF-β诱导SKOV3细胞p38MAPK信号通路的影响
注:TGF-β为转化生长因子-β,p38为p38丝裂原活化蛋白激酶,p-p38为磷酸化的p38丝裂原活化蛋白激酶。①与对照组相比,P<0.05。②与TGF-β(10 μg∕L)组或洛伐他汀(10 μmol∕L)组相比,P<0.05。
组别对照组TGF-β(10 μg∕L)组洛伐他汀(10 μmol∕L)组洛伐他汀+TGF-β组F值P值重复次数3 3 3 3 p38 1.000±0.076 1.023±0.095 1.014±0.103 0.997±0.098 0.05 0.983 p-p38 1.000±0.074 1.897±0.145①0.378±0.039①1.256±0.116①②114.01<0.001
3 讨论
卵巢癌严重威胁女性的生命健康,其发病机制是一个多因素参与的过程。临床上主要采用手术和放化疗结合,但由于大部分病人确诊时已是晚期,无法采取手术治疗,化疗易产生耐药性,导致病人预后较差[9-10]。其中肿瘤组织的远端转移以及化疗耐药性是目前制约临床治疗效果的主要原因之一。EMT是肿瘤细胞侵袭、迁移过程中的重要过程,去EMT化已成为肿瘤研究的重点和热点。Ncadherin、Vimentin、E-cadherin是EMT过程中的关键调控因子[11-12]。E-cadherin是上皮细胞表型的标志物质,是EMT过程的关键限速因子;而N-cadherin、Vimentin是间质细胞表型的标志物质,E-cadherin表达量降低及N-cadherin、Vimentin表达量增加均可促进细胞侵袭、迁移。EMT过程受多种信号因子的调控,TGF-β是其中最重要的信号因子[13-14]。
洛伐他汀是一种常见他汀类药物,可抑制羟甲基戊二酰单酰辅酶A还原酶转变为甲基二羟戊酸,从而调节细胞的重要生物学功能。临床试验结果证实,洛伐他汀通过抑制鼻咽癌细胞凋亡、阻滞细胞周期,增强细胞的化疗敏感性,为临床治疗鼻咽癌提供新的思路[15];洛伐他汀通过上调或下调细胞增殖、凋亡、周期、EMT相关蛋白的表达量,从而抑制乳腺癌的发生发展[16];洛伐他汀通过调控环氧合酶-2和过氧化物酶体增殖物活化受体γ诱导人肺癌细胞凋亡[17]。上述研究均表明,洛伐他汀可通过调控细胞的生物学特性抑制肿瘤的病理进展,但其在肿瘤转移过程中的作用及机制尚不完全清楚。
在本研究中,10 μg∕L TGF-β作用于SKOV3细胞,提高细胞增殖活性,增强其侵袭、迁移能力,与前人的研究结果相似;不同浓度(0、5、10、20、40、60 μmol∕L)洛 伐 他 汀 对10 μg∕L TGF-β作 用 于SKOV3细胞增殖具有抑制作用,其中10 μmol∕L洛伐他汀在24 h即可明显抑制细胞的增殖,因此后续选取10 μmol∕L洛伐他汀进行研究;10 μmol∕L洛伐他汀对10 μg∕L TGF-β作用于SKOV3细胞侵袭、迁移具有明显的抑制作用,提高上皮细胞表型标志物E-cadherin蛋白水平,降低间质细胞表型标志物N-cadherin、Vimentin蛋白的表达量,表明洛伐他汀可抑制TGF-β诱导的卵巢癌细胞增殖、侵袭、迁移以及EMT过程。研究证实,TGF-β、洛伐他汀均可通过调控p38MAPK信号通路的活性发挥作用[18-19]。为进一步探究洛伐他汀的作用机制,本实验检测了p38MAPK信号通路关键蛋白因子p38总蛋白以及磷酸化p38蛋白水平,结果发现,洛伐他汀对TGF-β诱导的卵巢癌细胞中p38总蛋白水平无明显影响,但可降低磷酸化p38蛋白水平,表明洛伐他汀可能通过抑制p38MAPK信号通路阻碍TGF-β诱导的卵巢癌细胞增殖、侵袭、迁移以及EMT过程。
综上所述,洛伐他汀可逆转TGF-β诱导的卵巢癌细胞增殖、侵袭、迁移以及EMT过程,可能通过抑制p38MAPK信号通路发挥作用,提示洛伐他汀有可能成为卵巢癌治疗的潜在药物。未来会进一步在多株细胞以及动物模型中进一步探究洛伐他汀的抗肿瘤作用,为肿瘤的临床治疗提供新的实验基础。
