多花黄精产吲哚乙酸内生菌的分离筛选及其对黄精种子萌发的影响
2023-01-05杜佳慧徐伟芳杨晓冬谭松尹登科刘园旭
杜佳慧 徐伟芳 杨晓冬 谭松 尹登科,2,3 刘园旭,2
(1.安徽中医药大学药学院,合肥 230012;2.安徽省中医药科学院药物制剂研究所,合肥 230012;3.中药研究与开发安徽省重点实验室,合肥 230012)
多花黄精(Polygonatum cyrtonemaHua.)为百合科(Liliaceae)黄精属(Polygonatum)多年生草本药用植物,是2015年版《中国药典》收载的中药黄精基原植物之一[1]。多花黄精以其干燥根茎入药,有补气养阴、健脾益肾等功效,多用于治疗脾胃气虚、肺虚燥咳、体倦乏力等症,是传统经典的药食同源植物之一[2-3]。目前,多花黄精的繁殖方式主要依靠无性繁殖和有性繁殖[4]。其中,根茎无性繁殖是黄精传统繁殖方式,但这种方式繁殖系数低,不仅消耗大量药材,而且存在着病虫害严重及种性退化等问题[5];而有性种苗繁育技术可提高繁育系数,但种子具有形态及生理休眠等特性,萌发时间长且萌发率较低,在一定程度上导致种子繁殖困难等一系列问题[6-7]。此外,随着多花黄精市场需求量的增加,加上人类长期以来的过度采挖,以及多花黄精生长受限,资源恢复困难等因素导致多花黄精资源十分匮乏[8]。因此,寻找一种绿色环保、安全有效的方法来解决多花黄精资源短缺的现状具有重要意义。
植物内生菌(endophyte)是指生活史中一定阶段或全部阶段在健康植物组织和器官内部与植物共生,但不引起宿主植物发生明显病害特征的一类微生物群体,包括内生细菌和内生真菌[9]。作为植物微生态系统的重要组成部分,内生菌构筑了宿主植物的健康屏障,且可通过垂直传播使子代植物具有相似的内生菌群[10]。内生菌可通过产生植物激素,如吲哚乙酸(indole-3-acetic acid,IAA)来直接促进宿主植物生长[11]。IAA 是一种调节植物生长的重要信号物质,其在植物生长过程中起到促进细胞生长、增加细胞体积和质量、促进细胞分裂分化、调节植物生根等方面的作用[12-14]。有关玉米[15]、花生[16]、马铃薯[17]、辣椒[18]等多种植物内生菌的研究结果表明,产IAA 内生菌因能促进宿主植物生长与增强植物抗逆性而被广泛应用,具有研制成微生物肥料的巨大潜力。然而,利用产IAA 内生菌来促进黄精植物种子萌发和改善其生长发育的相关研究鲜见报道。
因此,本研究以多花黄精(Polygonatum cyrtonemaHua.)为植物材料,利用传统的组织分离培养法从多花黄精根部分离纯化内生细菌和内生真菌,从中筛选出可分泌IAA 的内生菌分离株,并利用形态学观察、生理生化检测、分子生物学方法详细鉴定目标功能菌株,进一步利用温室种子发芽实验检测其促生功效,以期为利用内生菌解决多花黄精繁殖难题并提高宿主多花黄精产量奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 供试植物材料 新鲜多花黄精样品采自安徽中医药大学“沁馨园”药园(31°56′19″N,117°23′20″E),该植物经安徽中医药大学杨青山老师鉴定为百合科黄精属的多花黄精(Polygonatum cyrtonemaHua.)。黄精种子购自中药植物市场。
1.1.2 供试培养基 高氏I 号培养基(GA):可溶性淀粉20.00 g,KNO31.00 g,NaCl 0.50 g,K2HPO40.50 g,MgSO40.50 g,FeSO40.01 g,琼脂15.00-20.00 g,蒸馏水1 000 mL,pH 7.2-7.4;营养琼脂培养基(NA):蛋白胨10.00 g,牛肉膏3.00 g,NaCl 5.00 g,琼脂15.00-20.00 g,蒸馏水1 000 mL,pH 7.2-7.4;Luria-Bertani 固体培养基(LB):胰蛋白胨10.00 g,酵母提取物5.00 g,NaCl 10.00 g,琼脂15.00-20.00 g,蒸馏水1 000 mL,pH 7.2-7.4;马铃薯葡萄糖琼脂培养基(PDA):马铃薯200.00 g,葡萄糖20.00 g,琼脂15.00-20.00 g,蒸馏水1 000 mL,pH 自然;察氏培养基(CZA):NaNO33.00 g,K2HPO41.00 g,KCl 0.50 g,MgSO40.50 g,FeSO40.01 g,蔗糖30.00 g,琼脂15.00 g,蒸馏水1 000 mL,pH 自然。以上培养基不加琼脂即为对应的液体培养基,且均在121℃高压灭菌20 min 备用。
1.1.3 主要试剂 基因组DNA 提取试剂盒PrepMan Ultra Sample Preparation Reagent( 美国ABI 公司,批号4318930);革兰氏染色试剂盒(北京索莱宝科技有限公司,批号G1060);细菌生理生化检测鉴定试剂盒(广东环凯微生物科技有限公司,批号5110110);99.8%吲哚乙酸(上海源叶生物科技有限公司,批号B21810);Taq PCR Mix 预混液、DNA 分子量标准Marker、DNA 引物等常规分子试剂(上海生工生物工程股份有限公司,批号分别为B639295-0005,B500350-0500);可溶性淀粉、蔗糖(上海源叶生物科技有限公司,批号分别为S11006、S11055),蛋白胨、牛肉膏(北京索莱宝科技有限公司,批号分别为T8490、G8270),葡萄糖、NaCl 等(国产分析纯,批号分别为10010518、10016318)。
1.1.4 主要仪器设备 SW-CJ-1D 超净工作台(苏州博莱尔净化设备有限公司),41317065 电热恒温培养箱(美国Thermo),THZ-82A 数显气浴恒温振荡器(常州普天仪器制造有限公司),YM100 型立式压力蒸汽灭菌器(上海三申医疗器械有限公司),427029 倒置显微镜(德国莱卡),3711293 PCR 仪(德国耶拿),DYY-8C 型水平电泳仪(北京六一生物科技有限公司),D07745 凝胶成像仪(德国耶拿),UV-1000 型紫外可见分光光度计(上海翱艺仪器有限公司)。
1.2 方法
1.2.1 多花黄精内生菌的分离与保种 参考谢洁等[19]的方法进行多花黄精根部的表面消毒和内生菌的分离,并利用平板划线法和菌丝顶端纯化法纯化内生细菌和内生真菌。纯化后的内生菌进行甘油保种,并置于-80℃冰箱备用。
1.2.2 产IAA 菌株的筛选 采用Salkowski 比色法[20]对IAA 产生菌进行筛选。将获得的内生细菌和内生真菌活化后,分别接种于LB 液体培养基和PDB 培养基中进行摇床培养,其中内生细菌培养温度为28℃,发酵时间为3 d,内生真菌培养温度为25℃,发酵时间为7 d。发酵结束后,在12 000 r/min 条件下离心30 min,取发酵上清液进行IAA 检测,具体检测方法参照文献[20]。在本实验中,以培养基作为阴性对照,以30 mg/L IAA 标准溶液作为阳性对照,若待测菌株发酵液与Salkowski 显色试剂的混合液出现红色反应,则说明有IAA 的产生,且红色越深说明IAA 产量越高。
1.2.3 产IAA 菌株的定量检测 标准曲线的制备:取蒸馏水和IAA 标准品制备标准溶液,浓度分别为5、10、15、20、30、40、50、100 mg/L,将配置好的标准液与Salkowski 显色剂按体积比1∶1 混合后室温避光放置30 min。以蒸馏水与Salkowski 显色剂等体积混合作为空白对照,用紫外分光光度计测定OD530处各浓度的吸光度,以IAA 标准品各浓度为横坐标,对应的吸光度为纵坐标,绘制IAA 标准曲线。
IAA 含量测定:将新鲜的产IAA 菌株接种到LB液体培养基中,于28℃的摇床振荡培养。发酵24、36、72、96 和120 h 后,按上述方法分别测定1 mL菌株发酵上清液与Salkowski 显色剂反应后的OD530的吸光值,再根据IAA 标准曲线计算相应的IAA含量。
1.2.4 产IAA 菌株的菌种鉴定
1.2.4.1 产IAA 菌株的形态学鉴定 将上述产IAA活性明显且稳定的促生菌接种于新鲜的LB 培养基上,28℃培养箱中培养18-24 h,观察单菌落的大小、形状、颜色、透明度等特征。同时,将培养24 h 和48 h 的细菌分别进行革兰氏染色和芽孢染色,具体操作方法见参考文献[21]。
1.2.4.2 产IAA 菌株的生理生化鉴定 参照文献[22]的方法进行糖或醇(葡萄糖、乳糖、麦芽糖、蔗糖、甘露醇)的发酵试验、甲基红试验及乙酰甲基甲醇试验(MR-VP)等生理生化特性的测定。
1.2.4.3 产IAA 菌株的分子生物学鉴定 利用基因组试剂盒Prepman Ultra Sample Preparation Reagent(Applied Biosystems,USA)说明书中的方法提取各菌株的总DNA,并以其为模板,参照文献[23]中的细菌通用引物27F 与1492R 进行PCR 扩增反应。PCR 扩增反应体系(总体积25.00 μL)与PCR 反应条件分别参照文献[24-25]。扩增产物由生工生物工程(上海)股份有限公司测序。将获得的基因序列与National Center for Biotechnology Information(NCBI)的网站数据库进行(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,并下载同源性较高序列,使用MEGA 7.0 软件,以邻接法(neighbor-joining method)构建系统进化树。以上测序结果均提交至GenBank 数据库,以获得序列登录号。
1.2.5 目标菌株对黄精种子萌发的影响 种子萌芽实验参照周新华[26]的方法并稍作修改,本研究共设4 个实验组:(1)HNC2 菌株菌悬液;(2)HNC2 菌株发酵上清液;(3)HPB1 菌株菌悬液;(4)HPB1菌株发酵上清液。其中,菌悬液是由目标菌株经LB培养基发酵24 h 离心后,菌体沉淀用无菌水重悬并调节浓度为1.0×108CFU/mL,发酵上清液是由目标菌株经LB 培养基发酵24 h 离心后直接取上清获得。另设3 个对照组:(1)无菌水;(2)LB 培养基;(3)IAA 标准品(100 mg/L)。按上述分组进行24 h 浸种处理,浸种结束后,取各组种子置于铺有湿润无菌滤纸的玻璃平皿(直径=9 cm)中,每皿20 粒种子,每个处理3 个重复,于25℃、12 h/12 h 光照黑暗交替、湿度为90%的人工气候培养箱中静置培养。每天加无菌水维持湿度,连续保湿培养22 d,并于第12 天调查种子发芽势,第22 天统计其发芽率。培养结束时,统计萌发幼苗的胚芽长、胚根长以及子叶宽度等指标,观察目标菌株菌悬液与发酵上清液对黄精种子发芽的影响[27]。
种子发芽势及发芽率计算方式:发芽势(%)=处理后第12 天发芽种子数/供试种子数×100%;发芽率(%)=处理后第22 天发芽种子数/供试种子数×100%。
1.2.6 数据分析与处理 IAA 标准曲线和含量测定采用Origin 2018 软件作图。实验数据采用SPSS 23.0统计分析软件处理,多组间差异比较采用单因素方差分析检验,均数多重比较采用LSD 检验,P<0.05为差异有统计学意义。
2 结果
2.1 黄精内生菌的分离
利用LB、PDA、NA、GA 和CZA 培养基,现从多花黄精根部中分离培养并纯化出内生菌34 株,包括内生细菌25 株,内生真菌9 株(表1)。纯化后的菌落形态如图1和2 所示。
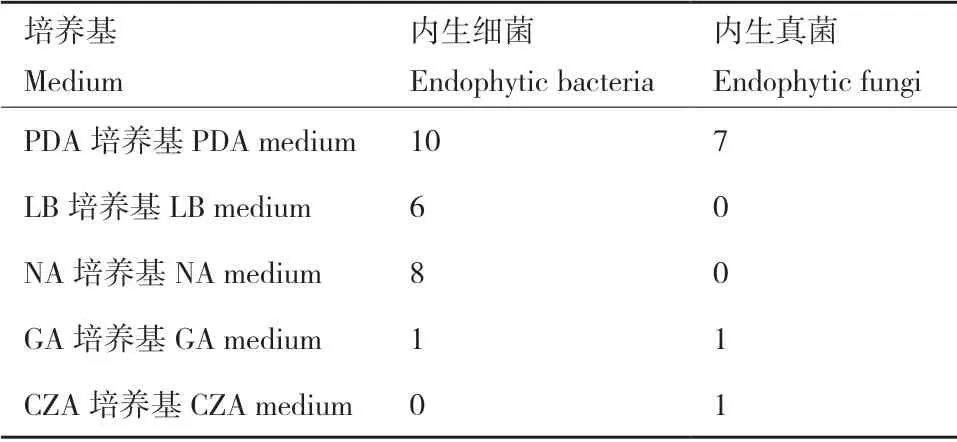
表1 多花黄精内生菌分离情况统计Table 1 Statistics of endophytes isolated from Polygonatum cyrtonema Hua.
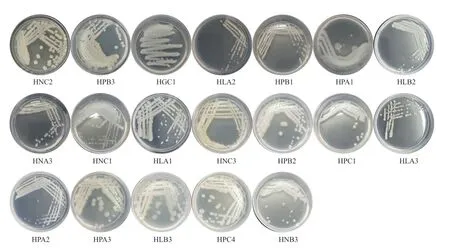
图1 部分多花黄精内生细菌在LB 培养基上的形态Fig.1 Morphology of some endophytic bacteria isolated from Polygonatum cyrtonema Hua.on LB medium
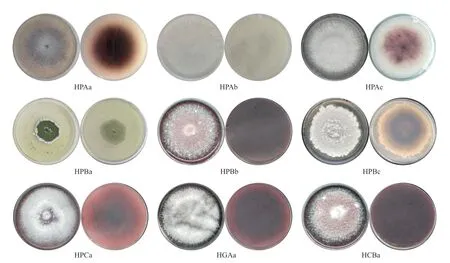
图2 多花黄精内生真菌在PDA 培养基上的形态图Fig.2 Morphology of endophytic fungi isolated from Polygonatum cyrtonema Hua.on PDA medium
2.2 产IAA菌株的筛选
以分离获得的多花黄精内生菌为基础,从中初步筛选出7 株具有产IAA 功能的内生细菌,具体初筛情况如表2所示。在本研究中,并未筛选到产IAA 能力的内生真菌。经多次IAA 活性检测后发现,编号为HNC2、HPB1、HPB3 的内生细菌发酵液能稳定与Salkowski 试剂反应呈红色(图3)。
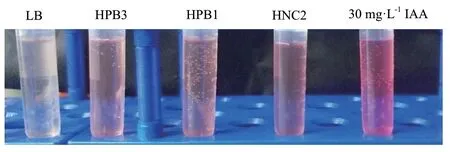
图3 多花黄精内生细菌产IAA 能力的定性检测Fig.3 Qualitative detection of IAA-production ability of endophytic bacteria isolated from Polygonatum cyrtonema Hua.

表2 产IAA 能力的多花黄精内生菌初筛统计Table 2 Statistics of IAA-producing ability of endophytic bacteria isolated from Polygonatum cyrtonema Hua.
配制不同浓度IAA 溶液制成标准曲线,如图4-A所示,标准方程为:y=0.015 3x+0.055 2,R2=0.992 9。促生菌株的IAA 定量实验结果显示,随着培养时间的增加,菌株分泌IAA 的能力均呈现先上升的趋势,达96 h 后,HNC2 菌株和HPB1 菌株分泌IAA的能力呈下降趋势,HPB3 菌株微呈上升趋势。其中HNC2 和HPB1 菌株分泌IAA 的含量在第96 小时达到最高值,分别可达4.833 mg/L、4.608 mg/L,均明显高于HPB3 菌株在发酵第120 小时分泌IAA 的峰值(4.524 mg/L)(图4-B);同时HPB3 菌株在每个发酵时间点分泌IAA 的能力均明显弱于HNC2 和HPB1 菌株。因此,将两株分泌IAA 能力稳定且含量较高的内生细菌HNC2 和HPB1 作为后续实验研究对象。
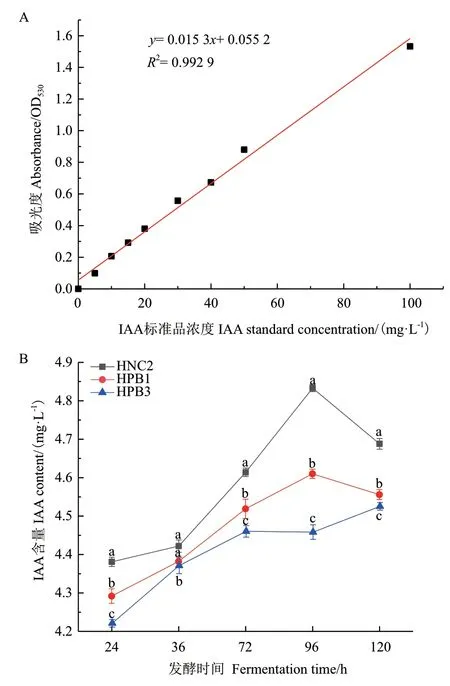
图4 IAA 标准曲线(A)与多花黄精内生菌分泌IAA 的含量随时间的变化趋势(B)Fig.4 IAA standard curve(A)and trends of the content of IAA secreted by endophytic bacteria of Polygonatum cyrtonema Hua.over time(B)
2.3 产IAA菌株HNC2和HPB1的鉴定
2.3.1 形态学特征观察 HNC2 菌株在LB 培养基28℃培养24 h,菌落呈白色、圆形,表面光滑不透明(图5-A),该菌株显微形态观察为长杆状,革兰氏染色呈蓝紫色,为革兰氏阳性菌(图5-B),芽孢染色结果表明该菌株能产芽孢(图5-C);HPB1 菌落形态则为表面光滑的圆形,乳白色,且为透明状(图5-D),显微形态观察为圆球形,革兰氏染色实验结果表明其为革兰氏阳性菌(图5-E),不能产生芽孢。
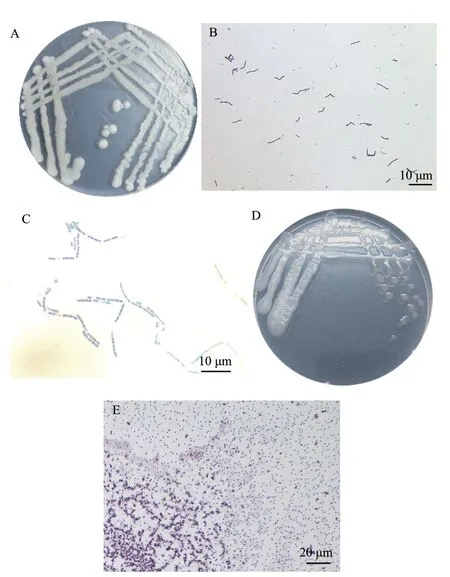
图5 HNC2 和HPB1 菌株的菌落及菌体形态特征Fig.5 Colony and morphological characteristics of HNC2 strain and HPB1 strain
2.3.2 生理生化检测 生理生化检测显示:HNC2菌株可利用葡萄糖、麦芽糖、蔗糖;MR 试验阳性;尿素试验为阴性。HPB1 菌株尿素试验为阳性;不可利用糖类物质如葡萄糖、乳糖等;MR 试验阴性。二者VP 试验均为阳性;均可分解蛋白胨中的色氨酸,产生吲哚;均可利用西蒙氏柠檬酸盐;均可在半固体琼脂培养基中扩散生长,表明其具有运动性;均不可利用乳糖、甘露醇;均不可分解培养基中含硫化合物(表3)。
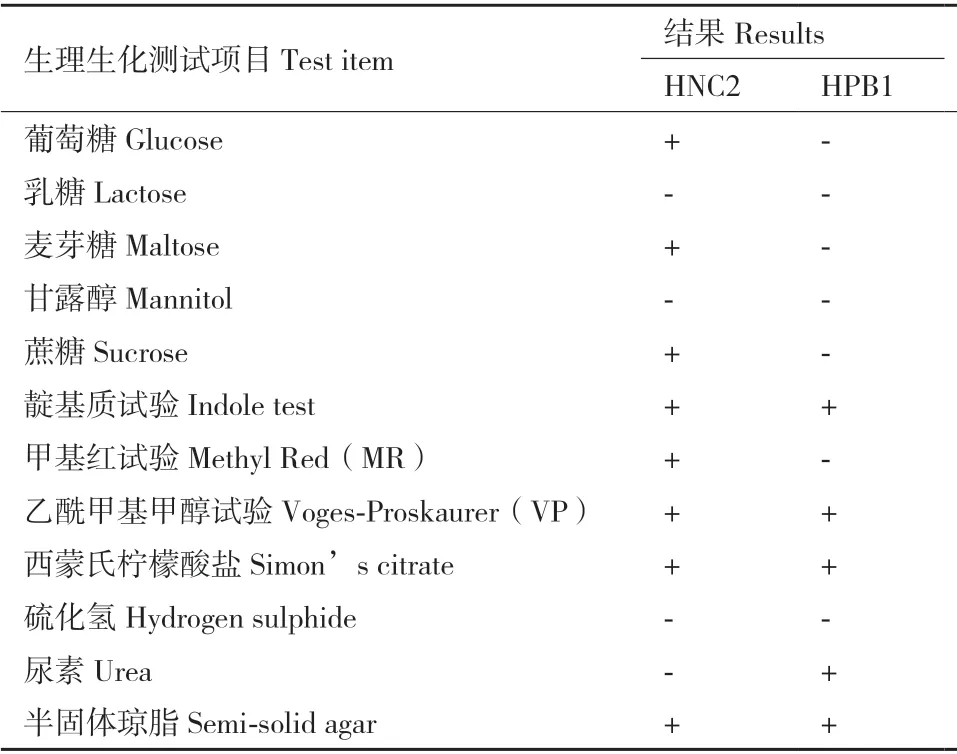
表3 HNC2 和HPB1 菌株的生理生化特征Table 3 Physiological and biochemical characteristics of HNC2 strain and HPB1 strain
2.3.3 分子生物学鉴定 以多花黄精产IAA 菌株HNC2 和HPB1 的DNA 为模板,经PCR 反应扩增后,成功获得长度分别为1 454 bp、1 457 bp 的16S rDNA 基因序列。进一步将序列提交至GenBank中,得到菌株登录号分别为MZ298557、MZ315031。基于16S rDNA 的序列比对及系统发育分析结果表明,HNC2 与登录号为MT516449 的菌株Bacillussp.的相似性高达99.93%,并与其处于同一最小分支(图6-A),而HPB1 菌株与登录号为KY264989的菌株Staphylococcussp.同源性很高,且与其处于同一最小分支(图6-B)。
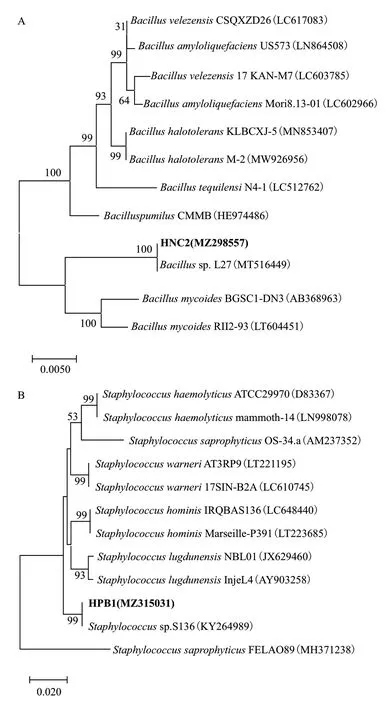
图6 HNC2 菌株(A)与HPB1 菌株(B)基于16S rDNA序列的系统进化树Fig.6 Phylogenetic tree of HNC2 strain(A)and HPB1 strain(B)based on 16S rDNA sequence
结合形态学、生理生化特征,及基于16S rDNA序列的系统发育分析结果,故将HNC2 鉴定为芽孢杆菌属(Bacillussp.),命名为Bacilussp.HNC2,将HPB1 鉴定为葡萄球菌属(Staphylococcussp.),命名为Staphylococcussp.HPB1。
2.4 产IAA菌株HNC2和HPB1对黄精种子萌芽的影响
将黄精种子进行纸床培养,不同处理组的种子萌芽时间、发芽势、发芽率以及萌发幼苗生长状况均有所差别。(1)从萌芽时间上看,HNC2 和HPB1发酵液处理组中的黄精种子分别在第4 天和第8 天开始发芽,而LB 培养基对照组则在第9 天开始发芽;HNC2 和HPB1 菌悬液处理组中的种子均在第6天开始发芽,而无菌水对照组则第11 天开始发芽,且IAA 阳性对照组在第7 天开始发芽;(2)从发芽势和发芽率上看,无论是菌悬液处理组还是发酵液处理组,HNC2 菌株和HPB1 菌株均能明显提高黄精种子的发芽势和发芽率,尤其是在发芽势指标上表现更为明显:与LB 培养基对照相比,HNC2 发酵液处理组和HPB1 发酵液处理组的发芽势分别提高了366.60%和133.40%;与无菌水对照相比,HNC2菌悬液处理组和HPB1 菌悬液处理组的发芽势分别提高了173.58%和223.43%(表4);(3)从幼苗生长指标上看,尽管胚根长、胚芽长及叶宽在各菌株间未出现显著性差异,但仍可以看出,经HNC2 菌悬液处理的种子胚芽长(20.10 mm)优于无菌水对照组(19.47 mm);两株菌悬液处理组种子胚根长(HNC2 14.60 mm;HPB1 12.23 mm)及叶宽(HNC2 2.73 mm;HPB1 2.53 mm)优于无菌水对照组(胚根长6.83 mm;叶宽1.73 mm),这种促生效果亦体现在菌株发酵液处理组(表4)。
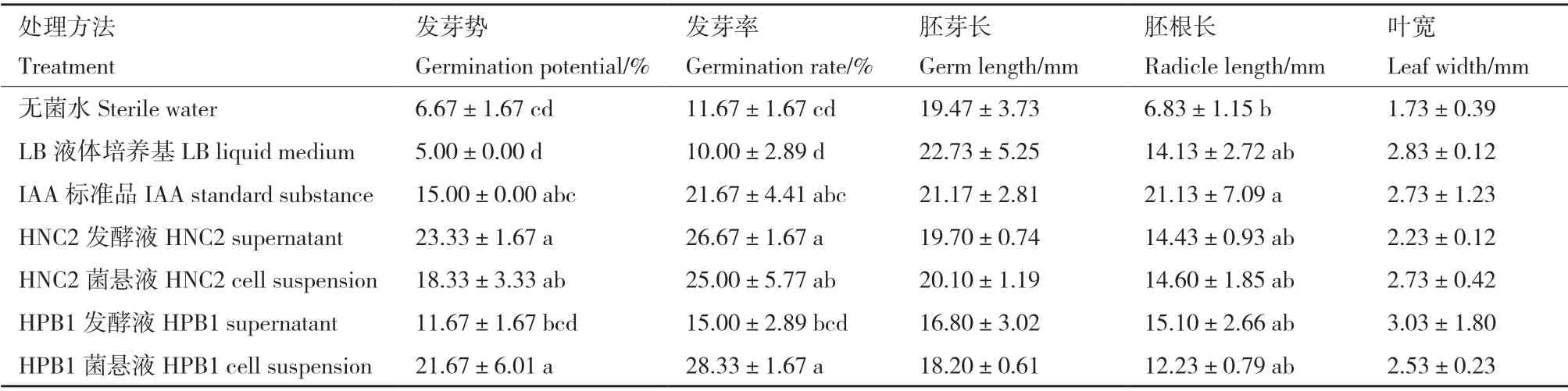
表4 内生细菌HNC2 和HPB1 对黄精种子发芽的影响Table 4 Effects of endophytic bacteria HNC2 and HPB1 on the germination of Polygonatum seeds
3 讨论
国内外研究表明,植物内生菌不仅可以有效提高宿主植物的生长发育,且在增强植物对病虫害抵抗能力方面亦发挥重要作用[28]。内生菌可从溶磷、解钾、固氮作用、产生铁载体和分泌植物生长激素[29]等方面直接促进宿主植物生长,也可通过产生抗菌化合物和分泌活性酶等提高宿主植物对各种病虫害和病原菌的抵抗能力,从而间接促进植物生长[30]。Xu 等[31]从桑树33 株拮抗菌中筛选出8 株能够促进桑苗生长的内生菌,其中芽孢杆菌属Bacillussp.CW16-5 的促生能力最强;Swain 等[32]研究发现,与未用细菌悬浮液处理的山药相比,经产IAA 的枯草芽孢杆菌(Bacillus subtilis)菌悬液处理后,山药根和茎的生物量均有所提高;康慧颖等[33]从苜蓿组织内分离得到能够产生IAA 的短小芽孢杆菌B.pumilusALR33,且该菌株对紫花苜蓿的促生作用明显;阳湖荣等[34]从白术中分离得到能够合成IAA的B.endophyticusAMR83,且该菌株能够促进白术组培苗根部生长[34];傅晓方等[35]从健康玉米植株根茎中分离筛选得到4 株均具有不同程度的固氮酶活性和产IAA 能力的菌株,其中L2A2 菌株被鉴定为巴氏葡萄球菌(Staphylococcus pasteuri),其对小麦幼苗具有明显的促生作用。综合前人研究发现,以产IAA促生菌为生物肥料已广泛应用于中药材等各类植物的生产研究上。
然而,截止目前,关于多花黄精内生菌促生效果的报道较少。本研究从34 株多花黄精内生菌中筛选出两株高产IAA 的促生菌Bacillussp.HNC2 和Staphylococcussp.HPB1,其产IAA 能力分别可达4.833 mg/L、4.608 mg/L,明显高于迟慧荣等[36]从多花黄精中分离得到的贝莱斯芽孢杆菌(B.velezensis)产IAA 的含量0.008 29 mg/L。同时,黄精种子萌发实验结果显示,与无菌水和培养基对照相比,本研究筛选得到的两株产IAA 菌株可显著促进宿主种子萌发及其幼苗生长,这种经内生菌处理提高植株种子萌发的优势可能与其产生IAA,打破种子休眠,从而提高萌芽率有关。此外,HNC2 菌株促进种子萌芽的能力优于IAA 标准品,猜测该促生菌除了分泌IAA 外,还可能同时产生其他植物激素,或通过溶磷、解钾和生物固氮等作用促进植物生长发育。本研究获得的两株多花黄精促生菌(Bacillussp.HNC2和Staphylococcussp.HPB1)在一定程度上可为制备微生物肥料提供新的菌种资源,但两株菌株在多花黄精体内的定植情况,及对野外条件下黄精植株生长的影响不明确,有待进一步研究与探索。
4 结论
本研究从多花黄精根部筛选出两株具有稳定高产IAA 的内生细菌HNC2 和HPB1,经鉴定分别为芽孢杆菌(Bacillussp.)和葡萄球菌(Staphylococcussp.);黄精种子萌发实验结果表明,Bacillussp.HNC2 和Staphylococcussp.HPB1 均对黄精种子萌发具有促生功效,具备开发作为微生物肥料的条件。
