一株十二烷基硫酸钠高效降解菌的分离鉴定、降解特性及代谢途径研究
2023-01-05牛鸿宇舒倩杨海君颜智勇谭菊
牛鸿宇 舒倩 杨海君 颜智勇 谭菊,3
(1.湖南农业大学资源环境学院,长沙 410128;2.湖南农业大学植物保护学院,长沙 410128;3.湖南省长沙生态环境监测中心,长沙 410001)
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)易溶于水,是具有一定毒性的阴离子表面活性剂[1]。因其优异的去污[2]、乳化[3]和发泡[4]能力被广泛应用于日常生活和工业生产中,同时也是农业杀虫剂的重要成分之一[5]。然而其过量排放,会改变土壤理化性状、影响土壤对重金属的吸附、抑制动植物生物活性,并对人类健康产生较大危害[6]。因此,针对废水中SDS 的处理备受关注。与传统物理法(吸附[7-9]、电离辐射[10])和化学法(催化[11-12]、氧化[13-16])相比,生物法(植物修复[17]、微生物降解[18-21])因高效、低成本和可持续等优点广泛应用于废水中SDS 的去除。
目前报道的SDS 降解菌,主要包括假单胞菌属(Pseudomonas)[19-20,22-27]、不动杆菌属(Acinetobacter)[28-30]、克雷伯氏菌属(Klebsiella)[20,25,31]、葡萄球菌属(Staphylococcus)[32-34]、梭形杆菌属(Fusobacterium)[33]、产碱杆菌属(Alcaligenes)[17,33]、芽孢杆菌属(Bacillus)[21,33-34]、类芽孢杆菌属(Paenibacillus)[33]、气单胞菌属(Aeromonas)[20]、肠杆菌属(Enterobacter)[20,35-36]、沙雷氏菌属(Serratia)[18]、泛菌属(Pantoea)[30]和放线细菌属(Actinobacterium)[37]等。然而,已有的SDS 降解菌性能不稳定,处理高浓度SDS 废水的能力有限。
为克服以往菌株筛选方式和降解性能的不足,本团队尝试从微生物菌群、复合菌系(微生物联合体)中筛选出用于去除SDS 的高效降解菌。本研究以实验前期筛选保存的高效降解SDS 复合菌系SDS1 为菌源,从中筛选分离出对SDS 高效降解的菌株,开展菌株的鉴定和降解特性研究,考察菌株对SDS 的代谢途径。研究结果丰富了SDS 降解微生物的菌种资源,拓宽了获得SDS 降解菌种的渠道,以期为高浓度SDS 废水的生物强化处理提供理论依据和技术支持。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 SDS(化学纯,含量≥98%,上海麦克林生化科技有限公司),紫外可见分光光度计(上海美谱达仪器有限公司),高速离心机(上海卢湘仪离心机仪器有限公司)。
1.1.2 培养基 LB 培养基:配制浓度为10 g/L 的蛋白胨、10 g/L 的NaCl、5 g/L 的酵母膏,pH 7.0,加超纯水定容至1 000 mL,121℃灭菌20 min,备用。固体培养基中加入18 g 琼脂。
无机盐培养基:配制浓度为0.5 g/L 的KH2PO4、0.5 g/L 的NH4Cl、0.005 g/L 的FeSO4·7H2O、1.0 g/L 的K2HPO4、0.1 g/L 的MgSO4·7H2O、0.5 g/L 的NaNO3,pH 7.0,加超纯水定容至1 000 mL,121℃灭菌20 min,待培养基冷却至80℃左右,摇匀,备用。固体培养基中加入18 g 琼脂。
SDS 无机盐培养基:称取15 g 的SDS 用超纯水溶解,在超净工作台中使用0.22 μm 滤膜过滤灭菌,制成浓度为15 g/L 的SDS 母液,按比例加入无机盐培养基中,配置浓度为100-1 500 mg/L 的SDS 无机盐培养基,摇匀,备用。
1.2 方法
1.2.1 SDS 降解菌的分离纯化、驯化、稳定性测定 取驯化后SDS1 的菌液进行梯度稀释,均匀涂布于SDS 无机盐培养基,30℃恒温培养48 h,待培养皿中长菌后,对菌株进行多次分离和纯化培养直至获得单菌落。挑取单个菌落接种至LB 培养基培养至对数期,再转接至SDS 无机盐培养基。不断提高SDS 驯化浓度直至筛选到最高耐受浓度的降解菌。选择驯化后降解SDS 浓度最高、降解率最大的SDS降解菌进行传代,在最高耐受浓度下的SDS 无机盐培养基中传代15 次,检测每次传代后SDS 的含量,以传代15 次稳定性好的降解菌作为后续的实验菌株。
1.2.2 SDS 降解菌16S rRNA 基因分子生物学鉴定 菌株的16S rDNA 测定由上海生工生物工程技术服务有限公司完成,经BLAST 软件在基因数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)中对获得的序列进行基本的局部比对分析,并使用邻接法构建系统发育树[38]。
1.2.3 SDS 降解菌的降解特性研究
1.2.3.1 种子液的制备 将SDS 降解菌D2 接种于LB 液体培养基,30℃、180 r/min 培养24 h,将培养液在8 000 r/min 转速下离心8 min,弃去上清液,用已灭菌的生理盐水洗涤2-3 次后,用无机盐培养基将菌体重悬,并调整OD600为2.0,得到种子液。
1.2.3.2 菌株D2 降解性能影响因素 为分析菌株D2 降解SDS 的最适条件,利用单因素实验对培养体系中的培养温度、初始pH、培养时间、盐度(W/W)及外加氮源进行研究。在100 mL 锥形瓶中配制1 200 mg/L 的SDS 无机盐培养基,以SDS 为底物添加量8%(V/V),培养基装液量50%(V/V),接菌量2%(V/V),摇床转速180 r/min 为条件,探究培养温度(15、20、25、30、35、40℃)、初始pH(5、6、7、8、9、10)、培养时间(8、16、24、32、40、48 h)、盐度(W/W)(0.01%、0.05%、0.1%、0.3%、0.5%、0.7%、1%、2%)、外加氮源(氯化铵、硝酸钠、脲素、蛋白胨)对D2降解SDS 的影响,并测定摇瓶中最终剩余SDS 含量,确定最适环境条件。每组实验均设3 次重复,以不接种降解菌的SDS 无机盐培养基为空白对照。
1.2.3.3 降解菌正交试验设计 在单因素实验基础上,对培养条件进行优化,确定最佳培养条件并验证。每组实验均设3 次重复,以不接种降解菌的SDS 无机盐培养基为空白对照。
1.2.4 降解菌代谢产物的提取与检测
1.2.4.1 代谢产物的提取 降解菌在SDS 初始浓度1 200 mg/L,温度30℃,pH 7,盐度0.1%(W/W),接菌量2%(V/V),装液量50%(V/V),摇床转速180 r/min 的条件下培养。分别在12、24、36、48 h后取样50 mL,用于代谢产物的分析。以不接种降解菌的无机盐培养基为空白对照。
1.2.4.2 代谢产物的检测 采用离子色谱法检测硫酸盐[39]。取1.2.4.1 中培养液10 mL,过0.22 μm 水系滤膜,采用离子色谱仪分析。色谱柱为SH-AC-11(250 mm×4.6 mm),淋洗液15.0 mmol/L NaOH 溶液,流速1.0 mL/min,进样体积25 μL,压力3.6 MPa,柱温35℃,抑制电导检测器,电流75 mA。
采用气相色谱法检测1-十二烷醇[40]和十二烷醛[41]。取1.2.4.1 中培养液10 mL,进行气相色谱分析。色谱柱为RTX-5(30 m×0.25 mm×0.25 μm)毛细管柱,固定相为5%(V/V)二苯基和95%(V/V)二甲基聚硅氧烷,检测器为FID 氢火焰离子化检测器,进样量1 μL。分析条件为180℃保留5 min,15℃/min 升温至230℃,保留时间1 min,进样口温度230℃,分流模式,分流比为5,检测器温度250℃,氢气流量40 mL/min,空气流量400 mL/min。
采用液相色谱法检测十二烷酸[42]和乙酸[43]。分别取1.2.4.1 中培养液1 mL,过0.22 μm 滤膜后采用液相色谱仪分析。十二烷酸采用waters 液相色谱仪、C18色谱柱(4.6 mm×250 mm×5 μm)和紫外检测器(240 nm)检测,流动相为80%(V/V)甲醇和20%(V/V)水,流速为1.0 mL/min,柱温为30℃,乙酸采用岛津液相色谱仪、HPX-87H 色谱柱(300 mm×7.8 mm)和紫外检测器(210 nm)检测,流动相为5 mmol/L 的H2SO4溶液,流速为0.5 mL/min,柱温为55℃。
1.2.5 数据分析 采用Excel 2016 与SPSS 25.0 进行单因素分类方差分析、主体间效应检验与正交实验设计,利用Origin 2018 进行制图,使用MEGA7.0软件构建系统发育树。
2 结果
2.1 降解菌的筛选与驯化
从复合菌系SDS1 中分离纯化得到一株SDS 降解菌命名D2,经梯度驯化后,该菌株48 h 内对1 200 mg/L SDS 的降解率达到90.3%(图1)。D2 在初始浓度为1 200 mg/L 的SDS 无机盐选择培养基中传代15 次(图2),每次传代D2 对SDS 的降解率均在90%以上,至15 次传代后,菌株的降解率达94.2%。
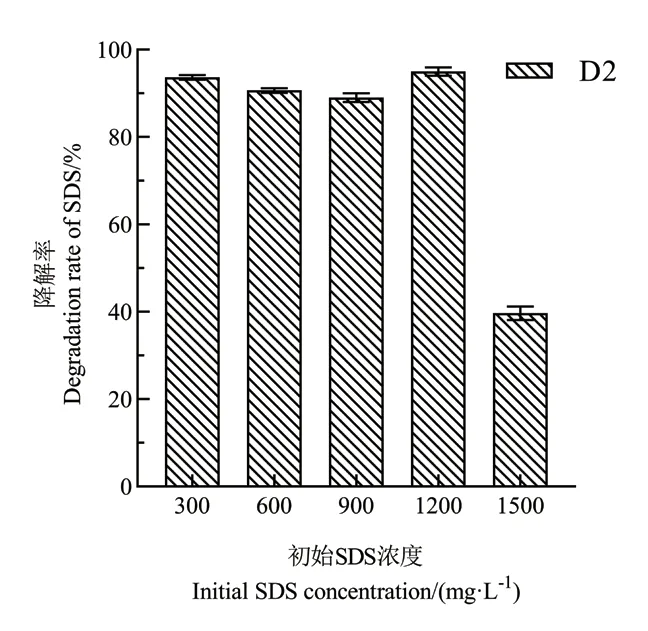
图1 初始浓度下菌株D2 对SDS 的降解率Fig.1 Degradation rate of SDS by strain D2 under initial concentrations
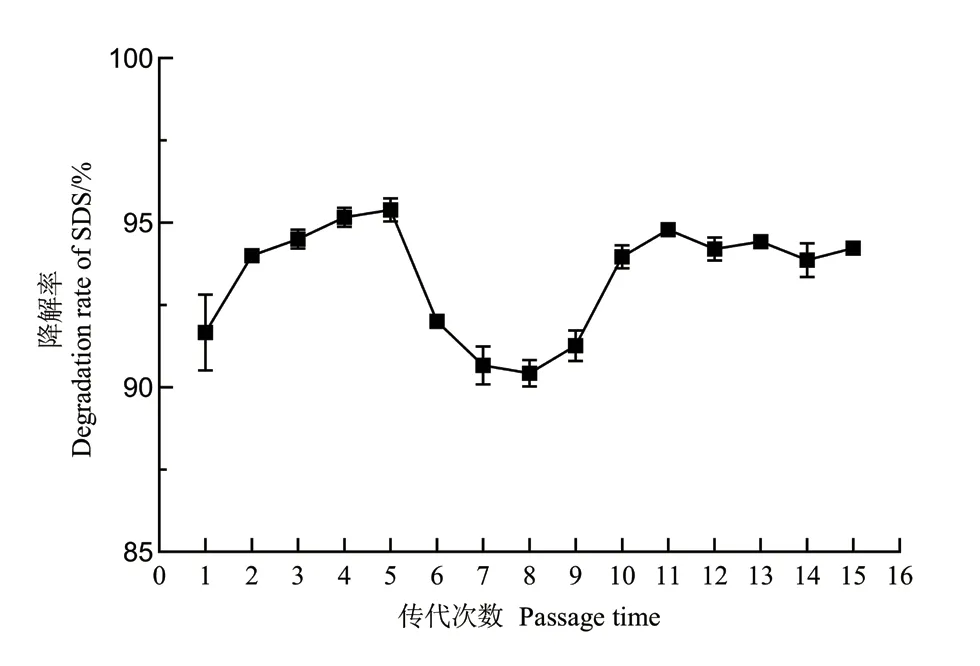
图2 菌株D2 各传代对SDS 的降解率Fig.2 Degradation rate of SDS by each generation of strain D2
2.2 菌株D2的鉴定
2.2.1 形态及生理生化鉴定结果 菌株D2 为革兰氏阳性菌(图3-A),其在LB 固体培养基平板上呈球形,淡黄色,多聚排列,不产生色素。菌落无光泽,易挑取,不透明,中间隆起,边缘整齐,一般湿润,不黏稠,质地均匀无气味(图3-B)。菌株D2 的生理生化特征如表1所示。
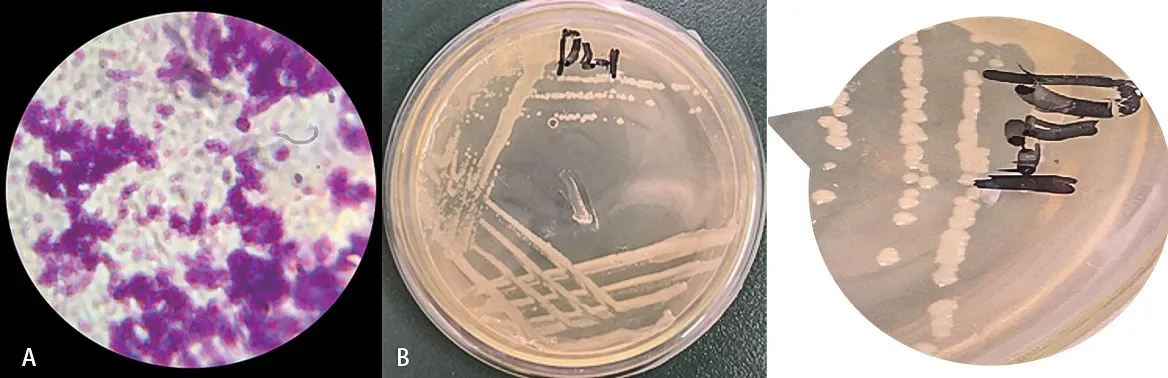
图3 菌株D2 菌落特征Fig.3 Colony characteristics of D2 strain
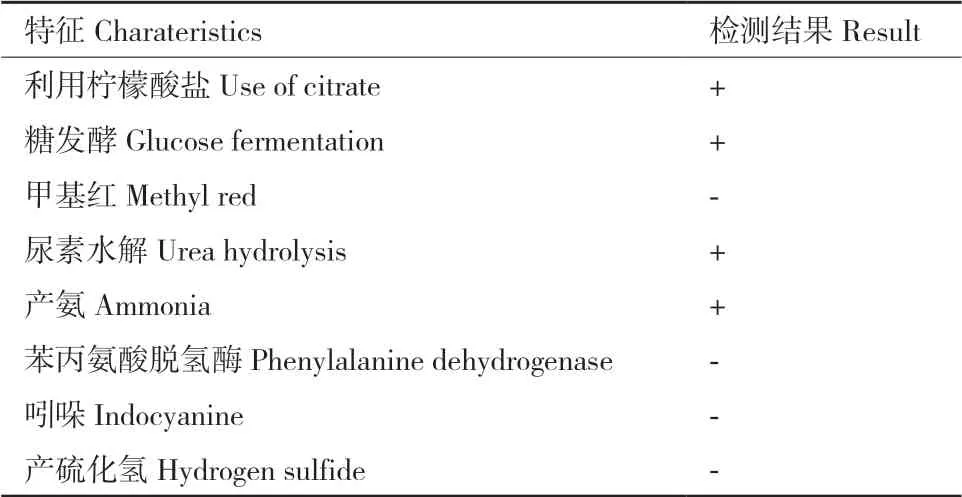
表1 菌株D2 的生理生化特征Table 1 Physiological and biochemical characteristics of D2 strain
2.2.2 16S rRNA 序列分析 菌株D2 的16S rRNA 序列(GenBank 登录号:OM 618123)与GenBank 数据库中收录的16S RNA 序列进行同源性比对,结果(表2)显示,菌株D2 与Paraburkholderia tropica具有极高的同源性(99.93%)。构建菌株D2 的相似序列系统发育树(图4),表明D2 与多株伯克霍尔德菌处在同一分支。同时结合形态学特征和生理生化试验结果,初步判断D2 为帕拉伯克霍尔德菌(Paraburkholderia tropica)。
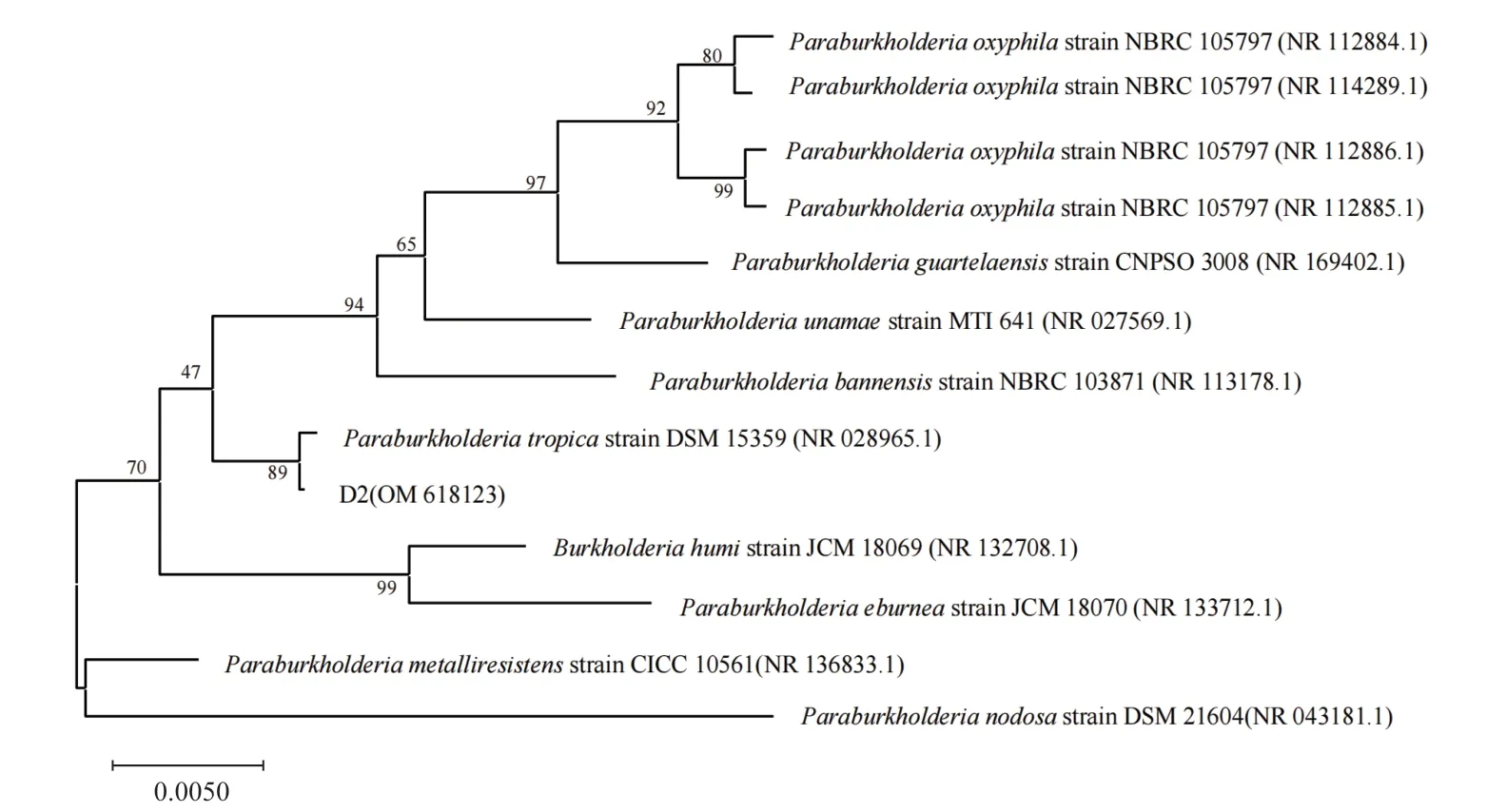
图4 菌株D2 及其相关菌株系统发育树Fig.4 Phylogenetic tree of strain D2 and its related strains
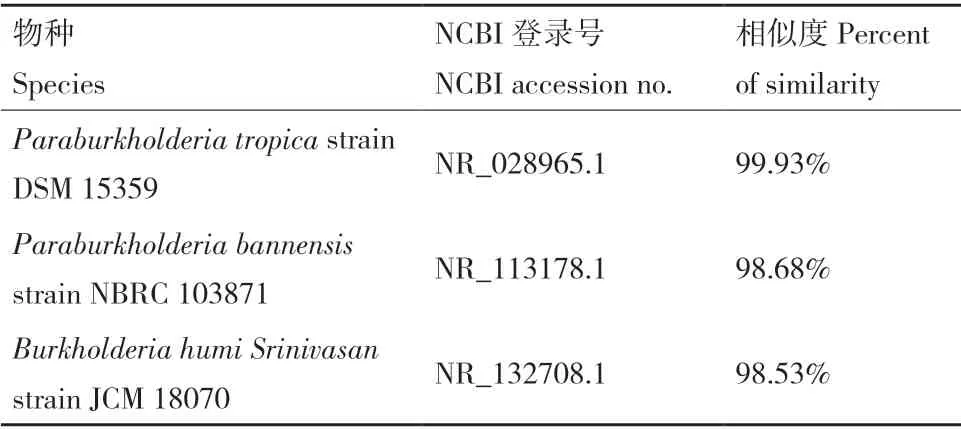
表2 D2 菌株16S rRNA 基因序列分析鉴定Table 2 Identification of D2 strain by 16S rDNA gene sequence analysis
2.3 菌株D2的降解特性分析
2.3.1 温度对菌株D2 降解SDS 的影响 菌株D2 降解SDS 的最适温度为30℃,48 h 内对SDS 降解率达到95.8%。而当温度≤15℃或≥40℃时,D2 对SDS 降解率均低于40%(图5-A)。不同温度条件下,SDS 降解率的显著差异表明温度对D2 降解SDS 的能力有显著影响(P<0.05)。此外,在25-35℃之间,D2 对SDS 降解率均在80%以上,说明D2 在25-35℃范围内具有降解SDS 的能力。
2.3.2 pH 对菌株D2 降解SDS 的影响 不同初始pH条件下,SDS 降解率之间存在显著差异,偏酸性和偏碱性实验条件下SDS 的降解率较低(均<40%),pH 6-8 时,菌株D2 对SDS 降解率均在86.5%以上,其中当pH=7 时,降解率达到最大值95.0%(图5-B),说明初始pH 对菌株D2 降解SDS 的能力有显著影响(P<0.05)。
2.3.3 培养时间对菌株D2 降解SDS 的影响 如图5-C 所示,培养时间对菌株D2 降解SDS 影响较大,相关性分析显示,培养时间与SDS 降解率之间存在显著正相关(P<0.05),当培养至48 h 时,D2 对SDS 的降解率达到最大值95.5%,故以48 h 为最佳培养时间进行后续实验。
2.3.4 盐度对菌株D2 降解SDS 的影响 当盐度为0.01%-0.05%(W/W)时,D2 对SDS 的降解率均在80%以上,远高于其他盐度条件下SDS 的降解率(均<20%),其中盐度为0.05%(W/W)时,降解率达到最大值93.9%(图5-D)。不同盐度条件下,SDS 降解率的显著差异表明盐度对D2 降解SDS 的能力有显著影响(P<0.05),同时也表明该菌株在盐度0.01%-0.05%的范围内,均可实现对SDS 的高效降解。
2.3.5 氮源对菌株D2 降解SDS 的影响 在SDS 初始浓度1 200 mg/L,温度30℃,pH 7,盐度0.05%(W/W),装液量50%(V/V),接菌量2%(V/V),摇床转速180 r/min 的条件下培养48 h,以硝酸钠和氯化铵为氮源,D2 对SDS 的降解率达到最高值96.1%,而以氯化铵、硝酸钠、脲素、蛋白胨分别作为唯一外加氮源时,D2 对SDS 的降解率均小于60%(图5-E),故以硝酸钠和氯化铵为最佳氮源进行后续实验。
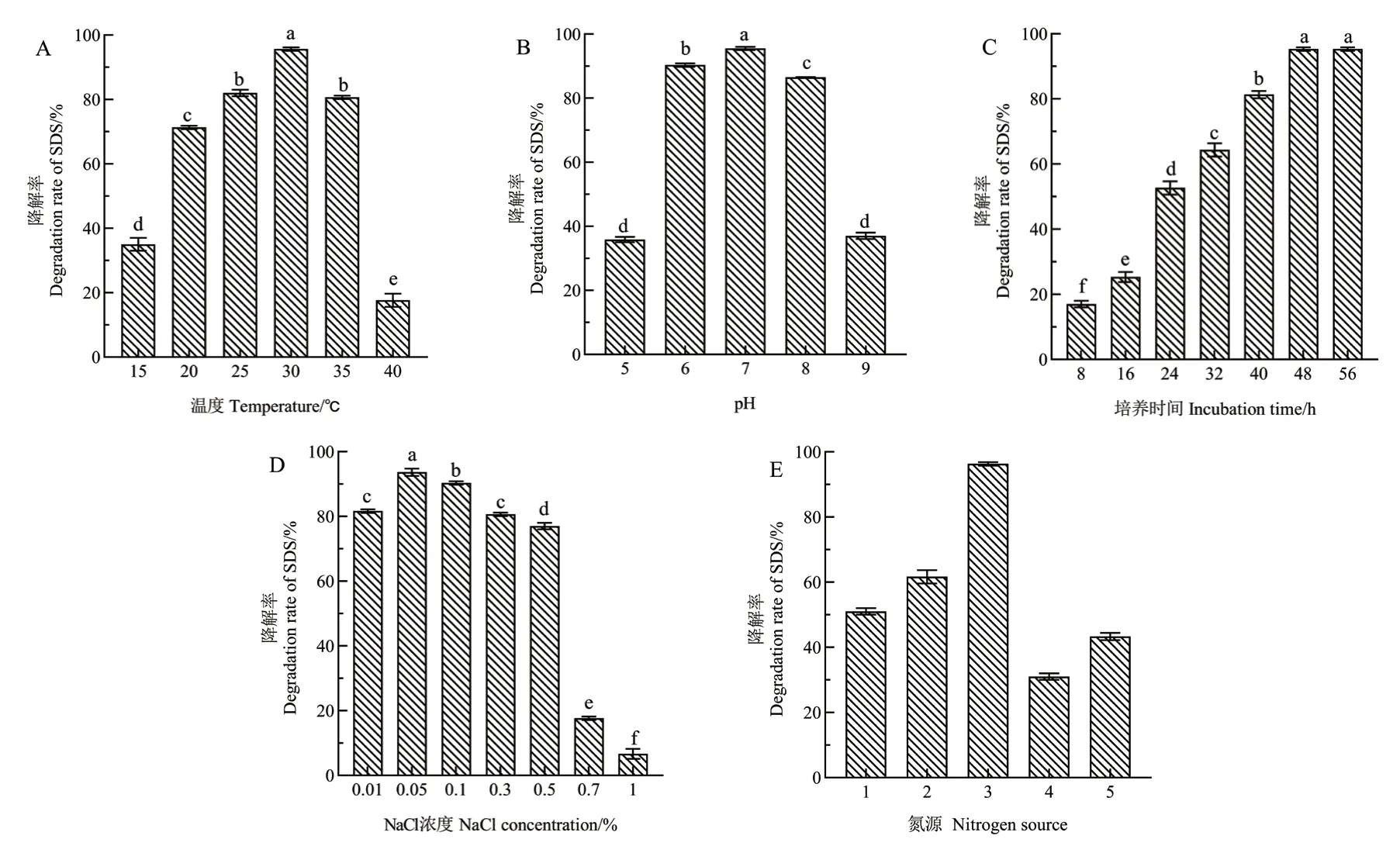
图5 环境因素对菌株D2 降解SDS 的影响Fig.5 Effects of environmental factors on the degradation of SDS by strain D2
2.3.6 菌株D2 降解SDS 的正交试验结果 根据单因素实验结果,选择对D2 降解SDS 影响最大的温度、pH、时间、盐度四因素进行正交实验,每个因素设置3 个水平(表3)。D2 降解SDS 的正交实验结果见表4。D2 降解SDS 的最佳环境条件组合为A2B2C3D2,即温度30℃、pH 7、时间48 h、盐度0.1%(W/W)。根据R值的大小可知,各因素对D2降解SDS 的影响大小依次为:温度>时间>pH>盐度。在SDS 初始浓度为1 200 mg/L,温度30℃,pH 7,盐度0.1%(W/W),接菌量2%(V/V),装液量50%(V/V),摇床转速180 r/min,外加氮源为硝酸钠和氯化铵的条件下培养48 h,D2 对SDS 的降解率可达到98.3%。
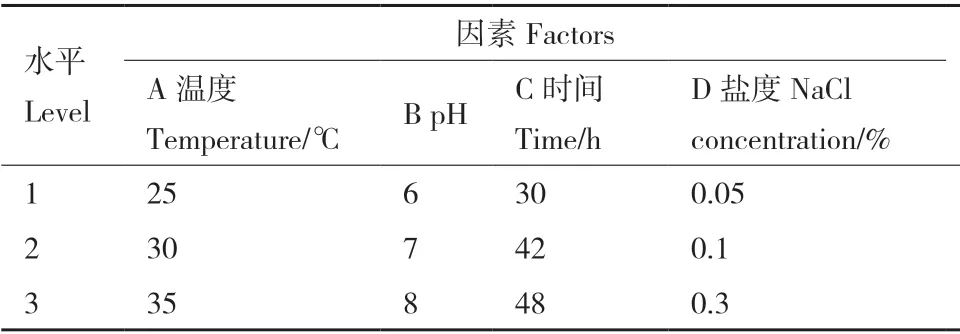
表3 正交实验设计Table 3 Orthogonal experimental design
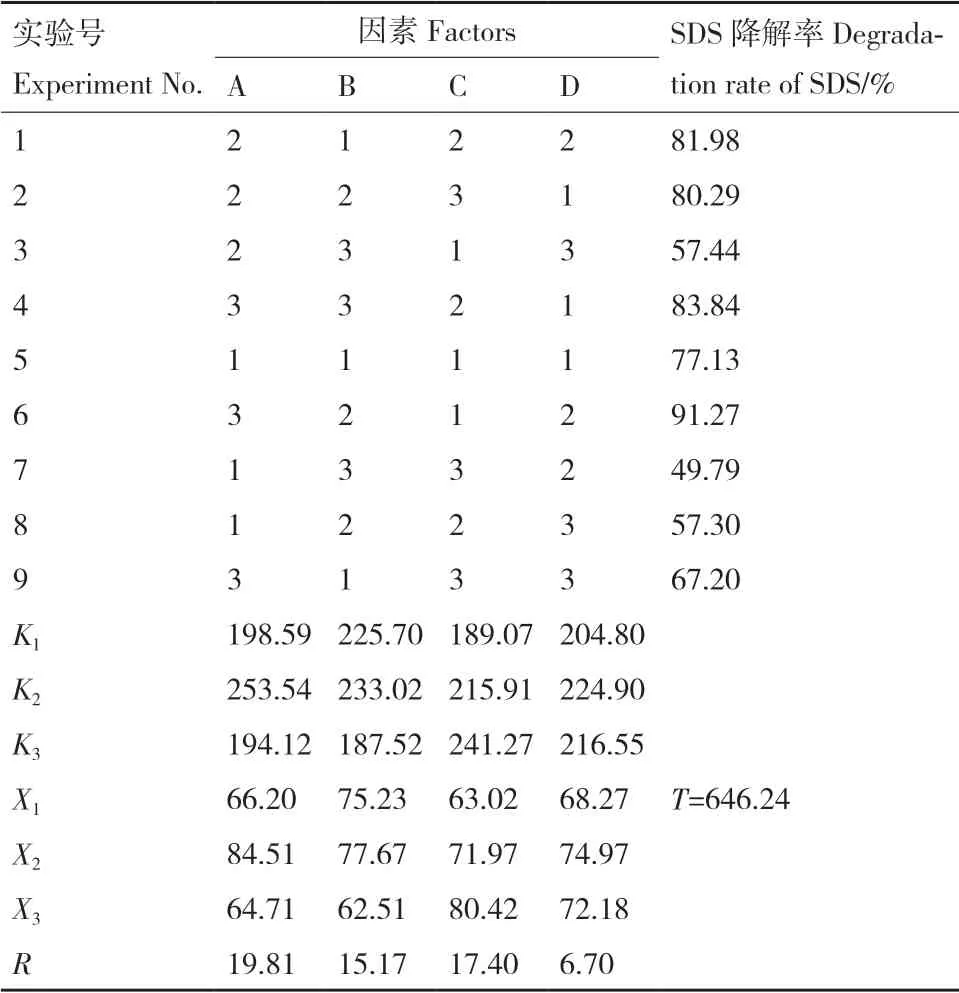
表4 正交实验结果Table 4 Orthogonal experimental results
2.4 菌株D2降解SDS代谢产物检测及代谢途径推测
2.4.1 菌株D2 降解SDS 的离子色谱检测结果 离子色谱检测结果(图6)显示,空白样品中有硫酸根检出,这主要是菌株D2 的无机盐培养基本身就含硫酸盐。菌株D2 对SDS 降解培养基在12.447-14.957 min 处均检测到硫酸盐,且硫酸盐的含量随着降解时间的延长而增大。在12 h 检出的硫酸盐含量与空白样品检出的硫酸盐含量基本一致。
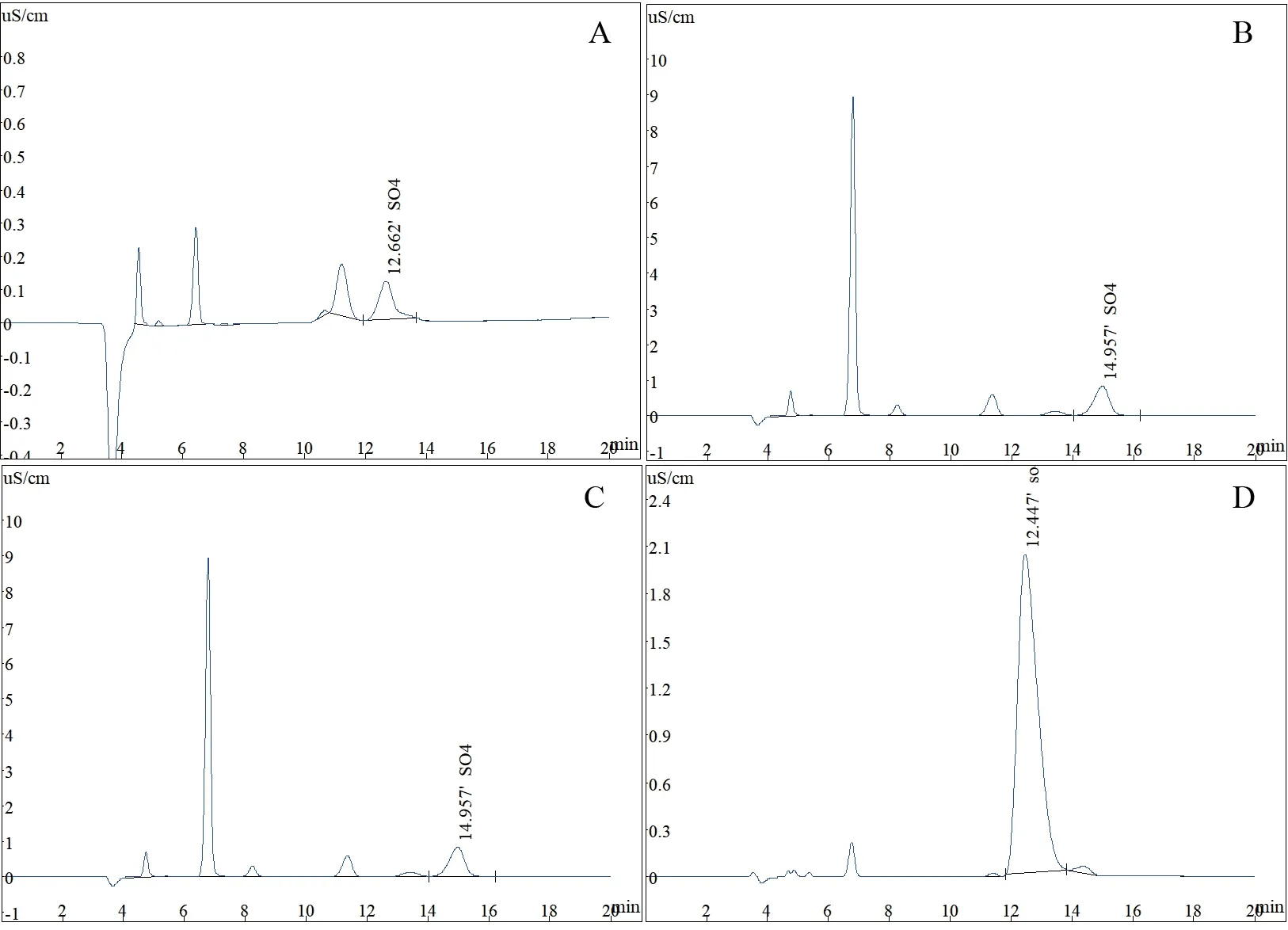
图6 菌株D2 降解SDS 的离子色谱图Fig.6 Ion chromatograms of degrading SDS by strain D2
2.4.2 菌株D2 降解SDS 的气相色谱检测结果 气相色谱检测结果(图7)显示,在12 h 时,菌株D2对SDS 的降解培养基中均未检测到1-十二烷醇和十二烷醛,而在24、36、48 h 时,在3.737-3.761 min 处检测到1-十二烷醇,在3.243-3.263 min 处检测到十二烷醛。在24 h 时,检测到的1-十二烷醇和十二烷醛含量均小于在36 h 时检测到的含量;在48 h 时,检测到的1-十二烷醇和十二烷醛含量也均小于36 h 时两种物质的检测含量。
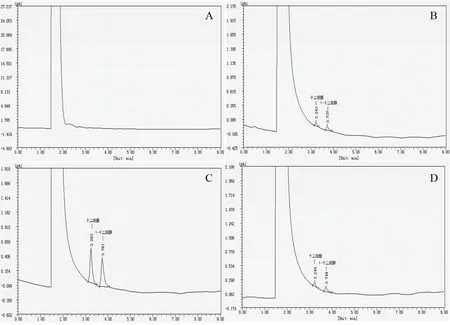
图7 菌株D2 降解SDS 的气相色谱图Fig.7 Gas chromatograms of degrading SDS by strain D2
2.4.3 菌株D2 降解SDS 的液相色谱检测结果
2.4.3.1 十二烷酸液相色谱检测 十二烷酸液相色谱检测结果(图8)显示,在12 h 时,菌株D2 对SDS 的降解培养基未检出十二烷酸,而在24、36、48 h 时,均在25.777-25.957 min 处检测到十二烷酸,且在36 h 时D2 对SDS 的降解培养基中检测到的十二烷酸含量均大于24 h 和48 h。
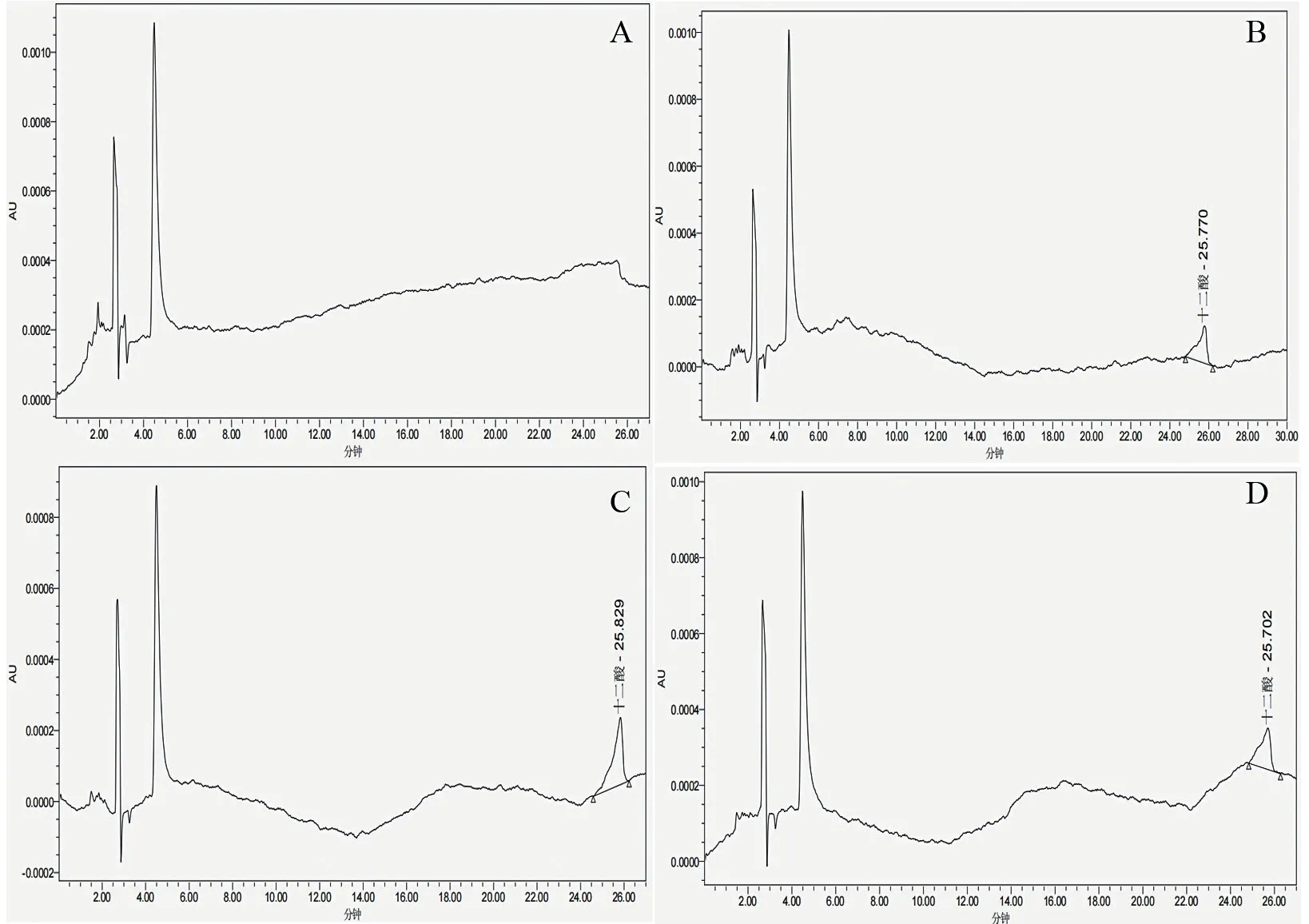
图8 菌株D2 降解SDS 的十二烷酸液相色谱图Fig.8 Dodecanoic acid liquid chromatograms of degrading SDS by strain D2
2.4.3.2 乙酸液相色谱检测 乙酸液相色谱检测结果(图9)显示,在12 h 和24 h 时,菌株D2 对SDS 的降解培养基中均未检测到乙酸,而在36 h 和48 h 时,均在25.702-25.829 min 处检测到乙酸,且在36 h 时,检测到的乙酸含量均大于24 h 和48 h。
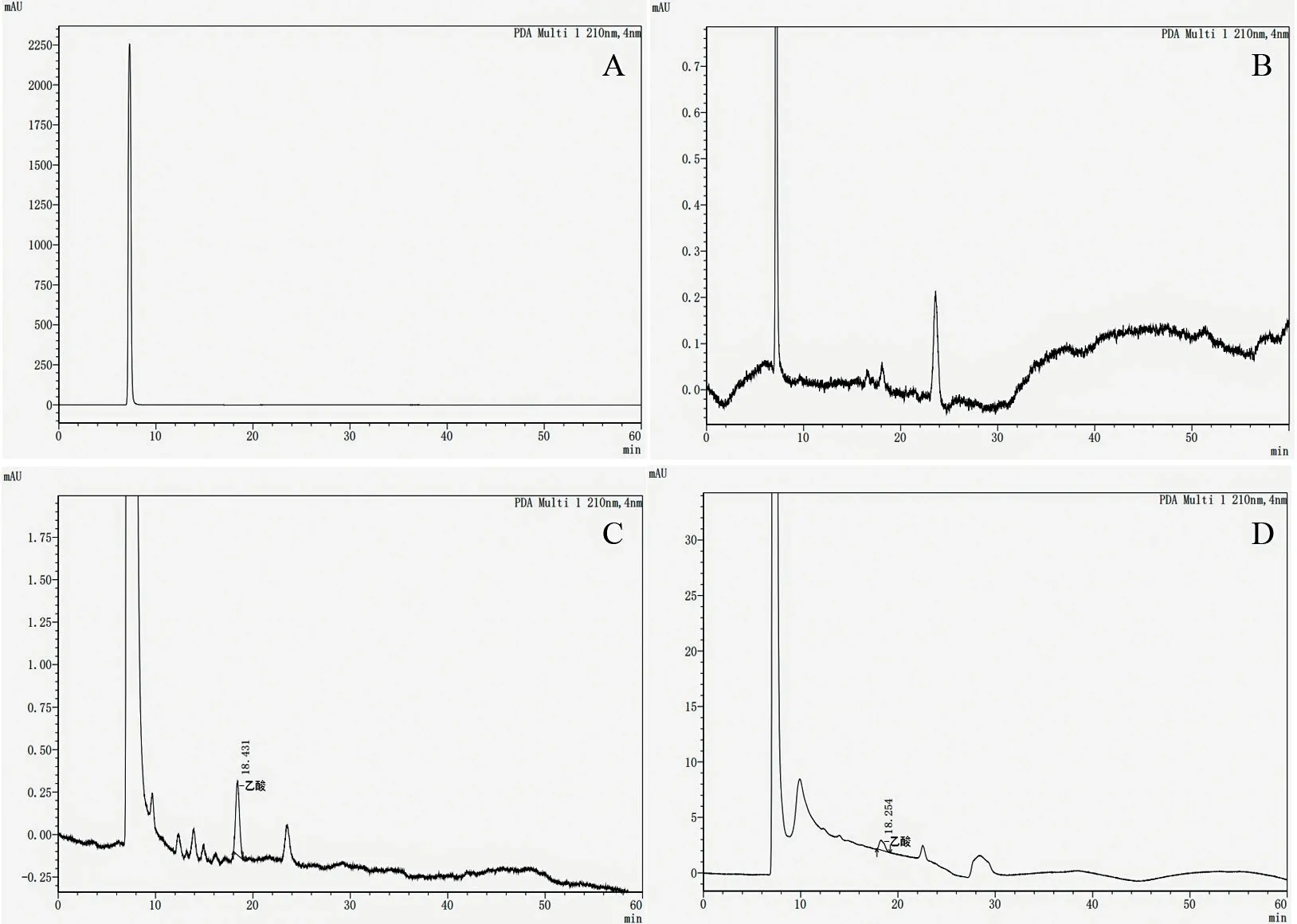
图9 菌株D2 降解SDS 的乙酸液相色谱图Fig.9 Acetic acid liquid chromatograms of degrading SDS by strain D2
2.4.4 菌株D2 对SDS 的代谢途径的推测 通过离子色谱、气相色谱、液相色谱对菌株D2 在浓度为1 200 mg/L SDS 的降解培养基中培养12、24、36、48 h 后的中间代谢产物进行检测与分析发现,在12 h 的降解培养基中检测到的硫酸根为原培养基所自带,未检测到其它新物质;而在24 h 则检测到硫酸盐、1-十二烷醇、十二烷醛、十二烷酸4 种物质,且该时段硫酸根含量大于12 h;在36 h 和48 h 均检测到硫酸盐、1-十二烷醇、十二烷醛、十二烷酸、乙酸5 种物质,不同的是各物质含量发生了变化。由此可推测出D2 对SDS 可能存在的降解途径如图10所示。
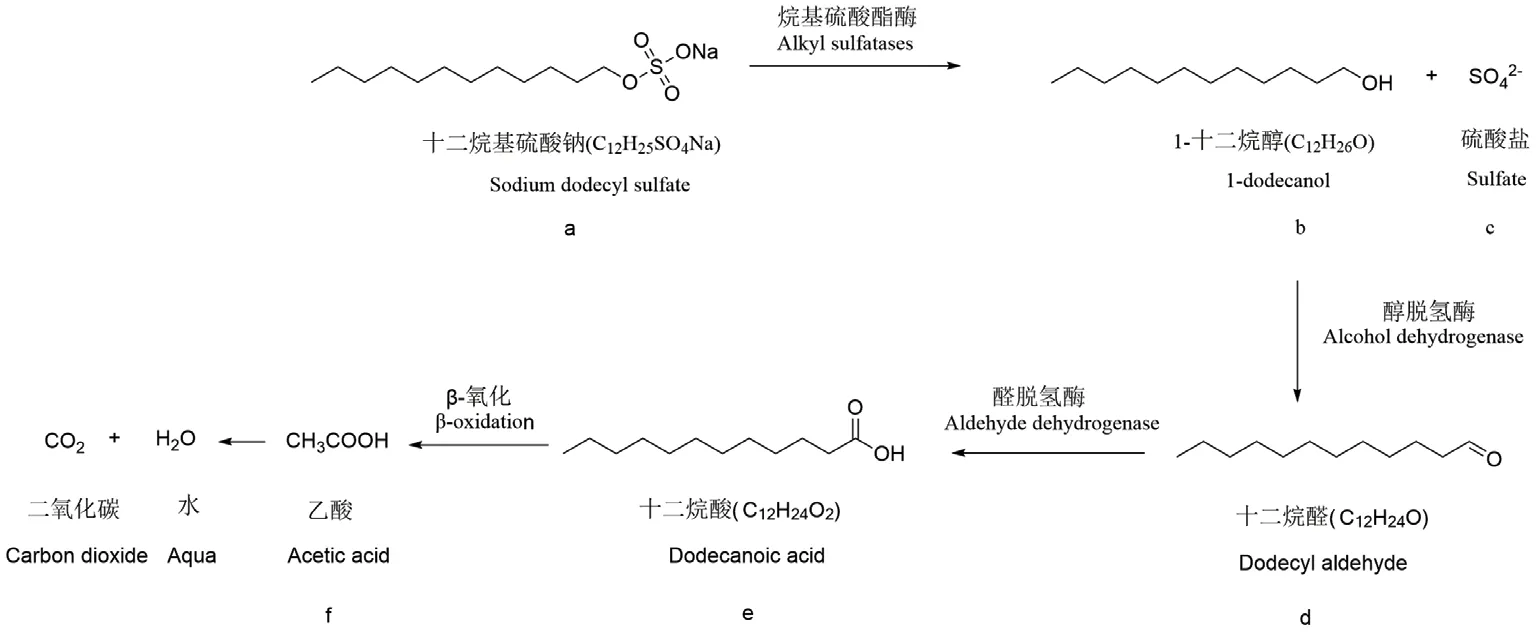
图10 菌株D2 对SDS 的降解途径Fig.10 Degradation pathway of SDS by strain D2
3 讨论
3.1 菌株D2对SDS降解能力
SDS 作为一种主要的阴离子表面活性剂,在日常生活和工业生产中得到广泛应用,同时大量高浓度SDS 废水的排放也造成了严重的环境污染问题[2]。微生物降解已成为SDS 废水处理的主要研究方向,Othman 等[18]筛选的降钼细菌黏质沙雷氏菌(Serratia marcescens)DRY6,可在10 d 内完全去除1 000 mg/L 的SDS。颜丙花等[37]筛选的降解菌PB-21,72 h 降解了90.0%的SDS(初始浓度400 mg/L)。Shukor[44]筛选的产酸克雷伯菌(Klebsiella oxytoca)DRY14,72 h 完全降解了1 000 mg/L 的SDS。上述降解菌对SDS 降解初始浓度较低,降解效率有待提高。为克服以上不足,研究者们进一步筛选更高效降解SDS 的菌株,并研究如何进一步提高它们的降解能力。Ibrahim 等[20]筛选的假单胞菌(Pseudomonas)传代10 次即可获得降解率稳定的菌株,Ambily 等[45]筛选的铜绿假单胞菌(Pseudomonas aeruginosa)MTCC10311 可在48 h 降解96% 的1 500 mg/L SDS,张若木[46]筛选的PseudomonasSDS-Zh2在最佳条件下24 h 可降解1 500 mg/L 的SDS。
目前已经分离出多株有效降解SDS 的菌株,但尚未见到关于Paraburkholderia属菌株降解SDS 的相关报道。本研究分离得到一株具有SDS 降解能力的菌株D2,通过对D2 进行形态观察、生理生化实验及生物学分析,鉴定该菌株为帕拉伯克霍尔德菌(Paraburkholderia tropica)(GenBank 登录号:OM 618123)。对分离得到的菌株D2 降解SDS 的影响因素进行系统研究发现,初代菌株D2 对浓度为1 200 mg/L 的SDS 降解率达90.3%,其传代15 次,降解率稳定在(94±1)%,说明D2 对SDS 的降解具有稳定性。发现菌株D2 对环境抗逆性较好,如当温度在25-35℃范围内,菌株D2 对SDS 的降解率超过80%。此外,当初始pH 在6-8 范围内,菌株D2 仍可以维持较高的降解率。在单因素实验基础上,通过正交实验对培养条件进行优化,确定最佳培养条件。条件优化后,菌株D2 在48 h 对初始浓度1 200 mg/L SDS 的降解率达到98.3%。菌株D2 的发现为SDS 的生物降解提供了新资源。
3.2 菌株D2对SDS的代谢途径
SDS 的细菌降解涉及多种酶的相互作用[3],细菌对SDS 的降解主要由烷基硫酸酯酶促发,其大致过程为烷基硫酸酯酶催化SDS 分子中酯键的断裂水解,释放出硫酸盐和长链醇(主要为1-十二烷醇),长链醇一部分通过中枢代谢途径被吸收,另外一部分被醇脱氢酶进一步氧化为十二烷醛,十二烷醛被醛脱氢酶进一步氧化成十二烷酸,十二烷酸不断通过β-氧化断裂成短链酸,继续转变成乙酸,最终转化为CO2和H2O[6]。SDS 微生物降解的实质是酶促反应,SDS 通过某种方式进入微生物细胞内,刺激微生物产生某种特殊的酶,在细胞内与SDS 分子反应,以酶的作用在一定程度上减少或消除SDS 的毒性[18]。
目前SDS 的微生物降解途径有以下4 种:(1)途径A,SDS 酯键的断裂水解产生硫酸盐和1-十二烷醇。Marches[47]利用气相色谱仪检测到菌株PseudomonasC12、ATCC 19151、BPS 的代谢产物1-十二烷醇,并推断这3 种菌的代谢途径为SDS →硫酸盐+1-十二烷醇。John 等[48]则利用液相色谱仪检测出香鱼假单胞菌(Pseudomonas plecoglossicida)S5 对SDS 的降解产物,发现了降解过程的中间产物1-十二烷醇,并推测S5 的代谢途径为SDS →硫酸盐+1-十二烷醇,但S5 对SDS 降解是否能最终矿化成CO2和H2O,尚待进一步研究。(2)途径B,SDS 酯键的断裂水解产生硫酸盐和1-十二烷醇,1-十二烷醇被氧化为十二烷醛。Panasia 等[27]通过检测分析P.aeruginosaPAO1 对SDS 降解全过程的产物,发现了中间产物1-十二烷醇、十二烷醛,由此可推断该菌的代谢途径为SDS →硫酸盐+1-十二烷醇→十二烷醛,该菌没有完全矿化SDS。(3)途径C,由SDS 酯键的断裂水解产生硫酸盐和1-十二烷醇,1-十二烷醇部分被氧化为十二烷醛,十二烷醛部分被进一步氧化成十二烷酸,十二烷酸不断通过β-氧化断裂成短链酸(乙酸),乙酸最后矿化为CO2和H2O。Ambily 和Jisha[45]利用气相色谱质谱联用分析P.aeruginosaMTCC10311 降解SDS 的代谢产物,在12 h 时检测到了1-十二烷醇,而在24 h 时检测到了十二烷醛和十二烷酸,48 h 后则检测到了己酸、丙酸、乙酸等短链酸,该菌对SDS 的降解途径为SDS →硫酸盐+1-十二烷醇→十二烷醛→十二烷酸→乙酸→CO2+H2O,由此可推断该菌可完全矿化SDS。(4)途径D,SDS 在烷基硫酸脂酶作用下产生1-十二烷醇、硫酸根、2-十二烷醇和3-十二烷醇,且部分1-十二烷醇在醇脱氢酶作用下产生十二烷醛。Furmanczyk 等[22]利用SPME-气相色谱-质谱仪检测月桂酰硫酸假单胞菌(Pseudomonas laurylsulfatovorans)AP3 22 对SDS 的降解产物,检测到大量的1-十二烷醇,及微量的十二烷醛、2-十二烷醇和3-十二烷醇,但未检测到十二烷酸,由此可推断该菌对SDS 的降解途径为SDS →硫酸盐+1-十二烷醇(产生十二烷醛)+2-十二烷醇和3-十二烷醇。
降解过程中发现,菌株D2 在12 h 对SDS 的降解未进行或刚开始,在24、36、48 h 时均对SDS 有降解效果,根据气相色谱检测结果推断,在36-48 h 1-十二烷醇被不断代谢成十二烷醛,而十二烷醛也被不断代谢成下游产物十二烷酸,48 h 检测到的乙酸含量比36 h 低,这可能是部分乙酸已被矿化成CO2和H2O。本研究中菌株D2 对SDS 的降解途径与途径C 完全一致。但菌株D2 可以实现更高程度的SDS 生物降解和矿化,拥有良好的应用潜能,可进一步挖掘,但在菌株D2 对SDS 的降解过程中具体有哪些酶参与到代谢中尚不十分清楚,有待进一步深入探讨。
4 结论
从复合菌系SDS1 中分离得到一株能高效降解SDS 的菌株D2,并确定该菌株为帕拉伯克霍尔德菌。D2 菌株48 h 内对SDS 的降解率可达90.03%,其降解SDS 的最适条件为温度30℃、pH 7、培养时间48 h、盐度0.1%。在此条件下,以硝酸钠+氯化铵为外加氮源,D2 对初始浓度1 200 mg/L 的SDS 降解率达到98.3%以上。初步推测D2 对SDS 的代谢途径为SDS →硫酸盐+1-十二烷醇→十二烷醛→十二烷酸→乙酸→CO2+H2O。
