山羊ZNF32的克隆及表达分析
2023-01-05盛雪晴赵楠林亚秋陈定双王瑞龙李傲王永李艳艳
盛雪晴 赵楠 林亚秋 陈定双 王瑞龙 李傲 王永 李艳艳
(西南民族大学畜牧兽医学院,成都 610041)
锌指蛋白这一结构最早由Miller 在非洲爪蟾转录因子TF ⅢA 中发现,是含有锌指结构的蛋白质的总称[1-2]。锌指蛋白是人类基因组中最大的转录因子家族,有2%的人类基因参与编码锌指蛋白。转录因子是调节基因表达的核心控制器,调控着细胞增殖、分化、发育、代谢、细胞凋亡、自噬和干性维持等多种生物学过程[3]。锌指蛋白32(zinc finger protein 32,ZNF32)是近年来发现的属于Krüppel 相关锌指家族的一种转录因子,人ZNF32包含6 个连续的典型C2H2 锌指基序和一个简并的C2H2 锌指基序,定位于人10q23-q24染色体区域[4-6]。已有研究证明,Krüppel 锌指家族有多个成员可能在细胞分化和增殖中发挥重要作用[7-9]。
ZNF 家族中ZNF423 被确定为前体脂肪形成的主要决定因子并保持白色脂肪细胞功能。Longo等[10]发现ZNF423 基因的表观遗传修饰调控小鼠脂肪细胞形成,Matsubara 等[11]发现ZNF423 基因与鸡脂肪细胞分化有关,Chiarella 等[12]发现ZNF521基因通过抑制ZNF423 的表达负调控人类脂肪干细胞分化。因此我们猜测ZNF32 可能参与脂肪细胞增殖和分化。
目前关于ZNF32 的研究较少,主要集中于肿瘤的发生发展方面[13-19],研究指出人ZNF32 与肿瘤细胞干性及耐药性相关;ZNF32 可通过与干细胞标志物SOX2 启动子特异性结合调控斑马鱼侧线系统的再生能力;也有研究报道指出ZNF32 参与肿瘤细胞的自噬、凋亡、失巢凋亡等细胞程序性死亡;陈宏丽等[20]发现ZNF32 的表达水平与STAT3 磷酸化水平呈正比,抑制ZNF32 的表达能干扰STAT3 信号通路从而抑制肿瘤细胞的多种生物学特性。现阶段关于ZNF32 的生物学功能研究较少,而其在山羊前体脂肪细胞中的作用未见报道。
皮下脂肪的累积可影响动物的储能、代谢、保温等,而前体脂肪细胞的增殖和分化对脂质沉积具有重要作用[21-22]。简州大耳羊是我国自主培育的第二大山羊品种,本研究旨在以简州大耳羊为研究对象,利用RT-PCR 克隆山羊的ZNF32 基因序列,通过生物信息学分析工具分析其表达特性,利用实时荧光定量PCR(real-time quantitative PCR,qPCR)技术阐明其在山羊各组织中的表达水平,并探究ZNF32 对山羊皮下前体脂肪细胞增殖和分化的影响。本研究将为山羊乃至肉用经济动物的分子育种等基础研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验动物与样品采集 以成年(1 周岁)健康简州大耳羊为试验动物,购自四川省简阳市大哥大牧业有限公司。屠宰后收集羊的肾、肺、心、肝、脾等14 个组织样品,清洗后置于液氮中保存。本试验经过西南民族大学动物伦理学术委员会审批通过(SMU20160108)。
1.1.2 试验试剂 自TaKaRa 公司购买TRIzol 试剂、SYBR® Premix ExTaqTM(2×),自成都擎科梓熙生物技术有限公司购买5×pchone007 Versatile Simple Vector Mix,自天根生化科技有限公司购买DNA 回收试剂盒、质粒提取试剂盒、大肠杆菌DH5α 感受态细胞,自康为世纪有限公司购买2×Super Pfx MasterMix,自Thermo 公司购买RevertAid First Strand cDNA Synthesis Kit。
1.2 方法
1.2.1 总RNA 提取和cDNA 的合成 从液氮中取出肾、肺、心、肝、脾等14 个组织样品,使用TRIzol法提取总RNA,检测OD260/280值及浓度,经测定符合实验标准;将1 μg RNA 作为模板,反转录合成cDNA,于-20℃保存备用。
1.2.2 山羊ZNF32 基因克隆 以山羊肾脏组织cDNA 为模板,按照GenBank 上牛的ZNF32 基因序列(登录号:NM_001046119.1)设计PCR 引物(表1)。
PCR 反应体系:高保真DNA 聚合酶12.5 μL,肾组织cDNA 0.5 μL,10 μmol/L 上游引物1.25 μL、10 μmol/L 下游引物1.25 μL,ddH2O 9.5 μL,共计25 μL 反应总体系。PCR 扩增程序:预变性(98℃,3 min);变性(98℃,10 s),退火(58℃,30 s),延伸(72℃,15 s),35 个循环;终延伸(72℃,10 min),4℃保温。1%琼脂糖凝胶电泳检测PCR 产物,纯化回收连接到007VS 载体上,转化、涂板接种,挑取培养基上阳性菌落进行PCR 鉴定,送至成都擎科生物技术有限公司测序。
1.2.3 山羊ZNF32 基因生物学特性分析 山羊ZNF32 基因生物学特性分析及方法参见表2。

表2 生物信息学分析内容及分析工具Table 2 Analytical contents and analysis tools for bioinformatics
1.2.4 山羊ZNF32 基因组织表达差异分析 按照“1.2.1”中的方法,将山羊各组织的总RNA 提取并将其反转录获得相应cDNA。使用Primer Primier 5.0对克隆获得的山羊ZNF32 基因序列设计其特异性qPCR 引物(表1),将TBP基因当做内参基因[23],用qPCR 法对ZNF32 基因在各组织中的表达差异进行检测。
qPCR 反应体系:SYBR® Premix ExTaqTM(2×)10 μL,cDNA 1 μL,10 μmol/L 上、下游引物各1 μL,ddH2O 7 μL,合计20 μL 反应总体系,每组设置3 个重复。反应条件:预变性(95℃,1 min);变性(95℃,10 s),退火(60℃,20 s),延伸(72℃,30 s),共39 个循环。
1.2.5 山羊ZNF32 基因在皮下前体脂肪细胞中的时序表达分析 根据实验室前期建立的山羊前体脂肪细胞分离及培养方法对山羊皮下前体脂肪细胞进行原代培养[24]。获得原代皮下前体脂肪细胞后,进行常规培养,当细胞传至F3代且融合度达约80%时,用胰蛋白酶进行细胞消化,用血球计数板计数后铺板,细胞数为4×104个/孔(12 孔板)。待细胞融合度达约80%时,使用浓度为50 μmol/L 的油酸诱导液进行诱导分化,每2 d 换一次液。分别收集0、24、48、72、96 h 后的细胞。按照“1.2.1”中方法得到各时期细胞的cDNA,以UXT基因作为内参基因用于矫正基因的相对表达水平[25],利用qPCR 法检测ZNF32 基因在山羊皮下脂肪细胞不同时期的表达差异,qPCR 反应体系及条件同“1.2.4”。
1.2.6 山羊ZNF32 基因CDS 区序列克隆及过表达载体构建 利用Primer Primier 5.0 对克隆获得的山羊ZNF32 基因序列设计CDS 区引物,上游、下游引物分别添加上EcoRI、XhoI 的酶切位点及对应的保护碱基(表1),以“1.2.2”中测序成功后提取的质粒为模板克隆ZNF32 基因CDS 序列,构建过表达载体。PCR 反应体系及扩增程序同“1.2.2”。1%琼脂糖凝胶电泳检测PCR 产物,纯化回收后,酶切PCR 产物和pCMV-Tag2B 载体,16℃过夜连接,转化、涂板接种,挑取单菌落进行PCR 鉴定,送至成都擎科生物技术有限公司测序。
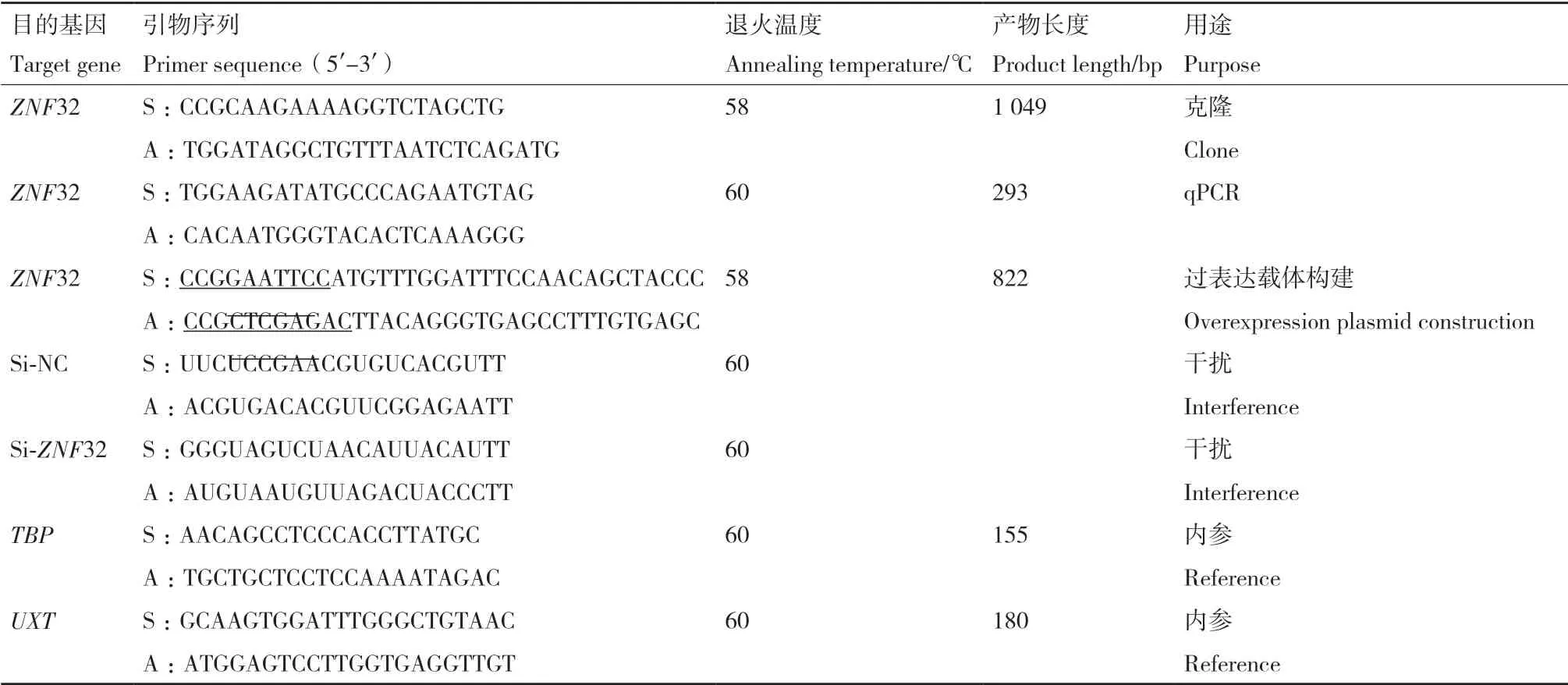
表1 引物信息Table 1 Primers information
1.2.7 细胞转染、过表达及干扰效率检测 同“1.2.5”中方法将细胞进行传代培养,传至F3代后以7×104个/孔(6 孔板)铺板,空白试验组分别以pcDNA3.1 和siRNA(NC)转染,试验组分别以pcDNA3.1-ZNF32 和siRNA-ZNF32 转染。转染48 h 后收取细胞,UXT作为内参基因,使用qPCR 法检测其过表达。转染体系:2 μg pcDNA3.1-ZNF32,400 μL opti,6 μL turbfect。qPCR 反应体系:SYBR®Premix ExTaqTM(2×)6.25 μL,cDNA 0.625 μL,10 μmol/L 上游引物0.625 μL、10 μmol/L 下游引物0.625 μL,ddH2O 4.375 μL,合计12.5 μL 反应总体系,每个样本设置3 个重复。反应条件同“1.2.4”。
1.2.8 过表达或干扰ZNF32 对增殖抑制相关基因表达量的影响 以“1.2.7”中反转录获得的cDNA 为模板,使用实验室前期设计并检测合格的引物(表3),检测过表达ZNF32 对山羊皮下前体脂肪细胞中增殖抑制相关基因表达的影响,每个样本设置3 个重复。qPCR 体系及反应条件同“1.2.4”。

表3 增殖抑制相关基因引物信息Table 3 Primers information of genes associated with proliferation inhibition
1.2.9 数据处理与分析 qPCR 数据用“平均值±标准差(Mean±SD)”表示,并用2-ΔΔCt法进行均一化处理;利用SPSS 软件中的One-way ANOVA 对数据进行显著性检验分析。*代表P<0.05,**代表P<0.01。
2 结果
2.1 山羊ZNF32基因的克隆
为研究山羊ZNF32 的生物学功能,获得该基因序列,本研究以简州大耳羊肾组织cDNA 为模板,经PCR 扩增后获得与预期目的产物大小相符的片段(图1)。测序得到ZNF32 基因片段长度1 049 bp,已提交GenBank 获得登录号为MZ054397;经序列分析CDS 区序列长度为822 bp(图2),与GenBank上山羊ZNF32 基因核苷酸预测序列完全一致,结果表明山羊ZNF32 基因序列克隆成功。
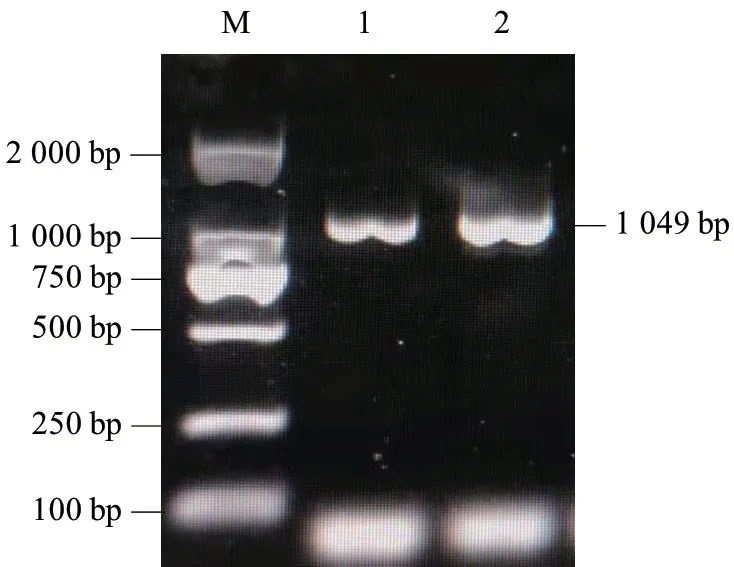
图1 山羊ZNF32 基因扩增结果Fig.1 Amplification of ZNF32 gene in goat
2.2 山羊ZNF32生物信息学分析
经分析显示,山羊ZNF32 蛋白分子式为C1334H2092N424O394S19,分子量为30 983.03 Da;理论等电点为9.52,带负电荷(Asp + Glu)和带正电荷(Arg+ Lys + His)的氨基酸残基数分别为21 和60,其不稳定系数为42.47,亲水性平均值为-0.813,因此,该蛋白可能为碱性亲水不稳定蛋白;在氨基酸序列组成中,丝氨酸(Ser)含量为9.2%,占比最高;磷酸化位点预测显示,山羊ZNF32 蛋白有32 个磷酸化位点(图2)。功能结构域预测结果显示,山羊ZNF32 蛋白包含7 个C2H2 锌指结构(图2)。
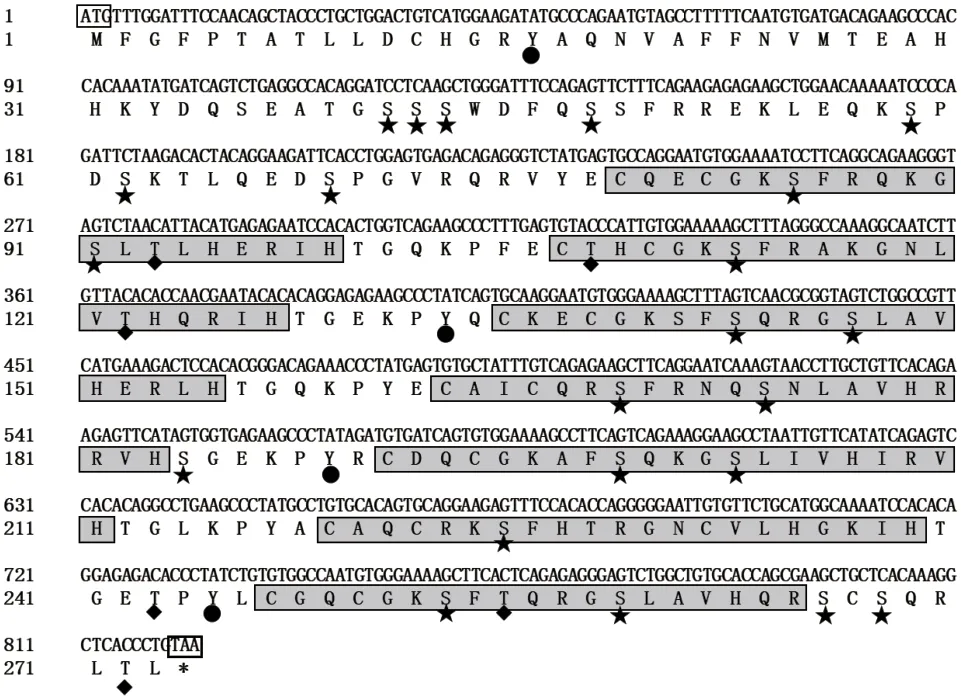
图2 山羊ZNF32 基因的ORF 序列及推断的氨基酸序列Fig.2 Sequences of ORF and deduced amino acids of ZNF32 gene in goat
分析该蛋白质二级结构可知,149 个氨基酸(54.58%)可能会形成无规卷曲(c),形成β-转角(t)的氨基酸有28 个(10.26%),48 个氨基酸(17.58%)可能形成α 螺旋(h),48 个氨基酸(17.58%)可能形成延伸链(e)(图4-A);三级结构经预测与二级结构结果一致(图4-B);在蛋白相互作用方面,可知ZNF32 蛋白可能与SOX2、ZNF821、MED31、ZNF414、FRA10AC1 等蛋白存在相互作用(图4-C)。使用NCBI 中Blast 进行比对可知,简州大耳羊与绵羊、牛的ZNF32 氨基酸序列相似性较高(图5-A),说明该蛋白在不同的物种间具有较高的保守性。利用MEGA 5.0 软件根据山羊与其他物种氨基酸序列同源性构建系统进化树,结果显示,山羊ZNF32 与绵羊、牛亲缘关系较近,聚于同一分支(图5-B)。

图3 山羊ZNF32 蛋白疏水性及氨基酸组成分析Fig.3 Analysis of hydrophobicity and amino acid composition of ZNF32 protein in goat

图4 山羊ZNF32 蛋白质结构及相互作用预测Fig.4 Protein structure and interaction prediction of goat ZNF32

图5 ZNF32 氨基酸序列比对及蛋白系统进化树Fig.5 Amino acid sequence alignment and protein phylogenetic tree of goat ZNF32 gene
2.3 山羊ZNF32基因组织表达分析
以TBP为内参基因,采用qPCR 检测ZNF32 基因在山羊各组织中的表达差异,以背最长肌为对照组织,结果显示,山羊ZNF32 基因在心、肝、瘤胃、肺等14 个组织中均有表达。其中在大肠中的表达量极显著高于其他组织(P<0.01),其次是臂三头肌、小肠及脾组织,而山羊ZNF32 基因在肝和肺组织中表达量最低(图6)。以上结果表明山羊ZNF32 基因的表达具有组织特异性。
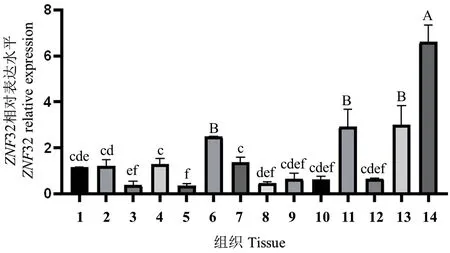
图6 山羊ZNF32 组织表达谱Fig.6 Expression profile of ZNF32 gene in different tissues of goat
2.4 山羊ZNF32基因时序表达分析
分别收集诱导0、24、48、72、96 h 后的细胞,以UXT为内参基因,采用qPCR 技术检测ZNF32 基因在山羊皮下前体脂肪细胞不同分化程度的表达差异。结果显示,随着诱导时间的延长,与诱导0 h相比,诱导分化24 h、48 h、72 h、96 h 后ZNF32 基因表达水平呈上升趋势,在96 h 表达量达到最高,差异极显著(图7)(P<0.01)。
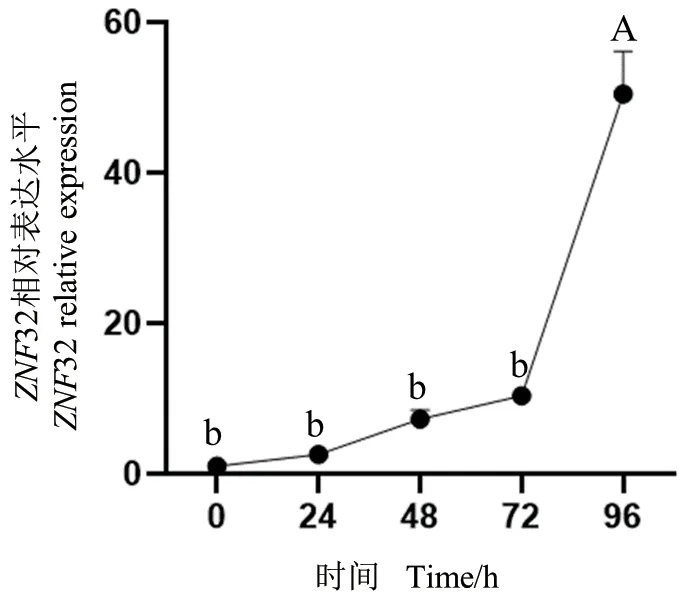
图7 ZNF32 基因在山羊皮下脂肪细胞不同分化阶段的相对表达水平Fig.7 Relative expressions of ZNF32 gene in goat during different stages of differentiation
2.5 山羊ZNF32过表达载体构建
为了进一步研究山羊ZNF32 的生物学功能,以“1.2.2”中测序成功后提取的007VS-ZNF32 质粒为模板,经PCR 扩增获得ZNF32 基因CDS 区序列(图8);以ZNF32 基因CDS 序列构建过表达载体,测序结果显示,CDS 区序列与克隆序列完全一致,红色下划线处为酶切位点(图9),以上结果表明pCMVTag2B-ZNF32 过表达载体构建成功。
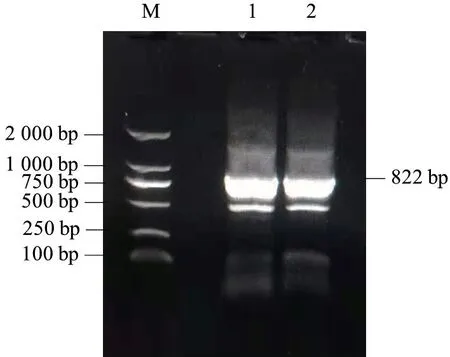
图8 山羊ZNF32 基因CDS 区扩增结果Fig.8 CDS amplification results of goat ZNF32 gene

图9 山羊ZNF32 基因过表达载体测序结果Fig.9 Sequencing results of goat ZNF32 gene overexpression vector
2.6 山羊ZNF32基因过表达效率及增殖抑制相关基因表达检测
山羊皮下前体脂肪细胞转染ZNF32 表达质粒48 h 后,利用qPCR 检测ZNF32 过表达效率,结果显示,与对照组相比,ZNF32 基因表达量上调了近750 倍(图10-A)。有研究指出人ZNF32 与肿瘤发生发展密切相关,因此,我们想到山羊ZNF32 是否调控皮下前体脂肪细胞增殖。本研究利用qPCR 法检测过表达ZNF32 后对增殖抑制相关基因p21、p27、p53及p57 的表达的影响,结果显示,过表达ZNF32 后抑制了增殖抑制相关基因p27 及p57 的表达(图10-B)。
2.7 山羊ZNF32基因干扰效率及增殖抑制相关基因表达检测
转染ZNF32-siRNA入皮下前体脂肪细胞48 h后,qPCR 检测结果显示,与Negative control(NC)组相比,干扰效率为25%左右(图10-C),干扰ZNF32后促进了增殖抑制相关基因p21、p27、p53 及p57的表达(图10-D)。
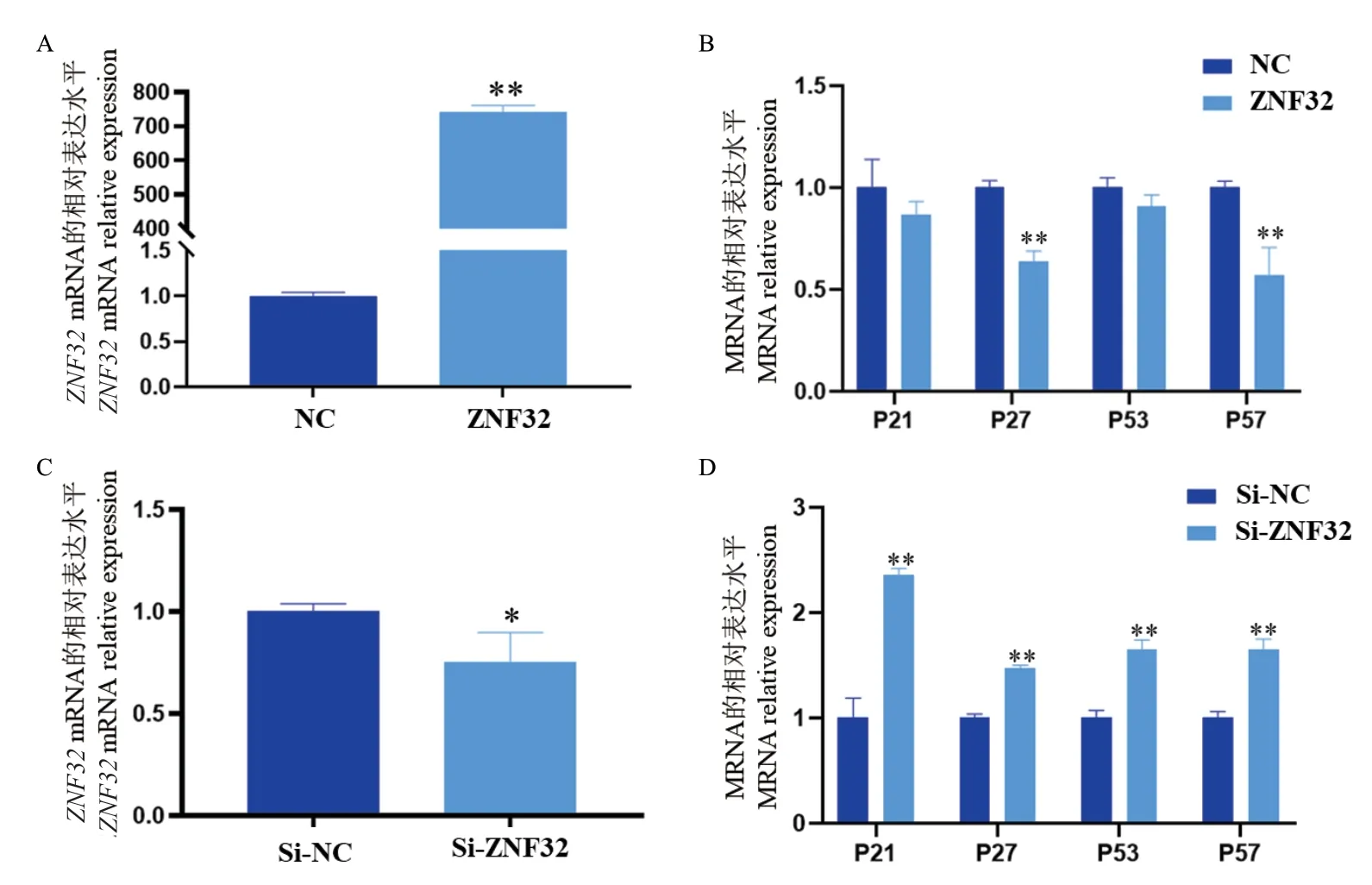
图10 山羊ZNF32 基因表达效率及增殖抑制相关基因表达检测Fig.10 Detection of ZNF32 gene expression efficiency and the expressions of genes related to proliferation inhibition in goats
2.8 ZNF32调控山羊皮下脂肪细胞增殖作用的机制探索
为了进一步明析ZNF32 对山羊皮下前体脂肪细胞增殖的调控机制,鉴于其转录因子的身份,人ZNF32 的转录结合序列为GA(C/T)ATTT[12],上述研究结果表明过表达ZNF32 后增殖抑制相关基因p27 及 p57 基因表达明显下调,干扰ZNF32 后增殖抑制相关基因p21、p27、p53 及 p57 明显上调。经过对人p21、p27、p53 及p57 基因启动子区(-2 000-+100)分析发现,p21、p27 及 p53 基因启动子区存在ZNF32 转录结合序列(图11)。以上结果表明ZNF32 可能通过靶向p21、p27 及 p53 的表达来调控山羊皮下脂肪细胞增殖。
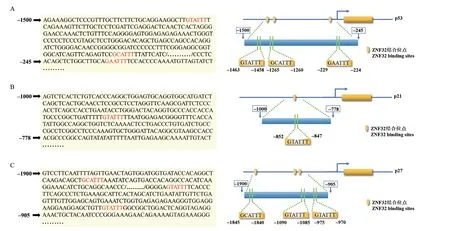
图11 p53、p21 和p27 启动子区ZNF32 结合序列Fig.11 Binding sequence of ZNF32 in p53,p21 and p27 promoter region
3 讨论
Krüppel 样转录因子是一类DNA 结合转录调控因子,这个家族内的每一个调控因子的羧基端都有Cys2/His2 锌指结构域,这个结构域十分保守。ZNF32 基因作为Krüppel 样锌指家族的一种转录因子,对于DNA 转录调控具有重要的作用。研究表明ZNF32 参与调控人肿瘤细胞增殖和分化等多种行为[13-18]。
为了研究山羊ZNF32 的表达特性,本研究成功克隆了山羊ZNF32 基因序列,得到CDS 区822 bp,共编码273 个氨基酸。通过生物信息学分析工具对山羊ZNF32 序列进行分析,结果显示,ZNF32 蛋白理论等电点为9.52,亲水性平均值为-0.813,因此,该蛋白可能为碱性亲水蛋白。山羊ZNF32 蛋白有32个磷酸化位点,磷酸化作为蛋白翻译后修饰的方式之一,参与调节细胞的生长、分化、凋亡等功能[26],因此这些磷酸化位点可能有助于ZNF32 蛋白发生磷酸化。功能结构域预测结果显示,山羊ZNF32 蛋白包含7 个C2H2 锌指结构,其中6 个连续的典型C2H2 锌指序列和1 个简并的C2H2 锌指序列,与Han[4]的报道一致,且研究表明,C2H2 型锌指蛋白参与细胞的增殖、分化和发育等过程[27-28],因此ZNF32 可能参与皮下前体脂肪细胞增殖与分化。利用STRING 预测蛋白相互作用,结果显示,ZNF32蛋白可能与SOX2 等蛋白存在相互作用,Wei 等[15]发现,ZNF32 与干细胞标志物SOX2 启动子特异性结合后,可负调控SOX2 的表达,与预测结果一致。通过构建山羊ZNF32 组织表达谱,知悉其在山羊各组织中均有表达,在大肠中表达量最高。
为进一步研究ZNF32 在山羊脂肪细胞中的功能,本研究构建了山羊ZNF32 时序表达谱,知悉ZNF32 基因表达水平在诱导分化过程中呈上升趋势,在96 h 表达量达到最高,极显著高于分化前。据报道,在目前KLF 家族中发现的18 个成员(即KLF1-KLF18)中有6 个成员(KLF2、KLF3、KLF4、KLF6、KLF7 和KLF15)在分化的细胞中的表达水平显著或极显著高于前体脂肪细胞,KLF4、KLF9、KLF12 可能在山羊前体脂肪细胞中具有重要调控作用[29]。研究发现,与ZNF32 同属ZNF 家族的ZNF423 控制小鼠脂肪细胞形成并与鸡脂肪细胞分化有关,ZNF521 是人类脂肪干细胞分化的负调控因子[10-12]。因此,ZNF32 基因在山羊脂肪细胞分化过程中可能具有调控作用,后续实验将进一步阐明ZNF32 在山羊脂肪细胞中的作用机制。
利用qPCR 技术检测增殖抑制相关基因的相对表达水平,结果显示,过表达ZNF32 后显著抑制了p27 及p57 基因的表达,干扰ZNF32 后显著促进了p21、p27、p53 及p57 基因的表达。P21、p27 及p57 是近年来发现的激酶抑制蛋白CIP/KIP 基因家族,参与细胞周期及新陈代谢的调节,发挥对细胞周期的负性调控作用[30-32],p53 是近年来发现的抑癌基因,p53 蛋白转录激活下游靶基因p21 和MDM2的表达,从而抑制CDK 活性,对细胞周期进行负性调控[33]。Sun 等[34]报道,过表达KLF15 可部分通过调控p21 和p57 抑制胃癌细胞的增殖;Wang 等[35]报道,HOXA5 通过调控p27 抑制宫颈癌细胞增殖;Yang 等[36]报道,BOP1 通过调节p53 的表达调控胃癌细胞增殖;孙等[37]报道,MIR221 可通过与p57 mRNA 3′-UTR 区域结合使结肠癌细胞中p57 蛋白表达下降而促进结肠癌细胞增殖,本研究经过对人p21、p27、p53 及p57 基因启动子区(-2 000-+100)分析发现,p21、p27 及p53 基因启动子区均存在ZNF32 转录结合序列,因此推测ZNF32 可能通过靶向调控p21、p27 或p53 基因表达调控山羊皮下脂肪细胞增殖。
4 结论
本研究成功克隆获得山羊ZNF32 基因序列(登录号:MZ054397),全长1 049 bp,CDS 区822 bp,共编码273 个氨基酸。组织表达谱显示,ZNF32 在山羊各组织中均有表达,在大肠中表达量最高。时序表达谱显示,随着诱导分化时间的延长,ZNF32的表达量升高,ZNF32 基因可能促进皮下脂肪细胞的分化。过表达ZNF32 后抑制增殖抑制相关基因p27 及p57 的表达,干扰ZNF32 后促进了增殖抑制基因p21、p27、p53 及p57 基因的表达,ZNF32 可能通过靶向p53、p21 及p27 基因实现对皮下脂肪细胞增殖的调控。
