高强度超声波联合加巴喷丁对神经病理性疼痛患者miR-19a、miR-30b、miR-29c的影响
2023-01-04吉伟丽李玲芝刘彤彤
吉伟丽,李 朦,李玲芝*,刘彤彤
(1.河北大学附属医院疼痛科,河北 保定 071000;2.河北大学附属医院神经内科,河北 保定 071000)
神经病理性疼痛属于慢性疼痛分类,其自身发病机制较为复杂,在常规情况下,一般是由于神经系统遭到损害以及神经功能出现障碍所引起的疼痛[1-2]。神经病理性疼痛的症状反复发作,一旦发作会持续一段时间,严重影响患者正常生活质量[3-4]。因此,为缓解患者的神经病理性疼痛症状寻找较为有效的药物和方法是治疗的关键。对于这类病症,进行有效镇痛是治疗神经病理性疼痛的常用手段[5]。加巴喷丁属于一种新型抗惊厥药物,能够通过对神经系统通道进行抑制,阻止机体疼痛因子的传导,从而缓解疼痛,但患者在服用过后会出现小程度的不良反应[6]。高强度超声波能够通过物理、理化效应,促进机体病变组织局部血循环,加速新陈代谢,以降低神经兴奋性而达到镇痛的作用[7]。两者联合能够更快地缓解患者疼痛感,高强度超声波通过物理方法缓解疼痛,加巴喷丁通过化学方法缓解患者疼痛,两者联合能够将其不良反应情况减低,提升安全性。加之对于两者联合治疗神经病理性疼痛的相关研究较少,本研究具有一定创新性。据相关研究指出,微小RNA-19a(microrna-19a,miR-19a)、微小RNA-30b(microrna-30b,miR-30b)可通过调节多个电压门控钾通道亚单位的功能,引起神经性疼痛,抑制miR-19a、miR-30b能够减轻机体炎症反应,缓解疼痛程度[8-10]。微小RNA-29c(microrna-29c,miR-29c)在脊髓小胶质细胞活化及神经病理性疼痛的形成、维持中神经系统调控中发挥作用。本研究旨在探究高强度超声波联合加巴喷丁对神经病理性疼痛患者miR-19a、miR-30b、miR-29c表达的影响,观察其治疗效果并进行总结。报告如下。
1 资 料 与 方 法
1.1一般资料 选取2020年2月—2021年6月我院收治的神经病理性疼痛患者72例,按照随机法将其分为对照组35例和联合组37例。纳入标准:①所有患者均符合中国医师协会疼痛可医师分会等专家组对神经病理性疼痛的诊断标准[11],患者及家属均知情同意并签署知情同意书,病历资料齐全;②对研究中所涉及的药物不过敏;③自愿接受高强度超声波联合加巴喷丁治疗方案。排除标准:①对高强度超声波、加巴喷丁治疗不耐受者;②妊娠及哺乳期者;③严重肝肾功能损害者;④有癫痫发作史者;⑤存在皮肤破损等影响疼痛评分结果的情况。2组性别、年龄、体重指数、病程、疼痛类型差异无统计学意义(P>0.05),具有可比性。见表1。
本研究经医院伦理委员会批准通过。

表1 2组一般情况比较Table 1 Comparison of the general conditions between two groups
1.2治疗方法 对照组采用加巴喷丁胶囊(江苏恩华药业股份有限公司,国药准字H20040527,规格:0.1 g×50粒)治疗,口服,0.1 g/次,3次/d。联合组在对照组基础上联合高强度超声波治疗,使用设备仪器为FEP-BY-01型HIFU治疗仪。在患病灶区和患侧相应节段神经根区进行治疗,选用脉冲式、接触移动法,剂量0.5~1.0 w/cm2,轻压声头,均匀移动于受治部位,对患者疼痛区域进行移动治疗,在进行治疗的过程中不得对声头进行停止移动,以此通过高强度超声波的波频,降低感觉神经兴奋性,来达到镇痛的作用。30 min/次,隔1 d治疗1次,5次为1个疗程,治疗5次后,镇痛效果明显。每全疗程至下个疗程间隔1周,2组均进行治疗3个月。
1.3指标检测
1.3.1神经功能评分 治疗前后应用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale, NIHSS)评分与改良Barthel指数评估患者神经功能情况与日常生活能力[12]。NIHSS评分:该评分量表包括意识水平、视野、凝视、共济失调、上肢运动、下肢运动、感觉、面瘫、语言、忽视症及构音障碍11项条目,分值为0~45分,得分越高说明患者神经功能损伤越重。4~7分为轻度组;7~15分为中度组;>15分以上为重度组。改良Barthel指数:该评分量表包括吃饭、穿衣、修饰、用厕、洗澡、小便、大便、转移(床←→椅)、上楼梯、活动(步行)10项条目,总分为0~100分,得分越高表示患者日常生活能力越好。
1.3.2疼痛评分 治疗前后采用视觉模拟评分法(visual analogue scale,VAS)、神经病理性疼痛量表(neuropathic pain Scale,NPS)评分对患者疼痛情况进行评定[13-14]。VAS评分评估患者疼痛程度,无疼痛症状为0~1分;轻度疼痛症状为2~4分;中度疼痛症状为5~7分;重度疼痛症状为8~10分,总分值为10分,分值越大表示疼痛程度越严重。NPS评分对患者刺痛、钝痛、深部痛、不适感、疼痛强度等进行评定,无痛为0分,剧烈疼痛为10分,患者自己选择0~10间的数字来进行疼痛程度判定,分值越大表示疼痛越严重。
1.3.3酶联免疫吸附实验法检测白细胞介素6(interleukin-6,IL-6)、C反应蛋白(C-reactive protein,CRP)水平 清晨空腹坐位抽取静脉血5 mL,标记酶标板、稀释标准品,设置标准、空白检测孔,标准孔添加标准品,空白孔添加终止液、显色剂,检测孔添加血清标本及抗IL-6、CRP抗体后封膜,空白孔为基准,使用酶标分析仪(上海酶联生物科技有限公司,型号:ML-dr3518)450 nm处测吸光值,计算IL-6、CRP水平。
1.3.4免疫透射比浊法检测CD4+、CD8+、CD4+/CD8+水平 稀释血清标本,取3个洁净试管依次标记为对照、标准、检测管,均添加350 μL缓冲液,之后分别添加20 μL蒸馏水、标准液、血清标本,震荡均匀后37 ℃保温箱保存15 min,使用流式细胞仪(美国BD公司,型号:BD Accuri C6),取出比色,340、700 nm波长处测定免疫复合物浊度,根据吸光度计算CD4+、CD8+、CD4+/CD8+水平。
1.3.5检测miR-19a、miR-30b、miR-29c表达水平 收取250 μL血浆样本,加入750 μLTrizol试剂,混匀,提取总RNA,进行逆转录反应,反应条件:42 ℃ 60 min,25 ℃ 5 min,70 ℃ 5 min,将逆转录反应后产物cDNA,-20 ℃保存备用,将逆转录产物进行预扩增。取预扩增产物4 μL,按照TaqManPCR试剂盒说明进行PCR反应。每个样本做3个复孔。采用RT-PCR检测方法,记录每个荧光反应管中的荧光信号达到所设定的阈值,RNA酶抑制剂(20 U/μL)0.5 μL,dNTPs(100 mmol/L)1 μL,buffer液1.5 μL,DEPC水5 μL,U6及miRNA引物3 μL。引物合成及序列测定由上海基康公司完成,序列如下:内参GAPDH 上游引物序列为(5′→3′):GTCAAGGCTGAGAACGGGAA;下游引物序列为(5′→3′):AAATGAGCCCCAGC-CTTCTC。miR-19a上游引物序列为(5′→3′):BCAAATCTATGCAAAAC,下游引物序列为(5′→3′):THHTHTCHTGGAGTCG;miR-30b上游引物序列为(5′→3′):GGGTGTAAACATCC-ACAC,下游引物序列为(5′→3′):CAGTGCGT-GTCGTGGAGT;miR-29c上游引物序列为(5′→3′):CTCCTCCTTTTAGCACCATTTG,下游引物序列为(5′→3′):TATCGTTGTACTCCACTCCT-TGAC。将原始数据取3次重复平均值,计算miR-19a、miR-30b、miR-29c表达水平。
1.3.6疗效评价标准 显效:临床症状消失,神经功能、疼痛程度及各指标水平恢复正常;有效:临床症状缓解,神经功能、疼痛程度及各指标水平有效改善;无效:临床症状、神经功能、疼痛程度及各指标水平均未得到缓解和改善[15]。总有效率=(显效+有效)例数/总例数×100%。
1.4统计学方法 应用SPSS 26.0统计软件分析数据。计量资料比较采用独立样本t检验和配对t检验,计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.12组神经功能评分、炎症指标水平比较 治疗前,2组NIHSS评分、改良Barthel指数、IL-6、CRP水平差异无统计学意义(P>0.05);治疗后,2组NIHSS评分、IL-6、CRP水平低于治疗前,改良Barthel指数水平高于治疗前,联合组NIHSS评分、IL-6、CRP水平低于对照组,改良Barthel指数水平高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组神经功能评分、炎症指标水平比较Table 2 Comparison of neurological function scores and inflammatory index levels between two groups
2.22组相关疼痛评分比较 治疗前,2组VAS评分和NPS评分差异无统计学意义(P>0.05);治疗后,2组VAS评分、NPS评分低于治疗前;联合组VAS评分、NPS评分低于对照组,差异有统计学意义(P<0.05)。见表3。
2.32组免疫功能情况比较 治疗前,2组CD4+、CD8+、CD4+/CD8+水平差异无统计学意义(P>0.05);治疗后,2组CD4+、CD8+、CD4+/CD8+水平高于治疗前;联合组CD4+、CD8+、CD4+/CD8+水平高于对照组,差异有统计学意义(P<0.05)。见表4。
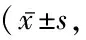
表3 2组相关疼痛评分比较Table 3 Comparison of related pain scores between two groups 分)

表4 2组免疫功能情况比较Table 4 Comparison of immune function between two groups
2.42组miR-19a、miR-30b、miR-29c表达水平比较 治疗前,2组miR-19a、miR-30b、miR-29c表达水平差异无统计学意义(P>0.05);治疗后,2组miR-19a、miR-30b、miR-29c表达水平低于治疗前;联合组miR-19a、miR-30b、miR-29c表达水平低于对照组,差异有统计学意义(P<0.05)。见表5。
2.52组临床疗效比较 联合组临床治疗总有效率高于对照组,差异有统计学意义(P<0.05)。见表6。
2.62组患者不良反应发生率比较 2组不良反应发生率差异无统计学意义(P>0.05)。见表7。

表5 2组miR-19a、miR-30b、miR-29c表达水平比较Table 5 Comparison of the expression levels of miR-19a, miR-30b, and miR-29c between two groups
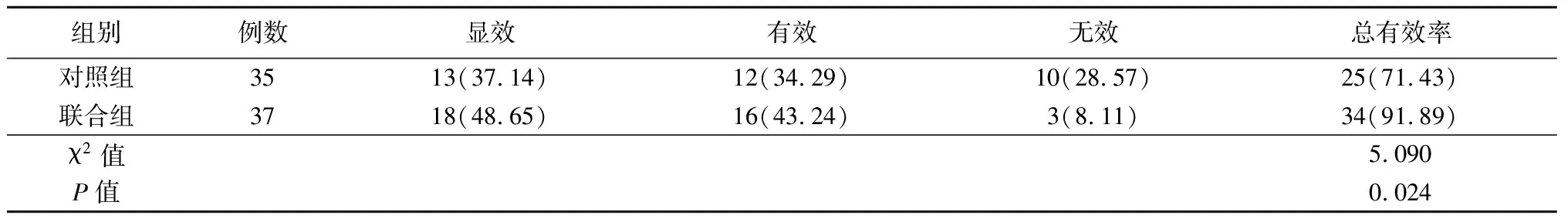
表6 2组临床疗效比较Table 6 Comparison of clinical efficacy between two groups (例数,%)
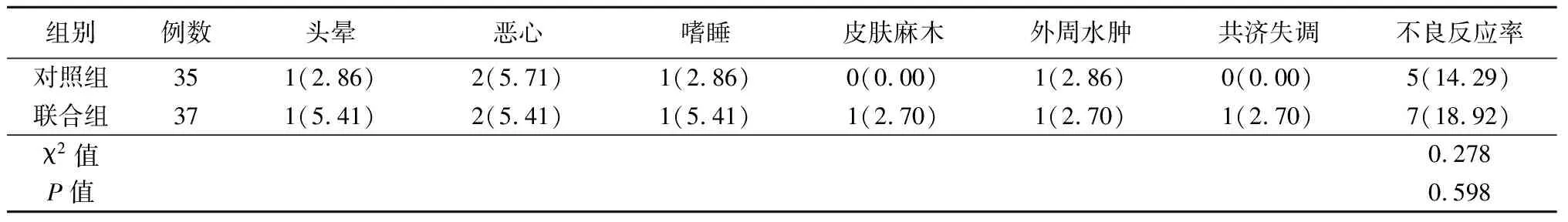
表7 2组不良反应发生率比较Table 7 Comparison of adverse reactions between two groups (例数,%)
3 讨 论
神经病理性疼痛俗称神经痛,是外周和中枢神经遭受损伤以及产生病变,所引发的一种慢性疼痛综合征[16]。临床学者对其病症的发生认为与神经功能障碍、交感神经兴奋以及感觉神经放电异常等情况有关。疼痛属于人体对正要发生或者即将出现的组织损害发出的一种警告,属于一种人体保护机制,据相关统计数据表明,我国1/3的人群中,慢性疼痛的存在,已经远超过心脏病、癌症等病症。神经病理性疼痛与外周神经、中枢神经之间存在密切的联系,部分学者通过对神经病理性疼痛的发病机制、进行研究,为其找到有效的治疗药物和方法[17]。本研究的高强度超声波联合加巴喷丁对神经病理性疼痛具有一定显著的效果。
本研究结果显示,使用高强度超声波联合加巴喷丁治疗的神经病理性疼痛患者NIHSS评分、VAS评分、NPS评分较低,改良Barthel指数较高。说明这一联合治疗方案在神经病理性疼痛的临床治疗上取得了较为理想的效果。NIHSS评分、VAS评分、NPS评分对比治疗前有所降低,说明患者的疼痛感逐步减轻、神经功能恢复正常;改良Barthel指数对比治疗前有所升高,说明患者的自主生活能力逐渐提升,有效促进患者病情恢复。
IL-6为炎症反应递质,在机体内能够诱导急性反应蛋白的生成,造成炎症反应。CRP为非特异性的炎症标志物,在机体内能够调理机体平衡,加强吞噬细胞的吞噬作用,激活补体[18]。神经病理性疼痛症状的发生发展、严重程度与机体内的炎症因子变化具有密切关联[19]。IL-6、CRP为临床评价炎症因子变化的常用指标,IL-6、CRP指标水平的高低变化,能够准确反映神经病理性疼痛患者的病情严重程度[20]。本研究结果说明,治疗后,相关炎症指标IL-6、CRP降低,而出现这种变化的可能是因为这一联合治疗方案能够有效平衡炎症指标水平。因此,使用这一联合治疗方案,能够将神经病理性疼痛患者炎症因子水平进行平衡调控,有效减轻患者的炎症反应,其治疗效果较为显著。
CD4+、CD8+、CD4+/CD8+属于T细胞中的主要成员,是T细胞中的一种蛋白质复合物,而T细胞在机体中属于重要的免疫系统,能够有效调节机体内的免疫功能,其存在的意义能够有效表现出机体的免疫状况。通过检测T细胞中所含有的相关指标,能够掌握细胞在体内的免疫状况。CD4+在T细胞中的作用主要是辅助机体的体液免疫和细胞免疫功能的正常运作。CD8+在T细胞中的作用主要是能够有效抑制机体的细胞毒[21-22]。经过相关研究发现,神经病理性疼痛患者病情的严重程度以及临床治疗效果,与T细胞亚群水平变化有直接关系。由此得出,神经病理性疼痛症状的发展发生以及严重程度能够透过T细胞亚群的水平变化进行体现。本研究结果显示,治疗后,相关免疫功能指标CD4+、CD8+、CD4+/CD8+水平升高,而出现这种变化的可能是因为这一联合治疗方案能够有效提升免疫功能指标水平。因此,神经病理性疼痛患者在使用该联合方案进行临床治疗后,能够有效调控患者的T细胞亚群水平,改善机体免疫能力,有效控制患者病情发展。
据相关研究表明,miR-19a、miR-30b、miR-29c在神经病理性疼痛的发展过程中发挥着重要作用,不仅参与神经元的存活、神经系统的分化及轴突的生长,还会因自身表达量的异常升高,导致其持续疼痛。通过相关研究指出,miR-19a、miR-30b会通过调控多个靶基因翻译、转录而改变神经元可塑性,并且通过调节多个电压门控钾通道亚单位的功能,以此引起神经性疼痛[23-24]。miR-29c在脊髓小胶质细胞活化及神经病理性疼痛的形成、维持中神经系统调控中发挥作用[25]。本研究结果显示,对神经病理性疼痛患者进行治疗后,其miR-19a、miR-30b、miR-29c表达量呈现急剧降低状态。说明,高强度超声波联合加巴喷丁能够有效抑制miR-19a、miR-30b、miR-29c表达量,在进行治疗的过程中通过对患者机体内炎症进行抑制,能够有效降低神经病理性疼痛的活跃程度,这一结果可能与高强度超声波联合加巴喷丁能够最大程度的对miR-19a、miR-30b、miR-29c树突分支、长度及树突棘密度具有紧密关联,从而有效抑制miR-19a、miR-30b、miR-29c表达量。因此,使用高强度超声波联合加巴喷丁对神经病理性疼痛患者进行治疗,能够有效缓解患者的神经病理性疼痛,并使其具有更好的预后。
本研究在对神经病理性疼痛患者进行治疗的过程中采用高强度超声波联合加巴喷丁治疗,通过高强度超声波物理方法联合药物治疗,能够有效缓解疼痛程度。在研究对超声波及辅助药物剂量、治疗时间及疗程进行了较为规范的要求,并且在进行研究的过程中多方参考其他临床研究的相关资料,设定了较为严格的治疗标准,让本研究更加具有科学性、可靠性。
综上所述,高强度超声波联合加巴喷丁治疗神经病理性疼痛,能够产生有效镇痛效果,改善神经功能、自主生活能力、免疫功能,减轻炎症反应,将miR-19a、miR-30b、miR-29c表达因子调控到正常水平,为神经病理性疼痛的临床治疗提供切实可行的参考依据。本研究也存在一定的局限性,在研究过程中选取病例数较少,且并未对患者进行一定时间的随访,未能对患者预后进行研究。下一步研究需增加样本量,对患者进行随访,研究该治疗方案对神经病理性疼痛患者预后的改善作用。
