甘露醇对缺血再灌注大鼠脑保护作用的机制研究
2023-01-04罗志中罗雅琪
罗志中,冯 凯,罗雅琪
(1.河北省唐山市人民医院心内科,河北 唐山 063000;2.华北理工大学附属医院重症医学,河北 唐山 063000;3.承德医学院临床医学系,河北 承德 067000)
脑梗死是人类死亡的主要原因,由中风引起的后遗症相关残疾也是该病危害人类的重要因素[1]。约80%的脑梗死患者是由大脑动脉阻塞引起的缺血性脑梗死,其导致缺血脑部的功能障碍和细胞死亡[2]。当然通过再灌注可恢复血液拯救缺血组织,但再灌注本身会导致组织损伤,即脑缺血再灌注损伤[3]。近年来,随着缺血性脑梗死血管内治疗的进展,脑缺血再灌注损伤相关的神经保护策略日益严峻。脑缺血再灌注损伤的生理病理过程包括氧化应激、炎症及神经元凋亡等[4-5]。甘露醇作为降低颅内压的常用药物,在临床应用中已得到认可。据报道,甘露醇对脑损伤患者的视神经也具有保护作用[6]。本研究旨在探究甘露醇对缺血再灌注脑损伤大鼠神经缺损、炎症氧化应激及神经元凋亡的调控及潜在机制。
1 材 料 与 方 法
1.1一般资料
1.1.1实验动物来源 60只雌性SD大鼠(6~7 周),(250±30) g,购自北京维通利华实验动物技术有限公司。在 23~25 ℃、光照黑夜各半、50%湿度的环境下饲养。手术前大鼠禁食12 h。
1.1.2药物、试剂及仪器 20%甘露醇注射液(国药准字H32025228)购自江苏恒瑞医药股份有限公司;鼠肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzymelinked immunosorbentassy,ELISA)检测试剂盒、鼠白细胞介素6(interleukin-6,IL-6)ELISA 检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒、丙二醛(malondialdehyde,MDA)含量检测试剂盒均购自北京索莱宝科技有限公司;MAPK信号通路激活剂盐酸二甲双胍(S1950)购自美国Selleck公司;TdT介导的dUTP末端标记法(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)细胞凋亡检测试剂盒、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)染色液购自上海碧云天生物技术有限公司。
1.2方法
1.2.1模型大鼠的建立 戊巴比妥腹腔注射麻醉大鼠,颈部中线切开,剥离颈部总、外、内动脉。在近心端的总动脉做切口,塞入尼龙线栓,穿入颈内动脉,阻断大脑动脉供血2 h。拉出栓塞线,恢复血流,制作脑缺血再灌注模型。假手术组大鼠仅做分离颈总、外、内动脉分离,不做血管栓塞处理。待大鼠麻醉苏醒后,进行神经功能缺损评分。
1.2.2大鼠分组与处理 将60只大鼠随机分为4组,每组15只,设为假手术组、模型组、甘露醇组、甘露醇+二甲双胍组。假手术组、模型组大鼠的处理同方法部分1.2.1。除假手术组外,其余大鼠均需进行造模。甘露醇组:大鼠在造模后,尾静脉注射15 mL/kg的20%甘露醇,6 h/次,给药24 h,4次。甘露醇+二甲双胍组:甘露醇尾静脉注射给药的基础上,给予二甲双胍腹腔注射250 mg/kg,1次/d。假手术组、模型组大鼠:尾静脉注射等量的生理盐水。24 h后,进行神经功能缺损检测。结束后,眼眶后静脉丛采血,3 000 r/min,取血清,-20 ℃保存。
1.2.3指标的测定
1.2.3.1大鼠神经功能缺损评分 依照Zea-Longa 5分评分标准[7]对大鼠神经缺损程度进行评分,分值越高缺损越严重。
1.2.3.2脑组织含水量检测 断头法处死大鼠,摘取脑组织,称重(g),记录为脑湿重。110 ℃烘烤48 h,称重,记录为脑干重。脑组织含水量(%)=(脑湿重-脑干重)/脑湿重×100%。
1.2.3.3脑组织梗死率测定 断头法处死大鼠,快速摘取脑组织,置于预冷的PBS中,-20 ℃冰箱保存30 min,剔除嗅球、小脑。切成2 mm的切片组织,进行1%TTC染色,37 ℃避光5 min。肉眼可见白色梗死区,再用4%多聚甲醛固定。Image J测量梗死面积、大脑总面积。脑梗死率(%)=梗死面积/总面积×100%。
1.2.3.4海马组织HE染色 取甲醛固定的海马组织,制作石蜡切片。操作步骤按照HE染色试剂盒说明书要求操作,染色、固定、封片,200倍显微镜下观察海马神经元变化。
1.2.3.5ELISA实验检测血清TNF-α、IL-6、SOD、MDA 按照鼠TNF-α ELISA检测试剂盒、鼠IL-6 ELISA 检测试剂盒、SOD活性检测试剂盒、MDA含量检测试剂盒的说明书要求操作,检测血清TNF-α、IL-6、SOD、MDA。
1.2.3.6TUNEL检测脑组织神经元凋亡率 按照一步法TUNEL细胞凋亡检测试剂盒说明书中的石蜡切片处理脑组织。末端转移酶:生物素-dUTP按照1∶10的比例配置生物素标记液。用生物素标记液标记组织切片,37 ℃避光孵育1 h。洗涤后,进行显色。链霉亲和素工作液孵育30 min,洗涤,DAB显色液。洗涤,用苏木素染色液进行核染,洗涤。最后用乙醇脱水,二甲苯透明,封片。400倍显微镜下观察神经元的凋亡情况,拍照。阳性的凋亡神经元为棕黄色,使用Image J图像分析软件计算阳性细胞数、总细胞数,取平均值。总凋亡率(%)=脑组织凋亡率-阳性细胞数/总细胞数×100%。
1.2.3.7WB实验检测脑组织p-p38、p-ERK1/2、p38、ERK1/2蛋白表达 RIPA裂解液充分裂解研磨的脑组织,提取总蛋白,并BCA定量,沸水变性。十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒展开蛋白电泳。配置10%的分离胶,8.2%的浓缩胶,灌胶。用变性蛋白上清上样,45 V电泳2.5~3 h,蛋白条带至浓缩胶下缘,调整电压至120 V电泳1~2 h至条带跑到分离胶下缘1 cm处。0 ℃预冷转膜仪,蛋白湿转至PVDF膜,期间维持系统在0 ℃。结束后,将膜用封闭液37 ℃封闭处理2 h。用电泳液漂去浮沫,浸入一抗溶液,4 ℃孵育过夜。漂洗后,转入二抗溶液,37 ℃孵育1.5 h。漂洗,电化学发光液显色,凝胶成像系统显影,曝光。Image J软件分析条带的灰度,用蛋白条带的相对灰度值表示蛋白的表达量。
1.3统计学方法 应用SPSS 23.0统计分析软件处理数据。计量资料比较采用单因素方差分析、SNK-q检验和独立样本t检验。P<0.05为差异有统计意义。
2 结 果
2.1四组大鼠神经功能缺损评分 与假手术组相比,模型组大鼠神经功能缺损显著升高,脑组织含水量显著升高,脑梗死率显著升高(P<0.05);与模型组相比,甘露醇组大鼠神经功能缺损、脑组织含水量、脑梗死率均显著降低(P<0.05);与甘露醇组相比,甘露醇+二甲双胍组大鼠神经功能缺损、脑组织含水量、脑梗死率均明显升高(P<0.05),见表1。
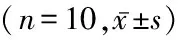
表1 大鼠神经功能缺损及脑梗死情况Table 1 Neurological deficit and cerebral stroke in rats
2.2四组大鼠海马组织病理变化 假手术组大鼠神经元排列整齐,紧致,结构完整,而模型组神经元之间间隙增大,排列疏松、神经元变形,核仁残缺。与模型组相比,甘露醇组大鼠神经元有明显恢复,核仁染色有明显恢复,细胞间排列明显紧致。与甘露醇组相比,甘露醇+二甲双胍组神经元的上述病理变化明显严重。见图1。
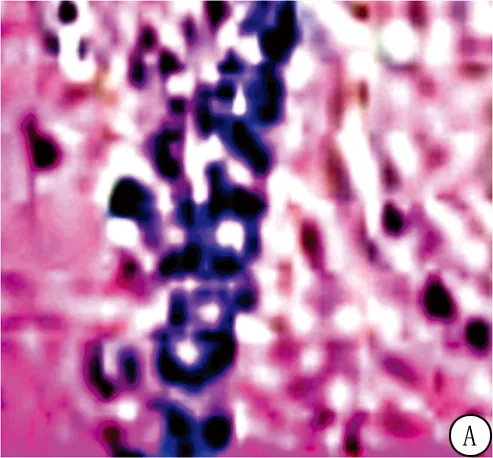
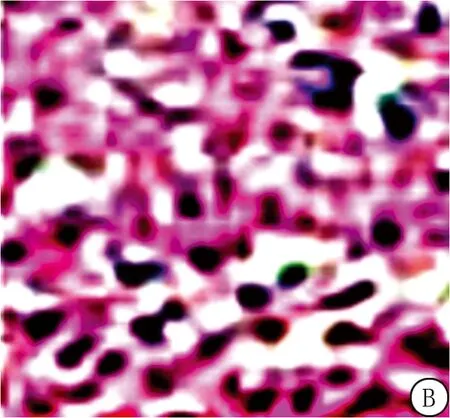


图1 大鼠海马组织(HE染色 ×100)
2.3四组大鼠血清炎症、氧化应激因子的变化 与假手术组相比,模型组大鼠血清TNF-α、IL-6、MDA均显著升高,SOD显著降低(P<0.05);与模型组相比,甘露醇组大鼠血清TNF-α、IL-6、MDA均显著降低,SOD显著升高(P<0.05);与甘露醇组相比,甘露醇+二甲双胍组大鼠血清TNF-α、IL-6、MDA均升高,SOD降低(P<0.05),见表2。
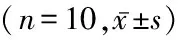
表2 大鼠血清炎症、氧化应激因子变化Table 2 Changes of serum inflammatory and oxidative stress factors in rats
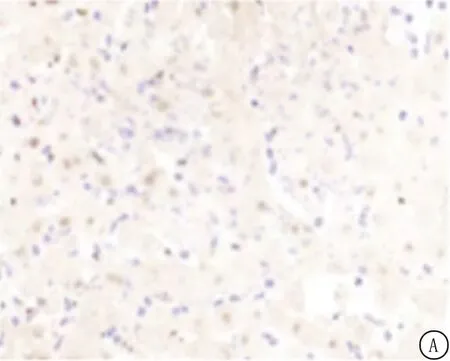


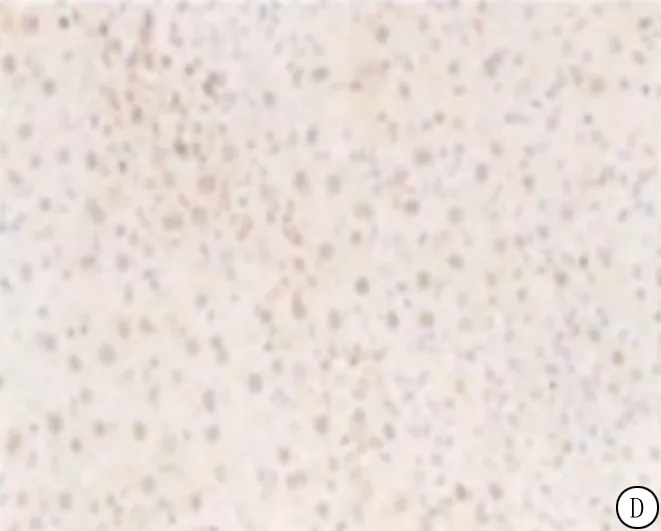
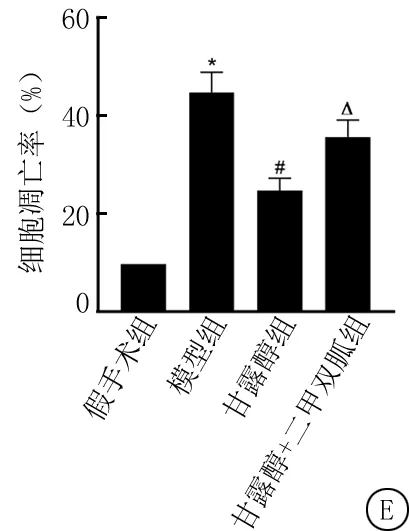
图2 大鼠脑组织神经元凋亡情况
2.4四组大鼠脑组织神经元凋亡变化 与假手术组相比,模型组大鼠脑组织神经元凋亡率显著升高(P<0.05);与模型组相比,甘露醇组大鼠脑组织神经元凋亡率显著降低(P<0.05);与甘露醇组相比,甘露醇+二甲双胍组大鼠脑组织神经元凋亡率升高(P<0.05),见图2。
2.5四组大鼠脑组织MAPK信号通路活性变化 与假手术组相比,模型组大鼠脑组织p-p38、p-ERK1/2蛋白表达显著升高(P<0.05);与模型组相比,甘露醇组大鼠脑组织p-p38、p-ERK1/2蛋白表达显著降低(P<0.05);与甘露醇组相比,甘露醇+二甲双胍组大鼠脑组织p-p38、p-ERK1/2蛋白表达升高(P<0.05),见表3、图3。
表3 大鼠脑组织MAPK信号通路活性Table 3 Activity of MAPK signaling pathway in rat brain tissue
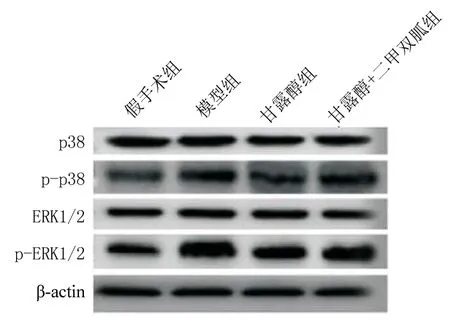
图3 MAPK信号通路关键基因的蛋白表达
3 讨 论
甘露醇在临床治疗中多用于降低颅脑血压,但是也有学者认为过量使用会加重患者的颅内压及脑损伤[8-9]。Huang等[10]在创伤性脑损伤患者的临床观察中发现,20%甘露醇、10%高渗盐水可降低创伤性脑损伤的颅内压、升高血清钠含量,升高血清渗透压。Patil等[11]报道,20%甘露醇、3%高渗盐水、10%甘露醇混合10%甘油组、对创伤性脑损伤患者的低血容量、低钠血症或肾功能衰竭均有疗效,但是,在神经功能方面仅20%甘露醇有效。王琴等[12]在研究中发现,甘露醇联合丁苯酞治疗能够降低急性脑梗死患者的氧化应激反应,改善神经功能和生活质量。因此本研究猜测甘露醇可能对脑损伤引起的神经功能障碍具有一定的作用。本研究建立了缺血再灌注脑损伤大鼠模型,模型大鼠的神经功能缺损、脑组织含水量、脑梗死率均升高,血清TNF-α、IL-6、MDA升高,SOD降低,脑组织神经元凋亡率升高,说明缺血再灌注脑损伤大鼠模型制造成功。20%甘露醇治疗的大鼠神经功能缺损、脑组织含水量、脑梗死率均明显下降,炎症、氧化应激反应也受到抑制,神经元凋亡情况得到改善,这些实验说明甘露醇对缺血再灌注脑损伤的具有保护作用。
近两年,国内外很多研究均报道,MAPK信号通路的抑制在脑损伤后大脑的抗炎、抗氧化应激及自我修改中发挥积极的有益功能[13-14]。王明程等[15]在研究中发现,缺血再灌注损伤小鼠脑组织内MAPK信号通路关键基因p-JNK、p-ERK1/2、p-p38的蛋白表达上调,该通路被异常激活;异丙酚处理后的模型小鼠脑组织p-JNK、p-ERK1/2、p-p38的表达受到抑制,小鼠的学习与记忆能力得到恢复。本研究发现,MAPK信号通路基因p-p38、p-ERK1/2在缺血再灌注脑损伤大鼠脑组织中表达升高,这与该通路在脑部损伤相关疾病中异常激活的实验结果相吻合。甘露醇治疗后,大鼠脑组织中p-p38、p-ERK1/2的表达明显受到抑制,而二甲双胍能够明显减弱甘露醇对p-p38、p-ERK1/2的抑制作用,上调MAPK信号通路的活性。此研究结果说明甘露醇可抑制缺血再灌注大鼠脑组织MAPK信号通路的活性,二甲双胍作为MAPK信号通路激活剂可再次激活缺血再灌注大鼠MAPK信号通路。重要的是,二甲双胍再次激活MAPK信号通路后,甘露醇治疗的模型大鼠神经功能缺损、脑组织含水量、脑梗死率又明显加重,炎症、氧化应激反应也升高,神经元凋亡再次升高,这说明了MAPK信号通路在甘露醇保护缺血再灌注大鼠脑损伤中的重要性。
综上所述,甘露醇可减轻缺血再灌注损伤造成的神经功能缺损、脑组织的水肿、梗死及炎症氧化应激和神经元的凋亡,保护脑损伤,这种作用与抑制MAPK信号通路有关,为脑血管损伤疾病的临床治疗提供参考。
