基于铁死亡基因结肠癌分子预后模型的建立与分析
2023-01-04孙姗姗
黄 奔,孙姗姗,王 洁,赵 鸿△
(南京医科大学第一附属医院:1.检验学部;2.放射科,江苏 南京 210009)
结直肠癌是世界范围内第三大常见恶性肿瘤,据预计至2030年全球将有超过220万新发病例和110万死亡病例[1]。有学者指出,转移性结肠癌患者5年生存率仅为14%[2]。肿瘤患者的治疗决策和预后预测主要依赖于TNM分期系统[3]。然而TNM分期对患者预后的评估存在局限性,如即使患者处于同一分期,其预后结局可能明显不同[4]。因此,分子预后便受到了研究者的关注。
铁死亡是区别于细胞自噬和细胞凋亡的一种新型细胞死亡形式,是一种铁依赖性和活性氧(ROS)依赖性细胞死亡[5]。有研究表明,在多种生理条件和病理应激下均可引发铁死亡,在肿瘤发生过程中发挥了关键作用[5]。DU等[6]指出,HSPA4、ISG20L2、NRAS、IL17D、NDRG1、ACSL4、G6PD 7个铁死亡基因在预测肝细胞癌预后方面可能比传统临床病理因素更稳定、可靠。胡文龙等[7]利用癌症基因图谱(TCGA)数据库构建了基于5个铁死亡相关基因的肺鳞癌预后模型,对肺鳞癌患者的个体化治疗提供了参考。因此,铁死亡相关基因的分子预后模型被许多研究者认为可作为癌症患者预后决策[8-9]。本研究通过利用TCGA结肠癌数据集,分析铁死亡相关基因在结肠癌中的分子作用机制,构建了基于铁死亡基因结肠癌分子预后模型,旨在为结肠癌提供新型分子预后标志物,为结肠癌的诊疗及预后评估提供参考依据。
1 材料与方法
1.1材料来源 在TCGA数据库(https://portal.gdc.cancer.gov/)中下载结肠癌转录组测序数据和患者临床信息。共有结肠癌组织473份,正常组织41份。从文献中检索铁死亡相关基因,并在铁死亡数据库FerrDb(http://www.zhounan.org/ferrdb/)下载铁死亡相关基因的数据集文件,包括驱动基因、抑制基因和基因标志物,将铁死亡基因与患者基因表达数据进行合并,获取患者铁死亡相关基因表达数据。
1.2方法
1.2.1功能富集分析 以|log2FC|>1,FDR<0.05为条件,使用R 4.1.0软件中的“limma”程序包对铁死亡相关基因进行差异表达分析,使用“clusterProfiler”程序包对差异表达基因进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)富集分析,了解铁死亡相关基因的生物学功能。
1.2.2COX回归分析 根据铁死亡相关基因表达数据,结合患者临床信息中的生存数据,使用单因素和多因素COX回归分析,筛选与患者预后有关的铁死亡基因。
1.2.3模型的建立 根据多因素COX回归分析筛选的基因构建基于铁死亡基因结肠癌分子预后模型。根据文献报道的公式建立风险预后方程,即风险评分=β1×mRNA1EXP + β2×mRNA2EXP+……+βn×mRNAnEXP。β为相应mRNA的多因素回归系数,mRNAnEXP为相应mRNA的表达量。
1.3统计学处理 采用R 4.0.1软件和SPSS25.0统计软件进行数据分析,采用Wilcoxon非参数秩和检验分析肿瘤组织和正常组织铁死亡相关基因表达的差异;COX回归分析铁死亡相关基因与患者生存率的相关性;Kaplan-Meier法分析高、低风险组生存率的差异;P<0.05为差异有统计学意义。采用R 4.1.0软件的“survminer”程序包绘制高、低风险组患者总体生存率的生存曲线图;采用受试者工作特征曲线曲线评价基于铁死亡基因结肠癌分子预后模型的灵敏度和特异度。
2 结 果
2.1铁死亡相关基因分析 在结肠癌中共筛选到72个差异表达的铁死亡相关基因。见表1。其中上调表达47个,下调表达25个。差异基因表达的火山图和表达热图见图1。差异表达基因主要富集在细胞对化学应激的反应、氧化应激的反应及ROS代谢过程等生物学过程中;富集在细胞顶端、基底外侧质膜、脂滴等细胞学成分;富集在有机阴离子跨膜转运蛋白活性、抗氧化活性、氧化还原酶活性等分子功能。见图2A。差异表达基因主要参与铁死亡、癌相关的中心碳代谢、P53信号途径以及与肿瘤相关的信号通路。见图2B。

表1 差异表达的铁死亡相关基因

A:铁死亡相关基因的表达火山图,绿色代表下调基因,红色代表上调基因;B:铁死亡相关基因的表达热图。图1 差异铁死亡相关基因的表达分析

A:铁死亡相关基因GO富集分析图;B:铁死亡相关基因KEGG信号通路富集分析图。图2 GO和KEGG功能富集分析
2.2COX回归分析 6个铁死亡相关基因与结肠癌患者预后相关,差异均有统计学意义(P<0.05),见表2。DRD4、TFAP2C、ENPP2、CAV1 4个铁死亡相关基因可参与模型的构建。见表3。
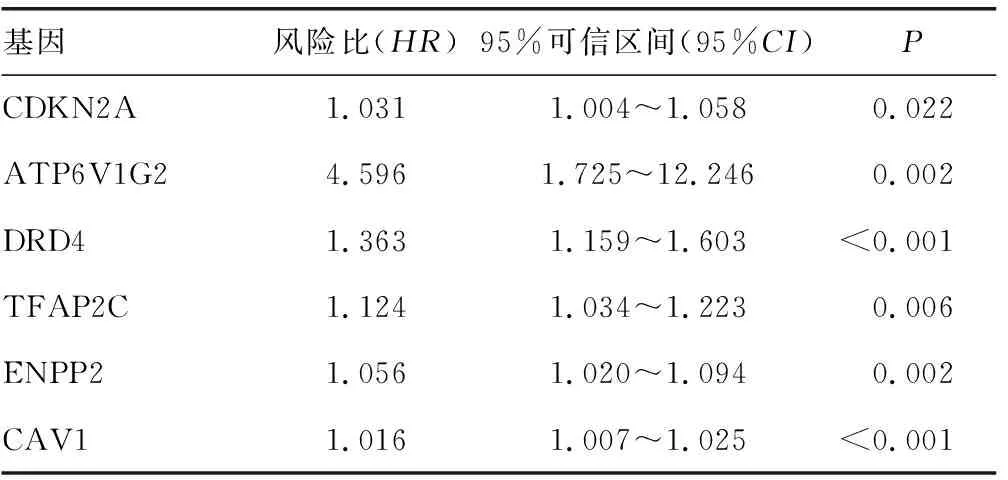
表2 COX回归分析

表3 多因素COX回归分析
2.3模型分析 根据风险评分=0.377×DRD4EXP+0.115×TFAP2C EXP+0.058×ENPP2EXP+0.014×CAV1EXP计算TCGA数据集中每例结肠癌患者的风险评分并分为高风险分组和低风险分组。高风险组患者总体生存率明显低于低风险组,差异有统计学意义(P<0.05)。见图3。
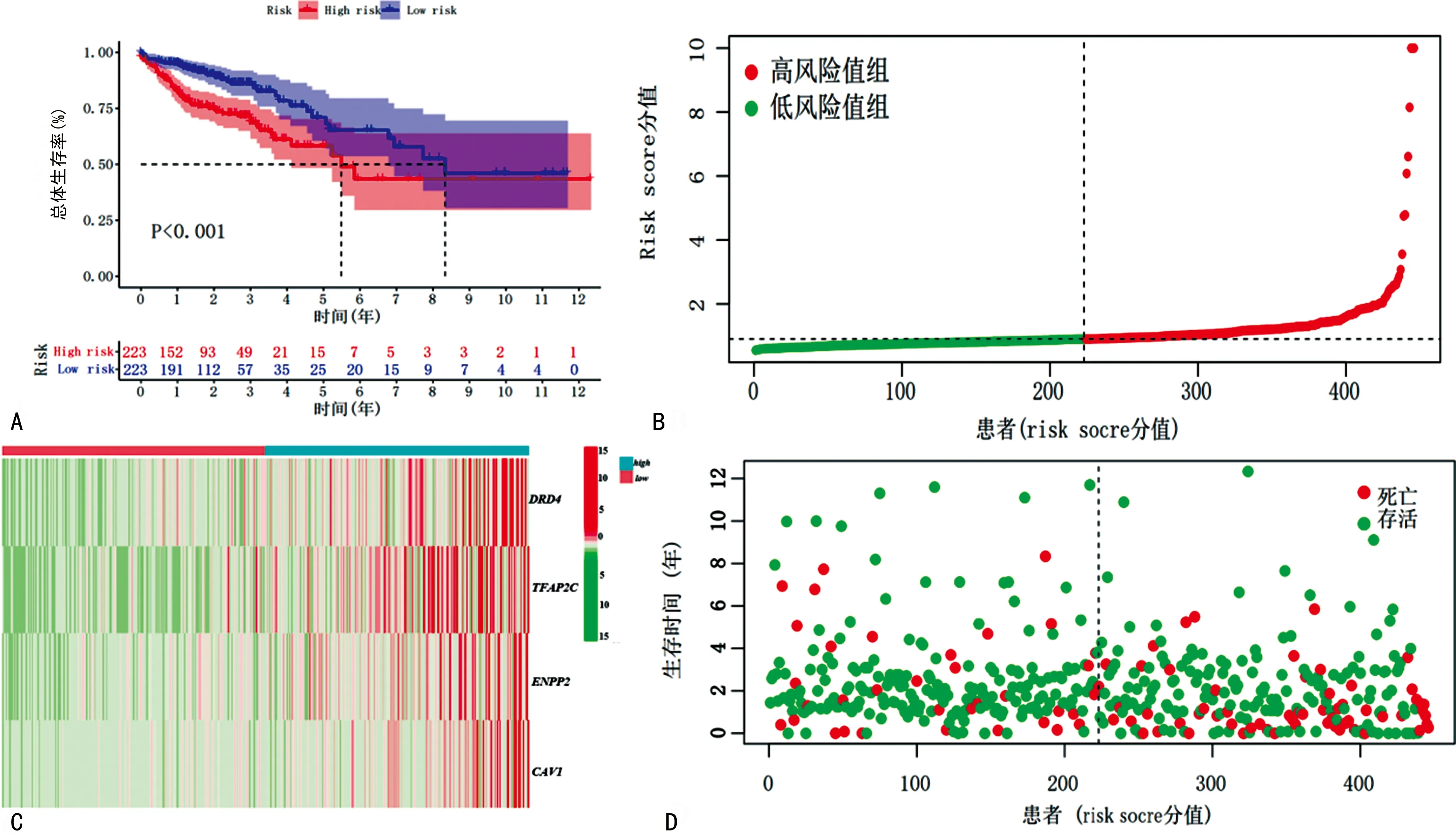
A:高低风险组患者生存曲线图;B:风险评分的分布图;C:4个铁死亡相关基因在高、低风险组的表达热图;D:TCGA结肠癌数据集中患者总体生存率和风险评分的分布图。图3 模型分析
2.4影响患者预后的临床因素 患者年龄、Stage分期、T分期、N分期、M分期、风险预测因子均与患者预后相关(P<0.05);患者年龄和风险预测因子为患者预后的不良因素(HR=1.041、1.144,95%CI:1.019~1.063、1.072~1.221,P=0.001)。见图4。风险预测因子和其他临床特征预测患者生存率的列线图见图5。
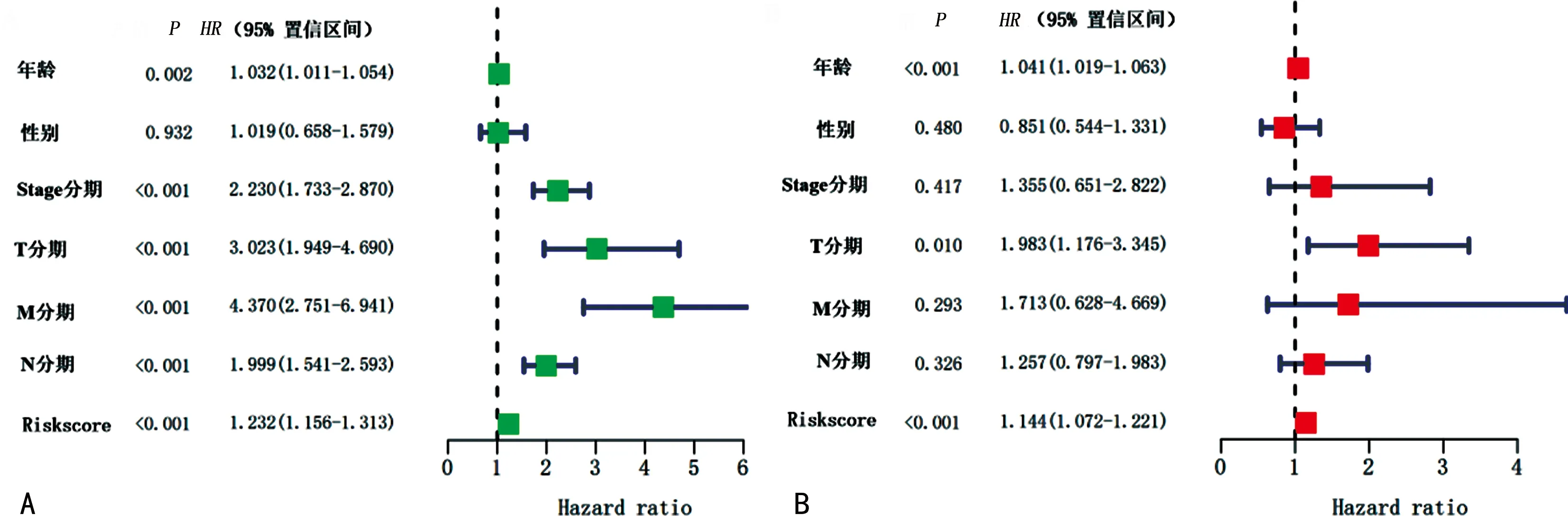
A:单因素COX回归分析的森林图;B:多因素COX回归分析的森林图。图4 COX回归分析

图5 列线图
2.5模型评价 基于铁死亡基因结肠癌分子预后模型预测患者1、3、5年生存率的ROC曲线下面积(AUC)分别为0.714、0.750、0.759。见图6A。预测患者3、5年生存率的AUC均大于相应TNM分期系统的AUC。见图6B、C。表明基于铁死亡基因结肠癌分子预后模型预测性能具有良好的灵敏度和特异度。

A:预测患者生存率的ROC曲线图;B:预测患者1年生存率的ROC曲线图;C:预测患者3年生存率的ROC曲线图;D:预测患者5年生存率的ROC曲线图。图6 ROC曲线
2.6功能分析 高、低风险组患者NRP1、TIGIT、PD-L1、CD44、TNFSF4免疫检查点比较,差异均有统计学意义(P<0.05)。见图7A、B。高、低风险组患者YTHDC2、YTHDF2、YTHDC1、RBM15、FTO、WTAP、METTL14、HNRNPC等m6A相关基因表达比较,差异均有统计学意义(P<0.05)。见图7C。高、低风险组患者免疫细胞共抑制、免疫细胞共刺激、免疫检查点、免疫T淋巴细胞、促炎症作用比较,差异均有统计学意义(P<0.05)。见图7D。表明高、低风险组患者免疫相关功能存在一定差异。
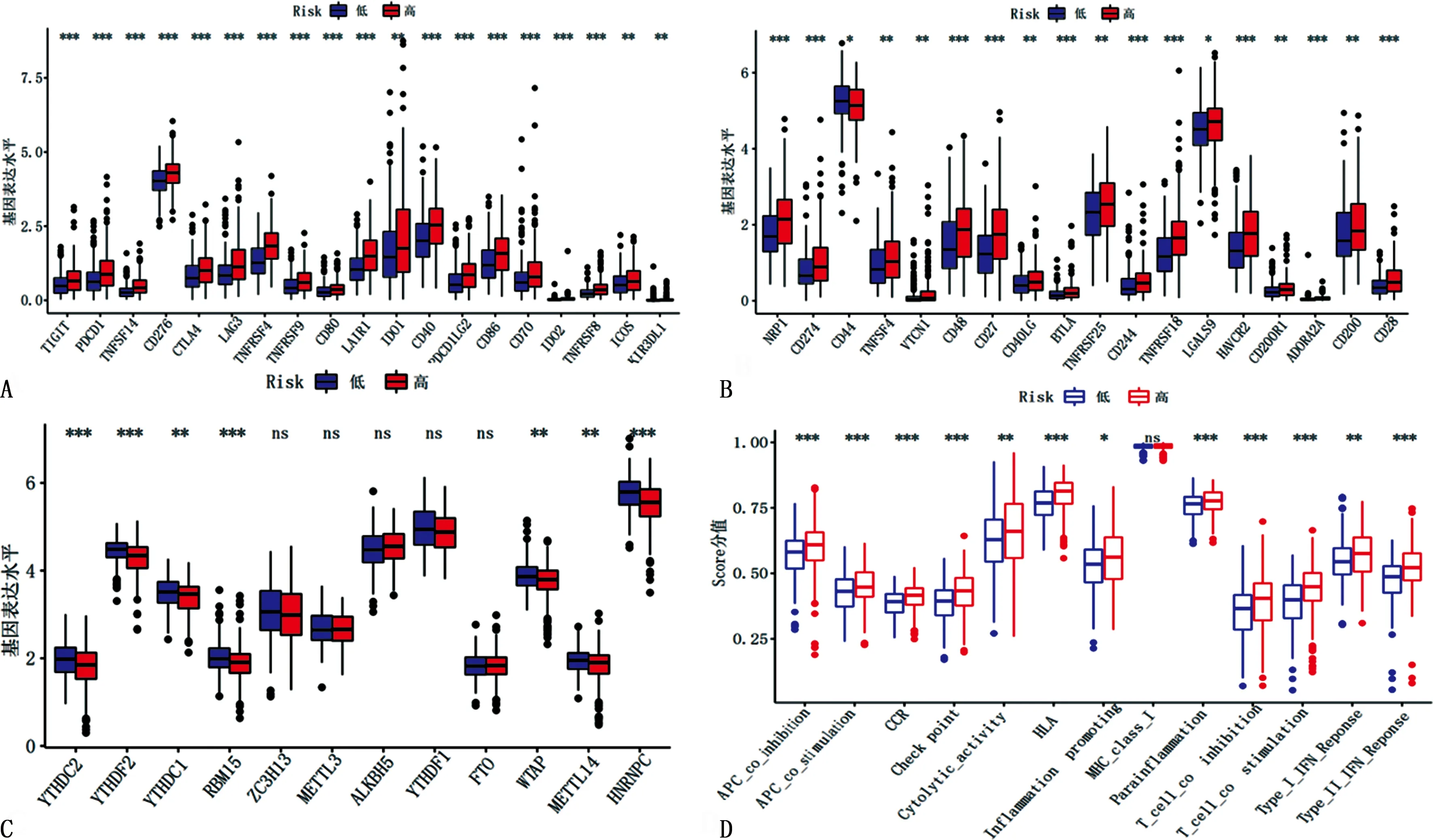
A、B:高、低风险组免疫检查点比较;C:高、低风险组m6A相关基因比较;D:高、低风险组免疫相关功能比较。与低风险组比较,aP<0.05。图7 高、低风险组患者免疫相关功能比较
3 讨 论
铁死亡是一种非凋亡的、铁依赖的调控细胞死亡形式,其标志为铁依赖性脂质过氧化物的积累[10]。多数肿瘤处于高氧化应激状态,为防止发生氧化损伤,肿瘤细胞需增强清除ROS的能力,因此,多数肿瘤细胞均易受到铁死亡的影响[11]。铁死亡通过去除环境中缺乏关键营养素或因感染或环境压力而受损的细胞,在肿瘤发生中具有关键作用[5]。近年来,许多研究揭示了铁死亡相关基因在肿瘤中的作用机制,也使铁死亡相关基因的分子预后价值受到了关注。
本研究通过生物信息学的分析,首次构建了基于铁死亡相关基因的结肠癌分子预后模型,差异表达分析结果显示,结肠癌组织中有72个失调表达的铁死亡相关基因,主要参与了铁死亡、癌相关的中心碳代谢、P53信号途径以及其他与肿瘤相关的信号通路,提示这些失调表达的铁死亡相关基因可能参与了结肠癌的发生与进展。本研究构建的基于铁死亡基因结肠癌分子预后模型基于4个铁死亡相关基因,即DRD4、TFAP2C、ENPP2和CAV1。这些基因在铁死亡相关信号途径中发挥了重要的作用。JIANG等[12]发现,TFAP2C基因在转录水平增加列腺癌相关转录物1 (PCAT1)表达,PCAT1可减少铁积累和氧化损伤反应激活SLC7A11表达,从而抑制铁死亡。机制分析结果显示,TFAP2C可诱导PCAT1 通过原癌基因MYC编码的转录因子/微小RNA-25-3p/SLC7A11信号阻断铁死亡促进癌细胞耐药。ENPP2是一种参与脂质代谢的脂质激酶,ENPP2基因表达可调节其他铁死亡相关基因——GPX4、ACSL4、NRF2的表达,从而增强了细胞中丝氨酸/苏氨酸蛋白激酶存活信号保护心肌细胞免受Erastin诱导的铁死亡[13]。LU等[14]指出,CAV1基因表达水平与ROS呈负相关,因此,CAV1是铁死亡途径的重要抑制因子之一。CAV1 在头颈癌组织中过表达抑制了铁死亡过程,导致肿瘤细胞的侵袭性表型[14]。表明这些基因在与铁死亡相关的癌症途径中均发挥了重要作用,可作为潜在的分子标志物。
本研究将结肠癌患者分为高、低风险组,两组患者差异基因均主要富集于免疫相关通路中,在免疫检查点和m6A相关基因方面存在明显差异。有研究表明,在铁死亡过程中SLC7A11 的转录调控发挥了重要作用[15]。免疫检查点,如CD44基因则可通过增强SLC7A11的稳定性表达,从而降低癌细胞对氧化应激和铁死亡的敏感性[15]。在TYRO3表达的肿瘤细胞中,TYRO3基因可协同调节铁死亡基因——SLC3A2的表达,抑制抗 PD-1/PD-L1引发的铁死亡,并降低 M1/M2巨噬细胞比率,促进肿瘤微环境的发展[16]。本研究高风险组患者显示着免疫检查点的高评分。有学者认为,肿瘤细胞能利用被激活的免疫检查点通路实现免疫逃避,促进肿瘤的恶化[8]。在分子途径方面,免疫检查点分子,如CTLA4、PD-1均可向T淋巴细胞发送信号,调节效应T淋巴细胞反应。T淋巴细胞可通过诱导肿瘤细胞铁死亡消除肿瘤细胞[17]。T淋巴细胞衍生的γ-干扰素可通过调节铁死亡基因——ACSL4的表达改变肿瘤细胞脂质代谢,并与花生四烯酸结合诱导免疫原性肿瘤铁死亡,作为CD8+T淋巴细胞介导肿瘤杀伤的一种作用方式[18]。本研究结果也表明了铁死亡与m6A修饰存在重要联系。SHEN等[19]研究表明,暴露于铁死亡诱导剂后由于甲基化酶METTL4水平明显上调,去甲基化酶FTO明显下调,肝细胞中m6A修饰的水平明显增加。机制分析结果显示,m6A修饰上调BECN1 mRNA增强了自噬性铁蛋白降解,并最终导致铁死亡。XU等[20]指出,METTL3介导的m6A修饰可稳定SLC7A11转录并促进其翻译,从而抑制细胞铁死亡,促进癌细胞增殖。此外,微小RNA -4443可通过调节FSP1 m6A修饰介导的细胞铁死亡,诱导非小细胞肺癌细胞产生顺铂耐药的表型[21]。因此,铁死亡与免疫检查点和m6A修饰均存在重要的联系。有学者认为,调节铁死亡可能是一种潜在的肿瘤治疗策略[22]。本研究结果还分析了铁死亡相关基因与其他多种免疫基因表达的关系,虽然尚缺乏文献报道,但需大样本实验加以验证。
本研究高风险组患者总体预后较差,或许是由于高、低风险组铁死亡基因表达的差异,引起上述多种免疫检查点和免疫相关基因的差异表达所致。此外,在ssGESA分析中还发现,高、低风险组患者免疫细胞刺激/抑制状态、免疫T淋巴细胞效应方面均存在差异,可能由于铁死亡基因的表达不同,通过调节体内激活剂或抑制剂进而调控肿瘤细胞的铁死亡,也导致了患者预后的差异[23]。
综上所述,成功构建了基于铁死亡基因结肠癌分子预后模型。与TNM分期比较,具有较好的预测患者3、5生存率的能力,有望为结肠癌患者个性化治疗和预后评估提供新参考。DRD4、TFAP2C、ENPP2、CAV1 4个铁死亡相关基因有望成为结肠癌的新型预后分子标志物。