白鹤灵芝总萘醌对高脂饮食诱导的非酒精性脂肪肝小鼠的作用研究
2023-01-03龚志强夏雨弘黄艳红陈晓兰蒙田秀杨立芳
龚志强,夏雨弘,韩 沙,黄艳红,霍 宇,陈晓兰,蒙田秀,杨立芳,
(1.广西民族大学化学化工学院,广西林产化学与工程重点实验室,广西多糖材料与改性重点实验室,广西南宁 530008;2.广西中医药大学赛恩斯新医药学院,广西南宁 530222)
非酒精性脂肪性肝病(Nonalcoholic Fatty Liver Disease,NAFLD)是指除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,与胰岛素抵抗和遗传易感性密切相关的获得性代谢应激性肝损伤[1]。饮食和生活方式的改变造成糖尿病、肥胖症等代谢相关疾病持续流行,NAFLD已发展成为危害人类健康的世界性卫生问题[2],影响了全球约24%的人口[3]。NAFLD的治疗包括非药物治疗(生活方式改变)和药物治疗两种,前者为治疗NAFLD的基础[4],药物治疗主要包括胰岛素增敏剂、降脂药、保肝抗炎药物等。但由于NAFLD常伴随代谢异常,西药的单靶点治疗往往得不到很好的疗效,目前尚没有一款FDA批准的NAFLD药物,NAFLD可持续恶化为肝硬化及肝癌,进而对社会公共医疗资源造成重大负担[5]。
白鹤灵芝为爵床科白鹤灵芝属植物Rhinacanthus nasutus(L.)Kurz的干燥枝、叶,别名癣草[6],主产于云、桂、贵等地深山,是壮族等少数民族秘传的珍贵药材,壮药名为Go’gyak(棵绛),壮药中归类清热毒药,主治能晗能累(湿疹)、痂(疥癣)、额哈(毒蛇咬伤)等,具有清热疏肝、杀虫止痒、收敛止血等功效[7]。白鹤灵芝中化学成分复杂,含有萘醌及其苷类、黄酮类、香豆素类及羧酸类,包含20余种类胡桃醌酯类衍生物的萘醌,其中含量较高的为rhinacanthin-C,是研究报道的主要活性物质[8-9]。白鹤灵芝在壮族少数民族地区有着悠久的用药历史,具有清热疏肝的作用,广泛用于肝炎的治疗,蒙田秀等[10-11]研究肯定了白鹤灵芝不同提取部位对高脂饮食诱导的鹌鹑高血脂症及动脉粥样硬化有较好的保护作用,还可以有效降低肾上腺素所致的小鼠高血糖;Supaporn等[12]研究表明白鹤灵芝叶提取物对改善HFD诱导的肥胖小鼠葡萄糖和脂质代谢受损有很好的调节作用;Muhammad等[13]通过体外细胞实验证实白鹤灵芝富含萘醌的提取物(RRE)对α-葡萄糖苷酶的抑制活性,其中,rhinacanthin-C可通过抑制α-葡萄糖苷酶活性而达到治疗糖尿病的作用;体内实验也表明RRE可显著改善大鼠血脂、肝肾生化指标,对糖尿病大鼠胰岛有修复功能,可作为治疗糖尿病的有效天然药物[14]。中医药防治高脂血症等糖、脂代谢疾病具有整体调整和多环节综合治疗的优势。这类疾病临床上多见与“肝”相关的证候,可用多种“疏肝理气、调肝化浊”等中草药进行防治[15]。较多研究已表明白鹤灵芝提取物可有效降血脂、降血糖及心血管保护作用,而其作用的确切物质基础及作用机制尚不明确。
本文通过反复柱色谱层析法富集白鹤灵芝药材提取物中的总萘醌(RRE)成分,以高脂饲料(HFD)诱导建立NAFLD小鼠模型,从体内动物实验研究白鹤灵芝总萘醌的体内降血脂、改善脂质沉积的作用,并结合网络药理学及分子对接技术对RRE治疗NAFLD的有效活性物质及作用机制进行探究,为进一步阐明白鹤灵芝降血脂、保护肝脏的有效物质基础及作用机制提供实验依据。
1 材料与方法
1.1 材料与仪器
SPF级昆明(KM)雄性小鼠 60只,体重(25±2 g),广西医科大学动物实验中学,实验动物生产许可证:SCXK(桂)2014-0002;小鼠基础饲料(Standard Diet,STD) 北京科澳协力饲料有限公司(批号:21037003);小鼠刨花垫料 江苏省协同医药生物工程有限公司(批号:21030307);D12492小鼠高脂饲料(High Fat Diet,HFD:60%脂肪、20%碳水化合物、20%蛋白质) 江苏省协同医药生物工程有限公司(批号:21030116);T-CHO、TG、HDL-C、LDLC、AST、ALT、AKP测定试验试剂盒 南京建成生物工程研究所;熊果酸(批号:C6213-25)、拉帕醇(批号:201206,含量>98%) 上海阿拉丁生化科技有限公司;白鹤灵芝素-C(自制,含量>98%,经NMR鉴定,Anna Sendl et al.,1996)、锌粉(批号:20201019)、亚甲基蓝(批号:20200113) 上海国药集团化学试剂有限公司;柱层析硅胶(批号:0170245) 青岛海洋化工有限公司;磷酸、二氯甲烷、乙醇、甲醇、石油醚、乙酸乙酯等 其余常规试剂均为分析纯(AR),西陇化工;白鹤灵芝药材 采收于广西中医药大学药用植物园,经广西中医药大学谢丽莎教授鉴定为爵床科白鹤灵芝Rhinacanthus nasutus(L.) Kurz,药材标本保存于广西中医药大学会展中心标本馆(编号:
20210305001)。
ALPHA 1-4 LSC冷冻干燥机 德国Martin Christ公司;Adventurer系列电子天平 美国奥豪斯公司;EYELA N1210BV旋转蒸发仪 日本东京理化;Agilent Cary 60紫外可见分光光度计 美国安捷伦科技有限公司;ZHJH-C11068型超净工作台 上海智城分析仪器制造有限公司;Olympus CKX41型倒置荧光显微镜 日本Olympus公司;Epoch型全波长酶标仪 美国Bio Tek公司。
1.2 实验方法
1.2.1 白鹤灵芝总萘醌(RRE)的制备及含量测定白鹤灵芝药材粗粉(6.0 kg)经95%乙醇回流提取,减压低温浓缩,石油醚、乙酸乙酯依次萃取,乙酸乙酯部位经硅胶色谱柱色谱分离,以二氯甲烷:甲醇(100:1→1:1)梯度洗脱,通过薄层色谱(TLC),以无色亚甲蓝显色剂检识萘醌类成分并富集,结果显示:萘醌类成分主富集于50:1→25:1的流分,富集此流分,减压浓缩得RRE浸膏(21.4 g)。以拉帕醇甲醇溶液为对照品[16],紫外分光光度法测定样品在251 nm波长的吸光度,以进样浓度(Y)和吸光度(X)建立标准曲线Y=9.6694X-0.0736(R2=0.9996),精密称取RRE,用甲醇定容,稀释至一定浓度后,于251 nm波长处测量其吸光度值,重复测定6次,代入标准曲线计算RRE浸膏中萘醌含量为452.6 mg/g。RRE浸膏经冷冻干燥碾磨,制备成羟甲基纤维素钠悬浮储备液,储备液浓度为(10 mg/mL),备用。
1.2.2 NAFLD小鼠造模及分组给药 NAFLD小鼠模型建立[17-19]:雄性KM小鼠60只,体重25±2 g,适应性喂养一周,饲养温度25±1 ℃,相对湿度60%±5%,光照昼夜各12 h,随机分为6组,每组10只,空白组实验全程STD喂养,剩余50只小鼠给予HFD喂养。HFD持续喂养6周后,禁食不禁水12 h,断尾尖取血,分离血清,测定各小鼠血脂水平,与空白组血脂水平比较,若P<0.05或P<0.01,则NAFLD造模成功。将50只NAFLD小鼠按TC水平随机分成5组,分别为模型组(n=10)、熊果酸组(n=10)、RRE高、中、低剂量组(n=10)。给药方法:RRE高(300 mg/kg)、中(200 mg/kg)、低剂量(100 mg/kg),熊果酸组(200 mg/kg),药物均配制成适当浓度的羟甲基纤维素钠悬浮液以灌胃;各组小鼠均按照10 mL/kg的体积灌胃,即灌胃RRE高(30 mg/mL)、中(20 mg/mL)、低剂量(10 mg/mL),熊果酸(20 mg/mL)。每天相同时间灌胃给药一次,空白组和模型组给予等剂量的蒸馏水灌胃,连续给药6周,每周称一次体重。实验通过动物伦理委员会审查,严格按照《实验动物护理和使用指南》执行。
1.2.3 指标测定 灌胃给药6周后,实验动物不禁水禁食12 h,摘眼球取血后,处死小鼠并进行解剖,离心分离血清(3000 r/min,4 ℃),采用酶标仪按照试剂盒中的方法测定血清中的TC、TG、HDL-C、LDL-C、AST、ALT、AKP水平。剥离肝脏并称重,计算肝脏系数后。肝脏系数计算公式为:

1.2.4 组织病理学分析 小鼠处死后,分离肝组织后拍照留存,取一部分肝脏置于10%甲醛组织固定液中固定,24 h后石蜡包埋,切片,苏木精-伊红(HE)染色;另取一部分肝脏,采用OTC(optimal cutting temperature compound)包埋,冰冻切片,油红O进行染色;显微镜下观察各切片肝脏组织病理情况以及肝脏脂肪颗粒沉积情况。
1.2.5 基于网络药理学及分子对接的技术预测作用机制 基于中药系统药理学技术平台(TCMSP)及OMIM、Drug Bank及Dig See在线数据库检索白鹤灵芝与NAFLD病变相关靶点富集相互关联,应用STRING数据库及Cytoscape 3.2.1软件构建交集基因蛋白质-蛋白质交汇(PPI)网络图,并进行拓扑学分析,获取核心预测靶点。采用Autodock 4.2.6分子对接软件,可视化软件采用Autodocktools-1.5.6,在蛋白质晶体数据库(www.rcsb.org)中获取相关靶点蛋白的晶体结构,并进行可视化分子对接。
1.3 数据处理
实验均数据采用Excel 2010软件进行数据录入;采用SPSS 20.0分析软件进行统计分析。计量资料采用均数±标准差(Mean±SD)进行统计描述;方差齐时用方差分析进行t检验组间比较,方差若不齐则用秩和检验作以分析;检验方法采用One-way ANOVA分析和Dunnett-t多组间比较,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 RRE对实验小鼠肝脏系数的影响
实验过程中,各组均无小鼠死亡,空白组小鼠精神状态良好,毛发顺滑;模型组小鼠多食少动,毛发略微稀疏,精神倦怠;熊果酸组及RRE给药组与模型组比较,精神状态明显改善。RRE干预后对小鼠体重及肝脏系数影响如表1所示,与空白对照小鼠相比,模型组小鼠体重明显增加,具有极显著差异(P<0.01);与模型组相比,熊果酸组以及白鹤灵芝RRE高、中、低剂量组小鼠体重均有显著性差异(P<0.05)。中剂量组显著降低小鼠肝脏重量及肝脏系数(P<0.05);高剂量极显著降低小鼠肝脏重量及肝脏系数(P<0.01)。综上,白鹤灵芝RRE高、中剂量组均能显著降低NAFLD小鼠体重及肝脏重量(P<0.05),并降低小鼠的肝脏系数。

表 1 白鹤灵芝总萘醌对NAFLD小鼠肝脏系数的影响(n=10)Table 1 Effects of RRE on liver coefficient of NAFLD mice (n=10)
2.2 RRE对实验小鼠血脂水平的影响
血脂是血浆中脂类物质的总称,包括甘油三脂和总胆固醇,为机体供应能量和储存能量的同时,亦可维持生物膜的正常结构和功能。血脂四项包括TC、TG、HDL-C和LDL-C,血脂异常及肝细胞脂肪变性与NAFLD病理进程紧密相关[20]。经过6周HFD喂饲后,与空白组相比,模型组小鼠血清中TC、TG、LDL-C含量均极显著性升高(P<0.01),HDL-C含量极显著性下降(P<0.01),表明HFD饮食成功诱导小鼠高脂血症。
高脂血症小鼠经RRE灌胃给药后,RRE对NAFLD小鼠TC、TG、HDL-C、LDL-C的影响结果如图1所示,与模型组相比,熊果酸组、各剂量组RRE均不同程度地降低了NAFLD小鼠血清中TC、TG、LDLC水平,升高HDL-C水平含量,改善NAFLD小鼠高血脂水平。其中,RRE高、中剂量组具有极显著性降低TC、TG水平(P<0.01);熊果酸组、RRE高、中、低剂量组均能极显著升高HDL-C、降低LDL-C含量(P<0.01)。其中,血清中TC、TG、LDL-C含量与灌胃RRE剂量呈现负相关,HDL-C含量与灌胃RRE剂量呈现正相关。

图 1 白鹤灵芝总萘醌对NAFLD小鼠血脂TC、TG、HDL-C、LDL-C水平的影响(n=10)Fig.1 Effects of RRE on the levels of TC, TG, HDL-C and LDL-C in blood lipids of NAFLD mice (n=10)
2.3 RRE对实验小鼠AST、ALT、AKP的影响
慢性肝胆系统疾病中,血液中ALT和AST活性测定是肝功能实验所必须的重要指标,ALT、AST一般都存在肝脏细胞中,在肝细胞受到损伤时,转氨酶代谢异常,肝细胞中ALT和AST两种酶进入血液,导致血液中ALT和AST水平升高[21]。AKP是一种磷酸单酯酶,临床上主要用于肝癌、肝硬化等肝胆系统疾病的诊断[22]。因此,ALT、AST和AKP三者的水平可以反映肝细胞的受损程度。经过6周HFD喂饲后,与空白组相比,模型组血清中AST、ALT、AKP含量极显著性升高(P<0.01),表明HFD饮食成功诱导小鼠肝细胞受损。RRE给药后对NAFLD小鼠血清中AST、ALT、AKP含量测测定结果如图2所示,与模型组比较,熊果酸组、RRE各剂量组小鼠血清AST、ALT、AKP水平均呈现下降趋势,RRE高、中剂量组均能显著降低NAFLD小鼠血清中AST、ALT、AKP水平(P<0.05或P<0.01),且效果均优于熊果酸组;RRE低剂量组可极显著降低AST水平(P<0.01),下调ALT、AKP水平,但无显著性差异(P>0.05)。

图 2 白鹤灵芝总萘醌对NAFLD小鼠血清中ALT、AST、AKP水平的影响(n=10)Fig.2 Effects of RRE on the levels of AST、ALT、AKP in blood lipids of NAFLD mice (n=10)
2.4 RRE对小鼠HFD造模后肝脏脂质堆积的影响
HFD造模后,经肝脏组织观察发现,正常组小鼠肝脏颜色呈鲜红色,表面具有光滑,并弹性好较好,质地柔软,没有出血点;HFD造模后的小鼠的肝脏偏大,颜色发白,表面有明显的白色点状,粗糙脂肪粒,肝组织弹性一般,脂肪堆积程度较重,并存在出血点;经高、中、低剂量的RRE作用后,NFLAD小鼠肝脏发黄以及油腻感等症状得到不同程度地改善,表面光滑度增加,表面白色点状物减少,出血点消失,小鼠肝脏病理变化得到显著逆转(结果见图3)。
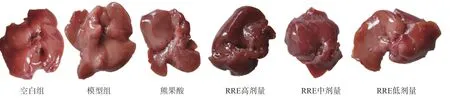
图 3 RRE对NAFLD小鼠肝脏病理影响Fig.3 Effects of RRE on representative picture of liver change in NAFLD mice
2.5 RRE对实验小鼠肝组织病理学观察
肝脏组织经HE染色及油红O染色后的检测结果如图4所示。肝脏组织经HE染色后,空白组小鼠肝脏组织细胞形态正常,边界清晰,排列整齐,细胞胞质未见溶解和空泡;模型组小鼠肝脏组织排列混乱,细胞间隙含有大量脂肪空泡,边界模糊,大量细胞核仁发生偏移和破裂,胞质有溶解现象,可见较大的脂质液滴,呈现显著的细胞炎性损伤及肝脏脂肪病变;RRE高、中、低剂量组小鼠肝脏组织脂肪空泡较模型组明显减少,核仁偏移明显改善,边界较模型组清晰,细胞核萎缩或破裂等现象明显减少,显著降低了小鼠肝脏的脂肪变性程度。油红O染色观察结果同样显示,给予RRE高、中、低剂量处理后,其肝脏组织中的脂肪油滴显著减少,细胞形态得到明显改善。上述检测结果表明,RRE可有效改善NAFLD小鼠肝脏病理病变、减少脂肪堆积,具有改善非酒精性脂肪肝的功效。
2.6 基于网络药理预测白鹤灵芝防治NALFD的作用靶点
基于中药系统药理学技术平台及OMIM、Drug Bank 及Dig See在线数据库,检索药物“白鹤灵芝”、“白鹤灵芝素”、“Rhinacanthus nasutus”及“HFD”、“NAFLD”等相关关键词进行药物和疾病作用靶点富集,借助DAVID数据库对交集基因进行GO功能注释,及OmicShare Tools在线作图平台实现富集结果可视化,结果显示,白鹤灵芝作用靶点与NAFLD病变相关靶点交集基因经PPI网络图连线,SREBP-1c、SIRT1、NF-κB经处于核心位置,结果图5、图6所示。

图 4 白鹤灵芝总萘醌对NAFLD小鼠肝脏组织病理组织影响Fig.4 Effect of RRE on liver histopathology of NAFLD mice
2.7 基于分子对接技术筛选白鹤灵芝总萘醌防治NALFD的活性分子
白鹤灵芝萘醌为主要报道的活性分子[23-25],从RRE中提取分离鉴定了5个萘醌类化合物rhinacanthin-B、rhinacanthin-C、rhinacanthin-D、rhinacanthin-H、rhinacanthin-N和1个苯丙素类化合物Ficucaricone B,其中对白鹤灵芝素-C研究多与心血管疾病相关[26-28],通过分子对接技术分别将上述6个化合物与AMPKα和SIRT1靶蛋白进行分子对接,筛选RRE中分离的单体化合物对相关预测靶点的分子作用。蛋白质晶体数据库中获取预测蛋白的晶体结构AMPKα(编号:2ya3)、SIRT1(编号:5btr)。分子对接结果表明rhinacanthin-C和2ya3的结合能为-5.63 kJ/mol,rhinacanthin-C能与AMPKα和SIRT1的表面空腔结合,但暴露在蛋白质外的连接部分不同,rhinacanthin-C与AMPKα的3D结合如图7所示,His397与苯环之间的N-H-π相互作用,同时rhinacanthin-C上的羰基和萘环上的羟基与Arg401之间的氢键相互作用都在结合亲和力中起主要作用。同时色酮母核和酯基与链1上的Lle400、Val549,链2上Lle246、Ser245、Ala243、Lle272之间存在溶剂接触,对接结果如图7所示。此外,苯环位于Lle543、Thr548等形成的疏水孔中,表明疏水相互作用可能也是一个重要因素。rhinacanthin-C与SIRT1的3D结合如图8所示,rhinacanthin-C上的羰基与Phe414之间存在氢键相互作用,在结合亲和力中起主要作用。然而,由于烯烃长链的内部折叠,其疏水性降低了氢键的作用,羟基被包裹在分子内,从而阻止羟基形成氢键。此外,rhinacanthin-C分子还和Lle223、Leu202、Lle210、Leu206、Thr209、Leu215、Pro211、Gin294、Lys444存在溶剂接触,同时萘环位于由Arg446、Val445、Pro212、Gly415等形成的疏水孔中,表明疏水相互作用可能也是一个重要因素。

图 5 NALFD干预的信号通路功能富集图Fig.5 Signal pathway function enrichment map of NAFLD

图 6 白鹤灵芝作用靶点与NAFLD病变相关靶点交集基因经PPI网络图Fig.6 PPI network diagram of target intersection between Rhinacanthus nasutus action target and NAFLD lesion related target
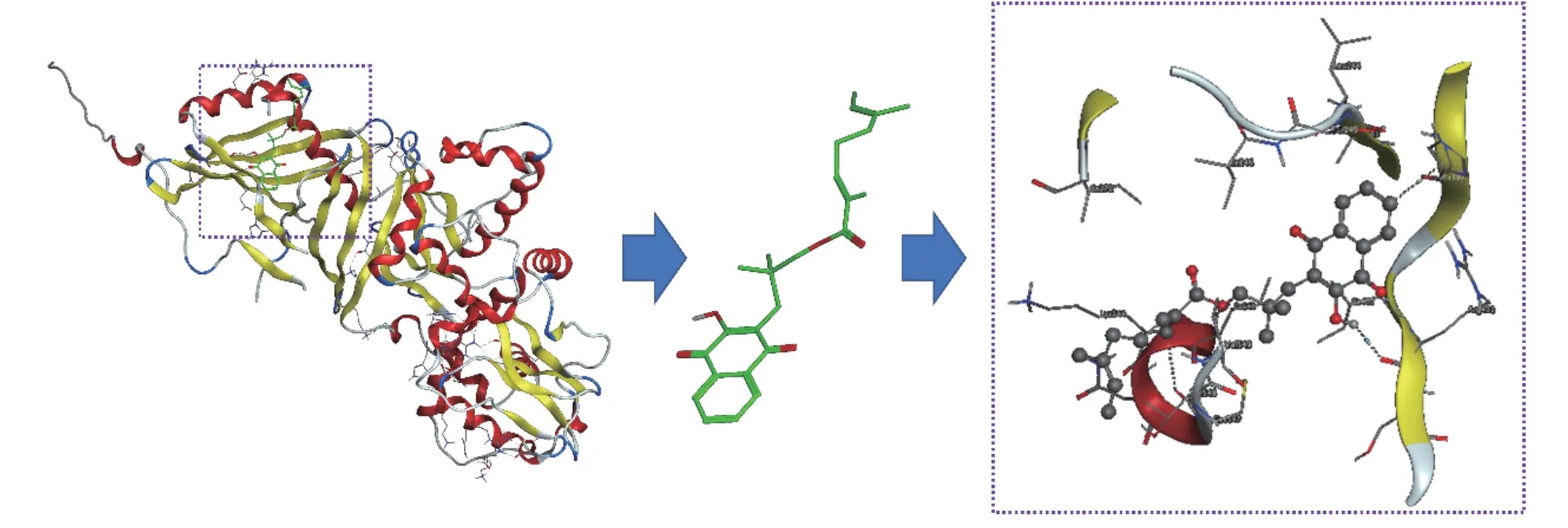
图 7 AMPKα(2ya3)蛋白与rhinacanthin-C分子表面的3D结合模型Fig.7 3D binding model of rhinacanthin-C on the molecular surface of AMPKα (2ya3)
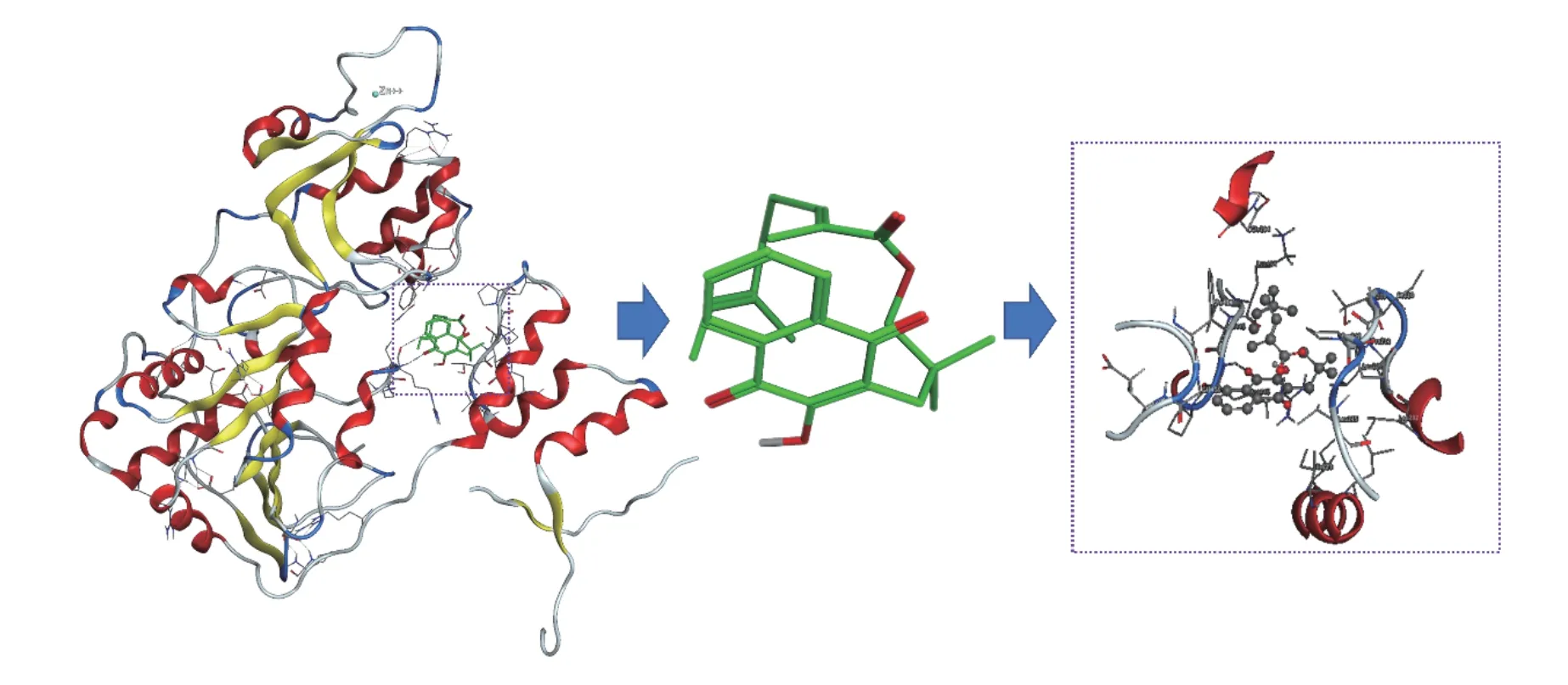
图 8 SIRT1(5btr)蛋白与rhinacanthin-C分子表面的3D结合模型Fig.8 3D binding model of rhinacanthin-C on the molecular surface of SIRT1 (5btr)
3 讨论
3.1 RRE对HFD诱导小鼠血清血脂四项水平的影响
多分子途径研究揭示了NAFLD患者与高阶病变NASH疾病的机制及其临床表现具有高度的异质性,其中游离脂肪酸是NAFLD发病机制的核心[29]。HFD诱导的模型动物常伴随体重、血清TC、TG、LDL-C、HDL-C等生化指标改变,其机制可能是进食高脂营养食物经消化吸收后形成游离脂肪酸在肝内循环形成TG,TG可以作为VLDL进入血液或储存在脂滴中,当脂肪酸供应过量时可作为脂肪毒性物质产生的底物引起内质网络应激和肝细胞损伤,导致游离脂肪酸氧化和VLDL减少,减少TG运出肝细胞,导致TG在肝细胞基质代谢过程中有毒脂质沉积,加重肝脏的脂肪变性,诱发NAFLD的病理形成[30]。因此检测血脂四项的水平,可作为评价NAFLD病理进程改善的重要指标。RRE灌胃给药后,血清中TC、TG、LDL-C含量与灌胃RRE剂量呈现负相关,HDL-C含量与灌胃RRE剂量呈现正相关,因此RRE可通过改善HFD小鼠高血脂症,减少血液中的游离脂肪酸,减少LDL-C含量,升高HDL-C水平,延缓NAFLD的病理进程。
3.2 RRE对HFD诱导小鼠肝脏指标的影响
在临床上,肝脏脂肪变性是NAFLD的标志性特征,同时伴随血清中AST、ALT、AKP的含量升高[31]。AST分布于肝细胞浆和线粒体中,ALT主要分布与肝细胞浆,如果肝细胞坏死,血清中ALT升高提示肝细胞膜损伤,AST升高则提示肝细胞损伤到了细胞器水平。因此,大多数情况下AST、ALT升高程度与肝细胞受损程度相一致,是目前最常用的肝功能检测指标[32]。AST/ALT的比值也能反映肝炎患者的病理进程,HFD诱导的小鼠模型组中与空白组比较,AST增加了107.3%、ALT上升了130.2%,AST/ALT=1.12,结果表明小鼠成功诱导产生中度、重度慢性肝炎,肝细胞线粒体也受到了严重破坏,AST从线粒体和胞浆内释放。经过灌胃不同剂量的RRE的小鼠,均出现抑制血清中AST、ALT、AKP含量上升的现象,而且下降趋势和剂量呈正性相关,表明RRE对NAFLD肝脏的损伤有良好的保护作用。
3.3 网络药理学及分子对接对RRE活性物质及作用机制的预测
网络药理学通过疾病与药物共同靶标网络的建立与分析,预测物质基础与关键靶点,阐释中药治疗疾病的物质基础和作用机制,本文基于TCMSP等在线数据库检索药物与疾病关键词,对白鹤灵芝防治肝脏疾病的作用靶点进行富集和预测,其中AMPKα、SIRT1与脂质代谢异常的靶点以及NF-κB炎性损伤相关的蛋白靶点被富集。AMPK是机体能量代谢重要的通路,SIRT1通过参与脂质和碳水化合物代谢在各种代谢组织中发挥作用,包括肝脏、脂肪组织、骨骼肌等,AMPK-SIRT1-NF-κB是与能量代谢密切相关的一条信号通路,通过介导炎症反应受到机体能量代谢改变的影响[33]。肝脏细胞中AMPK-SIRT1介导的能量代谢与NF-κB介导的炎症因子相互激活,肝脏炎症损伤NF-κB上调可激活SIRT1介导的脂质合成,造成脂质沉积和下游SREBP-1c脂代谢紊乱,在NAFLD的发展中发挥关键作用。通过分子对接技术对白鹤灵芝中分离的6个萘醌类化合物分别与AMPKα和SIRT1靶蛋白进行分子对接,其中rhinacanthin-C结合能最强,分别为-5.63 kJ/mL和-3.93 kJ/moL,表明rhinacanthin-C可能基于AMPKSREBP1c-SIRT1信号通路,参与调节肝脏脂质合成改善NAFLD脂质代谢紊乱发挥降血脂减少脂肪堆积和保护肝脏的作用。
4 结论
本研究通过HFD诱导小鼠建立NAFLD小鼠模型,对白鹤灵芝总萘醌提取物的降血脂、降血糖、减少脂质沉积和改善脂肪肝的作用进行评价。结果表明,RRE高、中剂量组能显著降低NAFLD小鼠血清中TC、TG、LDL-C、AST、ALT、AKP水平,升高HDL-C水平;减少肝脏脂肪颗粒,减少炎症损伤,改善肝组织病理学,缓解NAFLD小鼠肝脏组织损伤。通过网络药理学方法将NAFLD疾病网络与白鹤灵芝研究报道进行网络整合,由寻找单一靶点转向综合网络分析,预测了AMPK-SREBP1c-SIRT1信号通路可能是白鹤灵芝防治NAFLD的作用靶点之一,并采用分子对接技术筛选了白鹤灵芝素-C可能为白鹤灵芝防治NAFLD的药效物质基础。本研究为阐明壮药白鹤灵芝改善NAFLD的作用及有效活性物质提供了实验依据,并为寻找治疗NAFLD疾病的先导化合物,开发和利用好少数民族地区特色壮药资源提供参考依据。
