不同杂粮多糖的体外抗氧化、益生和抗癌活性比较
2023-01-03杨斯惠马明芳曹亚楠任远航彭镰心
杨斯惠,马明芳,曹亚楠,任远航,万 燕,邹 亮,彭镰心,
(1.成都大学农业农村部杂粮加工重点实验室,四川成都 610106;2.四川省杂粮产业化工程技术研究中心,四川成都 610106;3.青海省产品质量检验检测院,青海西宁 810004)
杂粮是指除水稻、小麦、大豆、玉米和薯类作物以外的粮谷类作物[1],具有生育期短、种植面积小、地域性强、种植方法特殊等种植特点[2]。谷类杂粮主要包括大麦、小米、青稞、燕麦、荞麦等;豆类杂粮主要有绿豆、芸豆、蚕豆、豌豆等[3]。随着人们对膳食结构多样化和饮食均衡化重视的加深,人们逐步发现在调节饮食结构和均衡膳食方面,杂粮是日常饮食中不可或缺的部分。与功能活性含量较低的稻谷、小麦相比,种类繁多的杂粮营养成分含量更高[3],其富含膳食纤维、维生素、矿物质等营养物质[4],具有细粮不可替代的地位。我国作为杂粮生产大国,具有悠久的杂粮饮食文化,可杂粮产品主要集中于原粮,加工产品低端,如何充分利用杂粮生理功能活性物质是杂粮开发的方向之一。多糖物质(如β-葡聚糖、阿拉伯木聚糖、纤维素)作为杂粮营养组成的重要部分,对其功能活性深入研究于杂粮行业发展具有积极的意义。
多糖是由10个或10个以上的单糖经过糖苷键聚合、脱水形成的天然高分子化合物[5],主要分布于动物、植物、藻类及微生物中[6]。根据来源不同,多糖可以被分为动物多糖、植物多糖和微生物多糖[7]。作为多糖中的一种,广泛存在于自然界植物体中的植物多糖具有多种生物活性,如抗氧化、抗肿瘤、抗肝损伤、降血糖、益生作用等[8-9]。多糖作为结构复杂的高分子化合物,其功能特性与结构、物理性质密切相关。因此,对多糖提取、分离技术的探究成为了研究多糖的铺垫。目前,对多糖提取工艺的研究有热水浸提、酸提法、碱提法、超声波提取法等。其中,热水浸提法是多糖中最常用的提取方法,具有经济、便捷、能较好地保存分子结构的特点。
近年来,植物多糖在加工、结构和生物活性方面备受关注,成为越来越多科研工作者的研究热点。其中针对杂粮多糖的研究也逐步增加。Hu等[10]通过DPPH法和ABTS法评估了柱层析纯化后藜麦多糖的抗氧化能力,结果显示,藜麦多糖对DPPH和ABTS自由基表现出显著的抗氧化活性。Qian等[11]采用超声辅助法提取大麦多糖,发现大麦多糖在总还原能力、清除DPPH自由基、羟自由基、超氧阴离子自由基等方面具有抗氧化活性。Sargautiene等[12]探索了燕麦非淀粉多糖潜在益生作用,发现地衣芽孢杆菌可以对燕麦非淀粉多糖进行预消化,降低其β-葡聚糖的高粘度,使其他细菌能够更容易利用半纤维素。Lin等[13]发现不同分子量的青稞β-葡聚糖对结肠癌细胞HCT116的体外生长抑制作用无明显差异,分子质量较低的青稞β-葡聚糖也具有较强的抗癌活性。虽然杂粮多糖的不同生物活性被逐步揭示,可目前研究更多集中于单种杂粮多糖的提取分离纯化、理化特性及某种活性探究,由于提取、分析方法的差异,可比性不足,不利于杂粮的综合评价。
本研究以燕麦、薏米、藜麦、糙米、黄小米、大麦、青稞、苦荞、黑麦为原料,小麦作为对照,通过测定、比较10种多糖的抗氧化活性、抑制结肠癌细胞HCT116活性以及对益生菌生长的影响,综合评价,筛选出活性强的多糖。以多糖为切入点,揭示其在杂粮中的功能作用,明确不同杂粮多糖的功效差异,为杂粮功能性产品的开发和杂粮多糖的合理利用提供理论依据,奠定基础。
1 材料与方法
1.1 材料与仪器
小麦、燕麦、薏米、藜麦 赣州康瑞农产品有限公司;糙米、黄小米、大麦 福建盛耳食品有限公司;青稞 沈阳信昌粮食贸易有限公司;苦荞 云南健爽科技有限公司;黑麦 涞水县金谷粮油食品有限公司;耐高温α-淀粉酶(活性5万U/g)、高转化率糖化酶(活性10万U/g) 河南万邦化工科技有限公司;中性蛋白酶(活性10万U/g) 南宁东恒华道生物科技有限公司;长双歧杆菌(ATCC 15707)、短双歧杆菌(ATCC 15700)、青春双歧杆菌(ATCC 15703)、鼠李糖乳杆菌(ATCC 53103) 明州生物科技有限公司(中国宁波);MRS培养基(不含葡萄糖) 山东拓普生物工程有限公司;TPY液体培养基 青岛高科技工业园海博生物技术有限公司;HCT116细胞 中国科学院细胞库;RPMI1640改性培养基、胎牛血清(FBS,Fetal bovine serum) Gibco公司;NaOH(片状)、盐酸、无水葡萄糖、硫酸、苯酚、L(+)-抗坏血酸(VC)、硫酸亚铁、水杨酸 分析纯,成都市科隆化学品有限公司;30% H2O2分析纯,成都市科龙化工试剂厂;Trolox标准品(水溶性VE)、ABTS标准品、过硫酸钾 上海麦克林生化科技有限公司;DPPH标准品 上海源叶生物科技有限公司。
FE28型pH计 梅特勒-托利多国际贸易(上海)有限公司;XMTD-7000恒温水浴锅 北京市永光明医疗仪器有限公司;FD-2型真空冷冻干燥机北京博医康实验仪器有限公司;Synergy HTX多功能微孔板检测仪酶标仪 美国伯腾仪器有限公司;UPH-1-10T型超纯水制造系统 四川优普超纯科技有限公司;LDZX-50KB型高压蒸汽灭菌锅 上海中安医疗机构厂;DHP-9160B生化培养箱 上海琅玕实验设备有限公司;JJ-CJ-IFD超净工作台 苏州市金净净化设备科技有限公司。
1.2 实验方法
1.2.1 多糖的提取、分离 参考曾海龙[14]、王希[15]等的方法,略作修改。称取100 g灭酶原料(原料米85 ℃烘1 h灭内源酶活,备用),采用热水提取法,料液比为1:20(g/mL),在100 ℃浸提2 h,过滤取上清液。调节溶液至pH5.5,在溶液中加入0.5 g耐高温α-淀粉酶,93 ℃水浴30 min;加入1 g高转化率糖化酶,60 ℃水浴处理30 min。在水浴温度55 ℃下,再加入2 g中性蛋白酶,反应30 min,再加热至100 ℃灭酶10 min,收集酶解液。酶解液以1 mol/L NaOH液调至pH8.0,添加30% H2O2至浅黄色,于50 ℃下水浴加热2 h。浓缩液体到原体积的1/4,向多糖溶液中逐渐加入4倍体积的无水乙醇,使体系中乙醇最终体积达到80%,4 ℃静置24 h,离心取沉淀,冷冻干燥得粗多糖样品。
1.2.2 多糖含量的测定 参考杨雅蛟等[16]的方法,略作修改。取干燥后的多糖样品用蒸馏水配制成浓度0.2 mg/mL的多糖溶液,备用。以无水葡萄糖为对照品(回归方程为y=5.6483x+0.0094,R2=0.9993),采用苯酚-硫酸法测定多糖含量。取1 mL多糖溶液,加入质量分数为5%的苯酚溶液1.0 mL,混合均匀后迅速加入浓硫酸5.0 mL,置于40 ℃水浴条件下反应30 min,将反应得到的溶液在波长490 nm处测吸光值。
1.2.3 体外抗氧化活性测定
1.2.3.1 DPPH自由基清除率的测定 取干燥后的多糖样品用蒸馏水配制成浓度5 mg/mL的多糖溶液。取2 mL 5 mg/mL多糖溶液,加入2 mL DPPH溶液,混匀暗反应30 min,在波长为517 nm处测定吸光度A1;取2 mL 5 mg/mL多糖溶液与2 mL无水乙醇溶液反应测定吸光度A2;2 mL无水乙醇溶液与2 mL DPPH溶液反应测定吸光度A0[17-18]。按下式计算样品的DPPH自由基清除率。以Trolox标准品为对照品,试验结果以每1 g干重(DW)样品中等量Trolox(μmol)表示:μmol Trolox/g DW。
DPPH自由基清除率(%)=[A0-(A1-A2)]/A0×100
1.2.3.2 ABTS自由基清除率的测定 参考李巨秀等[19]的方法,略作修改。取干燥后的多糖样品用蒸馏水配制成浓度3 mg/mL的多糖溶液。取1 mL 3 mg/mL多糖溶液,加入4 mL ABTS溶液,混匀暗反应10 min,在波长为734 nm处测定吸光度A1;取1 mL 3 mg/mL多糖溶液与4 mL无水乙醇溶液反应测定吸光度A2;1 mL蒸馏水与4 mL ABTS溶液反应测定吸光度A0。按下式计算样品的ABTS自由基清除率。以Trolox标准品为对照品,试验结果以每1 g干重(DW)样品中等量Trolox(μmol)表示:μmol Trolox/g DW。
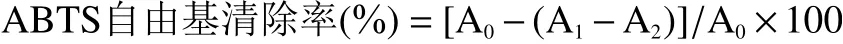
1.2.3.3 羟自由基(·OH)清除率的测定 取干燥后的多糖样品用蒸馏水配制成浓度3 mg/mL的多糖溶液。取2 mL H2O2(9 mmol/L)、FeSO4(9 mmol/L)、多糖溶液(3 mg/mL)混匀静置10 min,加入2 mL水杨酸(9 mmol/L),混匀反应30 min,在波长为510 nm处测定吸光度A1;2 mL多糖溶液(3 mg/mL)与6 mL蒸馏水反应测定吸光度A2;蒸馏水代替多糖溶液测得对应吸光度A0[20]。按下式计算样品的羟自由基清除率。以VC为对照品,试验结果以每1 g干重(DW)样品中等量VC(μmol)表示:μmol VC/g DW。
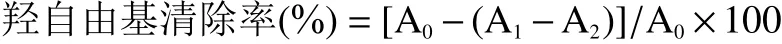
1.2.4 对益生菌生长的影响
1.2.4.1 培养基及培养条件 鼠李糖乳杆菌:MRS培养基,37 ℃恒温培养过夜。
长双歧杆菌、短双歧杆菌、青春双歧杆菌:TPY培养基,37 ℃恒温厌氧培养过夜。
1.2.4.2 生长曲线的测定 选择长双歧杆菌、短双歧杆菌、青春双歧杆菌和鼠李糖乳杆菌,活化后(OD600nm=0.5)以2%(v/v)的比例接种于不添加碳水化合物的液体培养基中,混匀后吸取180 μL于无菌96孔板中,加入20 μL多糖溶液(1%、10%)共培养,每个孔中多糖的最终浓度为0.1%、1%(w/v),每孔200 μL,每组分别设置6个平行,置于37 ℃恒温培养,每隔4 h检测发酵液的OD600nm值,根据前期预实验,选择连续测定40 h,最后以时间为横坐标,OD600nm为纵坐标,绘制微生物生长曲线,以无碳水化合物培养基为空白对照,以添加菊糖为唯一碳源的培养基为阳性对照[21-22]。
1.2.5 体外抑制结肠癌细胞HCT116的活性测定采用MTT法测定杂粮多糖对HCT116细胞增殖抑制作用。取对数生长期HCT116细胞,种板到96孔培养板中,每孔100 μL,置于CO2培养箱中培养过夜。吸弃培养基,加入含不同浓度多糖的培养基100 μL/孔,每个浓度设计5个复孔,将96孔板置于CO2培养箱中培养48和72 h[23-25]。对照组(阴性对照)只加细胞和新鲜培养基,空白组不加细胞只加培养液。按下式计算样品的细胞抑制率。
细胞抑制率(%)=[(对照组细胞OD值-实验组细胞OD值)/(对照组细胞OD值-空白组OD值)]×100
1.3 数据处理
所有实验至少重复三次,采用Excel 2010软件分析整理数据,数据采用平均值±标准差表示。采用SPSS 23.0统计软件对数据进行统计和分析,P<0.05表示差异显著;采用Origin 2018软件作图。
2 结果与分析
2.1 不同杂粮粗多糖的多糖含量
不同杂粮粗多糖的多糖含量如图1所示,小麦、黑麦、青稞、黄小米、糙米、薏米、燕麦、大麦、藜麦、苦荞中的多糖含量分别为37.11%、10.61%、56.74%、40.24%、45.97%、49.89%、45.61%、57.59%、42.83%、36.11%。多糖含量最高的为大麦粗多糖(57.59%),与之前王希[26]报道水提法提取的大麦多糖中多糖含量为64.29%相接近,本研究中过氧化氢脱色步骤可能导致部分多糖的损失[14];多糖含量最低的为黑麦粗多糖(10.61%)。
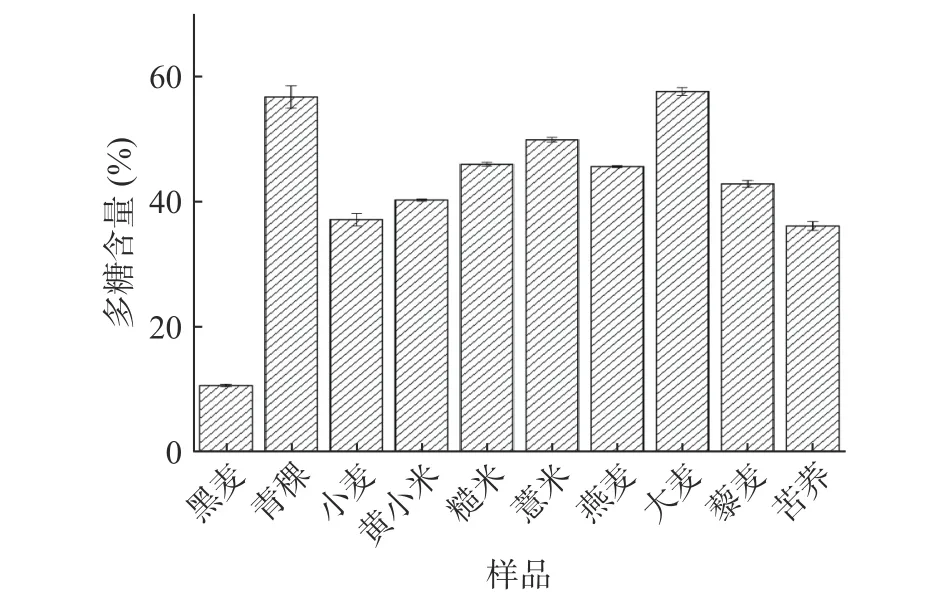
图 1 不同杂粮粗多糖的多糖含量Fig.1 Polysaccharide content of crude polysaccharide in different coarse cereals
2.2 体外抗氧化活性分析
2.2.1 DPPH自由基清除能力 DPPH·(1,1-二苯基-2-三硝基苯肼)是一种稳定的自由基,呈紫色,其最大吸收波长为517 nm,被广泛用于评价自由基清除活性[27-28]。如图2所示,不同多糖对DPPH自由基清除能力具有显著性差异(P<0.05)。10种杂粮多糖中,苦荞多糖的DPPH自由基清除能力显著高于小麦多糖,达12.76 μmol Trolox/g DW;而黄小米、薏米、燕麦等5种杂粮多糖均显著低于小麦多糖(P<0.05),其中DPPH自由基清除能力最弱的是黄小米多糖。在结构研究方面,王帅等[29]利用最小偏二乘分析初步分析纯化后6种多糖的结构、性质对其体外抗氧化活性的影响,提出单糖的组成(葡萄糖醛酸、半乳糖和葡萄糖)和分子量能对多糖抗氧化活性起到影响。已有报道中,苦荞多糖主要由葡萄糖、半乳糖组成[30],小米多糖则由鼠李糖、阿拉伯糖、木糖、葡萄糖、半乳糖组成[31]。因此,苦荞多糖和黄小米多糖清除DPPH自由基能力的差异可能是由于其单糖组成不同。除去单独存在的多糖,多糖还可通过与蛋白质、多肽以及酚类化合物的结合向缺乏电子的自由基提供质子从而增强其抗氧化能[32]。故苦荞多糖组清除能力强可能与多糖和酚类化合物的结合有关[33-34]。
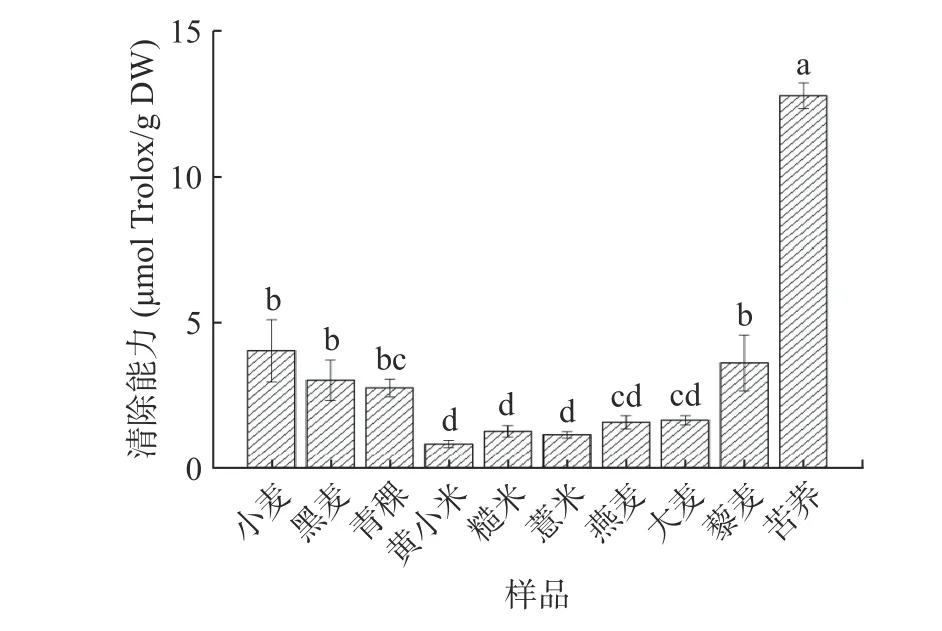
图 2 不同杂粮多糖的DPPH自由基清除能力Fig.2 DPPH radical scavenging ability of different coarse cereal polysaccharides
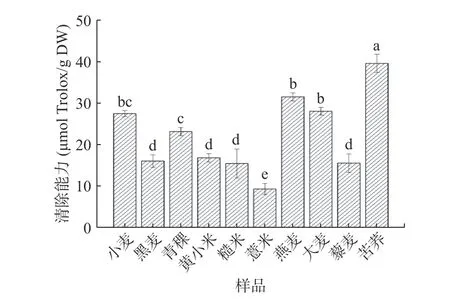
图 3 不同杂粮多糖的ABTS自由基清除能力Fig.3 ABTS radical scavenging ability of different coarse cereal polysaccharides
2.2.2 ABTS自由基清除能力 在反应体系中,ABTS自由基与抗氧化物质结合使体系褪色,通过测定最大吸收波长734 nm下吸光度的变化评价物质的抗氧化能力[35]。不同杂粮多糖的ABTS自由基清除能力如图3所示。在ABTS自由基清除能力上,不同多糖间具有显著性差异(P<0.05)。10种多糖中苦荞多糖显著高于小麦多糖(P<0.05),达39.56 μmol Trolox/g DW,而黑麦、黄小米、糙米、薏米和藜麦多糖均显著低于小麦多糖(P<0.05)。与DPPH自由基清除能力结果不同,ABTS自由基清除活性最弱的是薏米多糖(9.33 μmol Trolox/g DW)。复杂易变的分子结构和物理性质是造成多糖生物活性多变的重要原因。其中,单糖的组成和摩尔比是影响多糖的抗氧化活性的因素之一。孙元彬等[36]对纯化得到的苦荞多糖进行单糖组成分析,发现其只含有葡萄糖和少量的木糖。庄玮婧[37]发现水提法得到的薏米多糖由L-鼠李糖、L-阿拉伯糖、D-葡萄糖、D-半乳糖、D-木糖、D-甘露糖六种单糖组成。因此,葡萄糖含量高可能是苦荞多糖ABTS自由基清除能力强的原因。从杏鲍菇菇头[38]中提取的主要由葡萄糖组成(占84.4%)的多糖对ABTS自由基具有较强的淬灭作用也印证了多糖的单糖组成与抗氧化活性具有相关性这一观点。同时与DPPH自由基清除能力结果不同,在ABTS反应体系中,10种多糖清除率明显增大,这可能与ABTS的亲水亲脂特性及较大空间位阻有关[39]。
2.2.3 羟自由基(·OH)清除能力 羟自由基是活性氧中最具活力的,具有很强的电子氧化能力,是最有毒害的自由基,可对相邻的生物分子造成损害[40-41],加快生物体衰老,诱发疾病[42]。因此,清除羟自由基是体现多糖抗氧化作用的重要指标之一。不同杂粮多糖的羟自由基清除能力如图4所示。不同杂粮粗多糖间羟自由基清除能力有显著差异(P<0.05)。10种多糖中,苦荞多糖的羟自由基清除能力显著高于小麦多糖(P<0.05),达1615.32 μmol VC/g DW,而与DPPH、ABTS自由基清除能力结果不同,仅燕麦多糖活性低于小麦多糖。苦荞多糖比燕麦多糖表现出更高的羟自由基清除能力,这可能是由于其糖醛酸含量较高,糖醛酸含量的增加能增进多糖的还原能力并减少羟自由基的产生[43]。据报道,苦荞可溶性膳食纤维中含有糖醛酸26.10%[44],燕麦多糖含糖醛酸5.9%[45]。研究表明,糖醛酸含量较高(33.27%±0.10%)的硫酸化凉草粉多糖自由基清除效果更佳[46],这与之前Zhang等[47]的推测相似。同时,比较裙带菜中不同分子质量岩藻多糖的抗氧化性发现,低分子质量(分子质量小于1×104u)岩藻多糖对羟自由基清除能力更佳[48]。但鉴于本研究中未进行多糖分子量测定,仍需进一步验证。此外,苦荞中富含黄酮类物质,李宁等[49]发现通过优化联合提取工艺即水提醇沉法可以提高苦荞籽中的黄酮和多糖的提取率。之前的研究证明,苦荞黄酮粗提物具有清除羟自由基的能力,可随着对黄酮粗提物的精制,清除羟自由基的效果有所下降[50],故苦荞多糖表现出具有较强的抗氧化作用可能与黄酮的协同作用有关。
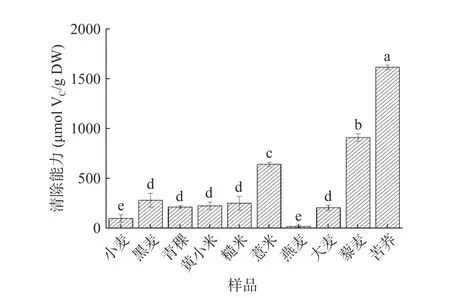
图 4 不同杂粮多糖的羟自由基清除能力Fig.4 Hydroxyl radical scavenging ability of different coarse cereal polysaccharides
本研究通过三种方法对不同杂粮多糖的抗氧化活性进行测定。总体而言,苦荞多糖表现出了良好的抗氧化能力。而不同多糖在DPPH、ABTS和羟自由基清除效果具有一定的差异。特别是小麦对照在清除DPPH、ABTS自由基上表现出优于部分杂粮多糖,但对羟自由基清除能力较弱。阿拉伯木聚糖,也称为戊聚糖,作为一种非淀粉多糖广泛存在于谷物中,特别在小麦籽粒中尤为丰富[51]。因其分子结构中具有一定的阿魏酸基团,阿拉伯木聚糖具有抗氧化活性[52]。在之前的报道中,具有较高的分子量和酯化阿魏酸的阿拉伯木聚糖被认为是较好的抗氧化剂[52-53]。Chen等[53]发现低取代度有益于阿拉伯木聚糖表现出更强的羟自由基清除活性,与之相反,阿拉伯木聚糖的DPPH自由基清除活性随取代度的增加而提高,因为取代度越高的阿拉伯木聚糖更易分散到反应混合物中参与氧化还原反应。因此,对照小麦中阿拉伯木聚糖取代度较高可能是清除DPPH、ABTS自由基能力较佳,对羟自由基清除能力较弱的原因之一。
2.3 对益生菌生长的影响
本研究采用体外单菌培养方法对不同杂粮多糖的益生活性进行分析。不同杂粮多糖对益生菌的增殖具有菌株特异性(图5)。在多糖浓度为0.1%时,除黑麦、青稞多糖外,其余8种多糖均能作为唯一碳源被长双歧杆菌利用(图5a);除黑麦、薏米多糖外,短双歧杆菌能利用其余8种多糖生长增殖(图5b);10种多糖对青春双歧杆菌的促生长作用不明显,均低于菊糖(图5c);而鼠李糖乳杆菌则能利用10种多糖作为唯一碳源生长增殖(图5d)。在多糖浓度为1%时,长双歧杆菌不能利用10种多糖,培养40 h后发酵液OD600nm与阴性对照无糖培养基相近(图5e),这可能与多糖的浓度具有一定关系,多糖浓度过高可能导致培养基渗透压增加,从而导致菌体脱水,影响益生菌生长[54-55];黄小米和大麦多糖对短双歧杆菌的益生活性高于菊糖,燕麦多糖与菊糖对短双歧杆菌的益生活性相近(图5f);黄小米和大麦多糖对青春双歧杆菌的益生活性高于菊糖,燕麦多糖与菊糖对青春双歧杆菌的益生活性相近(图5g);鼠李糖乳杆菌能利用黄小米、燕麦、糙米和大麦多糖作为唯一碳源生长增殖(图5h)。本研究结果显示,浓度为1%时,黄小米、大麦、燕麦多糖能够更易被短双歧杆菌、青春双歧杆菌和鼠李糖乳杆菌选择利用,对照小麦多糖则表现出抑制4种益生菌增长的趋势,同时不同杂粮多糖对益生菌的增殖作用不全是随着浓度增加而增强。据刘丽莎等[56]报道,高浓度(添加量大于2.0%)的白术多糖可能引起渗透压、pH改变及代谢物的积累等限制了双歧杆菌的生长。同样,张桂兰等[57]也发现褐藻硫酸多糖浓度为2.0%~2.5%时对双歧杆菌增殖作用最好;浓度大于5%时,双歧杆菌数量无明显增加。而来源不同的多糖对不同的益生菌作用不同,这也可能与其高度复杂的结构、物理特性密切相关[58],例如,水溶性高和黏度低的多糖被认为可以更快、更易被益生菌利用[59],因此还有待进一步研究证实。
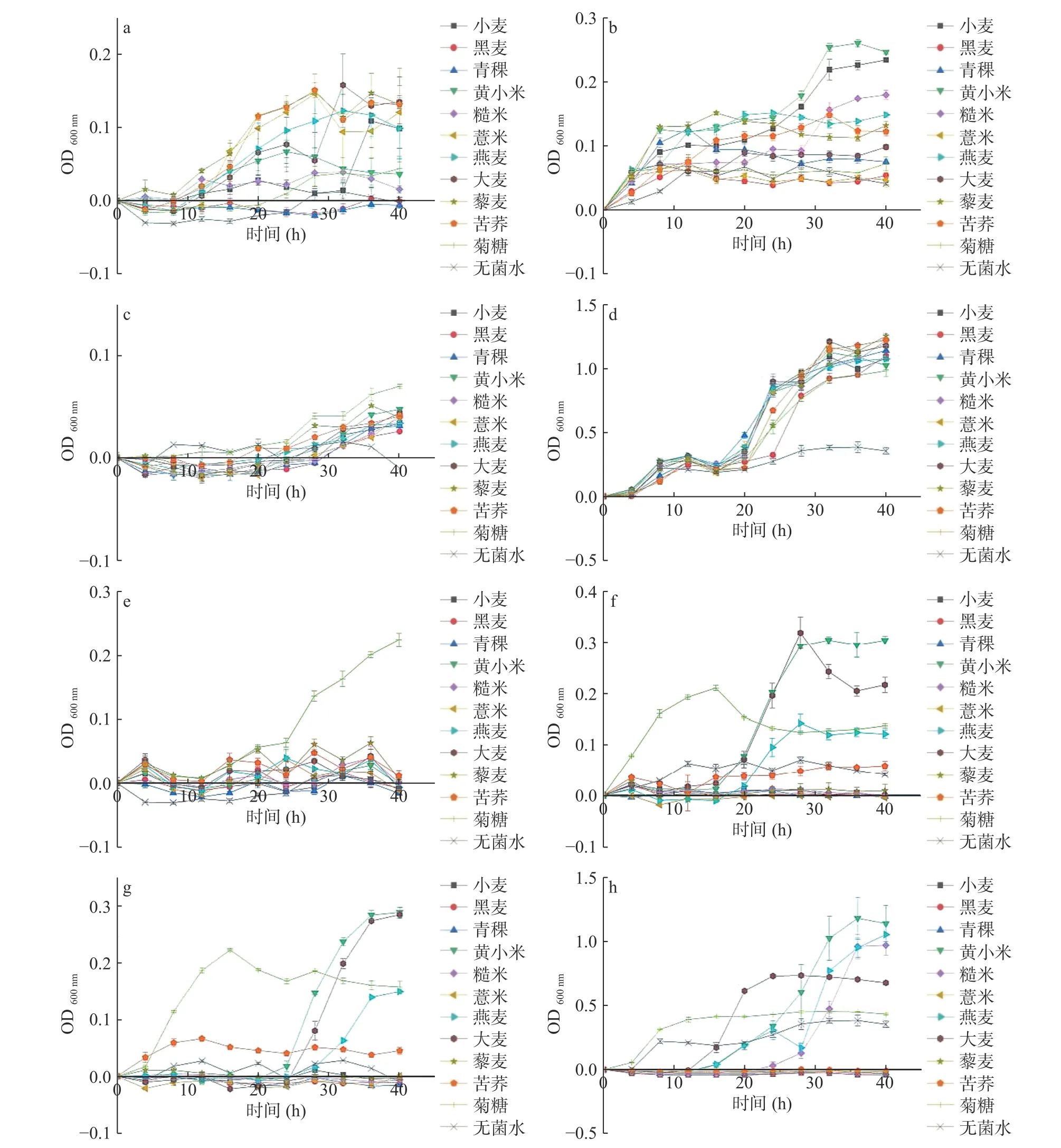
图 5 不同杂粮多糖对益生菌生长的影响Fig.5 The effects of polysaccharides from different coarse cereals on the growth of probiotics
2.4 体外抑制结肠癌细胞HCT116的活性测定
对10种多糖进行体外MTT增殖抑制试验初筛抗肿瘤活性,其中小麦、黄小米、糙米、薏米和大麦多糖对HCT116细胞有一定抑制作用,其余5种多糖对HCT116细胞没有明显抑制作用。根据预实验结果,选取5个浓度梯度,48、72 h两个时间梯度,对具有抑制作用的5种多糖进行MTT试验,如图6、图7所示,利用SPSS软件分析计算得出其对 HCT116细胞的半数致死浓度 IC50,不同多糖之间 IC50具有显著差异(P<0.05),如图8所示。随着对 HCT116细胞作用时间的延长,5种多糖抑制率也相应提高,表现出时间依赖关系。
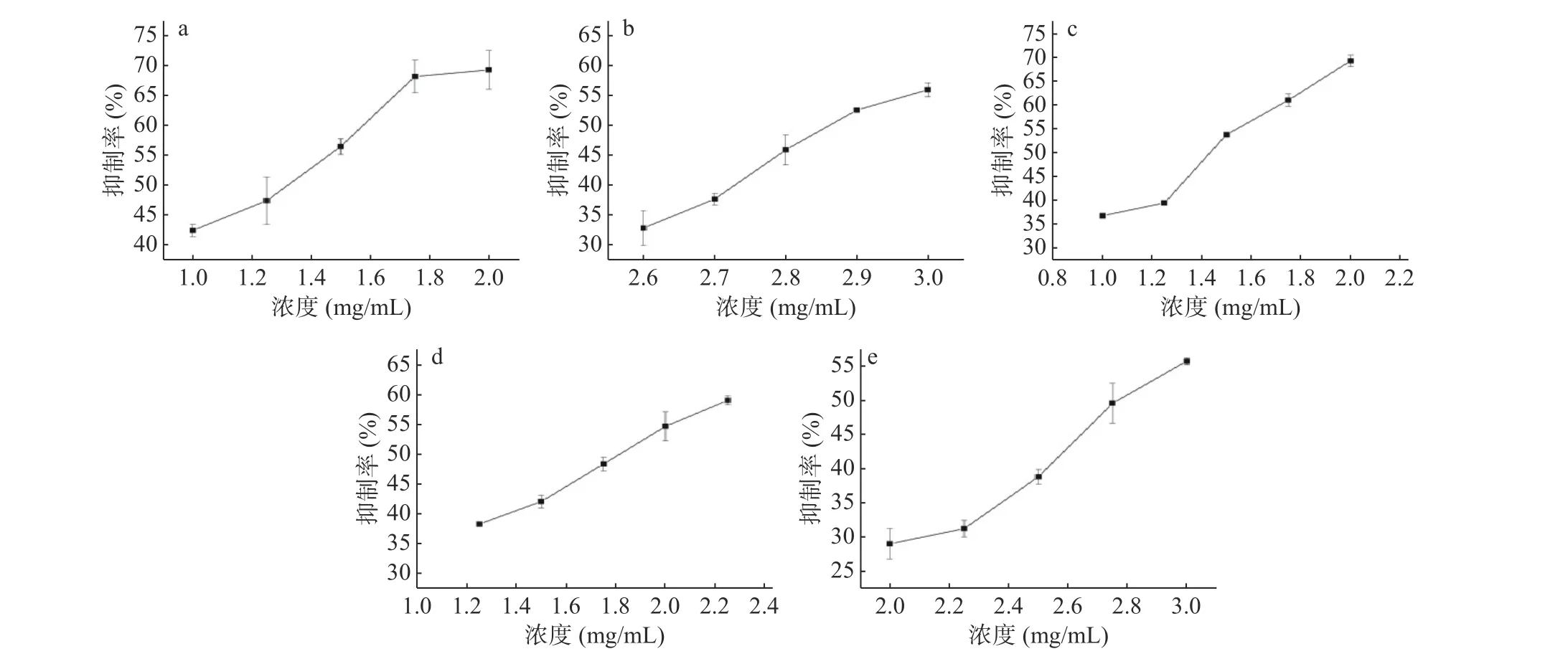
图 6 48 h下不同浓度小麦(a)、黄小米(b)、糙米(c)、薏米(d)、大麦(e)多糖对HCT116细胞的抑制活性Fig.6 Inhibitory activity of different concentrations of wheat (a), yellow millet (b), brown rice (c), adlay (d) and barley (e)polysaccharides on HCT116 cells at 48 h
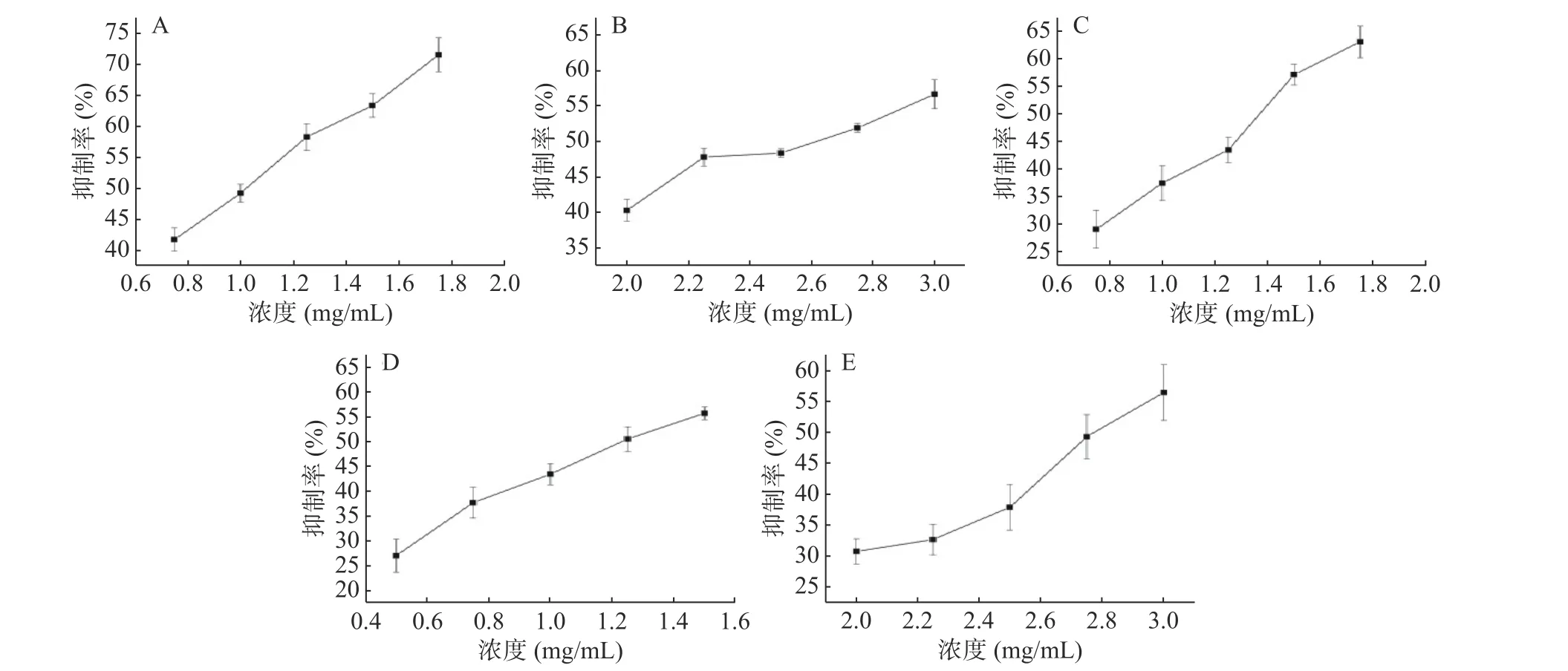
图 7 72 h下不同浓度小麦(A)、黄小米(B)、糙米(C)、薏米(D)、大麦(E)多糖对HCT116细胞的抑制活性Fig.7 Inhibitory activity of different concentrations of wheat (A), yellow millet (B), brown rice (C), adlay (D) and barley (E)polysaccharides on HCT116 cells at 72 h
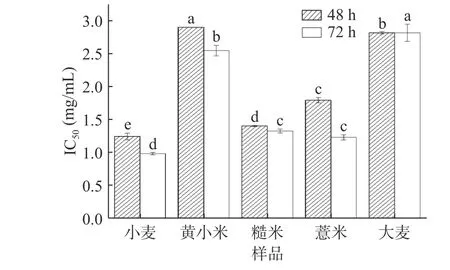
图 8 HCT116细胞上不同杂粮多糖的IC50值Fig.8 IC50 values of polysaccharides from different coarse cereals on the HCT116 cells
在48 h,小麦、黄小米、糙米、薏米和大麦多糖的IC50值分别为1.24、2.90、1.40、1.79、2.82 mg/mL。对比 IC50值大小说明 48 h 下不同多糖抑制 HCT116细胞增殖的活性强弱:小麦>糙米>薏米>大麦>黄小米。在72 h,小麦、黄小米、糙米、薏米和大麦多糖的IC50值分别为0.98、2.55、1.33、1.23、2.82 mg/mL。对比 IC50值大小说明 72 h 下不同多糖抑制 HCT116细胞增殖的活性强弱:小麦>薏米>糙米>黄小米>大麦。李彩娇[8]曾证明大麦多糖对HT 29结肠癌细胞有抑制作用,且通过线粒体凋亡途径诱导细胞凋亡,这与本研究中大麦多糖抑制HCT116细胞活性的途径是否一致,可以作进一步研究。令人意外的是,48、72 h下5种多糖中对照小麦多糖抗结肠癌细胞活性最强。之前的报道中,Murtazina等[60]已证实通过培养小麦细胞提取获得小麦细胞培养多糖(wheat cell culture polysaccharides,WCCPSs)具有抗HCT 116结肠癌细胞能力并提出从WCCPSs的单糖组成比例来看,葡萄糖的含量和葡萄糖:阿拉伯糖:甘露糖的比例可能是决定抗癌活性的主要因素。但小麦多糖具体如何表现出较高的抑制HCT 116细胞活性的原因和构效关系,有必要进一步深入探究。综上,明确多糖结构与抗结肠癌细胞活性的构效关系以及多糖抑制结肠癌细胞增殖机制仍是需要广大研究者们投入研究的关键。
3 结论
本研究以9种杂粮多糖为研究对象,小麦多糖为对照,对比了十种多糖的抗氧化活性、体外抑制结肠癌细胞HCT116的活性和对益生菌生长的影响。结果表明,不同杂粮多糖在三种体外活性上存在显著性差异。十种多糖对DPPH、ABTS和羟自由基均具有清除能力。其中,苦荞多糖对三种自由基的清除能力最强。在对益生菌生长的影响上,1%浓度的黄小米、大麦、燕麦多糖能够更易被短双歧杆菌、青春双歧杆菌和鼠李糖乳杆菌选择利用。在48 h下多糖抑制HCT116细胞增殖的活性强弱:小麦>糙米>薏米>大麦>黄小米,在72 h下多糖抑制HCT116细胞增殖的活性强弱:小麦>薏米>糙米>黄小米>大麦。本研究通过测定比较不同杂粮多糖的三种体外活性,明确不同杂粮多糖在体外活性上的差异,为杂粮多糖的开发提供理论依据,为其在食品、生物等不同领域的精准利用提供思路。
本研究仅对9种谷类杂粮进行了研究,然而杂粮种类丰富,品系庞杂,如何综合评价不同种类杂粮多糖生理活性将是一重大挑战。此外,本研究采用热水浸提法提取不同杂粮中的多糖,而热水浸提得到的大多是分子量较小的中性多糖[61],如采用酸提法、碱提法、酶解法等不同方法提取,得到的多糖结构不同,其在体外活性上的强弱可能会随结构的改变而产生变化。本文未对各种杂粮多糖进一步的纯化和鉴定,存在一定局限,但也为不同杂粮的活性差异提供重要参考。未来,可对活性较强的杂粮多糖进一步分离纯化,探讨其活性机制。
