低GI杂粮可可冲调粉辅助降血糖作用
2023-01-03那治国贺书珍
那治国,余 爽,贺书珍,初 众,
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150028;
2.黑龙江东方学院食品工程学院,黑龙江哈尔滨 150066;
3.中国热带农业科学院香料饮料研究所,海南万宁 571533)
糖尿病是一种慢性代谢病,一般是由于机体的生物学功能受损或胰岛素分泌不足造成的,具有高血糖的特点[1]。糖尿病患者长期处于高血糖的状态下,会造成眼、肾、心脏等多种器官受损。因此,糖尿病是一种备受关注的公共卫生问题,同时也是全球公认的四大非传染性疾病之一[2]。近年来,糖尿病的发病率逐年上升,目前,除药物治疗外,科学合理的饮食和调养已成为控制糖尿病的重要辅助手段[3-5]。
越来越多的研究发现,杂粮比其他食物具有更好的改善糖尿病的作用,这与杂粮自身的营养物质密切相关[6-7],如荞麦内含有荞麦碱、黄酮类、皂苷类等,有调节血糖的功效;燕麦含有多糖类和多肽类物质,对降低肠道对糖的吸收效率、提高胰岛素敏感性及改善胰岛素抵抗有重要影响[8-10]。芸豆类中含有皂苷、尿毒酶和多种球蛋白,它们对人体产生的肿瘤细胞起到减缓且抑制作用,而且抗性淀粉含量高,营养素齐全,可以降低人体血糖上升的趋势[11-12]。
未发酵可可豆中含有大量多酚物质,可可豆中大约60%的总多酚是单体黄烷醇(表儿茶素和儿茶素)和低聚体原花青素(二聚体和癸聚体),可可多酚通过抑制α-淀粉酶、α-葡萄糖苷酶活性,从而发挥降血糖作用[13-14]。将其与杂粮复配,可用于控制人体血糖。与合成的抗糖尿病药物相比,杂粮可可冲调粉能丰富低GI食品的种类,具有成本低、绿色、安全无副作用的优势,能满足糖尿病人群在快节奏生活方式下对健康、美味食品的追求。本实验室前期将可可豆与杂粮混合制得杂粮可可冲调粉,复配方案为可可:豌豆:红芸豆:白芸豆:燕麦:荞麦:大麦仁质量配比为8:6:11:45:5:15:10。本研究拟在动物水平对该复配方案进行验证,为功能性食品的开发提供理论依据与实践指导。
1 材料与方法
1.1 材料与仪器
可可豆 中国热带农科院香料饮料研究所提供,产地为海南省万宁市兴隆镇兴隆热带植物园;豌豆、白芸豆、红芸豆、燕麦、荞麦、大麦仁 哈尔滨市平房区中洋超市,产地为黑龙江省绥化市北林区。将可可豆及杂粮水煮40 min,经胶体磨均质机磨浆,喷雾干燥制成低GI杂粮可可冲调粉(C-MGP),实验前期通过氨基酸评分以及蛋白质体外消化等实验设计了9个基础配方,并以氨基酸评分、GI值、冲调性和模糊感官评价确定了最终配方进行动物实验,其配方为可可:豌豆:红芸豆:白芸豆:燕麦:荞麦:大麦仁质量配比为 8:6:11:45:5:15:10;52 只 SPF 级 C57BL/6雄性小鼠 8~12周龄;体重20±2 g,于SPF级环境下饲养,室内温度23±2 ℃,自由饮食和摄水,实验前适应性喂养7 d,提供方为常州卡文斯实验动物有限公司,动物证书编号:SCXK(苏)2016-0010;基础饲料、高糖高脂饲料 购于上海启发实验试剂有限公司;甘油三酯试剂盒(A110)、总胆固醇测定试剂盒(A111)、高密度脂蛋白胆固醇测定试剂盒(A112)、低密度脂蛋白胆固醇测定试剂盒(A113)、游离脂肪酸检测试剂盒 南京建成生物工程公司;二甲双胍
中国上海蓝木化工有限公司;小鼠胰岛素ELISA试剂盒 德国赛默飞世尔科技有限公司;小鼠 GLP-1 ELISA 试剂盒 美国明尼苏达州安诺论生物公司;Glycogen Colorimetric Assay Kit Abcam公司;脂多糖试剂盒(CSB-E13066m) 武汉华美生物工程有限公司;小鼠糖化血红蛋白ELISA试剂盒 上海西唐生物科技有限公司,
FORMA 700超低温冰箱 Thermo公司;Direct-Q with pump超纯水仪 Millipore公司;3K15低温高速离心机 Sigma公司;GZX-9140MBE鼓风干燥箱
上海博迅实业有限公司医疗设备厂;YXQ-LS-50SⅡ立式压力蒸汽灭菌器 北京众实迪创科技发展有限责任公司;ZS-MV-IV型小动物麻醉机 北京众实迪创科技发展有限责任公司;LB941微孔板式多功能酶标仪 Berthold公司;罗氏智航血糖仪 罗氏公司;JTM-L80胶体磨 张祥胶体磨厂;SD-1000型喷雾干燥机 日本东京理化仪器制造有限公司。
1.2 实验方法
1.2.1 动物造模 将C-MGP添加到高糖高脂饲料中进行干预,通过查阅文献,换算杂粮辅助降血糖有效剂量约为小鼠饲料添加量的10%(质量分数)[10,15],因此确定低、中、高剂量组C-MGP添加量分别为5%(质量分数)、10%(质量分数)、30%(质量分数)。SPF级C57BL/6雄性小鼠适应性饲养7 d后,将其随机分为正常组(12只)和模型组(40只)。正常组饲喂基础饲料,模型组饲喂高糖高脂饲料。4周后,模型组给予一次性注射STZ(30 mg/kg),72 h后测定模型组小鼠有无出现毛发无光泽、精神状况萎靡等情况,出现上述状态之后所有小鼠禁食不禁水12 h后,使用血糖仪进行尾部采血测定血糖值,当出现“三多一少”症状,并且空腹血糖值≥16.8 mmol/L即为造模成功[15-17]。
1.2.2 实验动物分组及饲养 将造模成功的Ⅱ型糖尿病小鼠按照体重随机分为5组,即模型组(Model)、二甲双胍组(Metformin)、5% C-MGP组、10% CMGP组、30% C-MGP组,每组8只小鼠[18-19]。正常对照组(Control):正常对照小鼠,基础饲料喂养,连续4周(n=12);模型组:造模成功的小鼠,高糖高脂饲料喂养,连续4周(n=8);二甲双胍组:造模成功的小鼠,高脂饲料喂养,二甲双胍(200 mg/kg)灌胃,一日一次,连续4周(n=8),其余各组灌喂等量蒸馏水;5% C-MGP组、10% C-MGP组、30% C-MGP组:造模成功的小鼠,高糖高脂饲料分别含5%、10%和30% C-MGP饲喂,连续4周(n=8)。
1.2.3 指标测定
1.2.3.1 小鼠一般状况、摄食饮水量及体重观测 实验过程中,对小鼠精神状态、毛色、釆食、饮水及体重等情况进行观察、测量并记录。从造模开始定期监测小鼠体重,分组时称重1次,前4周(造模期间)每周称重1次,后4周每两周称重1次,第8周的体重为最终重量;在造模结束后的饲养实验期间,每日定时记录小鼠的饮食和饮水量;每日提供定量的饲料(15 g)喂养小鼠,对饲料的消耗进行记录[20-23]。
在造模结束后的饲养实验期间,定期检测小鼠体重、采食量、饮水量。
1.2.3.2 空腹血糖水平(FBG)检测 在实验过程中,每周对每一组小鼠进行FBG测定,隔夜禁食禁水12 h,然后用剪刀剪去小鼠尾部1~2 mm的尾端,然后轻轻按压尾巴,使血液富集成一滴,测定血糖值,对比各组小鼠的血糖值及血糖下降水平。血糖下降水平按公式(1)计算。
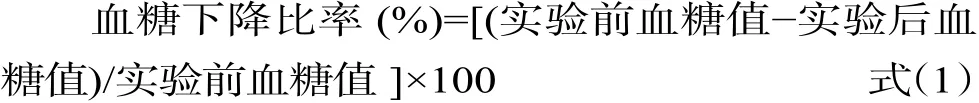
1.2.3.3 葡萄糖耐受实验 在实验进行到最后3 d时,进行葡萄糖糖耐受试验(OGTT),在实验的前一天晚上8点时,将小鼠换入清洁的笼子里禁食,禁食12 h,直到第二天早晨,禁食期间,小鼠进行正常的饮水。在进行葡萄糖耐受性实验前,先称量每只小鼠的体重,然后用记号笔在小鼠尾部标记序号。把小鼠从笼子中取出,轻轻地放在铁丝网格子上,用剪刀将小鼠的尾部剪掉1 mm,轻轻地按压小鼠尾部,用血糖仪测量其FBG,测量结果计为0 min的血糖值。在小鼠进行30 min的适应后,开始准备葡萄糖进行腹腔注射。将小鼠轻轻抓起,灌胃给予1.5 g/(kg·bw)葡萄糖。从灌胃完毕起开始计时。在0.5 h和2.0 h测定每只小鼠的血糖值,比较各组小鼠给予葡萄糖后各时间点血糖曲线下面积(AUC)的变化[24]。AUC按公式(2)计算。

1.2.3.4 小鼠血液及脏器指数测定 实验最后一周小鼠末次饲喂后,对每只小鼠隔夜禁食禁水12 h,称重、测血糖后,将小鼠麻醉,进行心脏取血,于4 ℃、3000 r/min条件下离心5 min,将分离的上层血清放入-80 ℃低温冰箱中保存。采用二氧化碳法将所有小鼠处死,切开腹部取出脏器(心脏、肝脏、脾脏、肾脏)和腹部脂肪,仔细剔除无关组织,PBS洗涤去除残留血液和污染物,冲洗干净后称重。脂肪质量以称重质量计,各脏器指数按公式(3)计算[25-28]。

1.2.3.5 生化指标测定 血清中甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、糖化血红蛋白(GHb)、游离脂肪酸(FFFA)、空腹胰岛素水平(FINS)和胰岛素抵抗指数(HOMA-IR)、胰高血糖素样肽-1(GLP-1)、脂多糖(LPS)、肝糖原(HG)等含量的测定均根据试剂盒说明书操作。
1.3 数据处理
数据采用Graphpad Prism 5 (Version 5.01)进行分析与作图,所有数据均以means±SD表示,组间统计学差异采用one-way ANOVA和Tukey’s检验,P值小于0.05认为有显著性差异,P值小于0.01认为有极显著性差异。
2 结果与分析
2.1 C-MGP对STZ诱导糖尿病小鼠摄食饮水量及体重的影响
C-MGP对STZ诱导糖尿病小鼠摄食、饮水量及体重的影响如图1所示,与正常对照组相比,模型组小鼠摄食量和饮水量均极显著上升(P<0.01),这符合糖尿病小鼠多饮多食多尿的代谢特征,造模成功。小鼠体重的变化可以反映其生长发育及健康状况,在实验期间,与正常对照组相比,模型组小鼠体重极显著下降(P<0.01)。与模型组相比,二甲双胍组、10%C-MGP和30% C-MGP组小鼠体重显著上升(P<0.05、P<0.01),与模型组相比,在干预期间,二甲双胍组、10% C-MGP和30% C-MGP组小鼠摄食量和饮水量均极显著下降(P<0.01)。以上结果表明10% C-MGP和30% C-MGP可以在一定程度上改善STZ诱导糖尿病小鼠的代谢,控制体重下降。在实验期间,正常对照组小鼠毛色白净光亮,精神状态活跃,反应迅速,模型组小鼠毛色发黄,精神状态萎靡,反应缓慢。与模型组相比,二甲双胍组、C-MGP(5%、10%和30%)组小鼠的毛色、体型、精神状态均有一定程度的改善。
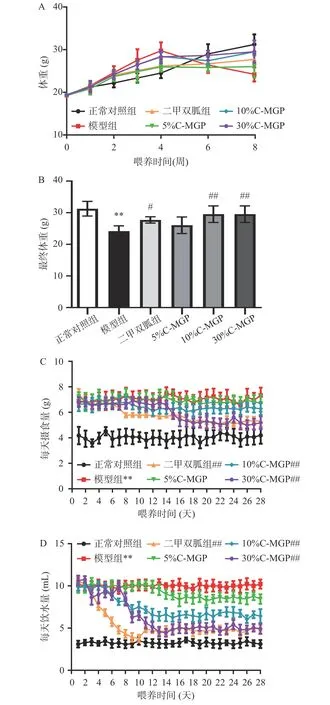
图 1 C-MGP对STZ诱导糖尿病小鼠体重、摄食和饮水的影响Fig.1 Effect of C-MGP on body weight , food and water intakes in STZ-induced diabetic mice
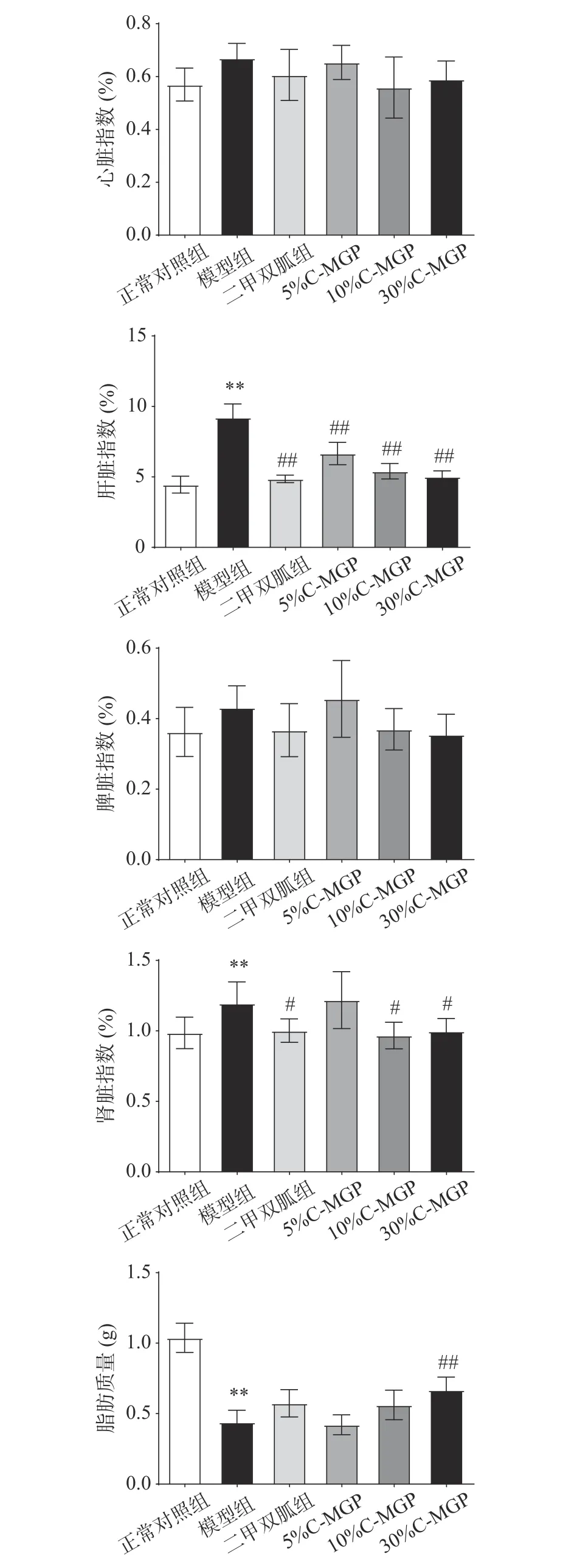
图 2 C-MGP对STZ诱导糖尿病小鼠脏器指数和脂肪质量的影响Fig.2 Effects of C-MGP on visceral index and fat mass in STZ-induced diabetic mice
2.2 C-MGP对STZ诱导糖尿病小鼠脏器指数的影响
C-MGP对STZ诱导糖尿病小鼠脏器指数的影响如图2所示,与正常对照组相比,模型组肝脏系数、肾脏系数极显著上升(P<0.01),心脏和脾脏系数无显著差异(P>0.05),说明长期的高血糖使得STZ诱导的糖尿病小鼠主要脏器造成损害,有进一步诱发各种并发症的风险,如冠心病和糖尿病型肝肿大等[29-30]。与模型组比,C-MGP组(5%,10%和30%)肝脏系数极显著下降(P<0.01);10% C-MGP和30%C-MGP组肾脏系数显著下降(P<0.05),5% C-MGP影响不显著(P>0.05);30% C-MGP组脂肪极显著上升(P<0.01)。表明一定剂量C-MGP对STZ诱导糖尿病小鼠的肝脏和肾脏具有一定的保护作用。
2.3 C-MGP对STZ诱导糖尿病小鼠血糖水平的影响
如图3所示,为C-MGP对STZ诱导糖尿病小鼠FBG的影响,各组STZ诱导糖尿病小鼠在开始时空腹血糖值在16.47~19.86 mmol/L之间,并且各组小鼠均显著高于正常对照小鼠的空腹血糖值(P<0.05)。饲养1周后,与模型组相比,二甲双胍组和C-MGP组小鼠空腹血糖值略有下降。饲养第4周时,与模型组相比,二甲双胍组、10% C-MGP和30%C-MGP组处理均可以显著降低STZ诱导糖尿病小鼠的FBG水平,其中10% C-MGP10组FBG水平显著下降了59.25%(P<0.05),30% C-MGP组FBG水平极显著下降了65%(P<0.01)。以上结果表明10%C-MGP和30% C-MGP能抑制STZ诱导糖尿病小鼠FBG水平的升高。
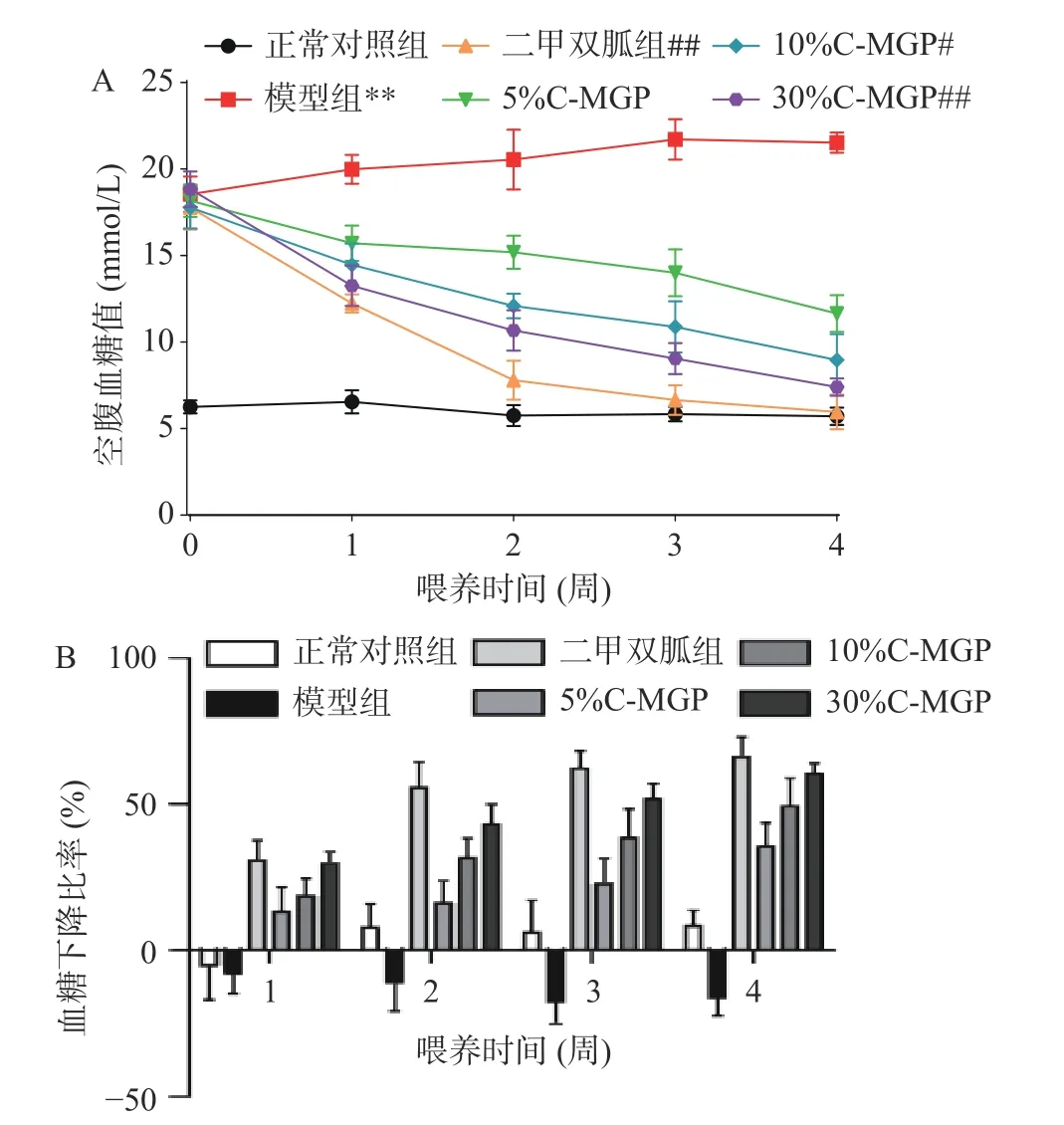
图 3 C-MGP对STZ诱导糖尿病小鼠血糖水平的影响Fig.3 Effect of C-MGP on blood glucose level in STZ-induced diabetic mice
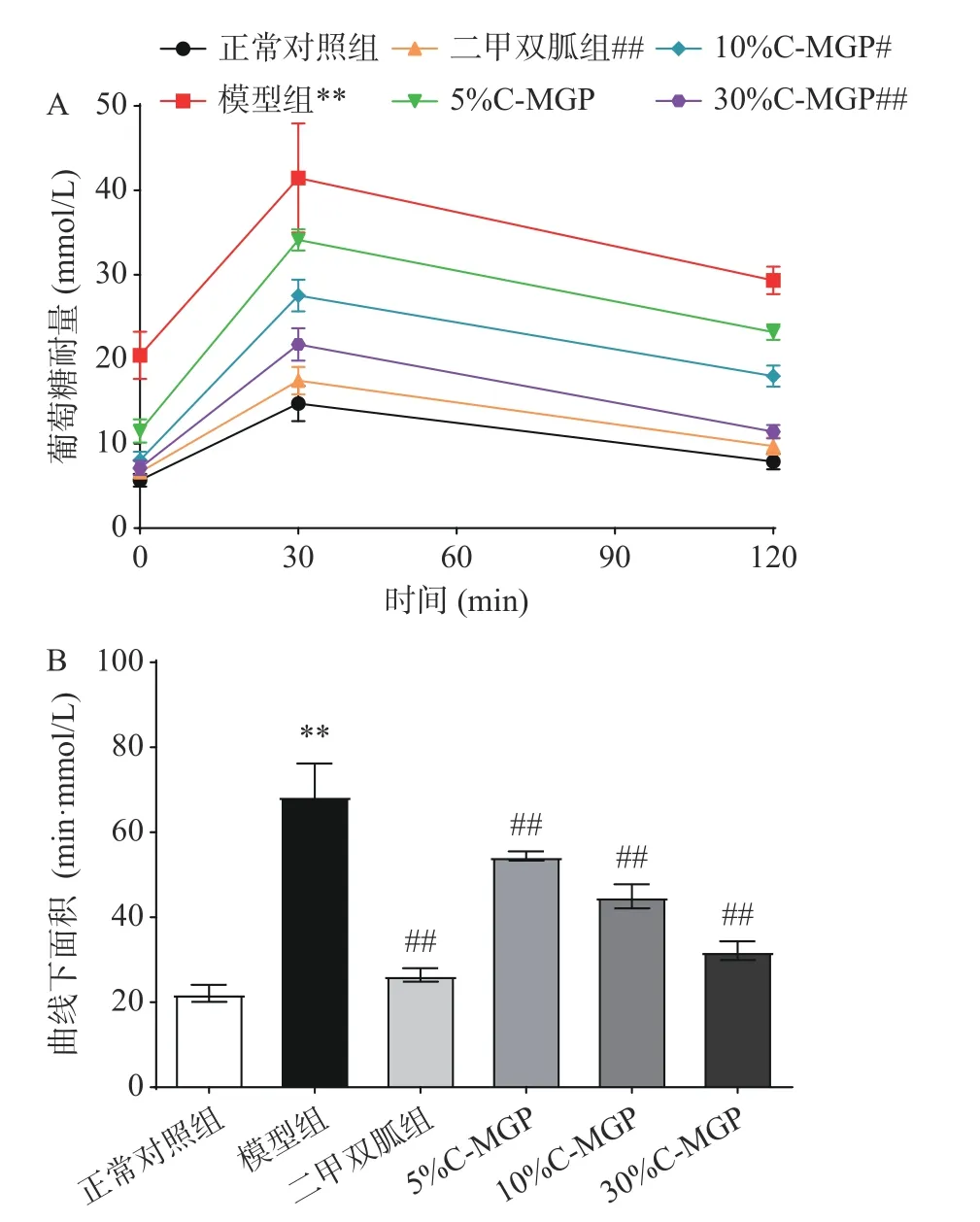
图 5 C-MGP对STZ诱导糖尿病小鼠葡萄糖耐受性的影响Fig.5 Effect of C-MGP on glucose tolerance in STZ-induced diabetic mice
如图4所示,为C-MGP对STZ诱导糖尿病小鼠糖化血红蛋白(GHb)浓度的影响,模型组与正常对照组相比,小鼠的GHb浓度极显著升高(P<0.01),为正常对照组的2.03倍。二甲双胍组、10% C-MGP和30% C-MGP组与模型组相比,小鼠GHb浓度极显著降低(P<0.01),10% C-MGP组和30% C-MGP组分别降低了31.15%、42.40%,而5% C-MGP组小鼠GHb浓度降低效果不显著(P>0.05)。表明一定剂量的C-MGP处理可以降低STZ诱导糖尿病小鼠GHb浓度。
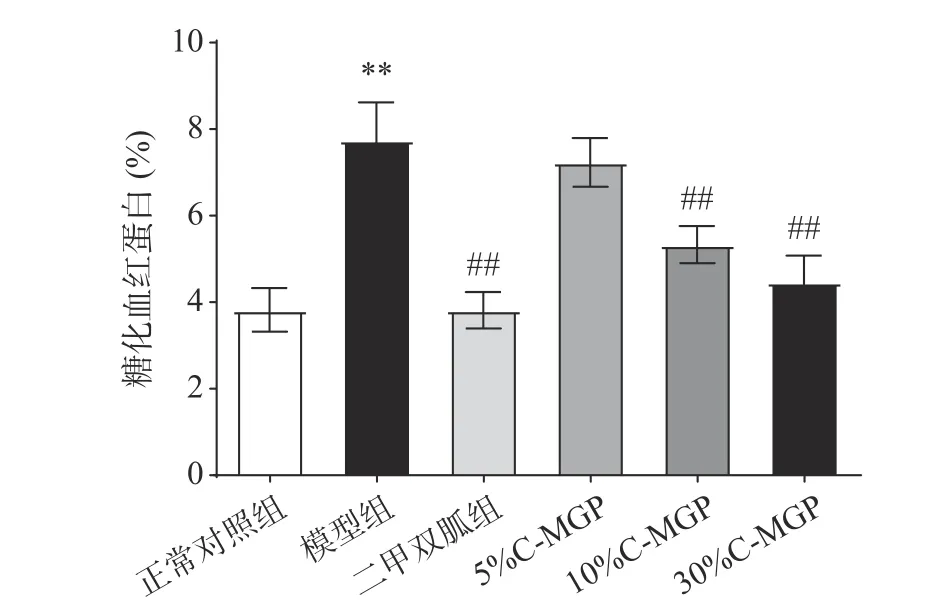
图 4 C-MGP对STZ诱导糖尿病小鼠糖化血红蛋白的影响Fig.4 Effect of C-MGP on GHb level in STZ-induced diabetic mice
2.4 C-MGP对STZ诱导糖尿病小鼠葡萄糖耐受性的影响
图5为C-MGP对STZ诱导糖尿病小鼠耐受性的影响,与正常对照组相比,模型组小鼠在给予葡萄糖后血糖值极显著升高(P<0.01),由此可见STZ诱导糖尿病小鼠的葡萄糖耐量(GT)严重受损(图5A)。二甲双胍组和C-MGP(5%、10%和30%)组与模型组相比,均能极显著降低STZ诱导糖尿病小鼠血糖值的升高(P<0.01);血糖曲线下面积(AUC)能在某种意义上反映出葡萄糖代谢能力,结果如图5B所示,模型组小鼠AUC水平显著高于正常对照组(P<0.05),为正常对照组的3.10倍。与模型组相比,二甲双胍和C-MGP(5%、10%和30%)处理均能极显著降低(P<0.01)STZ诱导糖尿病小鼠AUC,C-MGP(5%、10%和30%)组的AUC降低了20.63%、34.49%、53.13%。上述研究表明C-MGP对STZ诱导糖尿病小鼠的GT有改善作用。
2.5 C-MGP对STZ诱导糖尿病小鼠空腹胰岛素水平(FINS)及胰岛素抵抗指数(HOMA-IR)的影响
C-MGP对STZ诱导糖尿病小鼠血清FINS的影响如图6所示。模型组小鼠的FINS含量极显著高于正常对照组小鼠,为其1.95倍(P<0.01),其血液中高的胰岛素水平和高的葡萄糖,说明模型组小鼠存在胰岛素抵抗。经一段时间喂养后,二甲双胍组和C-MGP(5%、10%和30%)组的FINS得到降低。与模型组相比,二甲双胍组和30% C-MGP组能够极显著降低FINS,分别降低了39.97%、37.94%(P<0.01),10% C-GMP显著降低FINS 16.03%(P<0.05),5%C-MGP组小鼠的FINS水平降低效果不显著(P>0.05)。以上结果表明C-MGP可以有效刺激STZ诱导糖尿病小鼠胰岛素的分泌,且30% C-MGP作用效果与二甲双胍相当。
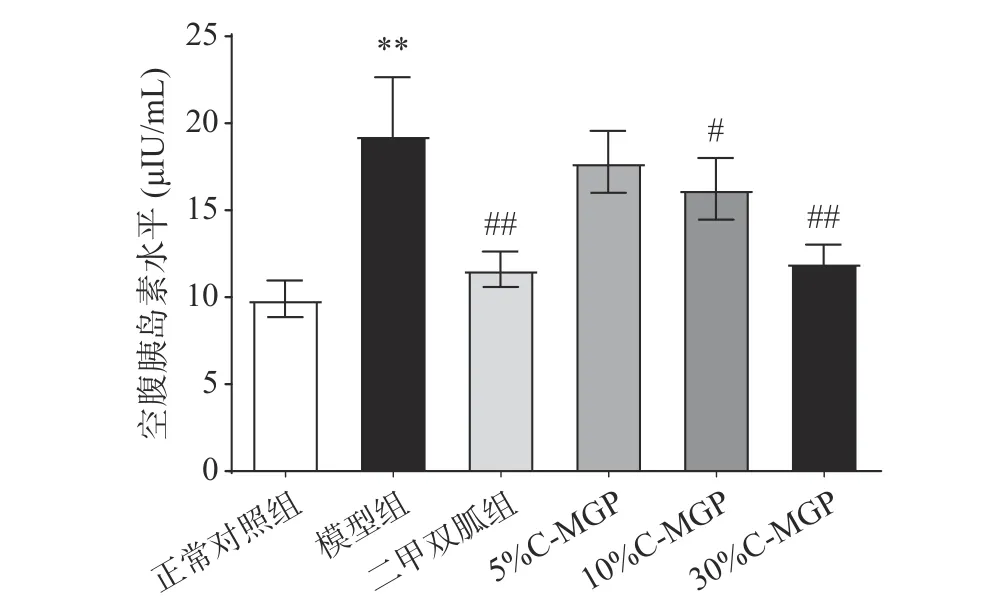
图 6 C-MGP对STZ诱导糖尿病小鼠血清空腹胰岛素的影响Fig.6 Effect of C-MGP on FINS in STZ-induced diabetic mice
C-MGP对STZ诱导糖尿病小鼠HOMA-IR的影响如图7所示。与正常对照组小鼠相比,模型组小鼠的HOMA-IR极高,是正常对照组小鼠的5.77倍。经4周干预后,与模型组小鼠相比,除5% C-MGP组,二甲双胍组和30% C-MGP组的HOMA-IR水平极显著降低(P<0.01),分别降低了42.43%、36.93%;10% C-MGP组HOMA-IR水平显著降低了19.23%(P<0.05)。说明C-MGP有改善STZ诱导糖尿病小鼠胰岛素抵抗状态的作用。
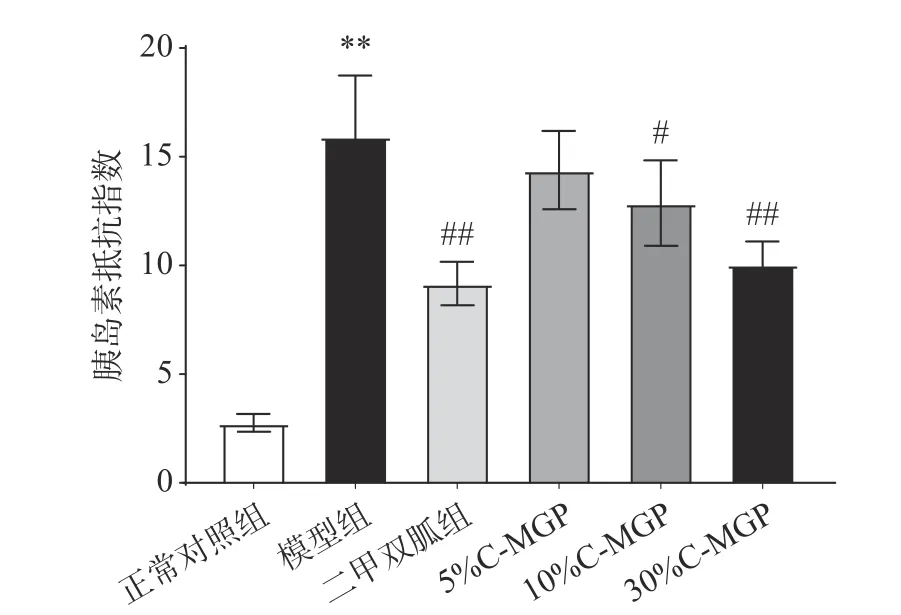
图 7 C-MGP对STZ诱导糖尿病小鼠胰岛素抵抗指数的影响Fig.7 Effect of C-MGP on HOMA-IR in STZ-induced diabetic mice
2.6 C-MGP对STZ诱导糖尿病小鼠血清胰高血糖素样肽-1(GLP-1)的影响
GLP-1是Ⅱ型糖尿病药物治疗的主要目标物质。如图8所示,为C-MGP对STZ诱导糖尿病小鼠血清GLP-1水平的影响,与模型组相比,二甲双胍组、10% C-MGP和30% C-MGP组均能极显著提高STZ诱导糖尿病小鼠血清GLP-1水平(P<0.01),其中10% C-MGP组和30% C-MGP组分别提高了30.76%、51.40%。5% C-MGP组差异不显著(P>0.05),以上结果表明,10% C-MGP和30% C-MGP可以改善STZ诱导糖尿病小鼠GLP-1的分泌水平,从而改善血糖水平的作用。
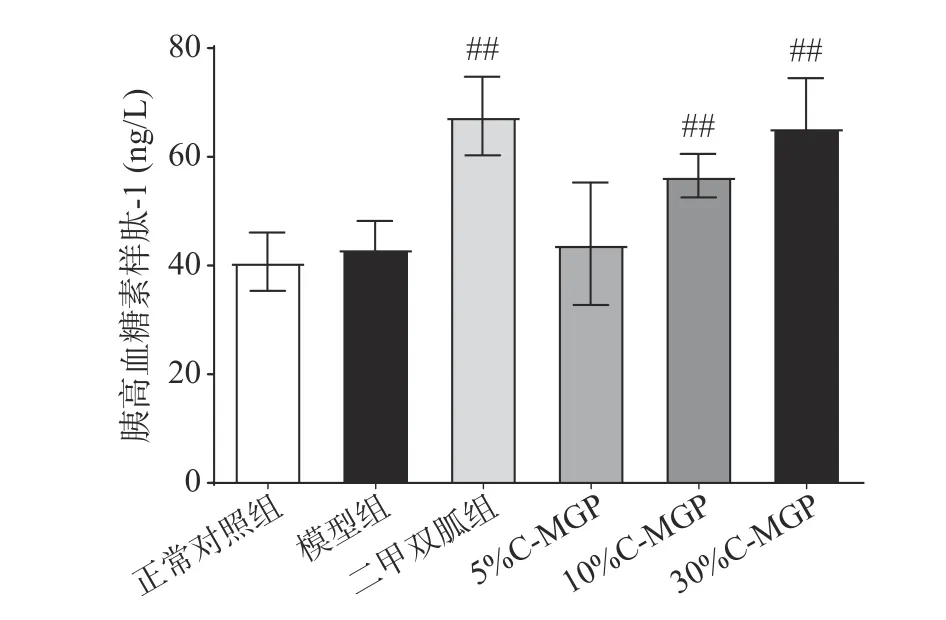
图 8 C-MGP对STZ诱导糖尿病小鼠胰高血糖素样肽-1的影响Fig.8 Effect of C-MGP on GLP-1 in STZ-induced diabetic mice
2.7 C-MGP对小鼠血脂水平的影响
由图9可知,经过4周饲养后,模型组小鼠的血清TG(甘油三酯)与正常对照组小鼠差异极显著(P<0.01)。与模型组相比,C-MGP(5%、10%和30%)喂养后,STZ诱导糖尿病小鼠血清TG值分别减少14.61%、31.31%、41.27%。
由图10可知,经过9周饲养后,与正常对照组小鼠相比,模型组小鼠的血清TC(总胆固醇)值极显著升高(P<0.01)。与模型组相比,C-MGP(5%、10%和30%)喂养后,T2DM小鼠血清TC值分别减少10.09%、33.13%、56.11%,并且二甲双胍组、10% CMGP、30% C-MGP组与模型组差异极显著(P<0.01)。TG和TC的研究结果显示10% C-MGP和30% CMGP对STZ诱导糖尿病小鼠血脂水平有显著地改善作用。
由图11和图12可知,经过4周饲养后,模型组小鼠的LDL-c(低密度脂蛋白胆固醇)与HDL-c(高密度脂蛋白胆固醇)含量与正常对照组小鼠差异极显著(P<0.01)。与模型组相比,C-MGP(5%、10%和30%)喂养后,血清LDL-c分别减少了10.81%、25.81%、54.81%;血清HDL-c分别增加了41.38、83.19%、177.15%。二甲双胍组、10% C-MGP和30% C-MGP组喂养后,LDL-c与HDL-c水平均有改善,虽距恢复正常水平仍有一定差距,但均与模型组小鼠有显著差异(P<0.01,P<0.05)。
FFA(游离脂肪酸)是监测机体脂代谢异常诱发炎症反应的重要指标,由图13可知,模型组与正常对照组相比,小鼠FFA水平极显著升高(P<0.01),为正常对照组的3.53倍,表明STZ诱导糖尿病小鼠出现炎症反应。与模型组相比,二甲双胍、10% C-MGP和30% C-MGP均可以极显著降低STZ诱导糖尿病小鼠血清FFA水平(P<0.01),其中10% C-MGP和30%C-MGP组分别降低了38.81%和49.92%。以上结果表明,C-MGP可以减轻STZ诱导糖尿病小鼠血脂代谢异常引发的炎症反应。
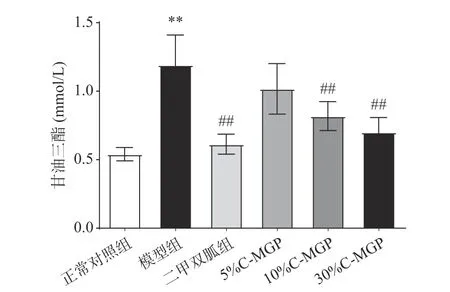
图 9 C-MGP对STZ诱导糖尿病小鼠血清甘油三酯的影响Fig.9 Effect of C-MGP on serum TG in STZ-induced diabetic mice
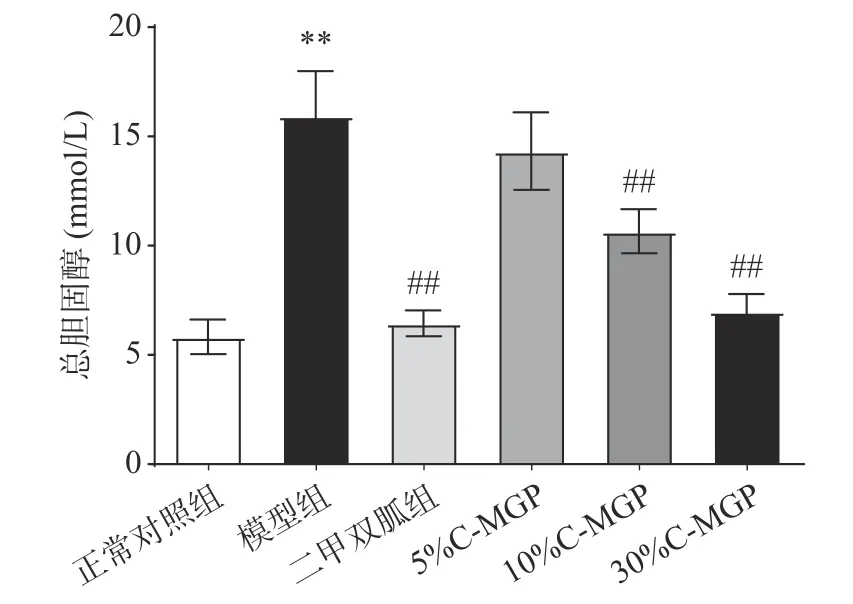
图 10 C-MGP对STZ诱导糖尿病小鼠血清总胆固醇的影响Fig.10 Effect of C-MGP on serum TC in STZ-induced diabetic mice
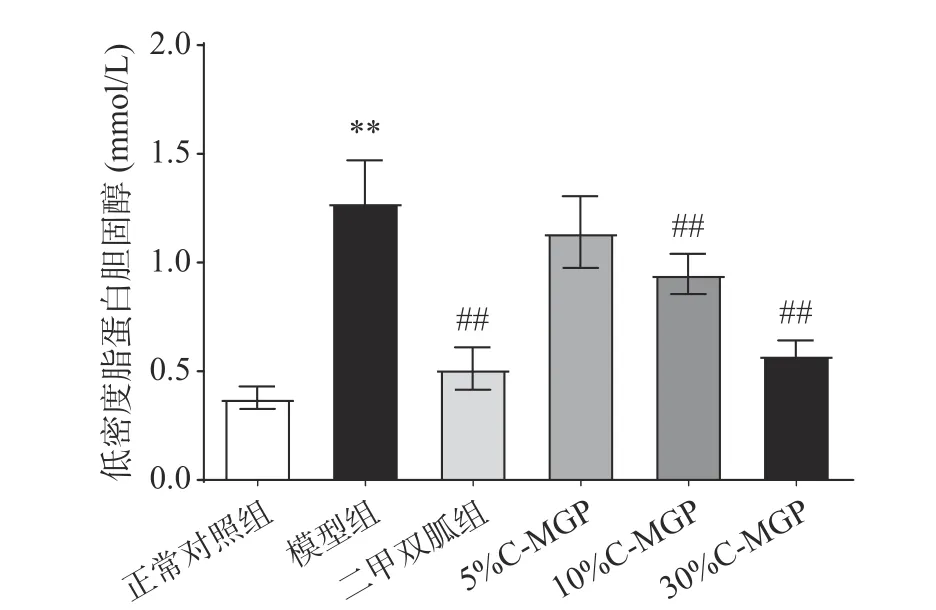
图 11 C-MGP对STZ诱导糖尿病小鼠血清低密度脂蛋白胆固醇的影响Fig.11 Effect of C-MGP on serum LDL-c in STZ-induced diabetic mice
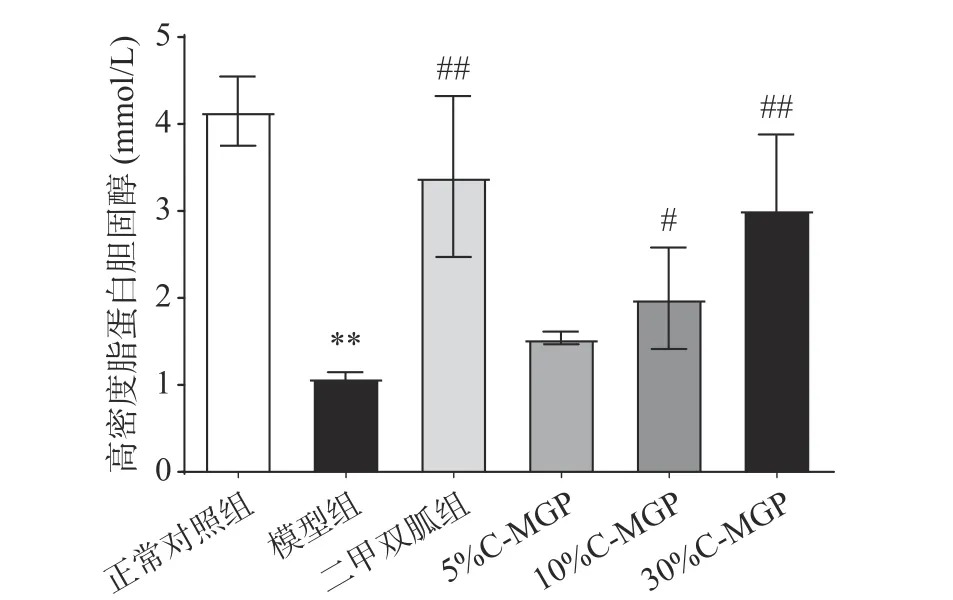
图 12 C-MGP对STZ诱导糖尿病小鼠血清高密度脂蛋白胆固醇的影响Fig.12 Effect of C-MGP on serum HDL-c in STZ-induced diabetic mice
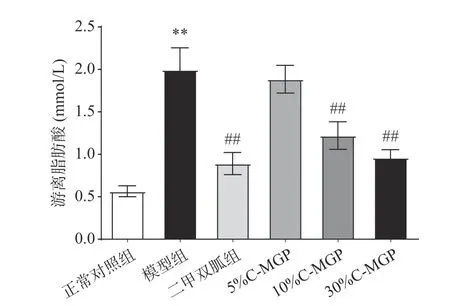
图 13 C-MGP对STZ诱导糖尿病小鼠血清游离脂肪酸的影响Fig.13 Effect of C-MGP on serum FFA in STZ-induced diabetic mice
2.8 C-MGP对STZ诱导糖尿病小鼠肝糖原(HG)的影响
C-MGP对STZ诱导糖尿病小鼠HG含量的影响如图14所示,与正常对照组相比,模型组小鼠HG含量显著性降低了51.10%(P<0.01),表明小鼠肝脏内糖原合成功能受损。与模型组相比,二甲双胍组、10% C-MGP组和30% C-MGP组小鼠HG含量极显著提高了84.85%、56.18%、75.80%(P<0.01),5% C-MGP组作用不显著(P>0.05)。以上结果表明,10% C-MGP和30% C-MGP可以促进STZ诱导糖尿病小鼠HG的合成。
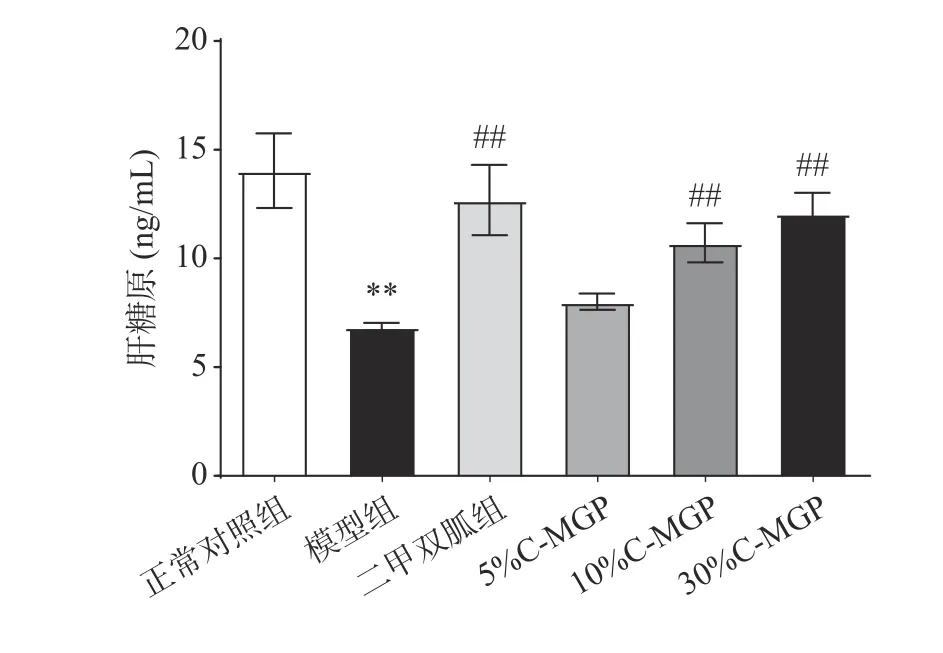
图 14 C-MGP对STZ诱导糖尿病小鼠肝糖原含量的影响Fig.14 Effect of C-MGP on HG contens in STZ-induced diabetic mice
2.9 C-MGP对STZ诱导糖尿病小鼠血清脂多糖(LPS)的影响
C-MGP对STZ诱导糖尿病小鼠LPS(脂多糖)含量的影响如图15所示。从图15中可以看出,模型组与正常对照组相比,小鼠血清LPS含量极显著升高(P<0.01)。与模型组相比,二甲双胍组、10% CMGP组和30% C-MGP组均可以极显著降低STZ诱导糖尿病小鼠血清LPS含量,分别降低了43.70%、25.98%、41.30%(P<0.01)。以上结果显示10% CMGP和30% C-MGP可以极显著降低STZ诱导糖尿病小鼠血清LPS水平(P<0.01)。血液中脂多糖的减少会降低炎症反应,减轻胰岛素抵抗水平,降低Ⅱ型糖尿病的发病率。
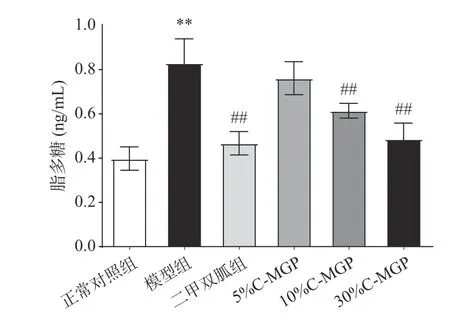
图 15 C-MGP对STZ诱导糖尿病小鼠血清脂多糖含量的影响Fig.15 Effect of C-MGP on serum LPS contens in STZ-induced diabetic mice
3 讨论与结论
目前已有许多研究表明,单一杂粮对于改善糖代谢具有积极影响,但杂粮复配后对血糖干预的研究较少。Perez-Ramirez等[31]研究发现,燕麦-豆粉饼干比普通燕麦-小麦饼干更好地提高高糖高脂喂养大鼠的胰岛素水平,但两种饼干对血糖均无明显影响。尹雪倩等[32]研究发现荞麦、燕麦、豌豆复配复合膳食能显著地减少大鼠的血糖,改善糖耐量及胰岛素抵抗,减轻糖尿病症状。傅樱花等[33]研究表明,鹰嘴豆酸奶和鹰嘴豆粗黄酮对STZ糖尿病小鼠进行灌胃,能够降低小鼠血糖水平。本研究在前期的实验基础上进行,采用饮食干预的方法研究可可豆、豌豆、白芸豆、红芸豆、燕麦、荞麦、大麦仁复配后对STZ诱导糖尿病小鼠的影响,发现10% C-MGP和30% CMGP干预均能明显改善STZ诱导糖尿病小鼠的精神行为状态,改善血脂异常,降低糖化血红蛋白水平、空腹血糖水平、血清空腹胰岛素水平及胰岛素抵抗,提高葡萄糖耐量,促进肝糖原合成,改善肝脏脂肪堆积。30% C-MGP可以显著提高STZ诱导糖尿病小鼠的血清胰高血糖素样肽含量,极显著降低血清脂多糖水平(P<0.01)。具有辅助降血糖作用。综上所述,低GI杂粮可可冲调粉可以降低糖尿病小鼠的空腹血糖,改善糖耐量及胰岛素抵抗,减轻糖尿病症状,具有进一步开发利用的价值。
