有机肥对环青海湖地区退化草地土壤微生物区系的影响
2023-01-03周学丽王英成赵阳安祁星民土旦加史德军芦光新董世魁
周学丽, 马 坤, 王英成, 赵阳安, 祁星民, 土旦加, 史德军, 芦光新*, 董世魁
(1.青海大学农牧学院, 青海 西宁 810016; 2.青海省草原改良试验站, 青海 共和 813000; 3.北京林业大学草业与草原学院,北京 100083)
土壤微生物是陆地生态系统中重要的组成部分,参与和调节一系列关键的养分和物质循环过程[1-2],土壤微生物群落组成与多样性作为表征土壤质量和健康的早期指标[3],同时土壤微生物也有助于植物获取营养,对维持植物生产至关重要[4]。微生物作为土壤环境变化的指示生物,在植物-土壤-微生物相互作用的生态学过程的研究中越来越受学者们关注[5]。
青海湖地区草地不仅是当地牧民赖以生存的生产基础,而且具有多种生态系统服务功能和重要的生态安全屏障功能作用。20世纪50年代以来,由于草地畜牧业发展迅速,区域人口和家畜数量快速增长[6],长期超载放牧导致高寒草地生态系统退化严重[7],严重制约草地畜牧业可持续发展[8],典型脆弱的草地生态系统面临生态环境保护和社会经济可持续发展的双重压力。草地退化引起我国各级政府及科学界的高度重视[9],针对青藏高原高寒草甸生态系统退化问题,国家出台一系列方针政策和开展生态保护工程[10],实施了多项强有力的恢复措施,包括围栏封育、草地施肥、鼠害防治以及建植人工草地等,以上措施在青藏高原退化高寒草甸恢复治理中都取得了一定成效[11]。其中,施肥是草地改良和恢复的有效的措施之一,研究表明,施用有机肥对土壤有机碳活性组分提高有显著的促进作用[12]。施肥后土壤的氮矿化率提高,植物生长加快,土壤有机质增加,从而导致生物群落发生变化[13-14]。近年来,草地和牧草施肥方面的研究及推广应用发展较为迅速,有关施肥对牧草产量的影响报道很多,主要集中在化学肥料的种类的选择、营养成分的配比等对草地群落结构及牧草产量的影响方面[15-20],但在生产实践中,施用化学肥料势必会导致成本增加,并且会带来环境污染问题,不利于高寒草地的生态环境保护[21-22]。鉴于青海省高寒草地生态保护价值,探索施用有机肥对退化草地改良以及保护好青海这片净土的生态环境、实现农牧业持续健康发展具有十分重要的意义[23]。
迄今为止,通过植被特征或土壤理化性质来反映施肥对草地改良的作用的报道较多[24-26],也有通过植被-土壤系统的综合效应来表征施肥效应的研究[27-30],课题组前期在高寒草地开展进行了有机肥对草地植物和土壤影响的相关研究[31-33],但有机肥对退化草地土壤微生物群落结构和多样性影响知之甚少。本文采用高通量测序技术,通过分析16S rRNA和ITS-rDNA基因序列信息,研究环青海湖地区草地土壤微生物群落及多样性对有机肥的响应特征,明确有机肥对土壤微生物区系的影响,旨在从土壤微生物群落结构与多样性角度评价施用有机肥对退化草地的改良效果,为该区或同类地区草地改良提供科学依据。
1 材料与方法
1.1 试验地概况
试验地位于青海省草原改良试验站的天然草地试验区(37°03′43.0″N,99°34′00.6″E,海拔3 270 m),年平均气温-0.7℃,绝对无霜期为20 d。年平均降水量为368.11 mm,相对湿度58%,年蒸发量1 495.3 mm,土壤为暗栗钙土,是以紫花针茅为主的高寒草原。样地于2015年封育,主要植物种类有:紫花针茅(StipapurpureaGriseb)、冷地早熟禾(P.crymophilaKeng)、线叶嵩草(Kobresiacapillifolia)、猪毛蒿(Artemisiascoparia)、肉果草(Lanceatibetica)、冷蒿(Artemisiafrigida)、青藏苔草(Carexmoorcroftii)、赖草(Leymussecalinus)、溚草(Koeleriacristata)、异叶青兰(DracocephalumheterophyllumBenth)、阿尔泰狗哇花(Heteropappusaltaicus)、多裂委陵菜(Potentillamultifida)、多枝黄芪(Astragaluspolycladus)、湿生扁蕾(Gentianopsispaludosa(Mun.)Ma.)、狼毒(Stellerachamaejasme)。2020年8月份进行草地植物群落结构调查,样地植物群落基本特征见表1。依据马玉寿等[34]草地退化等级划分,样地的退化程度介于轻度和中度之间。

表1 样地植物群落基本特征Table 1 Basic characteristics of plant communities in the sample sites
1.2 试验设计
于2020年6月,选择地势平坦,试验条件一致的区域,分为2块50 m × 50 m样区,试验分施有机肥与不施有机肥2个处理,施有机肥用F表示,不施有机肥用CK表示,每处理5个重复,分别标记为F1,F2,F3,F4,F5和CK1,CK2,CK3,CK4,CK5。施肥量为800 kg·hm-2(有机质含量>45%,N+P2O5+K2O>5%)(有机肥购自四川省成都市蒲江县绿地秸秆科技有限公司),人工均匀撒施。两个样区间有1.5 m的缓冲带,缓冲带上不做任何处理,试验设计布置图见图1。在试验处理之前采集土壤样品,测定土壤理化性质(见表2)。
图1 试验布置图Fig.1 Layout of test plots

表2 土壤理化性质测定Table2 Determination of soil physical and chemical properties
1.3 研究方法
1.3.1土壤样品采集 2021年8月,分别在2样区内按对角线取样法设置5个1 m × 1 m样方,2个样区共有样方10个。在每个样方内进行植物群落结构调查及土壤样品采集。在取过地上生物量的样方内将土壤表层的残留物和杂质清理干净,然后用7.5 cm直径土钻随机按0~20 cm钻取5钻混合后装入已灭菌的自封袋中,获得10个土壤样品,带回实验室,过40目土筛并剔除所有杂质。一份风干后用于测定理化性质,另一份保存在-80℃,用于微生物群落结构分析。
1.3.2土壤理化性质测定 测定的土壤指标有:总氮、有机质、硝氮、氨氮含量。具体测定方法参照鲍士旦的《土壤农化分析》中的相关测定方法[35]。
1.3.3土壤微生物DNA提取、PCR扩增和测序 参照Wang等[36]的方法,采用土壤DNA提取试剂盒(MOBIO Laboratories,Carlsbad,CA,美国)提取土壤微生物总DNA。采用NanoDrop-ND1000 测定DNA浓度,并经2%琼脂糖凝胶电泳对DNA样品质量进行检测,合格后用于构建文库;以土壤样品微生物总DNA为模板,分别用16SrDNA V4区(515F:5′-GTGCCAGCMGCCGCGGTAA-3′;806R:5′ ical propertieserties);ITS2区5.8F,5′-AACTTTYRRCAAYGG-ATCWCT-3′和4R,5′-AGCCTCCGCTTATTGATATGCTTAART-3′且带有10 bp长的barcode序列的特异引物为扩增引物进行PCR扩增,采用KAPA HyperPrep Kit DNA文库构建测序文库。在Illumina Miseq平台进行测序(深圳,美格基因)。
1.4 数据处理及分析
将所有原始数据以FASTQ格式以及样本对应的Barcode信息上传到中科院环境所邓晔老师课题组的Galaxy分析平台上(http://mem.rcees.ac.cn:8080)进行分析。测序数据采用Btrim和FLASH进行过滤优化和双端序列连接,优质序列利用UPARSE基于97%的相似水平进行OTU(Operational taxonomic units)聚类,并且通过RDP分类数据库对OTU表进行注释[37]。基于OTU丰度信息,利用R语言工具制作Venn图和群落柱形图,利用Mothur软件计算微生物群落结构多样性用物种丰富度(Richness)、Shannon-Wiener多样性指数、以及Pielou均匀度指数表示,采用PCA法对不同施肥处理和对照中土壤微生物群落的差异进行研究分析;通过Anosim,MRPP以及PERMANOVA三种方法进行相异性检验(Dissimilarity test)。
2 结果与分析
2.1 施用有机肥后土壤微生物类群及群落分布特征
2.1.1土壤微生物类群分析 施肥处理和CK的共10个土壤样本测序后经初步质控检测得到土壤细菌8 714 371条序列,真菌检测到5 933 081条序列,在97%的相似性水平下,所有10个样本得到细菌群落共28 376个OTU(Operational taxonomic unit),8 493种真菌OTU。施肥处理下土壤中的细菌的OTUs有14 509个,真菌的OTUs有4 183个,与CK相比,施用有机肥增加了细菌群落的OTU,降低了真菌群落的OTU。
2.1.2土壤微生物群落组成及相对丰度的变化 对施肥和CK中土壤细菌和真菌的群落组成及相对丰度进行了分析(图3),结果表明:施肥处理和CK土壤中,相对丰度大于1%的细菌门分别为:放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、未分类菌、芽单胞菌门(Gemmatimonadetes)、奇古菌门(Thaumarchaeota)、浮霉菌门(Planctomycetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、candidate division WPS-1疣微菌门(Verrucomicrobia)等;主要的真菌门分别为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、还有一些未分类菌。由此可见,在门水平上,优势细菌主要为放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria),三者相对丰度之和达87.3%~87.7%;优势真菌为子囊菌门(Ascomycota),相对丰度达92.1%~95.3%。与CK相比,有机肥处理后变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、未分类菌、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes) 的相对丰度较CK均有所增加,但放线菌门(Actinobacteria)、奇古菌门(Thaumarchaeota)、拟杆菌门(Bacteroidetes) 的相对丰度有所下降;子囊菌门(Ascomycota)和壶菌门(Chytridiomycota)的相对丰度降低,但担子菌门(Basidiomycota)和未分类菌的相对丰度增加。由图3可知,在属水平上细菌群落的组成占比较大的种类除未分类(Unclassified)的种类外,还有Gaiella,Gp6、粘红杆菌属(Solirubrobacter)、Gp16,Gp4、亚硝化球菌属(Nitrososphaera)。其中,Gaiella在施肥处理时丰度最高,达到了10.39%;Gp6、粘红杆菌属(Solirubrobacter)以及Gp16在其中的丰度相对稳定,平均丰度分别是4.23%,5.10%和3.93%。并且Gp6在施肥处理中丰度达到5.7%,粘红杆菌属(Solirubrobacter)在CK处理中含量占6.99%。Gp16在施肥处理中丰度占5.36%。
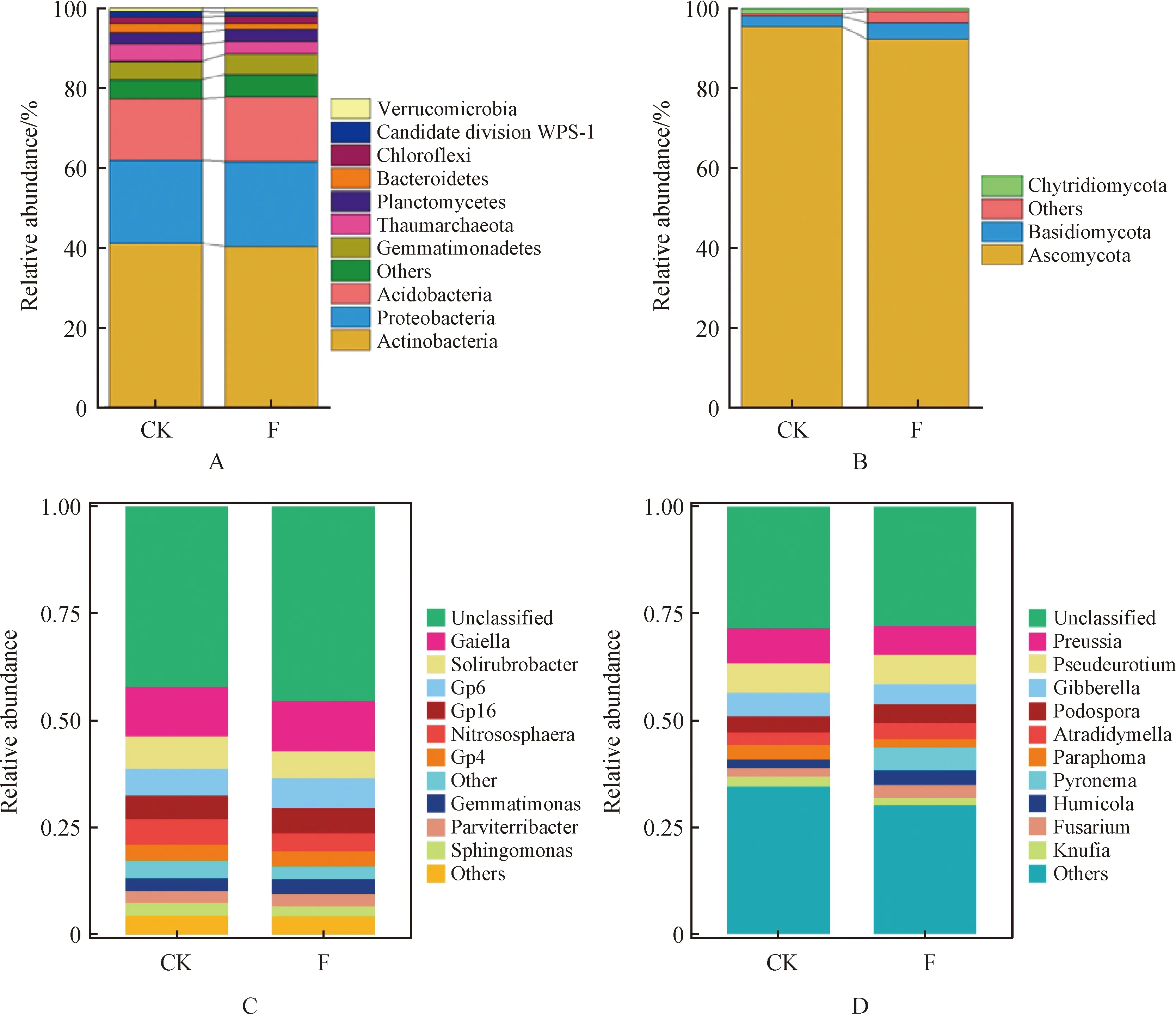
图3 土壤中细菌群落(A)和真菌群落(B)门水平组成分析,细菌群落(C)和真菌群落(D)属水平组成分析Fig.3 Analysis of the composition of bacterial community (A) and fungal community (B) phylum level,bacterial community (C) and fungal community (D) genus level in soil
真菌群落组成中,排在前五位的属有未分类(Unclassified)、Preussia、赤霉菌属(Gibberella)、拟杆菌属(Pseudeurotium)、炭疽病菌(Atradidymella)、粉孢菌属(Podospora)。Preussia在施肥处理后含量反而有所下降,施肥处理后Preussia菌属下降了21.54%,而赤霉菌属(Gibberella)在施肥处理后明显增加。拟杆菌属(Pseudeurotium)影响变化不大,平均丰度在5.69%。
2.1.3土壤微生物群落分布特征的影响 采用Bray距离对草地土壤细菌和真菌群落结构进行主成分(PCA)分析,如图4所示,施肥处理草地土壤的样品和对照样品在主坐标分析图上相对分离,说明施肥改变了土壤细菌群落和真菌群落的结构。对于细菌群落来说PCA1对土壤细菌群落结构差异的解释率为20.36%,PCA2的解释率为14.84%,两轴解释率总和为35.2%(图4A)。在施有机肥和对照土壤中,细菌群落结构均表现显著差异(P<0.05),表明施有机肥显著改变了草地土壤细菌群落结构。对于真菌群落PCA1对土壤真菌群落结构差异的解释率为20.83%,PCA2的解释率为16.49%,两轴解释率总和为37.32%(图4B)。在施有机肥和对照土壤中,真菌群落结构均表现显著差异(P<0.05),表明施肥改变了草地土壤真菌群落结构。不相似性检验分析进一步表明施用有机肥显著改变了细菌群落和真菌群落结构(表3)。
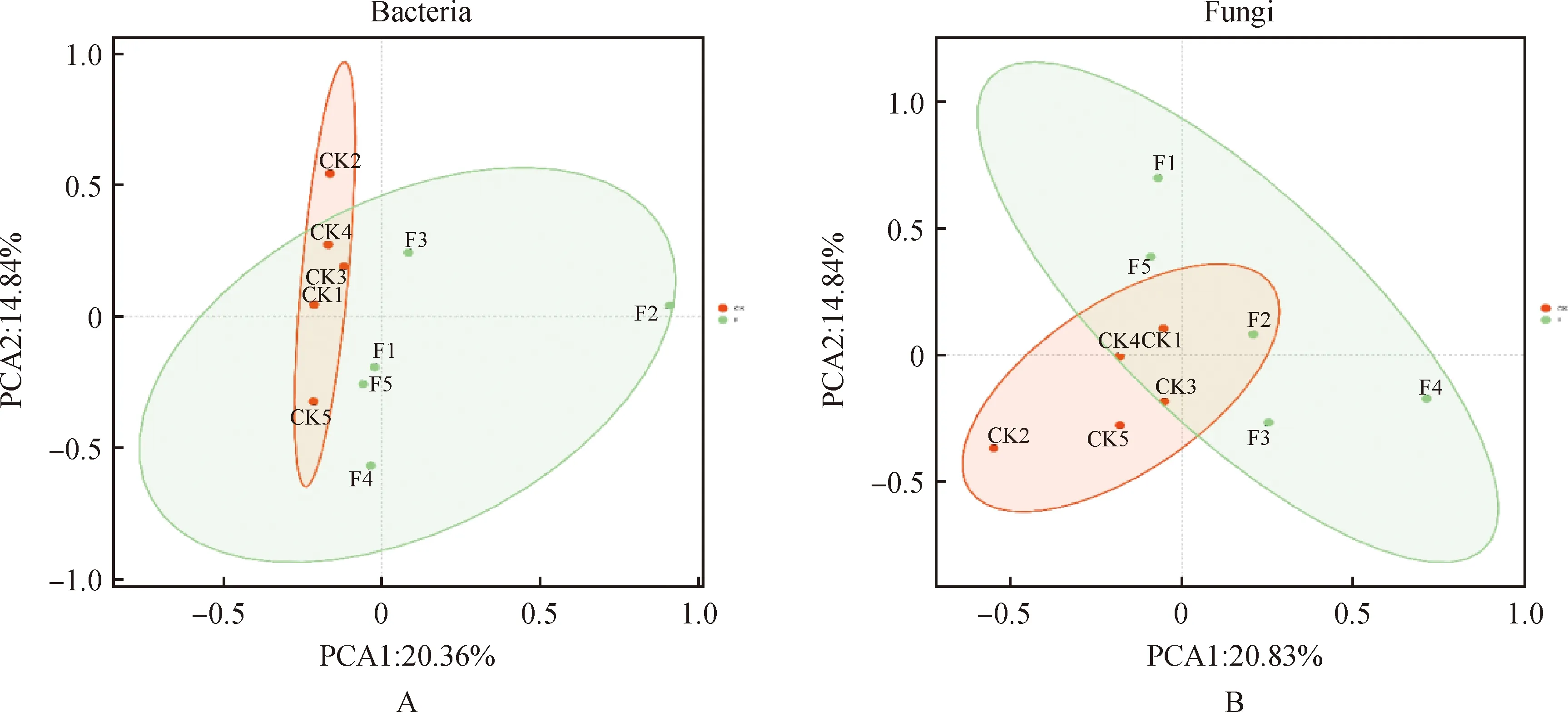
图4 土壤细菌群落A和真菌群落B的PCA分析Fig.4 Principal coordinate analysis of bacterial community (A) and fungal community (B) in natural grassland soil
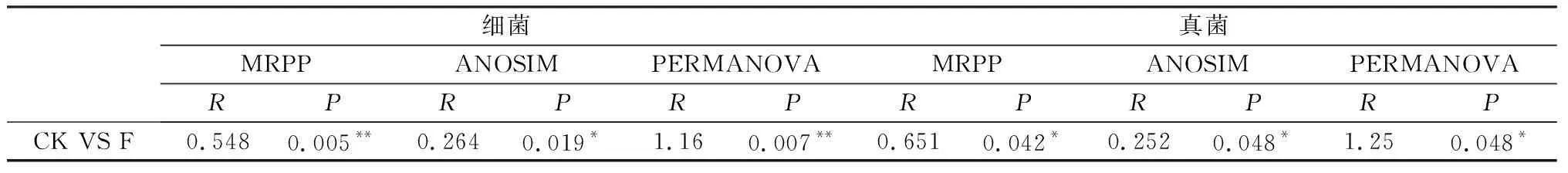
表3 天然草地不同处理间微生物的不相似性检验结果Table 3 Results of dissimilarity test of microorganisms among different treatments of natural grassland
2.2 施用有机肥后土壤微生物多样性分析
细菌群落的样品文库覆盖率为96.3%~96.6%,真菌群落的样品文库覆盖率为97.7%~99.9%,表明制备文库覆盖了施肥处理土壤样品中96.3%以上的细菌和真菌类群,库存容量足够反映样品中微生物的真实组成。
如图5所示,对施肥处理与对照中土壤细菌和真菌的Richness指数对比分析发现,施有机肥增加了土壤细菌群落的Richness指数,但降低了真菌群落的Richness指数;对施肥处理与对照中土壤细菌和真菌的Chao1指数对比分析发现,施肥处理降低了细菌群落的Chao1指数,但增加了真菌群落的Chao1指数。有机肥处理下细菌和真菌群落的Simpson,invsimpson指数均出现下降趋势,细菌和真菌的ACE指数均出现上升趋势。对施肥和对照中微生物Shannon和Pielou指数分析结果显示,有机肥降低了细菌和真菌群落的Shannon和Pielou指数,表明施用有机肥对细菌和真菌两大类群的影响不同。施有机肥能够增加细菌的丰富度,但减少了多样性和均匀度。而对真菌而言,施肥处理后丰富度、多样性和均匀度都有所降低。
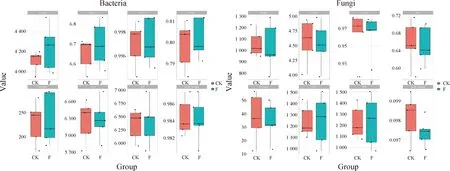
图5 土壤微生物α多样性Fig.5 Diversity of soil microorganism
2.3 施用有机肥后指示微生物类群分析
为了进一步研究施肥对土壤细菌与真菌群落的影响,采用LEfse(LDA effect size)分析了施肥处理与对照中土壤的指示微生物。如(图6A)所示,施肥土壤的细菌指示物种为Gammaproteobacteria,对照土壤的细菌指示物种是Actinomarinicota。施肥土壤的真菌指示物种是Dothideomycetes,对照土壤的真菌指示物种是Helotiaceae(图6B)。
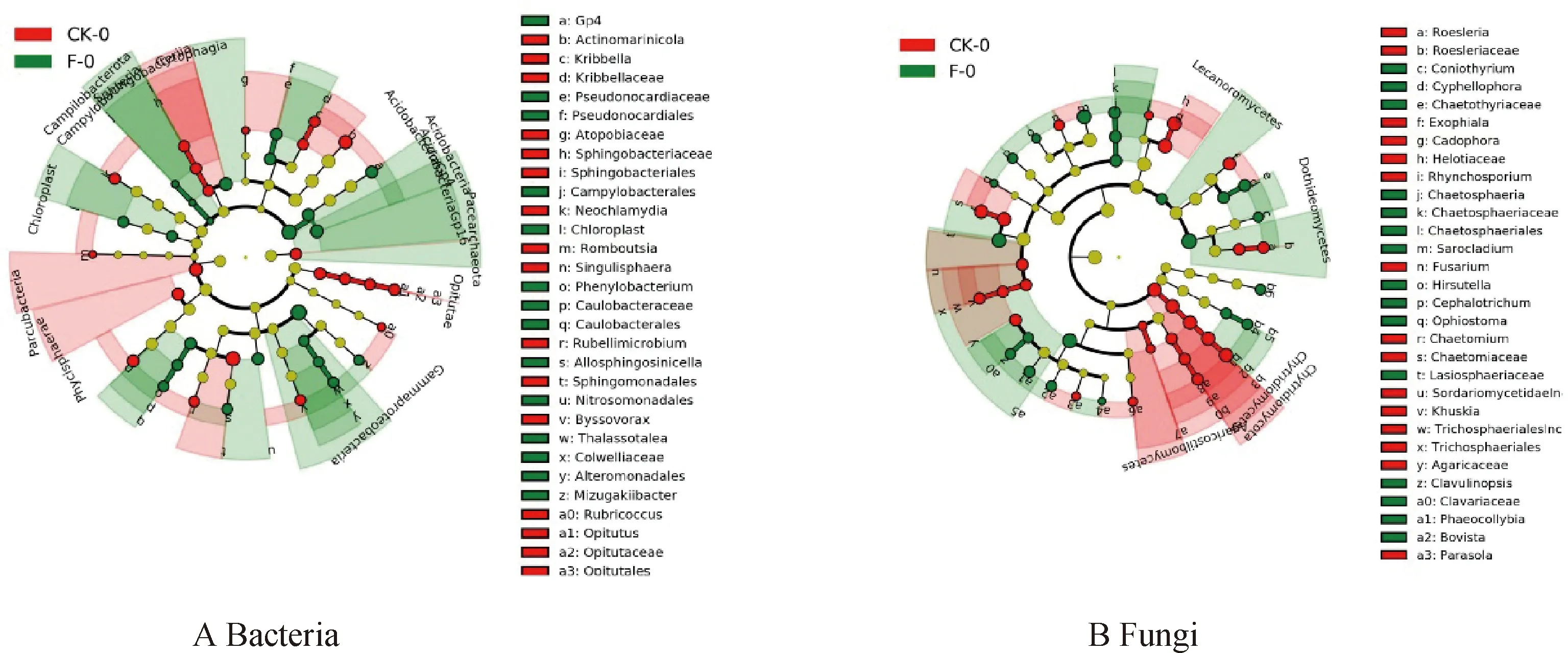
图6 施肥草地土壤微生物群落的线性判别分析Fig.6 Linear discriminant analysis of microbial community fertilization in natural grassland soil.
3 讨论
草地生态系统是陆地生态系统的重要组成部分,高寒地区的草地退化主要表现为草地沙化、出现黑土滩或草地盐碱化[38]。草地退化和改良过程中土壤养分的富集和亏缺,将对植物生产力和微生物群落产生实质影响。为进一步明确有机肥对高寒地区草地土壤微生物群落和多样性的影响,本文对比分析了施有机肥处理与对照之间土壤微生物类群、群落组成、多样性以及关键物种进行了分析。结果发现,施用有机肥后的第二年土壤微生物多样性和群落组成发生了变化,细菌和真菌两大类群对施用有机肥的响应表现出了差异,这与其微生物类群的生物学特性有关。即:施用有机肥增加了土壤有机质含量,更利于细菌的生存。而在草地土壤中,大部分真菌可以将大分子有机物分解成小分子的化合物,供菌体吸收和利用,推动土壤养分的循环,维持和完成正常的生命活动[39]。另外,微生物的功能和特征随其栖息的草地土壤环境的温度、湿度、土壤养分以及分布的植物种类也发生变化[40-41]。
通过有机肥对微生物群落多样性的影响分析发现,有机肥处理增加土壤细菌群落的丰富度,而降低了土壤真菌群落的丰富度,相关细菌群落变化规律与多数研究结果一致[42-43]。对微生物群落组成而言,施有机肥改变了土壤细菌群落和真菌群落的结构,指示物种也发生了变化,施肥对土壤细菌与真菌群落结构变化有显著的影响,这说明施用有机肥后草地土壤环境发生了变化,并且对地上植物部分从物种、功能群以及群落水平上都发生了结构性变化[44],土壤微生物群落的这些变化可能与植被特征和土壤理化性质的改变有关[45]。
4 结论
青藏高原环青海湖地区施用有机肥第二年,土壤细菌的OTUs增加,真菌的OTUs降低;并且改变了土壤细菌与真菌群落组成及相对丰度;有机肥添加能增加土壤细菌群落的Richness指数,降低了真菌群落的Richness指数,同时降低细菌群落的Chao1指数,增加真菌群落的Chao1指数,细菌和真菌群落的Shannon和Pielou指数均明显降低;施肥处理后土壤细菌和真菌的指示物种也发生了变化。
