基于ADAMTS1、ADAMTS4、miR-22和CD62p急性A型主动脉夹层患者预后列线图预测模型的建立与评价
2023-01-03任建立杨铠榕郭娅娅
郭 靖,任建立,杨铠榕,郭娅娅
急性A型主动脉夹层(acute type A aortic dissection, ATAAD)是心血管疾病危重症之一,目前临床治疗以外科手术为主。近年来随着医疗技术的不断进步,ATAAD早期病死率有所降低,但受术前状态、手术时机、器官保护等个体化差异的影响,患者术后1个月病死率为4%~53%[1]。早期识别ATAAD高危患者并进行针对性干预,有助于降低患者病死率。目前临床分析疾病预后主要以多因素分析为主,其对病死率的预测较为分散,预测价值相对较低。金属肽酶含血小板反应蛋白元1(ADAMTS1)和ADAMTS4是分泌型胞外酶,主要由巨噬细胞产生,其在动脉粥样硬化病变过程中水平逐渐升高,对心血管疾病进展有促进作用[2]。另有研究证实,miR-22、P选择素(CD62p)参与冠心病进展,可诱导异常的免疫炎症反应,加速心脏成纤维细胞失活、心肌细胞衰老[3-4],但其在ATAAD中的水平变化临床报道较少。本研究选取我院收治的ATAAD患者,在常规多因素分析基础上构建列线图预测模型,并通过决策曲线进一步分析,为临床评估ATAAD患者预后提供参考。现报告如下。
1 对象与方法
1.1研究对象 将2018年5月—2022年5月我院收治的ATAAD 228例作为观察组,男159例,女69例;年龄36~69(52.61±7.48)岁。纳入标准:均符合ATAAD诊断标准[5];为急性发病;年龄>18岁;均于我院进行手术治疗;发病至手术时间≤14 d。排除标准:认知功能障碍;近3个月出现严重心脑血管疾病急性发作者。另选取同期体检健康者76例为对照组,男55例,女21例;年龄34~67(50.83±7.22)岁。2组性别、年龄比较差异无统计学意义(P>0.05),具有可比性。2组均知情本研究并签署同意书。
1.2方法 抽取2组空腹静脉血,乙二胺四乙酸抗凝,室温下静置30 min,离心30 min(转速2000 r/min),取上层清液,以酶联免疫吸附试验检测ADAMTS1、ADAMTS4、CD62p水平,提取标本RNA,以逆转录-聚合酶链反应检测miR-22,计算相对表达量。
1.3观察指标 ①比较2组ADAMTS1、ADAMTS4、miR-22和CD62p水平。②住院期间以是否死亡为观察终点,统计ATAAD患者生存及死亡情况,并比较生存、死亡患者的相关资料。③分析ATAAD患者预后的影响因素。④建立ATAAD患者预后的列线图模型并以校准曲线验证。⑤绘制ADAMTS1、ADAMTS4、miR-22和CD62p评估ATAAD患者预后的决策曲线并进行分析。

2 结果
2.1ADAMTS1、ADAMTS4、miR-22和CD62p水平比较 观察组ADAMTS1、ADAMTS4、miR-22和CD62p水平均高于对照组(P<0.01)。见表1。

表1 2组ADAMTS1、ADAMTS4、miR-22和CD62p水平比较
2.2不同预后ATAAD患者临床资料比较 228例ATAAD患者中生存187例(82.02%),死亡41例(17.98%)。死亡患者高血压病患者所占比例、年龄、辅助通气时间、体外循环时间、ADAMTS1、 ADAMTS4、miR-22和CD62p水平均高于生存患者,差异有统计学意义(P<0.05,P<0.01)。见表2。
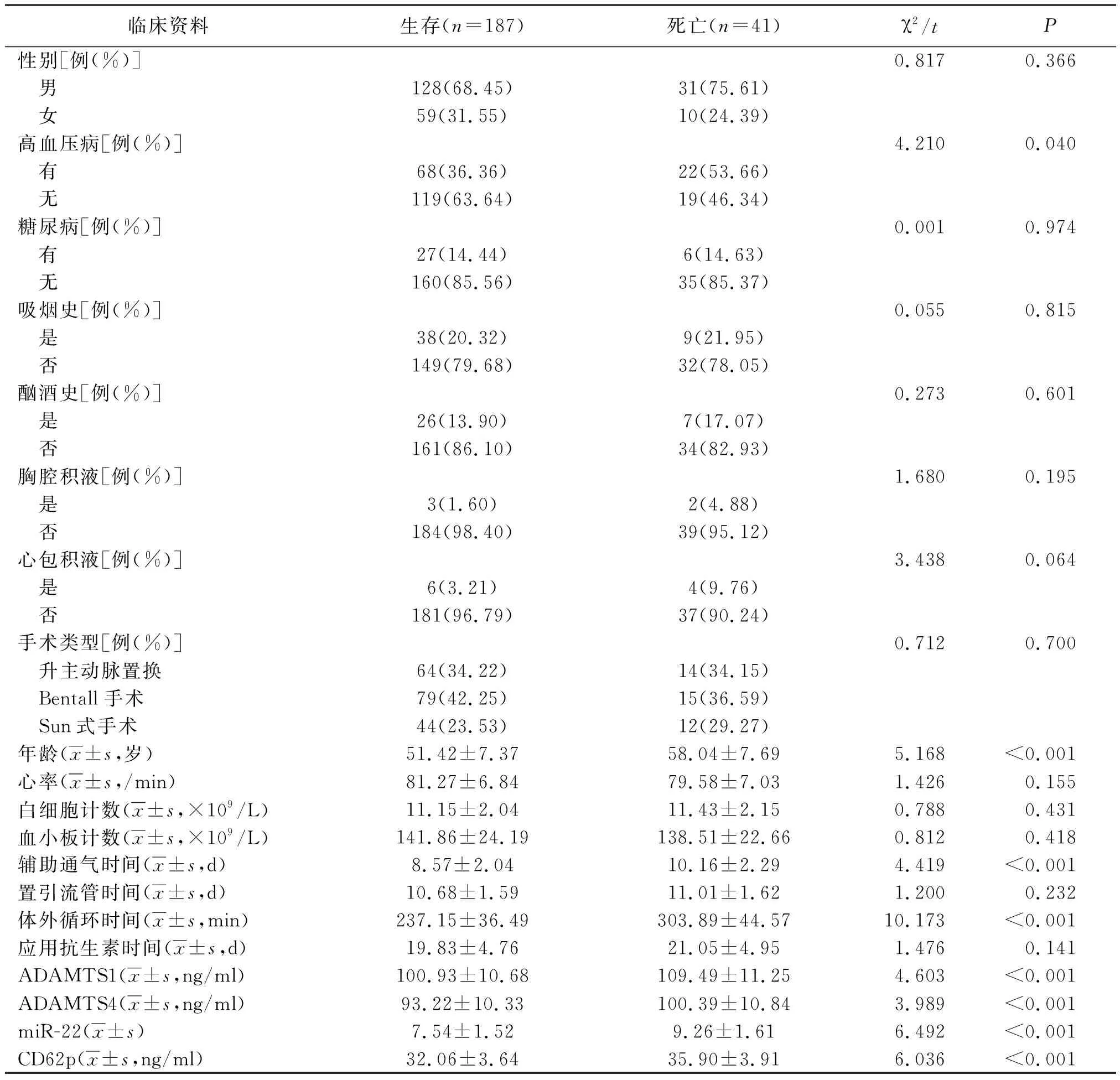
表2 不同预后ATAAD患者的临床资料比较
2.3ATAAD患者预后的影响因素分析 以ATAAD患者预后为因变量(赋值:生存=0,死亡=1),以高血压病、年龄、辅助通气时间、体外循环时间、ADAMTS1、ADAMTS4、miR-22和CD62p为自变量,采用多因素Logistic回归分析,结果显示,高血压病、年龄高、体外循环时间长及ADAMTS1、ADAMTS4、miR-22、CD62p水平高是ATAAD患者死亡的独立危险因素(P<0.05,P<0.01)。见表3。
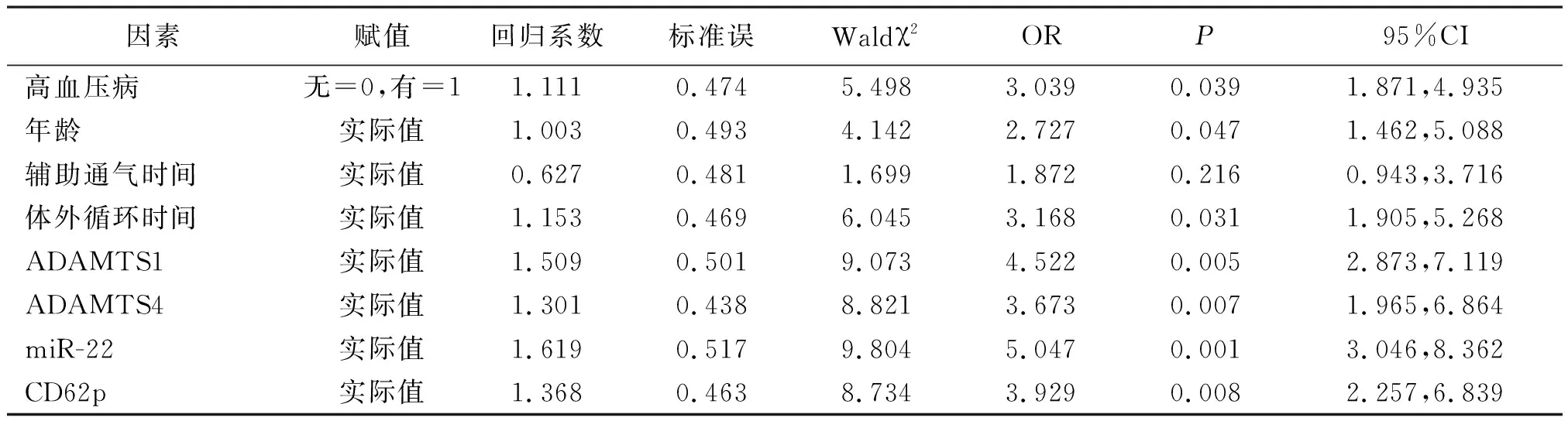
表3 ATAAD患者预后的影响因素多因素Logistic回归分析
2.4ATAAD患者预后的列线图模型 根据多因素Logistic回归分析结果,纳入7个独立影响因素(高血压病、年龄、体外循环时间、ADAMTS1、ADAMTS4、miR-22和CD62p)构建ATAAD患者死亡的列线图预测模型,见图1。采用校准曲线验证模型的精准度,预测值与实际结果几乎相同,校准曲线接近理想参考线,一致性指数为0.803,精准度、区分度较好。见图2。

图1 ATAAD患者预后列线图预测模型
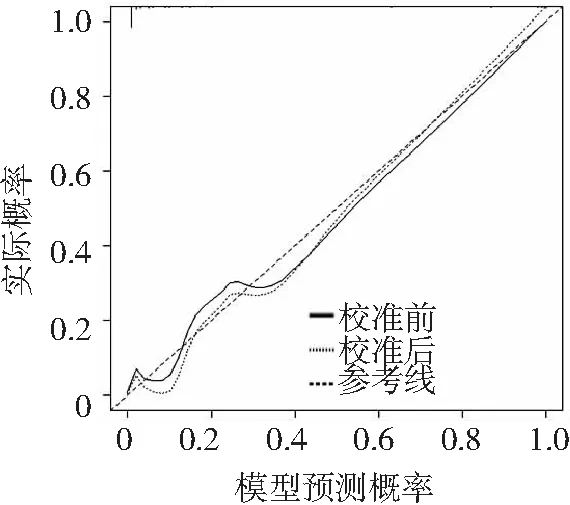
图2 ATAAD患者预后列线图预测模型校准曲线验证
2.5ADAMTS1、ADAMTS4、miR-22和CD62p评估ATAAD患者预后的决策曲线分析 利用决策曲线对不同模型进行比较,ADAMTS1、ADAMTS4、miR-22及CD62p联合检测对ATAAD患者预后的评估价值优于单独检测。见图3。
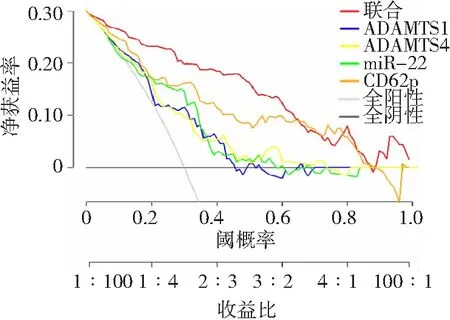
图3 ADAMTS1、ADAMTS4、miR-22和CD62p评估ATAAD患者预后的决策曲线
3 讨论
ATAAD可累及脑血管、冠状动脉诱发认知功能障碍、心肌缺血,病情进展迅速,死亡风险高,严重威胁患者健康。相关数据显示,25%~35%的患者可出现休克,经手术治疗后病死率约30%[6]。本研究中228例经积极治疗后死亡41例,病死率为17.98%,略低于上述文献报道,但仍处于较高水平。因此,临床亟需寻找早期评估患者预后的客观指标,以便早期进行精准干预。
ADAMTS是糖基化酶,其辅助区域可被蛋白水解酶加工,影响定位、分泌、激活剂催化功能[7]。ADAMTS1可在NxS/T位点发生糖基化,其聚蛋白多糖活性可同时被基质金属蛋白酶抑制因子2、3抑制,这可能是其影响血管病理改变的重要机制[8-9]。近年来有研究证实,ADAMTS可作为遗传性胸主动脉瘤的治疗靶点[10];另有报道表明,ADAMTS4在动脉粥样硬化发作过程中其水平动态增高[11]。miR-22在ATAAD中的作用机制已有相关报道[12-13],其可通过靶向调控NOD样受体热蛋白结构域相关蛋白3基因参与疾病的进展,其中细胞凋亡与炎性因子表达具有重要作用。CD62p是血小板活化经典指标,其有潜力作为抗血小板治疗靶点,可通过调节血小板及内皮细胞间的相互作用促使心血管疾病发生、进展[4,14]。相关研究指出,急性心肌梗死患者的CD62p水平明显高于健康人群,可作为冠状动脉相关疾病诊断标准[15-16]。本研究结果显示,ATAAD患者ADAMTS1、ADAMTS4、miR-22和CD62p水平均高于健康体检者,提示ADAMTS1、ADAMTS4、miR-22和CD62p参与ATAAD发生或进展。ADAMTS1、ADAMTS4水平变化与动脉粥样硬化斑块中的单核细胞、巨噬细胞活性增强有关,斑块破裂过程中会释放更多ADAMTS1、ADAMTS4进入血液循环,其水平随冠状动脉病变严重程度而进行性升高。ADAMTS1、ADAMTS4可降解血管壁中细胞外基质蛋白多聚糖versican,破坏纤维帽完整性,增加斑块破裂风险。大量研究证实,miR-22对心血管疾病有促进作用,通过抑制miR-22可靶向SIRT1信号通路减轻心脏肥大,上调miR-22则会通过加重线粒体功能障碍导致心肌损伤[17-18]。miR-22过表达会加重线粒体生物抑制反应,诱导氧化应激反应,降低心脏中活性氧水平,对ATAAD发展有促进作用。CD62p是整合素家族成员,主要存在于静息血小板颗粒膜上,在内皮细胞或血小板由于组胺、氧自由基、凝血酶等作用而活化时,内皮细胞的Weibel-palade小体和血小板A颗粒可与细胞膜迅速融合,促使CD62p在细胞膜表面高表达。CD62p具有黏附分子活性,可参与血小板或内皮细胞与中性粒细胞的黏附。有研究指出,经皮冠状动脉介入术后CD62p高水平表达是导致术后血栓形成的重要因素[19]。相关研究证实,冠状动脉粥样硬化狭窄程度越严重,可溶性CD62p水平越高[20],提示CD62p可反映冠状动脉粥样硬化程度。本研究进一步分析显示,在排除手术因素(体外循环时间)、患者自身因素(高血压病、年龄)后,ADAMTS1、ADAMTS4、miR-22和CD62p依然是ATAAD患者预后的独立危险因素,提示ADAMTS1、ADAMTS4、miR-22和CD62p或可为临床评估ATAAD患者预后提供参考。根据多因素Logistic回归分析结果建立列线图预测模型,发现ADAMTS1、ADAMTS4、miR-22和CD62p评估ATAAD患者预后具有较高价值,且校准曲线验证结果显示预测值与实际结果几乎相同,校准曲线接近理想参考线,一致性、精准度、区分度均较好。决策曲线分析结果显示,当风险阈值为0.65~0.85时,ADAMTS1、ADAMTS4、miR-22和CD62p联合检测评估ATAAD患者预后的价值优于单独检测,提示临床评估患者预后时应综合考虑实际情况,不应仅从单一指标进行判断。
综上所述,ADAMTS1、ADAMTS4、miR-22和CD62p高水平表达是ATAAD患者预后较差的独立危险因素,本研究构建的列线图预测模型具有较好的一致性及准确度,可为临床评估ATAAD患者预后提供参考。本研究已尽量选取与患者自身情况及手术相关的变量因素,但由于不同患者个体差异性较大,变量因素选取仍不够全面,临床可多中心选取病例进一步分析,以获取更准确结果。
