石斛碱生物合成途径及萜类化合物CYP450酶的研究进展
2023-01-03覃宏婷龚道勇
覃宏婷, 龚道勇,2, 李 标
(1.中国医学科学院 药用植物研究所,北京 100193;2.重庆大学 生物工程学院,重庆 400045)
0 引 言
石斛碱属于倍半萜类生物碱,拥有Picrotoxane骨架并形成N环和内酯环,具有独特的4环稠合结构[1]。金钗石斛作为石斛药材的基源植物之一,石斛碱被《中国药典》指定为其特征性成分[2]。石斛是我国传统常用名贵中药,首载于《神农本草经》,益胃生津,滋阴清热。《中国药典》中又称其干品为枫斗,用于热病津伤,口干烦渴,胃阴不足。石斛在石斛夜光丸、石斛明目丸、石斛提取液、石斛卫青粉等中成药制剂中广泛使用[3]。在现代药理研究中,石斛碱表现改善肠胃功能[4]、神经保护[5]、心血管保护[6]、抗炎[7]、抗流感病毒[8]等多种药理活性。石斛碱的合成通过植物中的萜类合成途径。其下游的生物合成途径包括骨架的形成及后修饰,骨架的形成一般由萜类合酶催化产生环化和重排等,后修饰一般由CYP450酶催化氧化反应产生各种官能团、脂环。
CYP450酶是最大的蛋白质酶超家族,长期以来因其作为多功能生物催化剂的广泛运用而备受关注[9]。第一种被成功克隆的植物CYP450酶是Bozak等[10]从牛油果植株中所得到。此后发现CYP450酶广泛分布于高等植物中,参与初级代谢和各种次级代谢产物的生物合成。CYP450酶催化的最常见的反应是氧化反应,特殊的还有扩环功能[11]。由此可以看出,CYP450酶的氧化参与后期结构修饰,从功能上鉴定参与石斛碱合成途径的CYP450酶就显得尤为重要。
本文综述了萜类化合物石斛碱生物合成的研究进展,发现石斛碱的合成研究节点为CYP450酶功能挖掘;同时总结了几种药用萜类青蒿酸、丹参酮、鼠尾草酸、人参皂苷、甘草甜素等合成途径中CYP450酶的鉴定和研究手段,发现CYP450酶在这几种萜类中的作用主要是氧化或者多步氧化,氧化的形式有羟基化、羰基化等。本文首次从CYP450酶的功能角度详细分析石斛碱的合成研究进展,以期为石斛碱生物合成途径中的CYP450酶的挖掘和鉴定提供参考。
1 倍半萜类石斛碱生物合成研究进展
1.1 倍半萜生物合成途径
倍半萜类化合物是一大类植物天然产物,其基本骨架来源于异戊二烯五碳结构单元(IPP和DMAPP)的缩合。该生物合成被分为2个阶段,即上游共同前体产生的阶段以及下游的骨架形成和后修饰阶段,如图1所示。其共同前体IPP及其同分异构体DMAPP通过两种途径合成,即MVA与MEP途径;MEP途径也称为非甲羟戊酸酯途径[12]。MVA途径位于细胞质或过氧化物酶体中,它起始于乙酰辅酶A(acetyl-CoA),以通用异戊二烯前体IPP及其同分异构体DMAPP的产生而结束。植物中,所有MEP途径的酶都位于质体中;丹参酮和其他二萜主要通过MEP途径合成[13]。
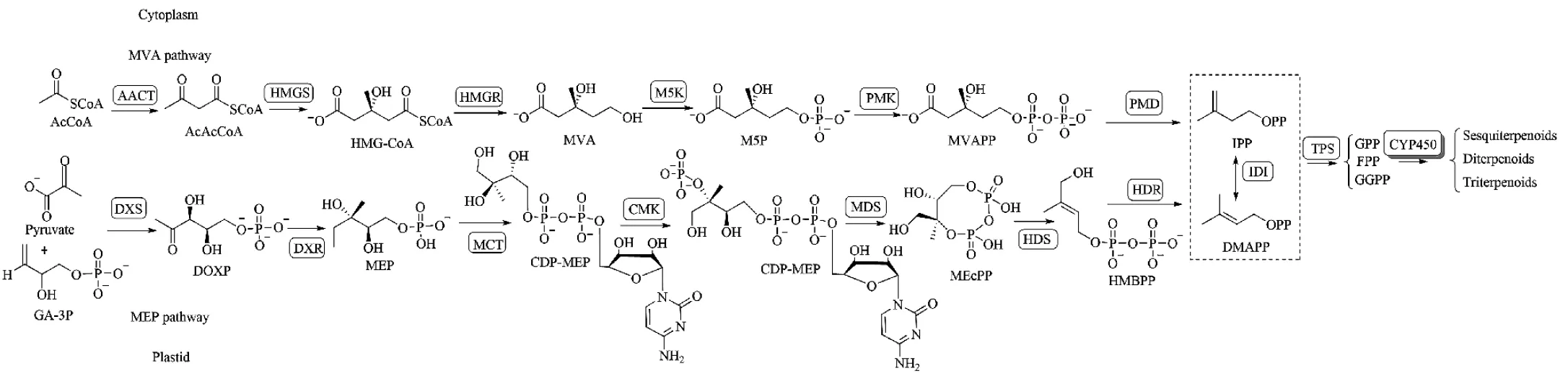
(a) MVA和MEP途径
前体IPP和DMAPP被用来构建萜类骨架,主要由萜类合酶催化。根据异戊二烯单元(C5)的数量,萜类化合物可分为半萜类(C5)、单萜类(C10)、倍半萜类(C15)、二萜类(C20)、三萜类(C30)、四萜类(C40)和多萜类。IPP与DMAPP在异戊烯基二磷酸异构酶(Isopentenyl Diphosphate Isomerase,IDI)的催化可以互相转化。随后,IPP和DMAPP在异戊二烯转移酶(Prenyltransferase)的催化下生成异戊二烯基二磷酸(Prenyl Diphosphate),异戊二烯转移酶也称为异戊二烯基二磷酸化合酶(Isoprenyl Diphosphate Synthase),包括香叶基二磷酸合酶(Geranyl Diphosphate Synthase,GPPS)、法呢基二磷酸合酶(Farnesyl Diphosphate Synthase,FPPS)和香叶基香叶基二磷酸合酶(Geranylgeranyl Diphosphate Synthase,GGPPS)。GPPS被认为参与质体中单萜和一些二萜如赤霉素的生物合成。FPPS将两个分子的IPP与一个分子的DMAPP首尾依次缩合,在细胞质中产生倍半萜和三萜的前体(E,E)-法呢基焦磷酸((E,E)-Farnesyl Pyrophosphate,FPP),同位素示踪实验表明石斛碱在这一步的前体为FPP。IPP和DMAPP也以不同的方式缩合形成(E,E,E)-香叶基香叶基二磷酸酯((E,E,E)-Geranylgeranyl Diphosphate,GGPP),它是植物中二萜类化合物包括丹参酮、类胡萝卜素、赤霉素、生育酚和叶绿素等的前体[14]。随后,后修饰酶进一步将环化骨架修饰成各种萜类化合物。萜类化合物后修饰酶的修饰主要包括骨架结构重排、羟基化、酰基化和糖基化等。
1.2 石斛碱的生物合成研究
石斛碱首次被发现是1932年,日本学者Suzuki[15]从金钗石斛中分离获取并测得其分子式及部分性质;在后续的研究中逐渐确定石斛碱的立体结构,并对其含量和药理作用进行了更广泛的研究。石斛碱生物合成的探索始于1966年,Yamazaki等[16]利用14C同位素示踪技术发现大量甲羟戊酸(Mevalonate,MVA)参与了石斛碱的生物合成,并第一次提出萜类途径参与了石斛碱的生物合成。后续研究在这一基础上进行了改进,不仅标记了碳原子(14C),还标记了氚原子(3H),进一步证明法呢基焦磷酸(Farnesyl Pyrophosphate,FPP)是石斛碱生物合成的关键中间体化合物;推测FPP的磷酸基团位置与异丙基上的C发生环化和去磷酸,随后通过进一步环化产生牻牛儿烷(Muurolane)[17]。基于此,石斛碱的生物合成途径被认为有MVA途径参与,并形成FPP的前体异戊烯基焦磷酸(Isopentenyl Dip-hosphate,IPP)和二甲基烯丙基焦磷酸(Dimethylallyl Diphosphate,DMAPP);又因为IPP与DMAPP的形成还可通过2-C-甲基-D-赤藓糖醇4-磷酸(2-C-Methyl-D-Erythritol 4-Phosphate,MEP)途径,且没有实验证据证明石斛碱与MEP途径无关,所以推测中一般将形成IPP与DMAPP的两条途径MVA和MEP共同看作石斛碱生物合成的上游途径。在这之后,陆续有学者提出从FPP到石斛碱合成过程的结构变化途径假说[18],这些假说途径均通过合成Picrotoxane骨架最后生成石斛碱。由于石斛碱具有Picrotoxane型倍半萜骨架,在萜类化合物中属于Picrotoxane型倍半萜,其合成途径与倍半萜相似。因此,倍半萜生物合成途径日益受到学者的重视。
基于倍半萜的生物合成途径和前人的实验结果,本课题组[3,19]分析了金钗石斛中提取的20种单体化合物,推测了石斛碱的生物合成途径,如图1所示。IPP和DMAPP通过MVA途径从acetyl-CoA起始,最终在FPPS酶的作用下产生FPP。石斛碱的生物合成下游途径始于FPPS酶的催化作用;其次,在萜类合酶的催化下,FPP发生分子内环化反应,形成Muurolene-lactone(图1b);该化合物再发生重排形成Copacamphane-lactone;在CYP450酶的催化下,Copacamphane-lactone生成石斛碱的基本骨架Picrotoxane-lactone。形成基本骨架后,经过氧化、甲基化及胺化最终生成石斛碱。这三步可能通过不同的顺序进行反应生成石斛碱,一方面, Picrotoxane型倍半萜可环化形成Dendronobilin C,然后胺化形成Mubironine B,Mubironine B进一步甲基化形成石斛碱;另一方面,它们也可以直接胺化产生Nobilline,Nobilline环化和脱羧形成石斛碱。途径上的骨架化合物推测都来源于从石斛属植物中分离纯化得到的类似化合物(图1方框所示)。在这条推测路径上,TPS、CYP450、甲基转移酶和氨基转移酶都可能是参与石斛碱生物合成途径的关键酶,其中CYP450酶的氧化功能对石斛碱骨架的后修饰起到关键作用。
虽然推测了石斛碱可能的生物合成途径,但关于石斛碱合成中间体化合物和关键酶基因鲜有报道。在金钗石斛及石斛属植物化合物分离过程中发现大量具有Picrotoxane骨架的化合物,基于此,在分离得到的Picrotoxane型化合物作为底物的情况下使用CYP450酶研究该类化合物如何通过氧化、酯化等修饰作用最终得到石斛碱就显得尤为重要。在石斛碱合成中间体化合物的挖掘上,本课题组从金钗石斛干燥茎中分离得到两个Picrotoxane骨架化合物,其中一个为新结构化合物[20],将为接下来基因功能的研究提供底物。另一方面,本课题组对石斛碱合成通路中合成酶的挖掘也取得一定进展。对于石斛碱合成的上游途径,到目前为止,本课题组已经克隆了HMGS[21]、HMGR[22]和MVD[23]基因,这些基因与石斛碱生物合成上游途径相关。对于石斛碱的下游的未知部分,已经成功构建FPPS酶的体外表达与功能验证,建立起成熟的研究体系;本课题组[24]还通过菌根真菌MF23的诱导,筛选出诱导后表达量显著上调的基因序列,得到了4个可能与石斛碱合成途径高度相关的CYP450酶基因CYP71D10、CYP71D55、CYP735A和CYP94C1。CYP71D10、CYP71D55、CYP735A属于CYP71多家族,CYP94C1属于CYP86多家族。为了深入探究CYP450酶对石斛碱合成的作用,总结萜类的CYP450酶功能和研究手段十分必要。
2 植物萜类生物合成的CYP450酶
2.1 CYP450 基因家族分类
MVA或MEP途径的萜类前体经萜类合酶形成基本骨架后,需要随后的修饰和重排过程来形成最终萜类化合物,这种后修饰作用主要是通过CYP450酶的催化。细胞色素P450酶广泛参与次生代谢产物的生物合成,是一个庞大的基因家族,具有多个分支,通常为催化氧化反应。
同一家族或亚家族中的CYP450酶可能催化同一途径中的连续步骤或不同底物上的类似反应。陆生植物CYP450酶分为CYP51、CYP74、CYP97、CYP710、CYP711、CYP727、CYP746七个单家族以及CYP71、CYP72、CYP85、CYP86四个多家族[25]。CYP71多家族包含了植物次生代谢产物合成的多数CYP450酶[26]。
单家族一般编码同一类重要的功能酶。CYP51是最古老和保守的真核细胞CYP450酶之一,催化甾醇合成中的甾醇14α-sterol的脱甲基反应[27]。此外,CYP51H10有助于通过β-amyrin的羟基化和环氧化进行avenacin A-1的生物合成[28]。CYP710可能从CYP51进化而来,CYP710家族的CYP710A也参与甾醇的生物合成,表现出以β-sitosterol的C-22位去饱和作用[29]。MAX1属于CYP711家族,在类胡萝卜素(Carotenoid)衍生而来的芽体分枝抑制激素的合成中起作用[30]。另一个家族CYP74,通常催化脂肪酸的过氧化氢转化[31]。CYP97家族在类胡萝卜素的生物合成中起作用,具有催化β-carotene环上羟基化的活性[32]。总之,CYP51和CYP710家族都参与甾醇合成,而CYP711和CYP97家族在类胡萝卜素途径中发挥作用,CYP74家族与多重不饱和脂肪酸的氧化代谢有关[33]。在多家族中,CYP86家族更保守,只有四个家族,它们与脂肪酸及其衍生物的代谢有关[34]。CYP85家族与萜类植物激素代谢有关[35]。CYP720是CYP85家族的成员,参与针叶树防御相关的萜类生物合成[36]。CYP72家族与脂肪酸、萜类、植物激素和细胞分裂素的代谢有关[37]。CYP71作为植物中最大的CYP450家族具有巨大的功能多样性,包括氨基酸衍生物、萜类化合物、生物碱、脂肪酸和激素前体的代谢[38]。
参与药用植物萜类生物合成的CYP450主要分布在CYP71、CYP85和CYP72家族中。金钗石斛转录组中筛选的CYP450酶属于CYP71、CYP73和CYP94这三个多家族。修饰和催化形成青蒿素、丹参酮、鼠尾草酸、人参皂苷、甘草甜素的CYP450酶分别在CYP71、CYP72、CYP85、CYP86个多家族中都有出现,其功能都非常相似,都是催化底物发生一步氧化(羟基化)或者多步氧化(醛基化),如表1。特殊的有丹参酮途径中的CYP76AH1能够催化丹参酮二烯的芳构化。

表1 植物药用萜类合成的CYP450 基因家族分类
2.2 萜类合成途径CYP450酶功能研究
萜类合成途径中CYP450酶的研究非常广泛,例如青蒿素、丹参酮、鼠尾草酸、人参皂苷以及甘草甜素的合成途径中CYP450酶解析比较透彻,为解析石斛碱生物合成途径提供了重要依据。
青蒿素是我国首次发现的有效抗疟药,与现有抗疟药相比,作用更快,毒性更低。CYP71AV1作为一种多功能倍半萜类氧化酶,在青蒿素生物合成途径中起关键作用,参与中间体紫穗槐-4,11-二烯(Amorpha-4,11-diene)、青蒿素醇(Artemisinic alcohol)和青蒿素醛(Artemisinic aldehyde)的异丙基上多步氧化形成青蒿素酸(Artemisinic acid)[39],见图2(蓝色)。

图2 药用萜类化合物的生物合成途径及其与石斛碱的关系
二萜类丹参酮(Tanshinone)是中药丹参中主要的亲脂性生物活性成分,包括丹参酮Ⅰ、丹参酮IIA、隐丹参酮和二氢丹参酮I[49]。其中,丹参酮IIA被认为是最重要的生物活性成分。近年来,丹参中丹参酮生物合成的基因组、转录组CYP450酶基因表达鉴定研究已有报道[40,50-52]。两种重要的萜类环化酶,共烯丙基二磷酸合酶(Copalyl Diphosphate Synthase,CPS)和贝壳杉烯合酶(Kaurene Synthase-Like,KSL),参与半日花烷(Labdane)相关二萜的生物合成。SmCPS1催化一般二萜前体GGPP环化为椰油酰二磷酸(Copalyl Diphosphate)[53],再由SmKSL1进一步转化为丹参酮的前体丹参酮二烯(Miltiradiene)。CYP76AH1催化了一个独特的四电子氧化级联反应,包括芳构化和在碳-12位引入氧原子,在丹参酮生物合成的后期生成弥罗松酚(Ferruginol)[40],见图2(粉色)。Ma等[54]通过RNAi技术下调CYP76AH1基因,导致Miltiradiene积累显著增加,丹参酮含量降低,验证了其在丹参酮生物合成中的关键作用。此外,CYP76AH亚家族的一些其他成员也被证明在萜类生物合成中起类似的作用。CYP76AH4是丹参CYP76AH1的迷迭香直系同源物,通过芳香中间体Miltiradiene的羟基化,在酚类二萜生物合成中产生Ferruginol[42]。随后的研究表明,CYP76AH3和CYP76AK1这两个CYP450酶依次作用,形成丹参酮生物合成的分叉途径[41]。RNAi和生化研究表明,这两种CYP450酶都表现出多底物催化功能。CYP76AH3在C-11位羟基化形成11-羟基弥罗松酚(11-Hydroxy Ferruginol),或先在C-7酮基化再C-11羟基化形成11-羟基柳杉酚(11-Hydroxy Sugiol)。CYP76AK1分别催化11-Hydroxy Ferruginol和11-Hydroxy Sugiol产生11,20-二羟基弥罗松酚(11,20-Dihydroxy Ferruginol)或11,20-二羟基柳杉酚(11,20-Dihydroxy Sugiol)。CYP76AH3在底物选择性和催化活性方面表现出多样性,而CYP76AK1表现出底物多样性,这表明丹参酮生物合成过程中存在分叉。除此之外,CYP76AH3的敲除实验仅略微减少丹参酮的积累,这反映了CYP76AH3可能为非限速酶。相比之下,CYP76AK1的过表达增加了丹参酮产量,这表明它在丹参酮的生产中起着更加重要的作用。
Miltiradiene和Ferruginol是松香烷型(Abietane-type)二萜,不仅作为丹参中丹参酮的前体,也是迷迭香中鼠尾草酸(Carnosic acid)的前体。Boži等[55]筛选来自鼠尾草的三个候选CYP450酶基因SfFS、RoFS1和RoFS2(Ferruginol Synthases,FS),并鉴定了其参与鼠尾草酸生物合成途径。系统发育分析表明,这三个CYP450酶都属于大CYP71家族的CYP76亚组,与唇形科CYP76AH1和CYP76AH4密切相关。在其他研究中,CYP76AH24、CYP76AK6和CYP76AK8催化了鼠尾草酸生物合成的大多数氧化反应[43],见图2(浅粉色)。作为一种双功能酶,CYP76AH24催化松香三烯(Abietatriene)的C-12和C-11连续氧化生成11-Hydroxy Ferruginol,与厚朴中的CYP76AH4具有相同的作用。由于连续氧化产生11-Hydroxy Ferruginol, CYP76AH4、CYP76AH22、CYP76AH23和CYP76AH24,都被重新命名为11-羟基弥罗松酚合酶(11-Hydroxy Ferruginol Synthases)[56]。迷迭香中的CYP76AK8是CYP76AK6的直系同源,这两个CYP450酶可以相继氧化labdane骨架上的C-20[44]。
人参皂苷(Ginsenoside)是一类四环三萜皂苷,主要分布在人参的根部。人参皂苷生物合成的第一步是2,3-氧化喹烯(2,3-Oxidosqualene)的环化,形成达玛烯二醇(Dammarenediol-II),由氧化喹烯环化酶组的达玛烯二醇合酶(Dammarenediol Synthase,DDS)催化[57]。据报道,达玛烷型三萜(Dammarane-type Triterpenoid)是人参皂苷的主要成分,具有原人参二醇(Protopanaxadiol)和原人参三醇(Protopanaxatriol)两种不同的苷元结构。研究发现有两个CYP450酶基因参与人参中达玛烯型人参皂苷的生物合成,见图2(浅绿色)。其中CYP716A47酶参与了Dammarenediol-II在C-12位的羟基化,生成Protopanaxadiol[45]。另一个酶CYP716A53v2参与Protopanaxadiol在C-6位的羟基化,产生Protopanaxatriol[58]。此外,三七中也发现了一个与CYP716A53v2同源序列,起到同样的催化作用[46]。CYP716A47和CYP716A53v2这两个CYP450酶分别作为Dammarenediol C-12羟化酶和Protopana-xadiol C-6羟化酶参与了达玛烷型人参皂苷的合成。CYP716A53v2的过表达和RNAi可以改变人参皂苷含量的积累[59]。
甘草甜素(Glycyrrhizin)作为齐墩果烷型三萜(Oleanane-type Triterpenoid)的典型代表,在世界范围内被用作天然甜味剂和药用材料。在甘草甜素合成途径中,三萜类化合物的常见前体2,3-oxidosqualene最初环化为三萜骨架β-香树脂醇(β-amylin)。CYP88D6基因编码β-amyrin氧化酶(β-amyrin 11-oxidase),其在体外和体内被证明催化β-amyrin在C-11顺序两步氧化,产生11-氧代-β-香树脂醇(11-oxo-β-amyrin)[47],见图2(绿色)。此外,11-oxo-β-amylin向甘草甜素的转化还需要在C-30位进一步氧化和C-3羟基的葡萄糖醛酸化。在甘草甜素等三萜皂苷生物合成的后期,三萜骨架的位点特异性氧化主要由CYP450酶催化。在鉴定了甘草甜素生物合成中最初的CYP450酶基因CYP88D6后[60],CYP72A亚家族也被认为参与了豆科植物中三萜皂苷的生物合成。CYP72A154能够通过三个连续步骤氧化11-oxo-β-amyrin的C-30,产生甘草次酸(Glycyrrhetinic acid),一种甘草甜素苷元[48]。
综上,CYP450酶家族广泛参与了萜类化合物的合成并在其中扮演着重要作用;随着技术手段的不断发展与研究的深入,将会有越来越多CYP450酶被发现。目前,对CYP450酶的研究主要是构建转录组文库,从文库中筛选出显著差异的CYP450酶基因进行组织特异性分析,随后对其进行功能分析。
3 CYP450酶的研究手段
3.1 基因的筛选
Eljounaidi等[61]利用花楸UniGene数据库搜索关键词Germacrene A氧化酶和广木香内酯合成酶,随后通过同源检索得到匹配度最高的同源物种洋蓟中的CYP450基因CYP71AV9和CYP71BL5。由于CYP716家族的特征是参与特定的三萜或皂苷元生物合成,因此来自蒺藜苜蓿的CYP716A12被用于在黄花蒿转录组数据集中筛选候选CYP450酶基因。结果,其中一个与CYP716A12相似度为63%的序列被注释为CYP716A14v2,并最终被鉴定为功能性三萜氧化酶[62]。
根据植物组织或多因子诱导表达差异筛选。植物黄花蒿的倍半萜类物质在其腺毛中分泌,因此Teoh等[39]为了鉴定与青蒿素生物合成相关的基因,从黄花蒿中分离腺毛,用作EST检索的mRNA数据源,发现12个CYP71D亚家族基因。西洋参的重要成分人参皂苷主要在根部,根部组织特异性结合茉莉酸甲酯(MeJA)诱导表达模式分析更有助于鉴定参与人参皂苷生物合成的酶[63]。西洋参根转录组EST测序和分析发现150个序列被注释为CYP450酶基因;结合MeJA诱导性上调进一步缩小范围,发现MeJA上调了6个CYP450酶基因,其中只有contig00248具有与Dammarenediol-II合酶相似的组织特异性表达模式,发现contig00248是催化达玛烷或原人参二醇氧化的候选基因[63]。
3.2 CYP450酶基因表达与功能鉴定
基因表达和酶功能鉴定方式使用基因工程的多重手段。在筛选得到所需要的CYP450酶基因序列后,通过克隆或全合成手段得到DNA序列,与载体系统(病毒、细菌质粒或噬菌体)的DNA组合成一个重组质粒。这样形成的重组质粒可以先转化或转染至大肠杆菌中,克隆和筛选出成功转化的含重组质粒的菌体,再从中提出重组质粒导入适当的表达体系(大肠杆菌、酵母或植物),使重组基因在细胞内表达,优化表达条件,产生所需要的CYP450蛋白。原核(大肠杆菌)表达产生的蛋白可以纯化后在体外加入底物分子共催化然后检验是否有催化产物生成,或者不进行蛋白纯化,直接在真核系统(酵母或植物)中加入底物分子检验酶的催化功能。例如,参与三萜合成的三个CYP716A亚家族基因CYP716A12、CYP716A15、CYP716A17使用了酵母表达体系鉴定[64]。CYP716A14v2通过在酵母和本氏烟草中表达,表征了其催化五环三萜的氧化,产生在C-3位羰基化的三萜的催化功能[62]。
3.3 异源合成与优化
CYP450酶作用的发挥依靠宿主细胞中内源性合成途径、膜结合相关的内质网以及大量遗传工具如蛋白修饰酶、伴侣蛋白等。所以将原植物的CYP450转入微生物系统中发挥作用存在许多挑战。为了在有效成分的异源合成中提升产量,蛋白质工程、氧化还原伴侣工程、底物工程及代谢工程等多种工程化改造手段相继被应用于P450酶的改造优化[65]。Keasling等[66]设计了一条全新的青蒿酸合成途径,将来自植物黄花蒿以及单细胞系统大肠杆菌、酵母中的多种基因精确组装和调控,优化表达,削弱酵母中FPP的支路途径,表达来自黄花蒿的CYP71AV1,成功构建了青蒿酸高产量达工程菌株。
4 讨论与展望
多年来,合成生物学的发展促进了萜类代谢的研究,为生产高价值的萜类产品提供了工程平台。然而,由于代谢和调节网络的复杂多样性,植物萜类工程仍然面临巨大挑战。但是青蒿素等萜类化合物合成的成功解析为接下来多种萜类化合物的生物合成探索提供了重要参考。CYP450酶在萜类生物合成中是复杂且至关重要的。克隆药物萜类生物合成的关键CYP450酶基因对于天然生产生物体和替代微生物的工程具有巨大的前景,以产生大量用于商业目的的目标分子。
天然产物一直是药物分子设计和开发过程中的重要灵感来源之一,源自天然产物的临床用药目前也占据着难以替代的地位。石斛碱及石斛碱类生物碱具有独特的化学结构,但是这类分子结构复杂、分离困难,利用传统的化学合成和天然产物化学方法难以满足日益增长的研究需求和市场需求。石斛碱类生物碱作为中药石斛特有的次生代谢产物和活性成分,具有广阔的应用前景。目前报道的此类化合物只有31种,而仅中国石斛属植物就有近80种。随着提取和分离技术的进步,可能会发现更多的化合物。目前对石斛碱类生物碱药理活性的研究主要集中在总生物碱和石斛碱两个方面。原因之一是通过传统提取和分离方法获得的其他生物碱的量非常少。如果石斛碱可以通过生物合成获得,那么其他具有Picrotoxane结构的石斛碱类生物碱可以通过后修饰获得。后修饰CYP450酶的催化反应对石斛碱类化合物最终结构的形成至关重要,其相关基因的功能研究鉴定有待进一步探索。
作为酶底物的中间体的获取也是一项难点,可以参考两种解决办法。一种是在构建加入萜类前体FPP的Picrotoxane合酶合成体系,生产中间体;另一种是通过天然药化手段从金钗石斛中提取得到Picrotoxane骨架的中间体化合物。后者由于天然产物分离过程的不确定性,可以建立课题组的中间体化合物库,作为标准品建立化合物离子质谱信息库,建立组内的代谢组学平台用于检测金钗石斛不同分离流分中的Picrotoxane类化合物含量,精准分离以提高得率。本课题组将继续探索石斛碱生物合成的构建,通过克隆萜类合成酶基因、构建酵母真核表达系统、加入分离的底物Picrotoxane型化合物等手段来解析石斛碱生物合成。
目前,已经有石斛碱合成关联CYP450酶基因通过金钗石斛转录组挖掘出来,下一步的方向是对这些相关基因进行表达和功能验证。
