circ_DONSON靶向miR-671-5p影响肺癌细胞放射敏感性的实验研究
2022-02-10覃波,陆录,赵涛
覃 波, 陆 录, 赵 涛
(湖北省利川市人民医院肿瘤科, 湖北 利川 445400)
肺癌是全球发病率和死亡率最高的恶性肿瘤,多数患者确诊时已处于中晚期,失去最佳手术治疗时期[1]。放疗是晚期肺癌治疗的主要手段,然而,肺癌细胞对放射线产生的抗性(即放疗抵抗)常导致放疗效果不佳[2],因此,增强肺癌细胞的放射敏感性对于提高放疗疗效、改善患者预后尤为重要。环状RNA(circular RNA,circRNA)和微小RNA(microRNA,miRNA)是真核生物中广泛存在的两类非编码RNA,且circRNA可与miRNA靶向结合,调控miRNA靶基因的表达,进而发挥生物学调控作用,在肿瘤的发生发展及放疗抵抗中起重要调控作用[3~5]。研究显示,circ_DONSON在神经胶质瘤和胃癌中的表达均明显增加,其发挥促癌基因作用促进肿瘤细胞恶性表型,是神经胶质瘤和胃癌治疗的潜在分子靶点[6,7]。然而,circ_DONSON对肺癌发生发展和放疗抵抗的影响还未知。Starbase靶基因在线软件预测显示,circ_DONSON可能与miR-671-5p存在靶向调控关系。据报道,miR-671-5p的过表达可通过靶向抑制小脑变性相关蛋白1阻碍肺癌细胞迁移和侵袭[8]。本研究主要探究了circ_DONSON和miR-671-5p对肺癌细胞放射敏感性的影响及circ_DONSON能否靶向miR-671-5p发挥作用,以期为改善肺癌放疗抵抗提供分子靶点。
1 资料与方法
1.1临床资料:收集于2018年5月至2020年10月于本院行手术治疗的43例肺癌患者的癌组织及癌旁组织,液氮保存,其中男性25例,女性18例,平均年龄(57.26±7.21)岁。纳入标准:首次确诊;术前未行放疗、化疗等治疗。排除标准:合并其他恶性肿瘤患者。本研究符合《赫尔辛基宣言》原则。
1.2细胞和试剂:A549细胞系,中国科学院上海细胞库;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒,大连宝生物;RPMI 1640培养基、细胞计数试剂盒-8(cell counting kit-8,CCK-8)、双荧光素酶活性检测试剂盒、LipofectamineTM 2000试剂盒、二喹啉甲酸蛋白检测试剂盒和膜联蛋白V(Annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)凋亡检测试剂盒,北京索莱宝科技有限公司;胎牛血清,美国Hycolne公司;引物序列、circ_DONSON小干扰RNA(si-circ_DONSON)、乱序无意义阴性序列(si-NC)、miR-671-5p模拟物(mimcs)、模拟对照序列(miR-NC)、miR-671-5p抑制剂(inhibitor),上海生工;兔抗人活化的半胱天冬酶-3(Cleaved-caspase3)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体及山羊抗兔二抗,中国Abcam公司。
1.3方 法
1.3.1实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测circ_DONSON和miR-671-5p表达在液氮保护下将收集的组织样本充分研磨,用RNA抽提试剂盒提取组织样本中总RNA,逆转录为cDNA后,行PCR扩增。引物序列:circ_DONSON上游5'-GTCGACTAGCGGCTCGACCGC-3',下游5'-CGATAGGCGCTGCCTAGCCG-3';GAPDH上游5'-GGAGCGAGATCCCTCCAAAAT-3',下游5'-GGCTGTTGTCATACTTCTCATGG-3';miR-671-5p上游5'-AGGAAGCCCTGGAGG-3',下游5'-GAACATGTCTGCGTATCTC-3';U6上游5'-AAAGCAAATCATCGGACGACC-3',下游5'-GTACAACACATTGTTTCCTCGGA-3'。2-△△Ct法计算circ_DONSON相对GAPDH、miR-671-5p相对U6的表达量。
1.3.2细胞培养和照射处理:用含10%胎牛血清的RPMI 1640培养液(完全培养液)培养A549细胞。将对数期A549细胞接种至6孔板中(1.0×105个/孔),培养12h后,一次性给予2Gy、4GyX-ray照射[5],剂量率为1.907Gy/min,源板距50cm。照射后,培养24h,收集细胞,用RT-qPCR法检测细胞中circ_DONSON和miR-671-5p表达,方法同1.3.1。同时设置对照组,细胞常规培养,不进行照射处理。
1.3.3细胞转染:将对数期A549细胞接种至6孔板中(1.0×105个/孔),培养24h后,弃培养液,加不含FBS的RPMI 1640培养液。然后用LipofectamineTM 2000脂质体法,分别转染si-circ_DONSON、si-NC、miR-671-5p mimic、miR-NC、共转染si-circ_DONSON与miR-671-5p inhibitor(si-circ_DONSON+miR-671-5p inhibitor)。转染6h后,弃培养液,加完全培养液。再培养24h,RT-qPCR法检测细胞中circ_DONSON或miR-671-5p表达验证转染效果,方法同1.3.1。
1.3.4CCK-8法检测细胞增殖活性:将未转染的A549细胞(对照组)、转染si-circ_DONSON、si-NC、miR-671-5p mimic、miR-NC、si-circ_DONSON+miR-671-5p inhibitor的A549细胞均接种至96孔板中(5.0×104个/孔),培养12h后,均一次性给予4Gy X-ray照射,照射条件同1.3.2。照射后,再培养24h。加10μL CCK-8,孵育2h后,酶标仪(450nm)测光密度(optical density,OD)值。OD值越大,说明细胞增殖活性越强。
1.3.5克隆形成实验检测细胞集落形成:将未转染的A549细胞(对照组)、转染si-circ_DONSON、si-NC、miR-671-5p mimic、miR-NC、si-circ_DONSON+miR-671-5p inhibitor的A549细胞均接种至6孔板中(1.0×105个/孔),培养12h后,均一次性给予4Gy X-ray照射,照射条件同1.3.2。照射后,继续培养10~14d。当出现肉眼可见的集落时,弃培养液。用4%多聚甲醛固定30min,0.4%结晶紫染色15min,显微镜观察,统计集落形成数。
1.3.6流式细胞术检测细胞凋亡:细胞接种及照射处理同1.3.5。照射后,继续培养24h。弃培养液,收集各组细胞。利用Annexin V-FITC/PI试剂盒检测细胞凋亡。
1.3.7蛋白质印迹法检测细胞中Cleaved-caspase3表达:细胞接种及照射处理同1.3.5。照射后,继续培养24h。然后弃培养液,收集各组细胞。用RIPA试剂提取细胞中总蛋白,经二喹啉甲酸试剂盒测蛋白浓度后进行电泳分离。然后将分离蛋白进行转膜和封闭处理后,在4℃冰箱中分别用Cleaved-caspase3(1∶500)和GAPDH(1∶1000)一抗孵育过夜。洗膜后,再于37℃摇床中用山羊抗兔二抗(1∶1000)孵育2h。加显影液,避光显影,曝光拍照,Image J软件分析Cleaved-caspase3相对GAPDH的表达量。
1.3.8双荧光素酶报告基因实验:由上海生工生物工程有限公司采用PCR技术扩增含miR-671-5p结合位点的circ_DONSON核苷酸序列,插入pGL3空载体,构建circ_DONSON野生型荧光素酶报告基因载体(WT-circ_DONSON);同时将结合位点突变后进行扩增,插入pGL3空载体,构建circ_DONSON突变型荧光素酶报告基因载体(MUT-circ_DONSON)。将对数期A549细胞接种至6孔板中(1.0×105个/孔),培养24h后,弃培养液。加不含FBS的RPMI 1640培养液。用LipofectamineTM 2000脂质体法,分别共转染WT-circ_DONSON与miR-671-5p mimic或miR-NC、MUT-circ_DONSON与miR-671-5p mimic或miR-NC。转染6 h后,更换为完全培养液。再培养24 h,裂解细胞。离心(3500 r/min、5 min),取上清液,检测荧光素酶活性,结果以萤火虫与海肾的荧光强度比值表示。
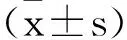
2 结 果
2.1circ_DONSON和miR-671-5p在肺癌组织中的表达及其与患者临床指标之间的关系分析:肺癌组织中circ_DONSON的表达量为4.27±0.38,高于癌旁组织中circ_DONSON的表达量(0.80±0.13,t=56.656,P<0.05);而miR-671-5p的表达量为0.37±0.07,低于癌旁组织中miR-671-5p的表达量(0.37±0.07,t=34.457,P<0.05)。见图1。
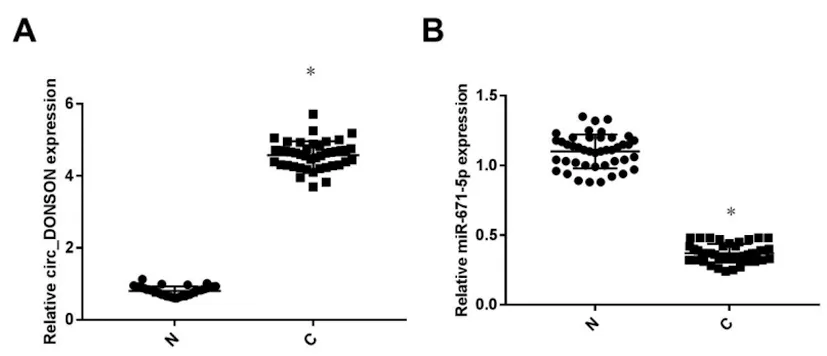
图1 肺癌组织中circ_DONSON和miR-671-5p的表达
2.2X-ray对肺癌细胞A549中circ_DONSON和miR-671-5p表达的影响:与对照组肺癌细胞A549比较,A549细胞经剂量(2Gy、4Gy) X-ray照射后,细胞中circ_DONSON表达升高(P<0.05),而miR-671-5p表达降低(P<0.05)。见表1。
表1 X-ray对肺癌细胞A549中circ_DONSON和miR-671-5p表达的影响
2.3沉默circ_DONSON对肺癌细胞增殖凋亡的影响:对照组、转染si-NC、si-circ_DONSON的肺癌细胞A549中circ_DONSON表达分别为1.00±0.00、0.99±0.04、0.16±0.01,三组比较差异具有统计学意义(F=1230.529,P<0.05)。转染si-circ_DONSON的A549细胞中circ_DONSON表达显著低于对照组和转染si-NC的A549细胞(P<0.05),表明沉默circ_DONSON的A549细胞构建成功。与对照组和转染si-NC的A549细胞比较,转染si-circ_DONSON的A549细胞经4Gy X-ray照射后,细胞增殖活性和集落形成数降低(P<0.05),而细胞凋亡率和细胞中Cleaved-caspase3蛋白表达均升高(P<0.05)。见图2、表2。
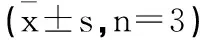
表2 沉默circ_DONSON对X-ray处理的肺癌细胞增殖和凋亡的影响
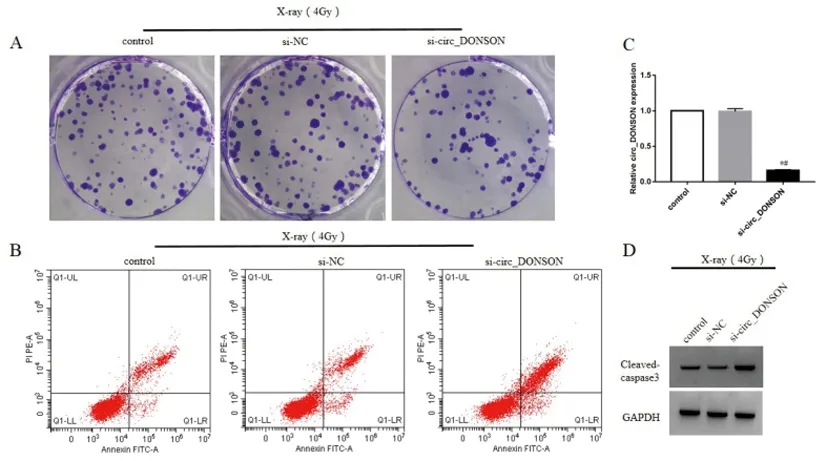
图2 沉默circ_DONSON对X-ray处理的肺癌细胞集落形成和凋亡的影响
2.4沉默circ_DONSON靶向调控miR-671-5p:Starbase靶基因在线软件预测显示的circ_DONSON与miR-671-5p的结合位点见图3。共转染WT-circ_DONSON与miR-671-5p mimic的肺癌细胞A549荧光素酶活性为0.28±0.02,明显低于共转染WT-circ_DONSON与miR-NC的A549细胞荧光素酶活性1.00±0.09(t=13.526,P<0.05);共转染MUT-circ_DONSON与miR-671-5p mimic的A549细胞荧光素酶活性为0.99±0.07,与共转染MUT-circ_DONSON与miR-NC的A549细胞荧光素酶活性1.02±0.11比较无显著差异(P>0.05),说明circ_DONSON可靶向结合miR-671-5p。同时,转染si-circ_DONSON的A549细胞中miR-671-5p表达为4.66±0.21,明显高于转染si-NC的细胞中miR-671-5p的表达1.00±0.02(t=30.051,P<0.05),说明沉默circ_DONSON促进A549细胞中miR-671-5p表达。
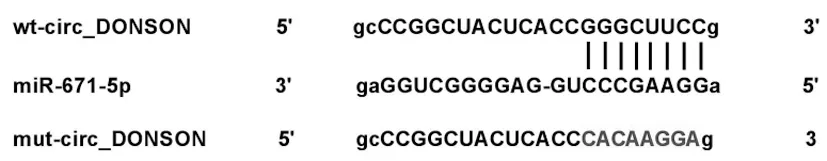
图3 circ_DONSON与miR-671-5p的互补序列
2.5过表达miR-671-5p对X-ray处理的肺癌细胞增殖和凋亡的影响:对照组、转染miR-NC、miR-671-5p mimic的肺癌细胞A549中miR-671-5p表达分别为1.00±0.00、0.98±0.09、4.01±0.21,三组比较差异具有统计学意义(F=524.178,P<0.05)。转染miR-671-5p mimic的A549细胞中miR-671-5p表达显著高于对照组和转染miR-NC的A549细胞(P<0.05),表明过表达miR-671-5p的A549细胞构建成功。与对照组和转染miR-NC的A549细胞比较,转染miR-671-5p的A549细胞经4Gy X-ray照射后,细胞增殖活性和集落形成数降低(P<0.05),而细胞凋亡率和细胞中Cleaved-caspase3蛋白表达均升高(P<0.05)。见图4、表3。
图4 过表达miR-671-5p对X-ray处理的肺癌细胞集落形成和凋亡的影响
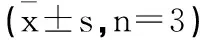
表3 过表达miR-671-5p对X-ray处理的肺癌细胞增殖和凋亡的影响
2.6抑制miR-671-5p降低沉默circ_DONSON对X-ray处理的肺癌细胞增殖和凋亡的影响:对照组、转染si-circ_DONSON、共转染si-circ_DONSON与miR-671-5p inhibitor的肺癌细胞A549中miR-671-5p表达分别为1.00±0.00、4.63±0.23、1.26±0.09,三组比较差异具有统计学意义(F=604.953,P<0.05)。共转染si-circ_DONSON与miR-671-5p inhibitor的A549细胞中miR-671-5p表达显著低于对照组和转染si-circ_DONSON的A549细胞(P<0.05),表明A549细胞中miR-671-5p表达受到抑制。与转染si-circ_DONSON的A549细胞比较,共转染si-circ_DONSON与miR-671-5p inhibitor的A549细胞经4 Gy X-ray照射后,细胞增殖活性和集落形成数升高(P<0.05),而细胞凋亡率和细胞中Cleaved-caspase3蛋白表达均降低(P<0.05)。见图5、表4。
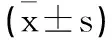
表4 抑制miR-671-5p降低沉默circ_DONSON对X-ray处理的肺癌细胞增殖和凋亡的影响
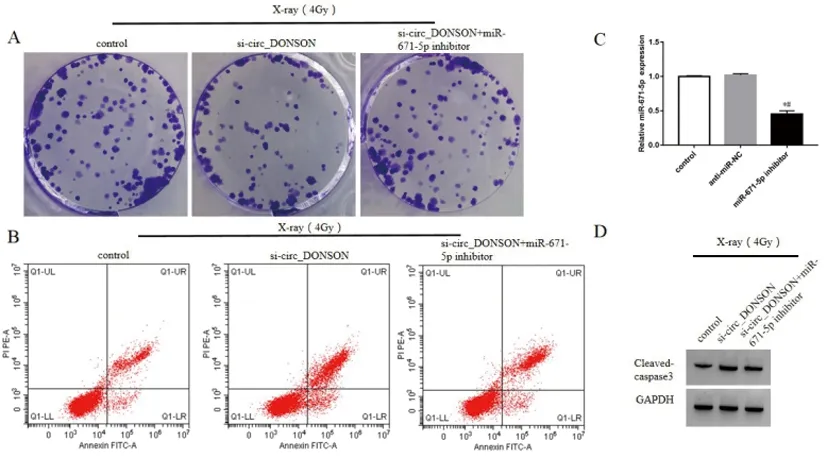
图5 抑制miR-671-5p降低沉默circ_DONSON对X-ray处理的肺癌细胞集落形成和凋亡的影响
3 讨 论
肺癌的发生发展及放疗抵抗与原癌基因的激活及抑癌基因的失活密切相关,探究肺癌中异常表达的基因分子及其对肺癌生发展和放疗抵抗的影响,可为肺癌发病机制的阐明及治疗靶点的选择提供新途径。circRNA呈闭合环状,稳定性较强,且高度保守。当前研究显示,肺癌中存在大量异常表达的circRNA,这些circRNA可通过发挥miRNA分子海绵作用,调控miRNA靶基因的表达,进而影响肺癌细胞的恶性表型及放射敏感性,对肺癌发生发展及治疗效果起调控作用[9,10]。研究显示,下调circ_0086720可通过调节miR-375/SPIN1轴增强了肺癌细胞对放射线的敏感性,circ_0086720有可能成为改善肺癌放射治疗疗效的分子靶点[11];circPVT1沉默的肺癌细胞进放射线处理后其增殖和侵袭能力降低,说明了沉默circPVT1可促进肺癌细胞对放射线的敏感性[12]。circ_DONSON是近年来新发现的一种circRNA,其对肺癌放射敏感的影响还未知。
本研究结果显示,肺癌组织中circ_DONSON的表达高于癌旁组织,提示circ_DONSON可能促进肺癌发展进程;将肺癌细胞置于放射线下照射后,细胞中circ_DONSON的表达增加,而沉默circ_DONSON可降低放射线照射的A549细胞增殖活性和集落形成数,并提高细胞凋亡率,这表明沉默circ_DONSON可增强A549细胞对放射线的敏感性,circ_DONSON有可能成为改善肺癌放疗抵抗的分子靶点。细胞凋亡受多种基因分子的调控,其中caspase级联反应在细胞凋亡中起关键调控作用。caspase3是caspase级联反应的核心分子,其在受到上游凋亡信号刺激后被活化后生成Cleaved-caspase3,进一步剪切各种细胞底物,诱导细胞凋亡[13]。本研究结果显示,沉默circ_DONSON可促进放射线处理的肺癌细胞中caspase3的活化,提示其可能通过调控caspase级联反应来影响肺癌细胞凋亡,进而影响肺癌细胞放射敏感性。
为了进一步探究沉默circ_DONSON增强肺癌细胞A549放射敏感性的分子机制,本研究证实了circ_DONSON可靶向结合并负调控miR-671-5p。miR-671-5p参与多种肿瘤的发展进程。研究显示,桂枝茯苓丸可通过上调miR-671-5p的表达削弱人皮肤恶性黑色素瘤细胞的增殖、迁移和侵袭能力,具有治疗黑色素瘤的潜在价值[14];骨肉瘤组织和细胞系中miR-671-5p表达下调,过表达MiR-671-5p了通过靶向抑制釉丛蛋白1(tuftelin 1,TUFT1)的表达阻止骨肉瘤细胞生长、迁移和侵袭,miR-671-5p/TUFT1轴可能为骨肉瘤的治疗提供了新靶点[15];miR-671-5p通过降低乳腺癌细胞的DNA修复能力增强其对紫外线和化疗药物的敏感性。本研究结果显示,miR-671-5p在肺癌组织及放射线照射的肺癌细胞A549中表达减少,提示miR-671-5p有可能参与肺癌放射敏感性;进一步研究发现,放射线照射的过表达miR-671-5p的A549细胞增殖活性及集落形成数较未过表达miR-671-5p的A549细胞明显降低,而凋亡率和细胞中Cleaved-caspase3蛋白表达明显升高,提示过表达miR-671-5p可增强放射线照射对A549细胞增殖的抑制作用及凋亡促进作用,即过表达miR-671-5p增强了A549细胞的放射敏感性。此外,本研究还显示,沉默miR-671-5p降低了沉默circ_DONSON对放射线照射的A549细胞增殖和凋亡的影响,提示circ_DONSON可能通过靶向抑制miR-671-5p表达来促进肺癌细胞放疗抵抗。
综上,放射线照射可引起肺癌细胞中circ_DONSON的表达增加,而miR-671-5p表达减少;沉默circ_DONSON可抑制放射线处理的肺癌细胞增殖,并促进其凋亡,增强肺癌细胞放射敏感性,其作用机制可能与靶向结合并负调控miR-671-5p表达有关。