昼夜节律对肝脏胆固醇代谢的影响*
2022-12-30李晶津王佳玉金泽宁
李晶津 王佳玉 金泽宁
首都医科大学附属北京天坛医院 (北京, 100070)
肝脏是胆固醇代谢的重要器官,而胆固醇的水平是影响动脉粥样硬化疾病的重要因素,临床上治疗动脉粥样硬化的基石药物他汀类药物,通过竞争性抑制内源性胆固醇合成限速酶,阻断细胞内羟甲戊酸代谢途径,抑制肝脏合成胆固醇[1]。昼夜节律系统是一种进化上保守的计时机制,控制哺乳动物每日的行为和生理节律,使之与外环境计时同步,以确保机体保持最佳的适应能力[2]。脏器的时钟节律由转录激活因子(CLOCK/BMAL1)和抑制因子(PER/CRY)组成的转录/翻译负反馈环驱动,并调节参与关键细胞功能的基因的节律性表达[3,4]。有研究报道,昼夜节律与肝脏相关脂代谢密切相关,CLOCK可节律性调控肝脏中甘油三酯水平 ,肝脏中敲除BMAL1后表现出能量代谢的紊乱及氧化损伤的累积[5,6]。本研究旨在通过生物信息的分析,研究昼夜节律对肝脏胆固醇代谢的影响,探讨昼夜节律通过胆固醇代谢调节动脉粥样硬化的作用。
1 资料与方法
1.1 研究对象 通过GEO数据库搜索关键字“昼夜节律”“小鼠”“肝脏组织”“饮食干预”“昼夜节律基因调节”获取相关研究样本数据。GSE52333检测样本数36(高脂饮食小鼠vs正常饮食小鼠)[7],GSE70497检测样本数24(昼夜节律基因Artnl敲除型小鼠vs野生型小鼠)[8]。
1.2 生物信息学分析 利用CirGRDB获得具有昼夜节律的基因表达谱[9],利用KEGG数据库检索胆固醇代谢通路相关基因[10],筛选出具有节律性的肝脏胆固醇代谢相关基因。
1.3 统计学方法 基因表达谱数据采用GraphPad Prism 5.0.1软件处理,结果以均数± 标准差表示。利用Lomb-Scargle 周期表算法预测时间序列的周期性(LSPR)分析方法获得相关基因的昼夜节律显著性(P值)、昼夜节律振幅(amplitude)、昼夜节律时相(即节律的波峰点,phase)[11]。
2 结果
2.1 小鼠肝脏昼夜节律表达基因谱分析 通过生物信息学分析两组芯片数据,发现高脂饮食小鼠肝脏中具有昼夜节律的基因有3 337个,昼夜节律基因Artnl敲除型小鼠肝脏中具有昼夜节律的基因有1 832个。KEGG数据库中胆固醇代谢通路涉及49个基因,通过韦恩图分析,上述具有昼夜节律的基因中有8个基因参与胆固醇代谢通路。见图1。

图1 肝脏组织中昼夜节律表达的胆固醇代谢相关基因筛选
2.2 小鼠肝脏中昼夜节律表达的胆固醇代谢相关基因分析 小鼠肝脏中昼夜节律表达的胆固醇代谢相关基因包括内皮脂肪酶(LIPG)、中性胆固醇水解酶1(NCEH1)、人血管生成素样蛋白4(ANGPTL4)、溶酶体酸性脂肪酶(LIPA)、尼曼-匹克C1型蛋白(NPC1)、ATP结合盒蛋白B11(ABCB11)、ATP结合盒蛋白G5(ABCG5)、ATP结合盒蛋白G8(ABCG8),在胆固醇代谢通路中的主要功能包括胆固醇合成、胆固醇排泄、胆汁酸排泄、抑制脂蛋白脂解酶。振幅、时相、P值等昼夜节律数据见表1。

表1 小鼠肝脏中胆固醇代谢相关基因的昼夜节律数据
2.3 小鼠肝脏中胆固醇代谢相关基因昼夜节律表达特征 通过分析上述胆固醇代谢相关基因的节律性,发现其昼夜表达特征。正常饮食小鼠肝脏中LIPG、NCEH1、ANGPTL4、NPC1、ABCG5、ABCG8的表达量在光周期下逐渐增加、中午达到峰值,随后在暗周期下逐渐降低;LIPA、ABCB11的表达量则在光周期下逐渐减少,中午降至最低,随后在暗周期下逐渐增多。与之相比,高脂饮食可增加相关基因的表达量,但不影响昼夜节律性,见图2。芳基烃受体核易位样蛋白1(Artnl)也被称为BMAL1,是昼夜节律系统的重要调节因子,敲除Artnl基因后,小鼠肝脏胆固醇代谢基因表达的昼夜节律消失,见图3。
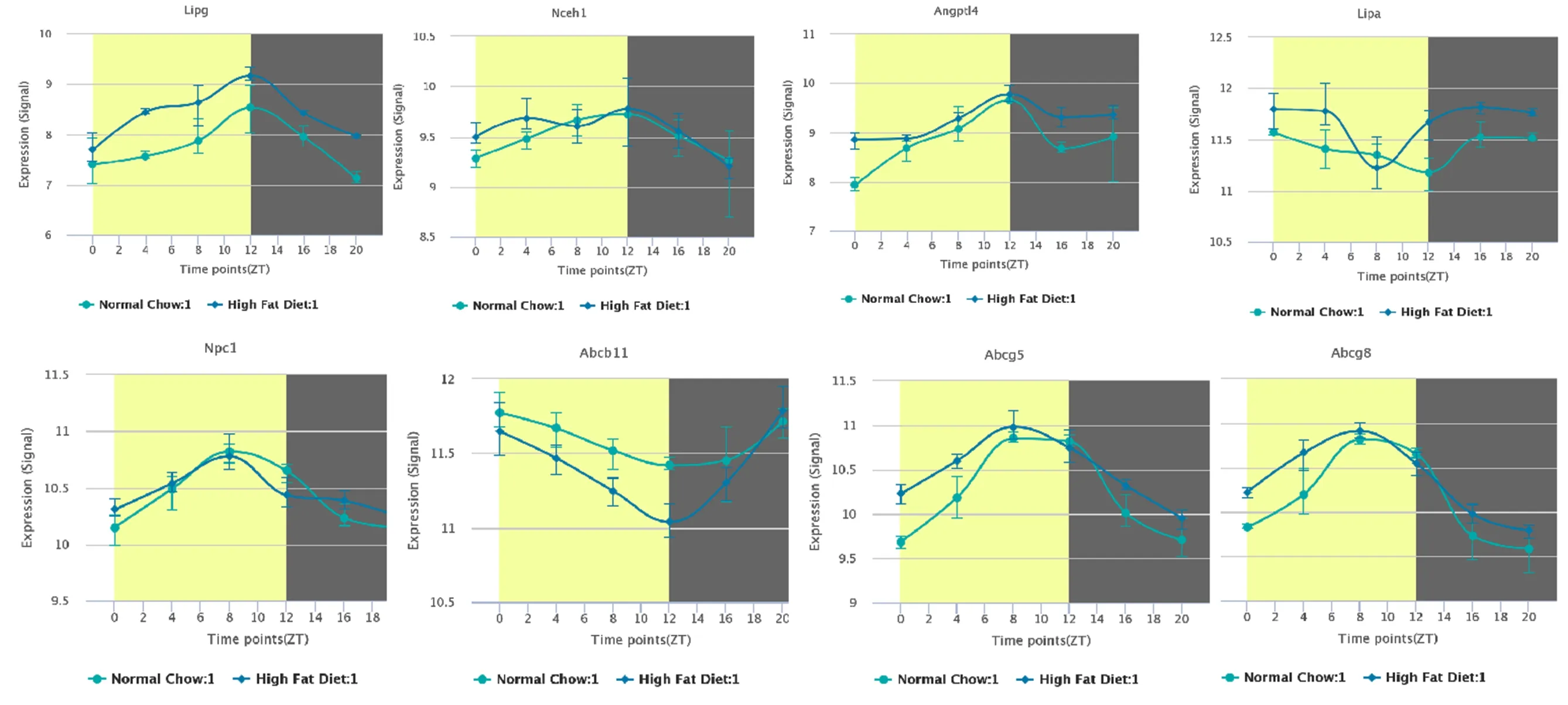
图2 小鼠肝脏中胆固醇代谢相关基因昼夜节律表达特征 (·为正常饮食组,■为高脂饮食组)
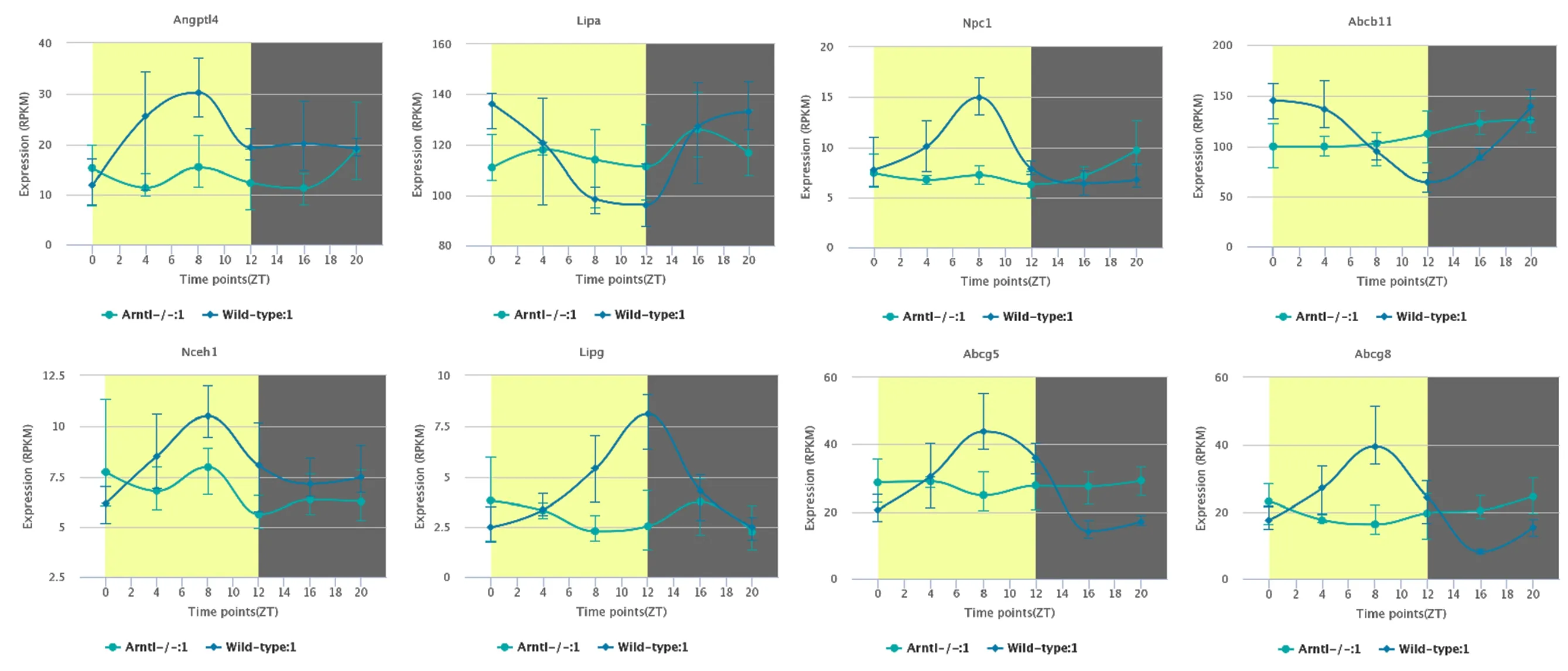
图3 Arntl基因敲除小鼠肝脏中胆固醇代谢基因的昼夜表达节律消失 (·为野生型组,■为Arntl基因敲除组)
3 讨论
胆固醇既是细胞生物膜的构成成分,又是类固醇类激素、胆汁酸及维生素D的前体物质,胆固醇代谢失调能够引起多种疾病,血浆胆固醇水平增高是引起动脉粥样硬化的主要因素,可引起一系列心血管疾病。肝脏是胆固醇合成的主要场所,也是将胆固醇转化为胆汁酸的主要器官,在胆固醇的代谢过程中起到重要作用。肝脏是所有类型脂质的主要代谢器官,主要通过调节脂蛋白合成、脂质摄取和转化、脂肪酸的从头合成和氧化来参与脂质代谢过程。肝脏的代谢功能受昼夜节律的影响较大,现代生活昼夜节奏不规律,夜间熬夜现象严重,昼夜节律紊乱导致代谢综合征[12],有报道昼夜节律控制因子敲出后导致胆固醇代谢紊乱[13]。小鼠肝脏中敲除REV-ERB-α和REV-ERB-β可调节脂代谢相关基因[14],相关分子机制在肝脏起到调节昼夜节律的作用[15]。
本研究通过芯片数据挖掘和生物信息学分析,探索昼夜节律对肝脏胆固醇代谢的影响,发现小鼠肝脏部分胆固醇代谢相关基因表现出昼夜节律性,LIPG、NCEH1、ANGPTL4、NPC1、ABCG5、ABCG8的表达量在光周期下逐渐增加、中午达到峰值,随后在暗周期下逐渐降低;LIPA、ABCB11的表达量则在光周期下逐渐减少,中午降至最低,随后在暗周期下逐渐增多。整体的昼夜节律表现出与生理相关的昼夜节律特性,白天进食后,相关合成排泄的高峰较为集中,因此协调的昼夜节律能够保持相关胆固醇代谢的稳态,统一协调整个代谢过程。而敲除昼夜节律调节因子后,相关节律消失,整个代谢的过程无法根据机体的整体昼夜节律调节波峰波谷,从而影响胆固醇代谢。
LIPG在肝、肺、肾和胎盘中均可表达,是甘油三酯脂肪酶家族的成员,具有磷脂酶活性,参与高密度脂蛋白代谢,进而参与胆固醇逆向转运调控[16]。NCEH1主要分布在脂肪和肝脏细胞中,是一种重要丝氨酸水解酶,参与胆固醇脂、脂肪酸酯的水解代谢,在胆固醇逆向转运中发挥限速作用,在人类动脉粥样斑块区大量表达,也有研究报道NCEH1相关的脂质代谢异常与肝癌发生发展相关[17]。ANGPTL4属于分泌型糖蛋白,是血管生成素样蛋白家族成员,在肠道、脂肪、肌肉和肝脏等多种组织广泛表达,与动物脂肪代谢密切相关,主要通过抑制脂蛋白脂酶活性参与脂质代谢调控,具有促进脂解和脂肪酸氧化分解、减少脂肪沉积并刺激脂肪动用的作用[18]。LIPA又称酸性胆固醇酯水解酶,是脂蛋白代谢中的水解酶之一,早在20世纪60年代人们就发现,LIPA突变会导致多种组织内的脂质堆积。NPC1是一种胆固醇转运蛋白,NPC2能够从细胞内富含胆固醇的低密度脂蛋白中抽提胆固醇,然后传递给细胞膜上的NPC1,进而将胆固醇通过下游蛋白传递至细胞的其他部位[19]。ABCB11是ABC转运蛋白家族成员,其蛋白转运方式整合了底物浓度梯度扩散和ATP水解供能的主动运输,胆固醇在肝细胞中合成并代谢为胆汁酸盐,然后由ABCB11外排至胆小管,参与胆汁形成,帮助消化脂类和脂溶性维生素[20]。ABCG5和ABCG8都是依赖于ATP的跨膜转运蛋白ABC家族G亚家族成员,在小肠和肝脏高表达,二者在内质网装配为二聚体后转运定位于质膜顶端,促进胆固醇排泄至胆汁[21]。这些节律表达的胆固醇代谢相关基因与代谢相关疾病,如动脉粥样硬化有着紧密联系,ABCG5和ABCG8的高表达也能减少高血脂导致动脉粥样硬化[22],NCEH1、ANGPTL4和NPC1敲出后均密切影响动脉粥样硬化的形成[23-25]。
研究结果提示,肝脏胆固醇代谢部分基因表达具有昼夜节律性,并在动脉粥样硬化病变过程起潜在作用。本研究也存在不足之处,昼夜节律影响肝脏胆固醇代谢的具体分子机制仍需进一步实验分析。
