羊栖菜多酚通过核转录因子-κB/丝裂原活化蛋白激酶通路缓解脂多糖诱导的RAW264.7细胞炎症反应
2022-12-30洪静霞张攀学杨文鸽
黄 平,洪静霞,米 杰,张攀学,李 超,杨文鸽
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211)
炎症是宿主应对感染、细胞应激或组织损伤的一种防御适应性反应,受多种信号通路调控,以保证炎症过程的启动、维持和消退[1-2]。当机体免疫反应异常活跃,可引起过度炎症,导致细胞和组织损伤[3]。巨噬细胞是先天免疫系统的重要组成部分,通过执行多种功能(吞噬、产生和分泌多种细胞因子和生长因子)参与免疫调节[4]。脂多糖(lipopolysaccharide,LPS),又称内毒素,为革兰氏阴性菌细胞壁外壁的组成成分,可作用于膜受体激活多种细胞(巨噬细胞、上皮细胞、内皮细胞等)信号转导系统,促进促炎细胞因子和其他炎性介质的合成及释放,引发炎症反应[5]。LPS激活巨噬细胞的过程主要包括:巨噬细胞膜上Toll样受体4(toll-like receptor 4,TLR4)识别LPS,使TLR4胞内的基团构象发生变化,将信号传入胞内,激活细胞中多种蛋白质磷酸化级联反应链,最终激活丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPKs)和核转录因子(nuclear factor,NF)-κB信号通路,促进多种炎症介质的基因转录和蛋白表达,如一氧化氮(NO)和前列腺素E2(prostaglandin E2,PGE2)及其上游炎症酶诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β和IL-6等[6-7]。
羊栖菜(Hizikia fusiformis)作为一种可食性褐藻,广泛分布于我国浙江沿海一带,富含多种活性物质,营养价值高[8]。羊栖菜多酚(Hizikia fusiformispolyphenols,HFPs)是羊栖菜中重要活性物质之一,约占藻体干质量的2%,HFPs主要为间苯三酚衍生物及连苯三酚衍生物,具有抗氧化[9]、抗菌[10]、抗炎[11]及抑制代谢酶[12]等作用。倪立颖等[11]采用LPS刺激胚胎期斑马鱼建立体内炎症模型,评估HFPs提取物的抗炎活性,结果表明HFPs提取物显著降低胚胎斑马鱼体内NO水平、细胞死亡率和活性氧生成率。Yang等[13]在研究HFPs体外抗炎功效时发现,其减少了巨噬细胞促炎因子(NO、IL-6和TNF-α)的分泌。目前,有关HFPs抗炎作用的报道主要集中于其对部分炎性介质的影响,而缺乏系统而深入的机制研究。本研究采用LPS诱导RAW264.7巨噬细胞建立体外炎症模型,基于MAPKs和NF-κB信号通路,从基因、蛋白相对表达水平和细胞吞噬功能等方面评估HFPs的抗炎活性,为其在新型抑炎制剂的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
羊栖菜干制品(产自浙江洞头海域) 温州星贝海藻食品有限公司。
小鼠巨噬细胞RAW264.7 中国科学院细胞库。
达尔伯克(氏)改良伊格尔(氏)培养基(Dulbecco’s modified Eagle medium,DMEM)、DMEM/F12无酚红培养基、胎牛血清 美国HyClone公司;噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、LPS、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、5×蛋白上样缓冲液、高效RIPA细胞快速裂解液 北京索莱宝科技有限公司;N-(1-萘基)乙二胺盐酸盐、对氨基苯磺酰胺 上海源叶生物科技有限公司;TRIzol试剂 美国Omega公司;绿色荧光微球 北京百灵威科技有限公司;Taq-based聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 日本ToYoBo公司;FastStart Essential DNA Green Master 美国Roche公司;c-Jun N末端激酶(c-Jun N-terminal kinase,JNK)兔单克隆抗体、p-JNK兔单克隆抗体、p38 MAPK兔多克隆抗体、p-p38 MAPK兔多克隆抗体、NF-κB p65兔单克隆抗体、p-NF-κB p65兔单克隆抗体、iNOS兔多克隆抗体 武汉爱博泰克生物科技公司;Tris缓冲盐溶液+吐温(Tris buffered saline+tween,TBST)洗膜液 山东思科捷生物技术有限公司;增强型化学发光(enhanced chemiluminescence,ECL)免疫印迹检测试剂 江苏新赛美生物科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
1300系列A2型生物安全柜、梯度PCR仪、恒温恒湿培养箱 美国Thermo Fisher Scientific公司;SpectraMax i3多功能酶标仪 美国Molecular Devices公司;CFX 96 Touch实时荧光定量PCR仪 美国Bio-Rad公司;Gallios流式细胞仪 美国Beckman公司;DYCZ-24DN型电泳仪、DYCZ-40D转印槽 北京六一仪器厂;ChemiScope 4300 pro化学发光成像系统 上海勤翔科学仪器有限公司。
1.3 方法
1.3.1 羊栖菜多酚的制备
参照Wang Chen[14]、李亚娴[15]等的方法并略作修改。取干燥羊栖菜粉末,加入体积分数60%乙醇溶液超声辅助浸提(料液比1∶20(m/V)、50 ℃、60 min),抽滤后真空减压蒸馏去除乙醇,获羊栖菜粗多酚溶液,依次采用等体积石油醚、乙酸乙酯分级萃取,真空减压蒸馏后冻干,获得HFPs粉末。测得HFPs粉末总酚含量为(23.67±0.24)mg/g。利用无菌水配制成多酚母液,再以细胞培养液稀释至不同浓度,用于后续实验。
1.3.2 细胞培养
完全培养基(含10%(体积分数,下同)胎牛血清和1%青链霉素双抗DMEM培养基)培养RAW264.7细胞,37 ℃、5% CO2培养,细胞融合度约80%时进行传代。
1.3.3 RAW264.7细胞活力测定
取对数生长期细胞,以3×105个/mL接种于96 孔板,每孔100 μL。待细胞贴壁后,更换为含不同质量浓度(0(即对照组)、10、20、40、60、80、100、120、140、160、180、200、250、300、350 μg/mL)HFPs的新鲜完全培养基,培养24 h。弃去上清液,加入100 μL含0.5 mg/mL MTT的DMEM/F12无酚红培养基,37 ℃避光孵育4 h。再次弃去上清液,每孔加入200 μL二甲基亚砜,37 ℃振荡30 min,测定540 nm处OD540nm值。按公式(1)计算细胞活力。

1.3.4 RAW264.7细胞NO相对含量测定
参照1.3.3节方法进行细胞接种,培养24 h细胞贴壁后,将细胞分为3 组:阴性对照组、LPS阳性对照组、HFPs+LPS组。阴性对照组加入含10%胎牛血清的DMEM培养基;LPS阳性对照组加入含LPS(1 μg/mL)和10%胎牛血清的DMEM培养基刺激24 h;HFPs+LPS组经含不同质量浓度(10、20、40、60、80、100、120、140、160、180、200、250、300、350 μg/mL)HFPs和10%胎牛血清的DMEM培养基培养24 h后,以含LPS(1 μg/mL)和10%胎牛血清的DMEM培养基刺激24 h。采用Griess法测定各组在540 nm处OD540nm值,按公式(2)计算NO相对含量。

1.3.5 RAW264.7细胞炎症相关基因相对表达量的测定
取对数生长期细胞,以4×105个/mL接种于6 孔板,每孔2.5 mL。细胞分为3 组:阴性对照组,LPS阳性对照组、HFPs+LPS组。LPS阳性对照组在含10%胎牛血清的DMEM培养基中培养24 h后,以含LPS(1 μg/mL)和10%胎牛血清的DMEM培养基刺激3、6、12、24 h;HFPs+LPS组经含不同质量浓度(30、60、90、120 μg/mL)HFPs和10%胎牛血清的DMEM培养基培养24 h后,以含LPS(1 μg/mL)和10%胎牛血清的DMEM培养基刺激3、6、12、24 h;阴性对照组用含10%胎牛血清的DMEM培养基孵育24 h后吸弃培养液,用含不同质量浓度(0、30、60、90、120 μg/mL)HFPs和10%胎牛血清的DMEM培养基培养24 h。培养结束后弃去培养液,用0.01 mol/L、pH 7.2(后同)的磷酸盐缓冲液(phosphate buffered saline,PBS)清洗细胞2 次,每孔加入500 μL TRIzol试剂提取总RNA,并将RNA逆转录为cDNA。以cDNA为模板,采用SYBR Green嵌合荧光法与引物(表1)进行实时荧光定量PCR。测定目的基因(IL-1β、IL-6、TNF-α、COX-2、iNOS)和内参基因次黄嘌呤磷酸核糖基转移酶1(hypoxanthine-guanine phosphoribosyl transferase,hprt1)Ct值,采用2-ΔΔCt法计算目的基因的相对表达量。

表1 实时荧光定量PCR引物序列Table 1 Primer sequences used for qPCR
1.3.6 RAW264.7细胞吞噬能力的测定
参照李煜等[16]的方法并略作修改。按照1.3.5节方法分组进行药物处理,阴性对照组为无LPS和HFPs处理,LPS组和HFPs+LPS组LPS刺激3 h后,去除培养基,加入1 mL荧光微球工作液(1×107个/mL)避光孵育2 h。收集细胞,1 000 r/min离心5 min,PBS洗2 次,加入1 mL PBS重悬细胞,经75 μm尼龙膜过滤后立即采用流式细胞仪测定细胞荧光强度。以实验组与阴性对照组荧光强度的比值百分数表征细胞吞噬能力。
1.3.7 MAPKs、NF-κB信号通路关键蛋白相对表达量测定
按照1.3.5节方法进行分组和处理,阴性对照组为无LPS和HFPs处理,LPS组和HFPs+LPS组LPS刺激诱导24 h后,收集细胞。加入200 μL RIPA细胞裂解液于冰上裂解30 min,离心(12 000 r/min、4 ℃)10 min取上清液。采用BCA蛋白质量浓度测定试剂盒测定各组蛋白浓度,用蛋白上样缓冲液调整蛋白质量浓度为2 mg/mL,95 ℃加热10 min使蛋白变性然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离;湿转到聚偏二氟乙烯膜;5%(质量分数)脱脂奶粉(TBST溶液配制)封闭1 h;一抗4 ℃孵育12 h;二抗室温孵育2 h;加入ECL试剂进行显色反应,测定蛋白条带灰度值。以β-actin为内参,目的蛋白包括iNOS、p65、p-p65、p38、p-p38、JNK和p-JNK,分别以p-p38/p38、p-JNK/JNK、p-p65/p65表示相应蛋白磷酸化水平。
1.4 数据统计与分析
每个实验重复3 次,结果均以平均值±标准差表示,采用Prism 8.3软件进行单因素方差分析。采用t检验进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 HFPs对RAW264.7细胞活力的影响
如图1所示,与对照组相比,当HFPs质量浓度不高于160 μg/mL时,其对细胞活力无明显作用;进一步提高多酚质量浓度后,HFPs显著抑制细胞增殖(P<0.05),并呈剂量依赖性,当HFPs质量浓度达到350 μg/mL,细胞活力显著降为对照组的50%(P<0.05)。
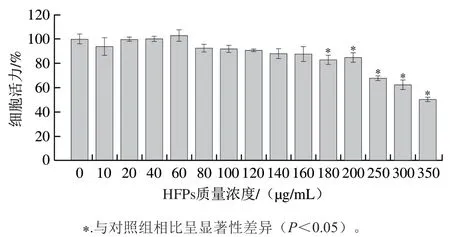
图1 HFPs对RAW264.7细胞活力的影响Fig. 1 Effects of HFPs on the viability of RAW264.7 cells
2.2 HFPs对RAWA264.7细胞NO相对含量的影响
巨噬细胞经LPS刺激后,可产生多种炎性介质包括促炎细胞因子、前列腺素和NO等。如图2所示,与阴性对照组相比,细胞经LPS刺激24 h后,其NO相对含量显著升高(P<0.05)。与阳性对照相比,采用HFPs预处理可剂量依赖性缓解LPS刺激导致的NO产生,且当HFPs质量浓度为100 μg/mL以上时,抑制效果显著(P<0.05)。
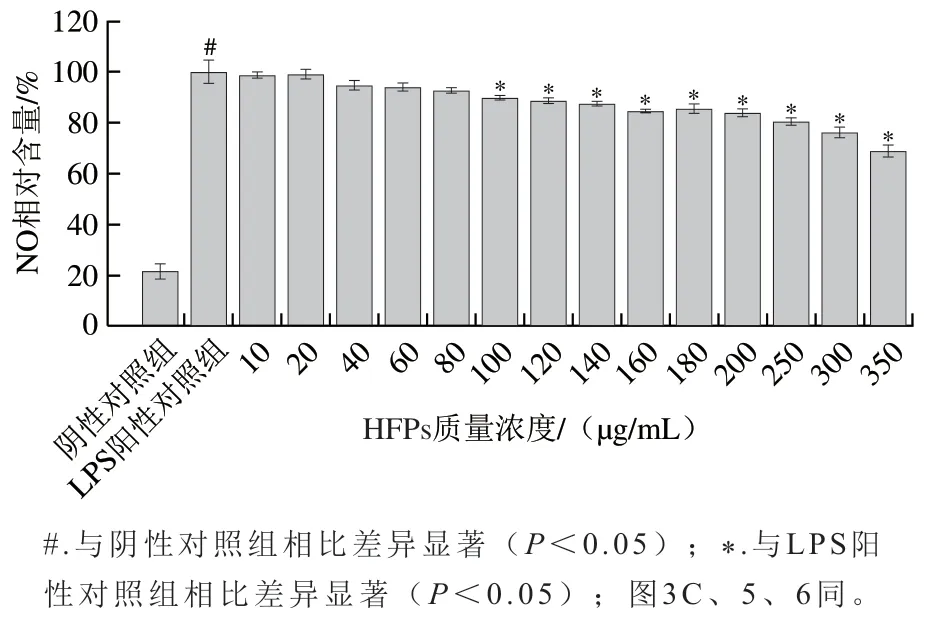
图2 HFPs对RAW264.7细胞NO生成量的影响Fig. 2 Effect of HFPs on NO production in RAW264.7 cells
2.3 HFPs对RAW264.7细胞iNOS mRNA和蛋白表达的影响
如图3A所示,LPS显著刺激细胞iNOS基因转录(P<0.05),且iNOSmRNA表达水平随LPS诱导时间延长而增加。HFPs预处理24 h后再经LPS诱导细胞,HFPs对iNOSmRNA表达水平的影响与LPS刺激时间有关,短期LPS刺激(0~12 h)后HFPs对iNOSmRNA表达水平无明显作用,而当LPS诱导时间延长至24 h时,HFPs(60~120 μg/mL)处理显著降低了iNOSmRNA相对表达量(P<0.05)。蛋白免疫印迹实验进一步印证了该结果,60~120 μg/mL HFPs预处理显著降低了LPS诱导24 h巨噬细胞iNOS蛋白水平(P<0.05)(图3B、C)。
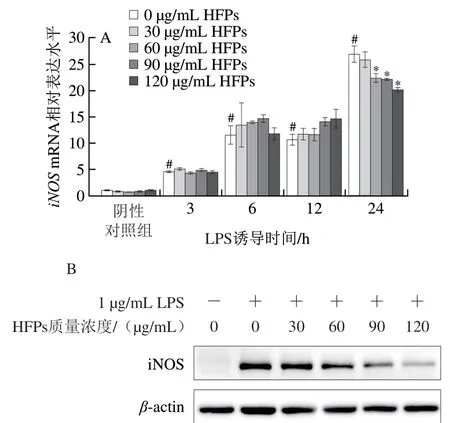
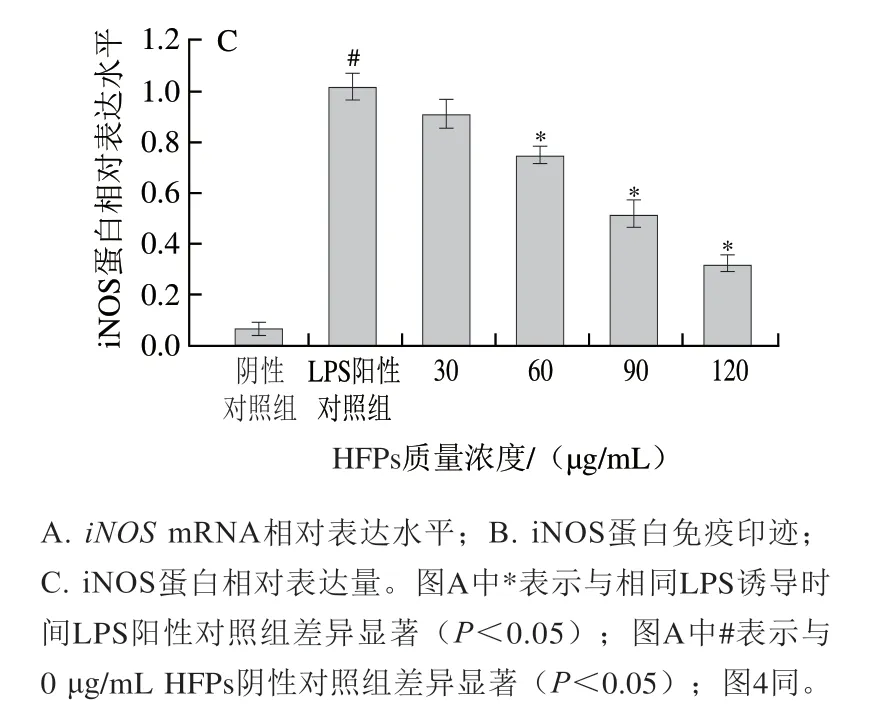
图3 HFPs对RAW264.7细胞iNOS mRNA和蛋白表达的影响Fig. 3 Effect of HFPs on the expression of iNOS mRNA and protein in RAW264.7 cells
2.4 HFPs对RAW264.7细胞炎症基因相对表达量的影响
采用实时荧光定量PCR测定HFPs对LPS诱导的巨噬细胞中重要促炎细胞因子IL-1β、IL-6和TNF-α基因相对表达量,以及炎症相关酶COX-2基因相对表达量的影响。如图4所示,LPS刺激不同时间后,所有炎症介质的mRNA表达水平均显著提高(P<0.05)。HFPs对促炎细胞因子的抑制作用与其剂量、LPS诱导时间及细胞因子种类相关。与LPS组相比,静息状态细胞经HFPs处理再经LPS诱导12、24 h后,IL-1β和IL-6的基因相对表达量显著下降;HFPs显著抑制LPS诱导3 h后TNF-α基因的相对表达,而在LPS诱导6~24 h的抑制作用总体不明显。在LPS诱导24 h,较低剂量HFPs(30、60 μg/mL)预处理对COX-2基因表达具有显著抑制作用,但提高剂量后该抑制效果消失,甚至出现反向促进作用,120 μg/mL HFPs预处理促使COX-2相对表达量较LPS组显著上升(P<0.05)。
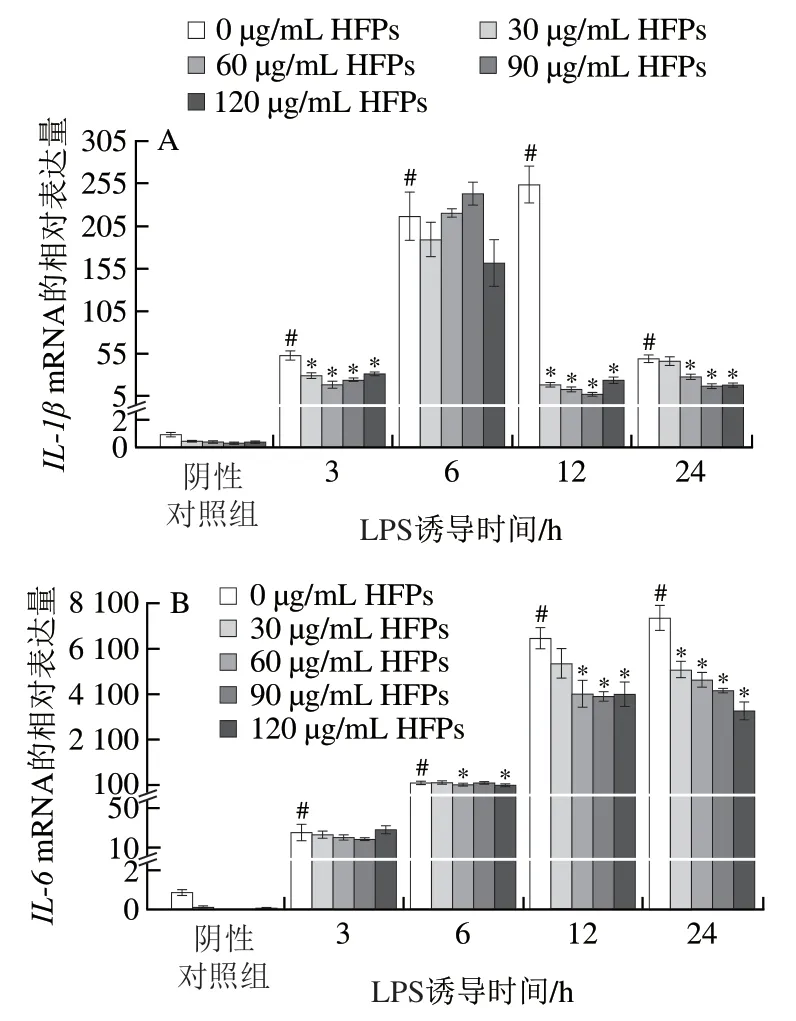

图4 HFPs对RAW264.7细胞炎症介质基因相对表达量的影响Fig. 4 Effect of HFPs on gene expression of inflammatory mediators in RAW264.7 cells
2.5 HFPs对RAW264.7细胞吞噬能力的影响
如图5所示,与阴性对照组相比,LPS刺激3 h显著促进了细胞吞噬荧光微球的能力(P<0.05)。经60、90、120 μg/mL HFPs预处理后,LPS诱导的小鼠巨噬细胞吞噬能力受到显著抑制(P<0.05)。
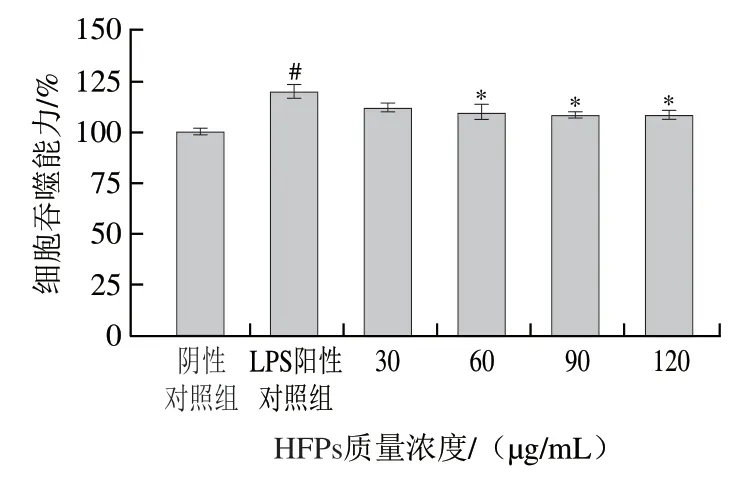
图5 HFPs对RAW264.7细胞吞噬能力的影响Fig. 5 Effect of HFPs on phagocytic capacity of RAW264.7 cells
2.6 HFPs对RAW264.7细胞MAPKs、NF-κB信号通路关键蛋白磷酸化水平的影响
采用蛋白免疫印迹法测定巨噬细胞中MAPKs和NF-κB信号通路关键蛋白的磷酸化水平。如图6所示,与阴性对照组相比,LPS刺激3 h后细胞中p38、JNK和p65蛋白的磷酸化水平显著升高(P<0.05)。90、120 μg/mL HFPs预处理对LPS诱导的巨噬细胞中p38和p65的磷酸化产生显著抑制作用(P<0.05),且呈一定的剂量依赖性,但对JNK的磷酸化没有显著影响,表明HFPs的抗炎作用可能与其靶向作用于p38 MAPK和NF-κB p65有关。

图6 HFPs对RAW264.7细胞MAPKs和NF-κB信号通路关键蛋白磷酸化水平的影响Fig. 6 Effect of HFPs on the expression of key proteins involved in MAPKs and NF-κB signaling pathways in RAW264.7 cells
3 讨 论
巨噬细胞是机体免疫应答的第一道防线,具有识别、吞噬、清除细菌及外来异物等功能[17]。然而,当巨噬细胞被异常激活,可分泌大量促炎细胞因子进而引发炎症风暴,导致机体组织损伤,故其静息-激活的动态平衡在维持免疫系统稳态中起重要作用[18]。针对过度免疫反应,一般可通过阻断或抑制炎症相关因子的表达达到缓解炎症及其引起的机体损伤。
细胞增殖能力是机体的重要生命特征和体现细胞活力的重要指标。MTT法是一种简单、快捷、无放射性污染测定细胞活力的方法[19],在本研究中用于评估HFPs对小鼠巨噬细胞的潜在细胞毒性。结果显示,HFPs的最大安全质量浓度为160 μg/mL,即不高于该剂量时HFPs对RAW264.7细胞活力无影响。
LPS是革兰氏阴性菌细胞壁外壁的组成成分,又名内毒素,是引起机体炎症损伤的重要诱因,可激活巨噬细胞产生NO、iNOS、COX-2等多种炎症介质和IL-6、IL-1β、TNF-α等促炎细胞因子[20-22]。IL-1β大量产生于炎症初期,其局部激活是介导促炎反应的中心环节,可导致继发性炎症介质的产生[20];TNF-α具有多效性,能增加血管内皮细胞通透性,激活中性粒细胞和淋巴细胞,促进其他细胞因子的合成和释放[23];IL-6作为重要促炎细胞因子,可诱导B细胞分化和产生抗体,诱导T细胞活化、增殖及分化,参与机体免疫应答[24]。研究表明,这些细胞因子及其他炎性介质的大量释放,与炎症相关性疾病的发生和发展密切相关[25-26]。本研究结果表明,RAW264.7细胞经LPS刺激后,其炎症介质基因(IL-1β、IL-6、TNF-α、COX-2、iNOS)表达显著增加,而这一现象在HFPs预处理后得到缓解,并呈剂量和时间依赖性。Kim等发现间苯三酚可降低LPS刺激的RAW264.7细胞中TNF-α、IL-1β和IL-6基因表达水平,抑制巨噬细胞炎症反应[27]。Kang等则研究发现褐藻Eisenia bicyclis提取物抑制LPS激活的HepG2细胞中iNOS和COX-2的表达[28]。结合本研究结果,表明HFPs及其他褐藻多酚可通过调节多种炎性介质的基因转录水平来抑制炎症的发生。
巨噬细胞的吞噬功能在机体防御病原体感染中发挥重要作用。需要注意的是,过多的免疫细胞(包括巨噬细胞)被激活,将增加炎症风暴风险[18]。流式细胞术结合荧光标记广泛应用于巨噬细胞吞噬功能评估[16]。本研究利用该技术检测了HFPs对RAW264.7细胞吞噬功能的影响。结果显示,RAW264.7细胞经LPS刺激后,其吞噬荧光微球的能力显著提升,这与Wen Li等[29]的发现一致。采用HFPs预处理后,LPS诱导的细胞吞噬能力受到抑制,表明HFPs通过调节细胞吞噬功能缓解了炎症反应。
NF-κB是具有多种生物活性的核转录因子,能通过快速调节细胞内基因的表达,调控细胞增殖、凋亡、突变和炎症反应等生理病理过程[30]。细胞经内毒素刺激可诱发信号级联反应,激活NF-κB并核转位,启动下游基因的转录与蛋白的表达,促进炎症相关因子的合成与分泌[18]。Yoon等发现马尾藻(Sargassum micracanthum)提取物通过NF-κB信号通路抑制LPS诱导RAW264.7细胞中iNOS、COX-2、TNF-α、IL-1β、IL-6等mRNA水平的上调[31]。Yayeh等研究表明,在LPS诱导的RAW264.7细胞中,褐藻Eisenia bicyclis多酚提取物通过抑制NF-κB p65及其上游激酶的磷酸化降低NF-κB的转录活性[32]。除NF-κB外,MAPK也是巨噬细胞炎症信号转导中的重要因子,其磷酸化可进一步导致NF-κB的激活[33]。Jung等[34-35]研究发现,苷苔(Ecklonia cava)提取物能够降低LPS诱导的小鼠BV2小胶质细胞中NF-κB的核转位及其DNA结合能力,而这一现象与抑制MAPKs的激活有关。目前,NF-κB/MAPKs信号通路的激活水平,即相关蛋白的表达和磷酸化水平,被广泛应用于评估和筛选抗炎活性物质。本研究发现,LPS刺激可显著促进关键蛋白的磷酸化(p-p65、p-p38、p-JNK),而HFPs预处理可剂量依赖性抑制p-p65和p-p38的表达,表明HFPs的抗炎活性与调控p38 MAPK和NF-κB p65信号通路有关。不同抗炎药物的抗炎机制不同,但主要通过阻断或遏制炎症相关通路,或直接中和机体中促炎介质以达到抗炎效果[36]。本实验结果表明,HFPs可选择性抑制LPS激活的p38/NF-κB信号通路,减少了IL-1β、IL-6、TNF-α、iNOS和COX-2等的表达,从而缓解炎症。
综上所述,HFPs可通过抑制NF-κB/MAPKs信号通路蛋白p65和p38的磷酸化水平,减少促炎细胞因子和其他炎性介质的合成与分泌,降低巨噬细胞吞噬作用,从而发挥抗炎活性。值得注意的是,许多报道证实了体内外试验结果具有良好的相关性[37],但生物体内情况复杂,化合物在体内外的作用效果可能出现差异,如多酚进入体内后可能会被胃液分解成小分子酚类物质,导致效果减弱[38]。因此,在体外实验的基础上还需结合体内实验,以确定HFPs在完整生物体中产生的抗炎作用,为其开发新的抗炎药物提供重要依据。
