新型鸭呼肠孤病毒的分离鉴定及板蓝根合剂的预防效果评价
2022-12-29朱明恩王光锋提金凤李汝春孙秋艳
朱明恩,王光锋,提金凤,李 舫,李汝春,孙秋艳
(山东畜牧兽医职业学院/山东省畜禽抗菌药使用减量化工程技术研究中心/山东省现代农业产业技术体系创新团队,山东 潍坊 261061)
新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)主要引起雏鸭肝脏和脾脏的出血性坏死,临床上也称之为“鸭新肝病” “鸭白点病” “鸭脾坏死病”等[1],后统称“新型鸭呼肠孤病毒病”,其在血清学、基因型、抗原性、致病性等方面均不同于经典番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)。新型鸭呼肠孤病毒病一般分为鸭出血性坏死性肝炎和鸭脾坏死病两类,鸭出血性坏死性肝炎与感染 MDRV的患鸭临床症状相似,但 MDRV对北京鸭无感染性;而鸭脾坏死病的主要病变在脾脏,与感染 MDRV的患鸭发病时期不同,脾脏病变亦存在着一定差异[2]。该病最初在 2005年的福建、广东和浙江等地区陆续开始出现,进而快速的传遍了中国主要的鸭生产地,现在已经成为一种鸭的常见病和多发病[3]。该病在一年四季均有发生,且樱桃谷鸭、麻鸭、番鸭、半番鸭等多种品种的鸭都可发病,发病日龄一般为 5~25 d,其发病率为 5 %~35 %,死亡率为 2 %~20 %。一般来说,鸭的日龄越小,其发病率和死亡率越高。此外,随着天气越加寒冷,该病的发病率和死亡率也随之增加[3-6]。该病毒可引起鸭脾脏坏死等病理性损伤,从而导致机体免疫抑制,进而更容易引起细菌的继发性感染[3,7,8]。近年来,NDRV在全国各地大面积流行,其作为鸭养殖地区流行的一种危害严重的传染病,给养鸭业造成了不可估量的经济损失。
NDRV的基因组分为L、M和S三类基因片段。其中,L由 L1、L2、L3三条大片段组成,M 由 M1、M2、M3三条中片段组成,S则由S1、S2、S3、S4四条小片段组成。基因组可编码至少14个蛋白(10个结构蛋白和4个非结构蛋白),其中 S1片段中的 σC蛋白是构成病毒外衣壳的重要组成成分,其主要功能是吸附细胞和产生新型特异性中和抗体,是NDRV重要的免疫原性蛋白[9-11]。此外,σC蛋白不仅是禽呼肠孤病毒编码蛋白中最容易变异的蛋白,也是鸭呼肠孤病毒同源性及遗传进化分析的重要参考依据[12-14]。本研究从山东多个地区的疑似呼肠孤病毒感染的鸭病料中分离鉴定出 5株 NDRV,并针对其 σC基因进行测序分析,进一步进行同源性及遗传进化分析,以探究不同地区分离株的生物学特性差异。板蓝根是常用的清热解毒中药,在防治各种病毒感染性疾病中发挥着重要作用。本研究利用5株分离株对板蓝根合剂药物对新型鸭呼肠孤病毒病的防治效果进行的评价,以探究板蓝根等药物对新型鸭呼肠孤病毒病的防治效果,为该病的治疗和防控提供新的参考依据。
1 材料和方法
1.1 材料
1.1.1 病料样品和实验动物 疑似感染鸭呼肠孤病毒病料分别采自山东高唐、商河、新泰、潍坊、莘县 5个地区的鸭场,10日龄 SPF鸭胚购自山东潍坊地区某孵化场,7日龄雏鸭购自山东临沂某孵化场。
1.1.2 主要仪器和试剂 PCR仪购自美国 Bio-Rad公司,凝胶成像设备购自美国 Bio-Rad公司,均由学院动物疫病检测中心提供;HiScript II One Step RT-PCR Kit购自南京诺唯赞生物科技有限公司。
1.2 方法
1.2.1 样品处理 取适量疑似病鸭的坏死脾脏,用无菌剪刀剪碎后按照 1:5比例加入 PBS,用无菌的研磨器进行研磨处理,将研磨好的组织匀浆转移至无菌5 ml离心管中,置于-20 ℃ 反复冻融3次,6 000 rpm离心5 min,取上清液备用。
1.2.2 病毒分离培养 将 1.2.1中获取的上清液用 0.22 µm 滤器进行过滤除菌,然后按照每个鸭胚0.2 ml的剂量,将其接种于10日龄SPF鸭胚中,每个样品分别接种 5个鸭胚。此外,用无菌PBS溶液接种5个鸭胚作为阴性对照。将所有鸭胚置于 37 ℃ 恒温箱中孵育培养,时刻观察鸭胚的状态,将24 h内死亡的鸭胚弃掉,无菌操作收集72 h内死亡的鸭胚及其尿囊液。将尿囊液按照上述方法接种于新的 SPF鸭胚中,连续传代 3次,无菌收集第3代鸭胚的尿囊液备用。
1.2.3 RNA提取及 PCR鉴定 采用 Trizol法对1.2.2中第3代鸭胚的尿囊液样品进行RNA的提取,利用HiScript II One Step RT-PCR Kit试剂盒按照说明书对鸭呼肠孤病毒 σC基因序列进行PCR扩增。上游引物为P1: 5'-ATGATGGATCGC AACGAGGCG-3',下游引物为 P2: 5'-GGCGAAT AGCTCTTCTCATTAC-3'[15]。RT-PCR 反应条件:50 ℃ 30 min,94 ℃ 3 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35 个循环;72 ℃5 min,PCR产物进行 1 % 琼脂糖凝胶电泳检测。将PCR阳性产物送至北京擎科生物科技有限公司进行测序,测序引物为本研究使用的 P1和P2引物。
1.2.4 测序结果分析 首先使用 Chromas软件对双向测序结果进行拼接和校对,并在线与GenBank数据库进行 Blast分析,根据同源性来初步鉴定毒株;利用DNAStar软件对病毒分离株σC蛋白的核苷酸和氨基酸序列分别进行同源性分析;利用 MEGA7软件对病毒分离株 σC蛋白的核苷酸序列进行进化树分析。同源性分析和进化树分析参考序列如下:NDRV-SY(MK 955827.1)、NDRV-SDLY18(MN 064706.1)、NDRV-SDHZYC(MK789277.1)、MDRV-ZJ99(DQ 643970.1)、MDRV-C4(DQ 066924.1)、MDRV-S12(DQ643970.1)、ARV-DVB03(KX 901897.1)、ARV-XY01(KX 451229.1)、ARVS1133(KF741762.1)。
1.2.5 病毒感染雏鸭的致病性试验 将 5株病毒分离株感染的第 3代的鸭胚尿囊液通过肌肉注射方式分别攻毒 10只 7日龄健康雏鸭(1.0 ml/只),另外取 10只健康雏鸭注射等体积无菌PBS,作为对照组。攻毒后每日观察记录雏鸭的发病和死亡情况。在第 7天处死所有雏鸭,观察记录肝脏病变情况。
1.2.6 板蓝根合剂对新型鸭呼肠孤病毒防治效果评价 自制板蓝根合剂配方:黄芪 30 g,板蓝根、大青叶、贯众、黄柏、茜草各 15 g,苍术12 g,丹皮、泽泻各 10 g,甘草 3 g。选取 40只7日龄健康雏鸭,随机分为4个组(10只/组),1组和 2组饮用水中添加自制板蓝根合剂(板蓝根合剂 50 ml + 水 1 000 ml),30 ml/只,1 剂/d。3组和 4组饮用水中不添加药物。连续喂药 7 d后,按照 1.2.4中的方法对 2组和 3组进行攻毒,试验动物具体分组情况见表 1。每日观察记录雏鸭的发病和死亡情况,第 7天处死所有雏鸭,观察记录肝脏病变情况。

表1 试验动物分组信息
2 结果与分析
2.1 病毒分离培养
SPF鸭胚接种样本上清液后,自第 3代开始,鸭胚的死亡时间和剖检病变趋于稳定。鸭胚的死亡时间主要集中在 48~72 h之间,且第3代的鸭胚死亡率达到了 100 %。不同时间点死亡的鸭胚均出现全身性的出血以及水肿。48 h死亡鸭胚和72 h死亡鸭胚的病变情况如图1所示。

图1 攻毒鸭胚的病变情况
2.2 病毒的分子生物学鉴定分析
对接种第 3代的鸭胚尿囊液进行 RNA的提取,并以此为模板进行 RT-PCR的检测,5个待测样品分别命名为 GT-1,SH-2,XT-3,WF-4,SX-5,RT-PCR检测的凝胶电泳结果如图 2所示,5个样品均扩增出 1000 bp左右的特异性条带,条带大小与预期的σC基因大小相一致。
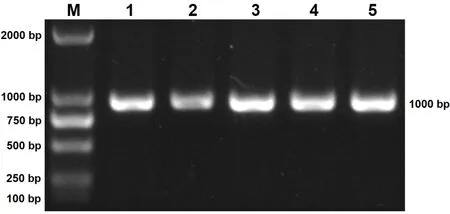
图2 5个分离株σC基因的RT-PCR扩增结果
2.3 分离株σC序列的同源性分析
使用DNAStar软件,根据5个分离株的PCR阳性产物测序结果,将其与 GenBank中发布的NDRV-SY(MK955827.1)、NDRV-SDLY18(MN 064706.1)和NDRV-SDHZYC(MK789277.1)的σC核苷酸序列以及氨基酸序列分别进行同源性分析,结果如表 2所示。5个分离株 σC基因的核苷酸和氨基酸同源性分别为 95.2 % ~ 99.6 %和 94.4 % ~ 99.7 %;而 5个分离株与其它 3个NDRV分离株的 σC基因的核苷酸和氨基酸同源性分别为96.9 % ~ 98.6 %和94.1 % ~ 99.4 %。

表2 分离株与NDRV的σC蛋白核苷酸和氨基酸同源性分析
2.4 分离株σC序列的系统进化树分析
根据 σC基因核苷酸序列的遗传进化树(图3)发现,5个分离株与 NDRV毒株构成一个独立的进化分支,其中GT-1和SH-2以及XT-3和SX-5的遗传距离较近,分别位于一个小分支,而WF-4则与其它 4株的遗传距离相对较远;番鸭呼肠孤病毒(Muscovy duck reovirus, MDRV)代表株(MDRV-ZJ99、MDRV-S12和 MDRV-C4)和禽呼肠孤病毒(Avian reovirus, ARV)代表株(ARV-S1133、ARV-DVB03、ARV-XY01)也分别形成一个进化分支。而 NDRV分支与MDRV、ARV分支亲缘关系都相对较远。

图3 NDRV分离株σC基因序列进化树分析
2.5 病毒致病性分析
将5个病毒分离株各攻毒5只健康7日龄雏鸭,攻毒后观察雏鸭的发病情况。攻毒雏鸭在24 h后开始发病,表现为精神沉郁,食欲不振。攻毒 7 d后,颈静脉放血处死所有雏鸭,剖检并观察肝脏病理变化,如图 4所示,与对照组相比,5株分离株感染雏鸭的肝脏均出现不同程度的肿大和出血。如图 5所示,与对照组相比,5株分离株感染雏鸭的脾脏出现不同程度的出血和坏死。

图4 NDRV分离株感染雏鸭的肝脏病变
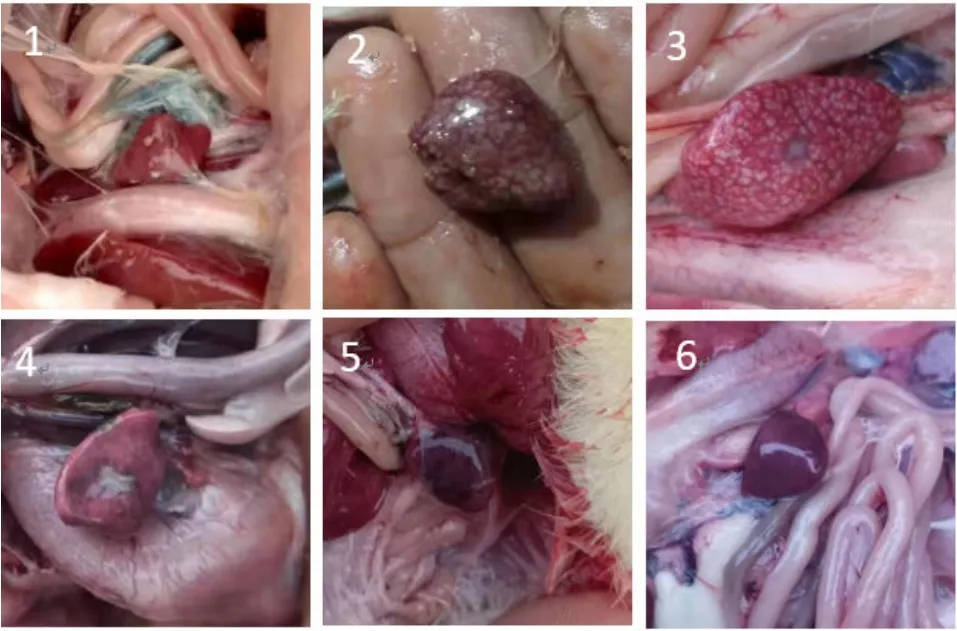
图5 NDRV分离株感染雏鸭的脾脏病变
2.6 板蓝根合剂对新型鸭呼肠孤病毒防治效果评价
板蓝根防治效果评价试验共分为 4组:1组(板蓝根组),2组(板蓝根-攻毒组),3组(攻毒组),4组(空白对照组),每组10只雏鸭。攻毒后每日观察记录雏鸭状态,在攻毒 7 d后,将所有雏鸭处死,剖检并观察肝脏病理变化,统计各组的发病雏鸭的数目。各组肝脏病变及发病情况统计结果如表 3所示,各组肝脏病理变化如图6所示。结果显示,板蓝根-攻毒组的发病率只有10 %,而攻毒组的发病率为 100 %,且肝脏病理结果表明在攻毒 7 d后,攻毒组雏鸭肝脏均有明显的出血现象,而板蓝根的使用明显减弱了攻毒带来的肝脏病变情况(图6)。

表3 各组雏鸭肝脏病变及发病情况统计结果

图6 板蓝根合剂使用后NDRV分离株感染雏鸭的肝脏病变
3 讨论
目前,新型鸭呼肠孤病毒病已经成为鸭的一种常见病,该病主要导致雏鸭的肝脏和脾脏出血以及坏死,其死亡率并不高,但是其可引起脾脏坏死和免疫抑制,进而可造成严重的继发性感染和生长迟缓等。此外,NDRV可以进行垂直传播,当种鸭感染NDRV时,其很容易引起后代的大面积快速传播[16]。因此,NDRV感染在实际生产中的防控非常困难。近年来,NDRV由于其高致病性和广泛的宿主范围,对养鸭产业造成了严重的危害,现在急需开发更有效的药物和疫苗来防控NDRV感染[17]。
2011年该病在山东地区开始流行传播,近年来NDRV的报道逐渐增多,其作为鸭养殖地区流行的一种危害严重的传染病,给山东地区养鸭业造成了不可估量的经济损失[14]。为了进一步明确山东地区NDRV的分布特征、致病性以及变异情况。笔者分别从高唐、商河、新泰、潍坊、莘县地区收集并成功获取 5个分离株,并对其进行了同源性以及遗传进化分析。结果显示,本研究分离得到的5株毒株来均自不同地区,且与NDRV参考株的 σC基因的核苷酸和氨基酸同源性很高,这不仅支持了5个毒株属于NDRV的观点,也证实了NDRV在山东地区的广泛流行。此外,5株分离株的系统进化树分析结果显示 5个分离株与 NDRV共同构成同一遗传分支,而与MDRV和 ARV的遗传关系都相对较远。这也再次说明了本研究鉴定的 5个分离株均属于NDRV。分离株接种鸭胚试验结果显示,5株NDRV连续接种3代之后,鸭胚的死亡时间和剖检病变趋于稳定。这些毒株均能致死鸭胚,且鸭胚的死亡时间主要集中于在 48~72 h之间,第 3代的鸭胚死亡率达到了100 %。48 h和72 h时间点死亡的鸭胚均出现全身性的出血以及水肿。此外,病毒感染雏鸭后24 h均引起雏鸭的精神沉郁、食欲不振等症状,病毒感染 7 d后发病率 100 %,且感染雏鸭的肝脏均出现不同程度的肿大和出血现象。上述结果显示这些毒株与已报道的其他NDRV感染鸭胚时的致病特征基本相一致[14-15]。
板蓝根是常用的清热解毒中药,多糖作为板蓝根的主要成分,抗病毒效果显著且应用范围广泛,板蓝根多糖既可以直接作用于病毒及其感染过程,在病毒感染细胞初期起到阻断及抑制作用,又可在感染病毒后,以多种途径参与机体免疫调节,间接地起到抗病毒作用。板蓝根多糖对多种病毒具有较好的阻断及抑制作用,在我国已有悠久的应用历史[18-19],在兽医临床上也被广泛应用[20-21]。本研究利用NDRV构建了雏鸭的动物感染模型,对板蓝根合剂的预防效果进行了分析评价。研究发现,NDRV攻毒雏鸭 7 d后,雏鸭的发病率为 100 %,且雏鸭肝脏均有出血等明显的病理变化。板蓝根合剂使用后再进行攻毒,攻毒7 d后雏鸭的发病率仅为10 %,显著低于攻毒组。与对照组相比,肝脏也没有明显的出血现象。上述结果揭示了本研究制备的板蓝根合剂对新型鸭呼肠孤病毒病具有良好的预防效果,能够有效抵抗NDRV的感染。
综上所述,本研究从山东不同地区分离鉴定出 5株 NDRV,其 σC蛋白基因序列与其他NDRV具有很高的同源性,其致病性并未发生明显的变化。进一步研究发现自制板蓝根合剂在对抗NDRV时具有良好的预防效果,这不仅为鸭呼肠孤病毒病药物研发上提供了新的思路,也为未来新型鸭呼肠孤病毒病的防控提供了重要的理论基础。
